
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Гидрокси – и оксоальдегиды и кетоны
- •Оксокислоты
- •Химические свойства
- •2. Кето-енольная таутомерия-оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Глоссарий
- •Тема 6. Аминокислоты. Первичная структура белков и пептидов
- •I. Аминокислоты с неполярными (гидрофобными) r-группами (8):
- •II. Аминокислоты с полярными (гидрофильными) незаряженными
- •III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3):
- •IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
- •III. Биологически важные реакции - аминокислот
- •2. Реакция декарбоксилирования:
- •IV. Аналитические, качественные реакции аминокислот и пептидов.
- •3. Взаимодействие с 2,4-динитрофторбензолом – днфб (реактивом Сенджера):
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Важнейшие природные моносахариды Альдопентозы
- •Альдогексозы Кетогексоза
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •1. Окисление
- •Галактаровая и др.) кислоты
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Химические свойства дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами Пиримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Названия нуклеозидов и нуклеотидов
III. Биологически важные реакции - аминокислот
1. Способность к образованию внутренних солей(биполярных, или «цвиттер» – ионов). Карбоксильная группа проявляет кислотные свойства, диссоциирует с отщеплением протона. Амино-группа, которая проявляет основные свойства, способна протонироваться по неподеленной электронной паре атома азота. В результате в водных растворах и в кристаллическом состоянии аминокислоты существуют в виде внутренних солей:



 +
+
NH2-CH-COOH NH3-CH-COO-
RR
Суммарный заряд молекулы зависит от строения радикала Rи рН среды:
а) моноаминомонокарбоновая кислота:
OH- +H++
NH2-CH2-COO- -1 NH3-CH2-COO -0 NH3-CH2-COOH+1
б) моноаминодикарбоновая кислота:
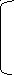



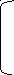
 +
+
+
+
NH2-CH-COO- -2 NH3-CH-COO- -1 NH3-CH-COO- °
HO- Н+
CH2 CH2 CH2
COO- COO- COOН


2Н+
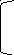
 +
+
NH3-CH-COOH +1
CH2
СOOH
в) диаминомонокарбоновая кислота:






NH2-CH-COO- ° + NH3-CH-COO- +1 + NH3-CH-COOH +2
HO- Н+
(CH2 )4 ( CH2 )4 (CH2)4 -
+ NH3 +NH3 +NH3
2НО-
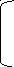

NH2-CH-COO- -1
(CH2)4
NH2
Свойство аминокислот изменять заряд при определенном значении рН, а следовательно, двигаться в электрическом поле к разным электродам лежит в основе метода электрофореза, который используется для разделения смесей аминокислот и белков.
Значение рН среды, при котором суммарный заряд молекулы равен нулю, называется изоэлектрической точкой(ИЭТ, или рНi , илиpI). В ИЭТ молекула теряет электрофоретическую подвижность, снижается растворимость белка в воде, он может выпадать в осадок.
