
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
САНКТ-ПЕТЕРБУРГСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ ИМ. И.И МЕЧНИКОВА
__________________________________________________________________
МЕТОДИЧЕСКИЕ РАЗРАБОТКИ
ПО БИООРГАНИЧЕСКОЙ ХИМИИ
Под редакцией
проф. В.А. Дадали, доц. В.С. Сорокиной,
доц. Е.А. Соколовой
Санкт-Петербург
2009
УДК 24.2.У912
Третье издание методических разработок практических занятий по биоорганической химии дополнено и переработано в соответствии с учебной программой. Оно включает адаптированный теоретический материал по всем темам курса.
Предназначено для студентов медицинских вузов.
Методические разработки подготовлены канд. хим. наук В.С. Сорокиной, канд. хим. наук Е.А. Соколовой, канд. биол. наук В.М. Тимофеевой, канд. хим. наук Р.П. Пономаревой, канд. биол. наук Ж.В. Антоновой, канд. хим. наук Н.К. Зайцевой, под общей редакцией проф. В.А. Дадали, доц. В.С. Сорокиной, доц. Е.А. Соколовой (кафедра биологической химии с курсом биоорганической химии).
100-Летию кафедры биохимии с курсом биоорганической химии посвящается (1909 – 2009 гг)
Рекомендовано для использования в учебном процессе методическим советом СПбГМА им. И.И. Мечникова ____ ____________ 2009 г.
|
JSBN 5-7243-0285-3 |
© Санкт – Петербургская государственная медицинская академия им. И.И. Мечникова, 2009 |
ВВЕДЕНИЕ
Курс органической химии в медицинских вузах в последние годы неоднократно подвергался значительной перестройке в связи с современными требованиями соответствия химических дисциплин модели профиля специалиста. Это заставило нас пересмотреть курс биоорганической химии, сделав акцент на тех вопросах и темах органической химии, которые тесно связаны с биохимией, фармакологией и другими медицинскими дисциплинами.
Основная цель курса биоорганической химии заключается в формировании системных знаний закономерностей химического поведения основных классов природных соединений, лежащих в основе процессов жизнедеятельности человека.
Главное внимание уделено изучению структуры и свойств биологически важных органических соединений – низкомолекулярных биорегуляторов, липидов и биополимеров (белков, углеводов, нуклеиновых кислот).
В каждую из 9 тем методических разработок входят: цель и конкретные задачи занятия, его мотивация, задания и вопросы для самоподготовки, этапы проведения занятия. Кроме того, разработки содержат адаптированный теоретический материал по всем темам курса, изучаемым на практических занятиях по биоорганической химии.
СОДЕРЖАНИЕ
СОДЕРЖАНИЕ 6
Тема 3. Альдегиды и кетоны 36
Тема 4. Карбоновые кислоты и их функциональные производные 44
Глоссарий 55
Тема 5. Липиды 56
Тема 1. Углеводороды
Цель занятия: сформировать представление о зависимости реакционной способности углеводородов от их электронного и пространственного строения.
Конкретные задачи
1. Студент должен знать: названия и структурные формулы углеводородов и углеводородных радикалов; виды изомерии (структурную и пространственную); виды гибридизации углеродного атома (sp3, sp2, sp); понятие ковалентной связи, ее разновидности; типы ковалентной связи и -.
2. Студент должен уметь: называть углеводороды по номенклатуре ИЮПАК; составлять формулы структурных и пространственных изомеров углеводородов; изображать пространственное строение органических веществ с помощью конфигурационных формул; прогнозировать свойства любого углеводорода на основе его электронного строения (состояния гибридизации углеродных атомов в его составе); показывать графически электронные эффекты заместителей.
Мотивация. Изучаемая тема обеспечивает понимание взаимосвязи « структура – свойства », что необходимо при изучении всех классов органических веществ, а также реакций, протекающих в живых организмах; понятия «конфигурация» и «конформация» в дальнейшем должны быть использованы при рассмотрении структуры и биологических функций биополимеров.
Вопросы для самоподготовки
1. Дайте определение - и- связей. Покажите их строение на примере алканов, алкенов. Укажите различие в их строении и свойствах.
2. Напишите уравнение реакции и механизм радикального замещения SR на примере хлорирования этана.
3. Напишите уравнение реакции и механизм электрофильного присоединения (АЕ) на примере взаимодействия 1-бутена с Н2,HCl, Н2О. Дайте современную интерпретацию правила Марковникова для последних двух реакций.
4. Напишите уравнение реакции окисления пропилена перманганатом калия. Объясните, почему эта реакция используется как качественная.
5. Дайте определение понятия «сопряжение». Напишите уравнения реакций гидрирования и галогенирования бутадиена–1,3 и объясните их особенности, связанные с электронным строением.
6. Сформулируйте критерии ароматичности для молекулы бензола. Напишите уравнения реакций галогенирования, сульфирования, алкилирования бензола, бензойной кислоты, фенола, толуола. Сравните реакционную способность этих веществ в реакциях электрофильного замещения (SE).
7. Изобразите графически электронные эффекты заместителей в молекулах фенола, толуола и бензойной кислоты.
Этапы занятия и контроль усвоения знаний
Продолжительность занятия – 4 часа.
|
Этапы занятия |
Форма проведения этапа |
Время |
|
1. Разбор теоретического материала. |
Опрос студентов у доски с коррекцией и объяснением преподавателем. Демонстрация плакатов, моделей. |
150 мин. |
|
2. Контроль усвоения материала. |
Тест: Электронные эффекты. |
30 мин. |
1–й этап. Разбор теоретического материала: «Реакционная способность углеводородов». Типы ковалентной связи:,. Примеры. Характеристика особенностей- и- связей. Полярность. Индуктивный и мезомерный эффекты и проявление их влияния на реакционную способность органических соединений и направленность реакций. Характерные реакции для алканов (SR), алкенов, диенов (АЕ). Понятие «ароматичность». Характерные реакции для ароматических углеводородов – (SE). Механизмы этих реакций.
2–й этап. Контроль усвоения темы. Тест – контроль «Электронные эффекты». Его оценка – 0 или 5 баллов.
Теория
Углеводородами называются органические соединения, состоящие из углерода и водорода. Важность этих веществ определяется тем, что они составляют основу всех классов биологически активных веществ. Некоторые углеводороды находят применение в медицине: вазелин, вазелиновое масло, парафин (смеси предельных углеводородов), нефть нафталанская рафинированная (смесь олефинов, ароматических углеводородов и других биологически активных веществ), циклопропан (циклоалкан) и др.
Вазелин:основа для мазей и косметических средств.
Вазелиновое масло– применяется в дерматологии для изготовления препаратов йода, йодоформа, йодистого тимола, ртутных препаратов, косметических средств и т.д.
Нефть нафталанская: рафинированная – основа для мазей: оказывает смягчающее, дезинфицирующее, рассасывающее действие. Употребляется при экземе, фурункулезе, рожистом воспалении, невралгии, радикулите. Неразветвленные насыщенные углеводороды (содержание их в нефти до 20 %) используются в микробиологической промышленности для получения кормового белка.
В условиях загрязнения крупных городов важное значение имеет исследование физиологического действия углеводородов.
Установлена зависимость реакционной способности, а также физиологического действия этих веществ от их электронного строения. Основным типом химических связей в органических соединениях является ковалентная связь.
Ковалентной называется химическая связь, образованная за счет обобществления электронов связываемых атомов.
Существуют два типа ковалентной связи в зависимости от симметрии перекрывания АО: - и- связи.
- связиимеют ось симметрии, проходящую через ядра атомов, при этом максимальное перекрывание орбиталей лежит на оси (прямой), связывающей ядра атомов. Наивысшая электронная плотность находитсявдоль линии,соединяющей ядра и сферически симметрична по отношению к этой линии.
- связиимеют ось симметрии, проходящую через ядра атомов, но максимальное перекрывание орбиталей лежитперпендикулярно линиимежду ядрами и осуществляется по обе стороны от нее.
- связиболее компактны,- МО находятся ближе к ядру. Они прочные и трудно поляризуются.
- МО выступают далеко за плоскость молекулы, легко поляризуются, легче разрываются.
Ковалентные связи характеризуются энергией, длиной, полярностью, поляризуемостью.
В полярных связях неравномерно распределена электронная плотность – возникает диполь. Полярность количественно оценивается величиной дипольного момента , измеряемого в дебаях.
Наличие в молекуле полярной -связи вызывает поляризацию ближайших- связей. Такой вид передачи влияния атомов называется индуктивным эффектом и обозначается символом.
Т.о., индуктивный эффект – передача электронного влияния заместителей по цепи - связей.
Группы, притягивающие электронную плотность - связей (электроноакцепторы) проявляют отрицательный индуктивный эффект -. Например, галогены, ОН, NO2, COOH, катионы.
Группы, смещающие электронную плотность - связей от себя, (электронодоноры) проявляют + эффект. Например, алкильные группы (метильные, этильные группы), анионы.
+II+I+-+![]() -
-
Н3С – СН2– СН2ClСН3СН=СН2
-+
Сопряженные системы
Если 2 связи разделены одной простой - связью или рядом с - связью расположен атом с р-орбиталью (занятой 1 или 2р- электронами или вакантной), то имеет место частичное перекрывание (взаимодействие) формально не связанных р-орбиталей.
Возникает общая - электронная система с делокализованной электронной плотностью, энергетически стабильная и реагирующая на внешнее влияние как единое целое.
Такие системы называются сопряженными системами.Они могут быть открытыми или замкнутыми и содержать не только атомы углерода, но и гетероатомы.
В зависимости от принадлежности р- орбиталей к двум -связям или к-связи и одному атому с р-орбитальюразличают ,- или р,- сопряженные системы.



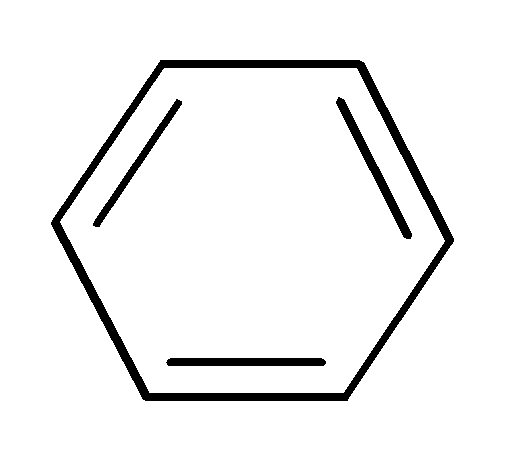
акриловая кислота бензол
, - сопряженные системы

-------- ---
---------------------
метилвиниловый эфир
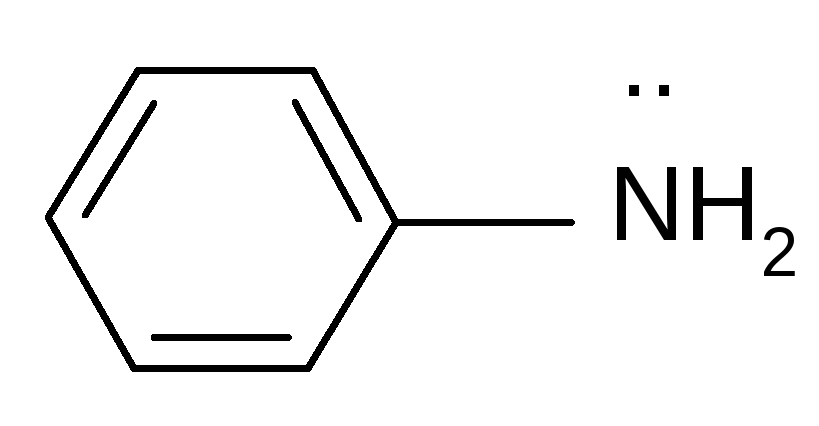
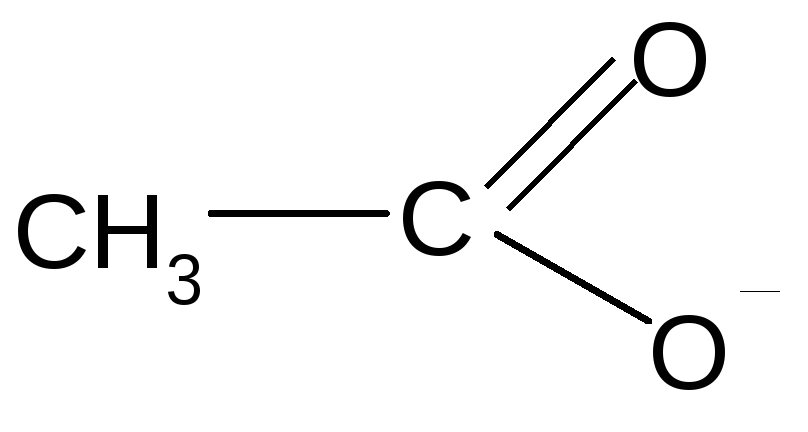
анилин ацетат ион
р, - сопряженные системы
 вакантная р-орбиталь
вакантная р-орбиталь
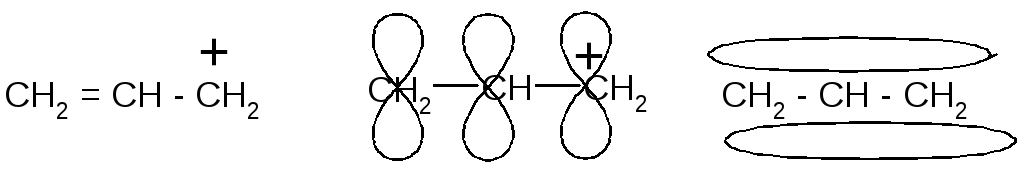
. .
аллил-катион
Передача электронного влияния по системе сопряжения называется эффектом сопряжения и обозначается символом .
Заместители – доноры проявляют +эффект. Например,NH2,OH, Сl,ORи другие. Заместители – акцепторы –-эффект. Например,NO2,COOH,C=O,SO3Hи др.
В зависимости от характера связи углеводороды делятся на классы: алканы, циклоалканы, алкены, алкадиены, арены и др.
Таблица 1
