
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Гидрокси – и оксоальдегиды и кетоны
- •Оксокислоты
- •Химические свойства
- •2. Кето-енольная таутомерия-оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Глоссарий
- •Тема 6. Аминокислоты. Первичная структура белков и пептидов
- •I. Аминокислоты с неполярными (гидрофобными) r-группами (8):
- •II. Аминокислоты с полярными (гидрофильными) незаряженными
- •III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3):
- •IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
- •III. Биологически важные реакции - аминокислот
- •2. Реакция декарбоксилирования:
- •IV. Аналитические, качественные реакции аминокислот и пептидов.
- •3. Взаимодействие с 2,4-динитрофторбензолом – днфб (реактивом Сенджера):
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Важнейшие природные моносахариды Альдопентозы
- •Альдогексозы Кетогексоза
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •1. Окисление
- •Галактаровая и др.) кислоты
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Химические свойства дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами Пиримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Названия нуклеозидов и нуклеотидов
Энантиомеры
Относительная и абсолютная конфигурация. Определение абсолютной конфигурации стало возможным только с появлением современных физико-химических методов (рентгеноструктурного анализа) в 50-х годах. Однако нет необходимости устанавливать ее для каждого соединения. Можно охарактеризовать их путем сравнения конфигураций с абсолютной конфигурацией эталонных (ключевых) соединений, т. е. определить их относительную конфигурацию.
За такой эталон условно принят глицериновый альдегид, предложенный в 1906 г. Н.А. Розановым:

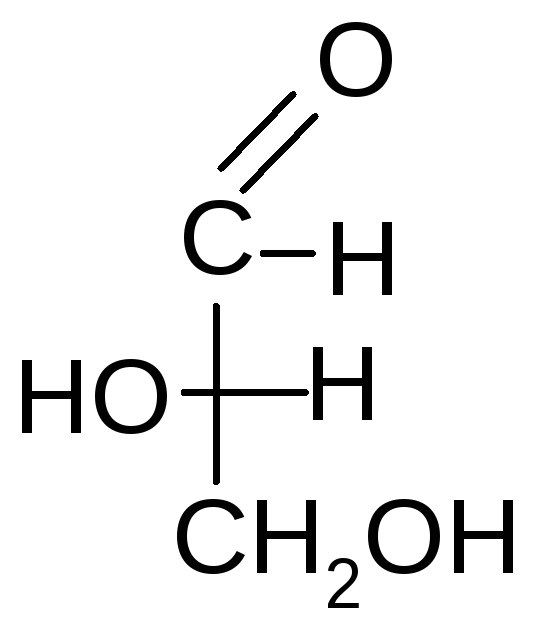

D- глицериновыйL-глицериновый
альдегид альдегид
Считается, что все вещества, родственные глицериновому альдегиду по конфигурации хирального центра, т.е. с расположением групп – ОН, -NH2, -Halсправа, относятся кD–ряду, слева – кL– ряду.
Например:

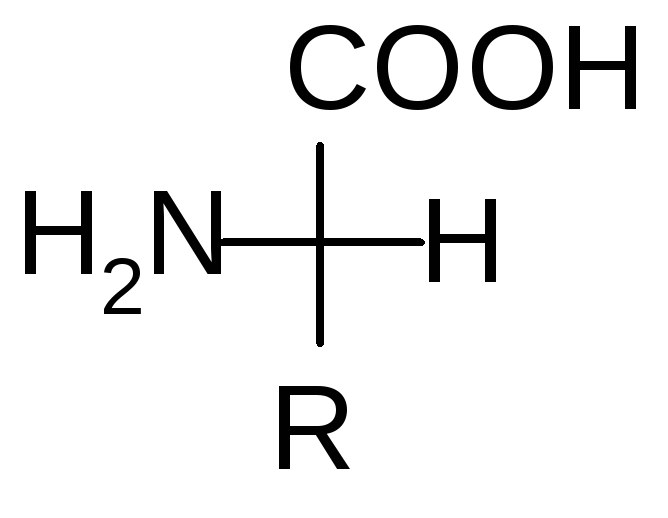
D- аминокислотаL– аминокислота
Запомним, что DиLуказывают на относительную конфигурацию молекулы. Познакомимся с некоторыми свойствами подобных молекул.
Хиральным соединениям свойственна способность вращать плоскость поляризованного света вправо (+) или влево (-), что называется оптической активностью. Отсюда и другое название энантиомеров – оптические изомеры.
Условиями оптической активностиявляются:
Отсутствие плоскости симметрии (хиральность молекулы)
Наличие в молекуле центров хиральности.
Мерой оптической активности является D- удельное вращения; характеризует угол и направление вращения плоскости поляризованного света. Знак вращения (+) или (-) не связан с конфигурациейDиLи определяется только инструментально на приборе – поляриметре или сахариметре (для сахаров). Например,
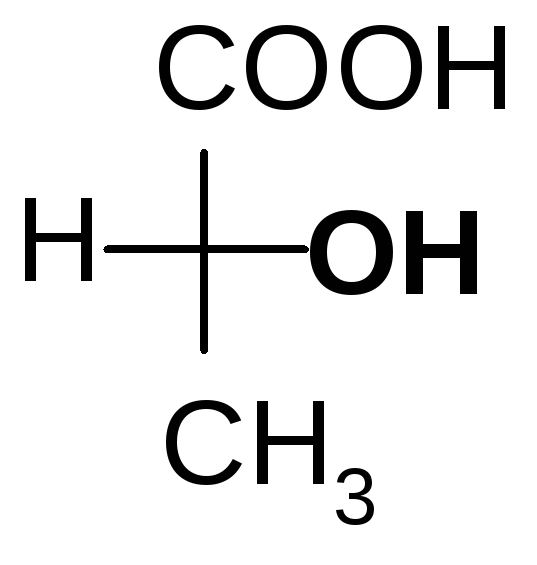
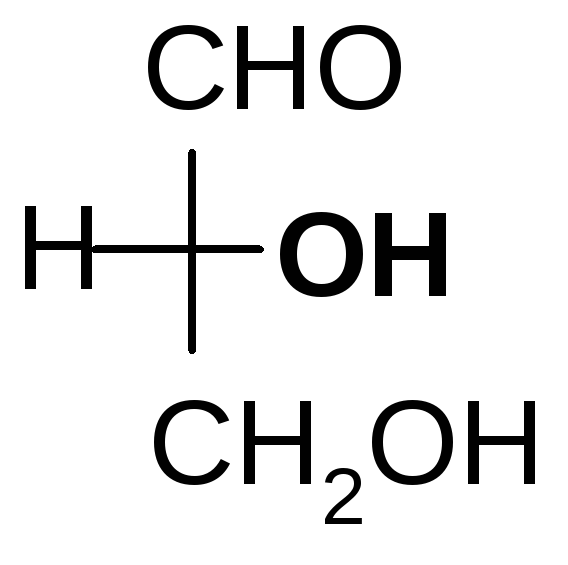
D(-) –молочнаяD(+)- глицериновый
кислота альдегид
Многие биологически важные вещества содержат в молекуле более одного центра хиральности. Подсчет числа стереоизомеров производится по формуле N= 2n, гдеn– число хиральных центров.
Представителем соединений с двумя центрами хиральности служит винная кислота. Рассмотрим этот пример подробнее.
У винной кислоты n=2, т.е.N= 22= 4.
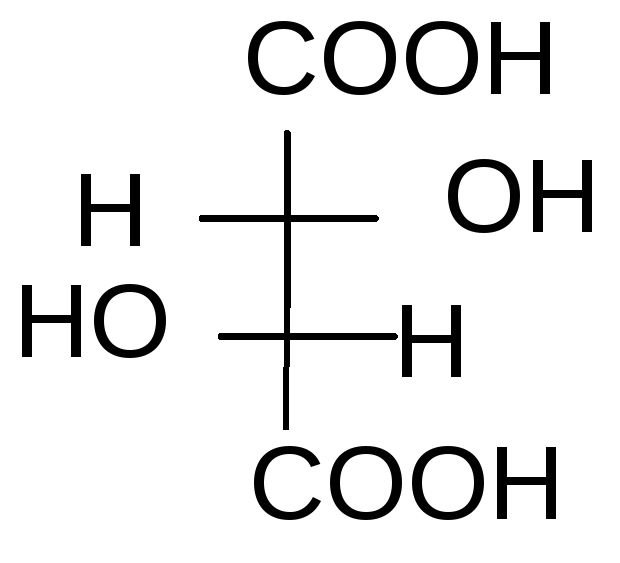

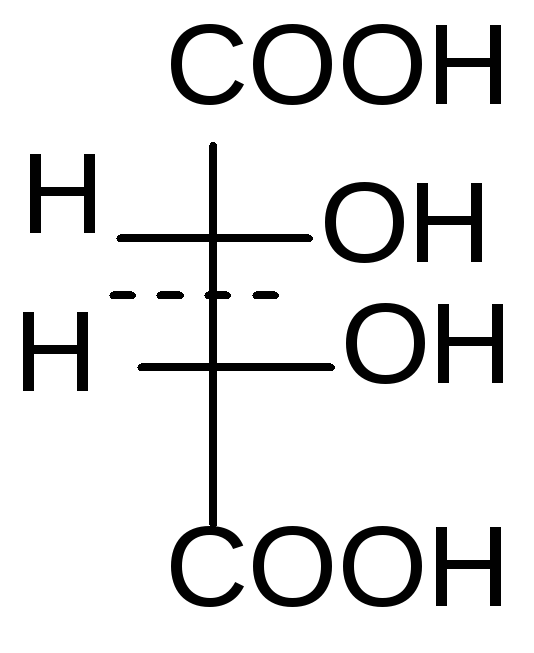

1 2 3 4
D–винная кислота; 2.L-винная кислота; 3 и 4 – мезовинная кислота
1 и 2 – это энантиомеры (DиL). Они отличаются не по физическим и химическим свойствам, а только знаком вращения плоскости поляризованного света. Формулы 3 и 4 являются идентичными. Формулы 1 и 3, 2 и 3 являются пространственными изомерами, но не зеркальными, это диастереомеры. Они отличаются по физическим и химическим свойствам.
При отнесении энантиомеров к D– илиL-ряду пользуются «оксикислотным ключом», т.е. сравнивают со стандартом тот хиральный центр, который остался без изменения при переходе от него. В данном случае это верхний хиральный центр (приведите путь превращения глицеринового альдегида в винную кислоту).
D– иL- энантиомеры проявляют оптическую активность. Мезовинная кислота – типичный пример молекулы, содержащей центры хиральности, но в целом являющейся ахиральной из-за наличия плоскости симметрии и потому не проявляющей оптическую активность.
Рацемат– это смесь равных количеств энантиомеров. Оптической активностью не обладает, вследствие компенсации вращения. Таким образом, у винной кислоты существуют 4 формы: 2 энантиомера (D- иL-), 1 мезо-форма и 1 рацемическая смесь. Рацемические смеси получаются синтетическим путем.
Поскольку природные источники не могут удовлетворить потребности современной биоорганической и биологической химии в разнообразных оптически активных соединениях, то либо расщепляют рацематы, либо ведут асимметрический синтез.
Существует несколько способов расщепления рацематов:
а) механический отбор кристаллов по их форме – исторически первый метод, примененный Луи Пастером;
б) биохимический (ферментативный) метод;
в) химический – через диастереомеры;
г) хроматографический на оптически активных сорбентах.
