
- •Передмова
- •ВСТУП
- •1. ТЕРЕЗИ І ЗВАЖУВАННЯ
- •1.2. Аналітичні терези АД-200
- •1.3. Аналітичні терези АДВ-200М і ВЛА-200М
- •1.4. Лабораторні аналітичні одноплечі терези
- •1.5. Експериментальна частина
- •1.5.3. Визначення еквівалента елемента
- •1.6. Запитання і задачі
- •1.7. Література
- •2. ТЕПЛОВІ ЕФЕКТИ ХІМІЧНОЇ РЕАКЦІЇ
- •2.1. Вступ
- •2.2. Експериментальна частина
- •2.2.1. Визначення теплоти нейтралізації
- •2.3. Запитання і задачі
- •2.4. Література
- •3. КОМПЛЕКСНІ СПОЛУКИ
- •3.1. Будова комплексних сполук
- •3.2. Номенклатура комплексних сполук
- •3.2.1 Комплексні сполуки - неелектроліти
- •3.2.2. Сполуки з комплексними катіонами
- •3.2.3. Сполуки з комплексними аніонами
- •3.3. Стійкість комплексних іонів
- •3.4. Експериментальна частина
- •3.4.1. Відмінність між простими і комплексними іонами заліза
- •3.4.2. Комплексні катіони
- •3.4.4. Дисоціація комплексних іонів
- •3.4.5. Комплексні аніони
- •3.4.5. Дисоціація подвійних солей
- •3.4.6. Утворення амінів міді
- •3.5. Запитання і задачі
- •3.6. Література
- •4. ВОДНЕВИЙ ПОКАЗНИК рН
- •4.1. Визначення кислотності
- •4.2. Концентрація водневих іонів і показник концентрації водневих іонів рН
- •4.3. Експериментальна частина
- •4.3.1. Вимірювання рН з допомогою індикаторів
- •4.3.2. Колориметричний метод визначення рН
- •4.4. Запитання і задачі
- •4.5. Література
- •5. БУФЕРНІ РОЗЧИНИ
- •5.1. Обчислення рН буферних розчинів, утворених слабкою кислотою та її сіллю
- •5.2. Обчислення рН буферних систем, утворених слабкими основами та їх солями
- •5.3. Експериментальна частина
- •5.3.1. Приготування буферних розчинів
- •5.3.2. Буферна дія
- •5.3.3. Вплив розбавлення на рН буферного розчину
- •5.3.4. Втрата буферної дії
- •5.4. Запитання і задачі
- •5.5. Література
- •6. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ І ХІМІЧНА РІВНОВАГА
- •6.1. Швидкість хімічних реакцій
- •6.2. Хімічна рівновага
- •6.3. Експериментальна частина
- •6.3.1. Вплив ступеня подрібнення (величини поверхні зіткнення речовин) на швидкість реакції в гетерогенній системі
- •6.3.2. Розчинення карбонату кальцію в соляній кислоті
- •6.3.3. Залежність швидкості реакції від концентрації
- •6.3.4. Вплив температури на швидкість реакції
- •6.3.5. Вплив концентрації реагуючих речовин на хімічну рівновагу
- •6.3.6. Оборотність зміщення хімічної рівноваги
- •6.3.7. Вплив температури на хімічну рівновагу (груповий дослід)
- •6.4. Запитання і задачі
- •6.5. Література
- •7. ВЛАСТИВОСТІ S-ЕЛЕМЕНТІВ
- •7.2. Елементи ІА-підгрупи (водень, натрій, калій)
- •7.3. Елементи ІІА-підгрупи (магній і кальцій)
- •7.4. Експериментальна частина
- •7.4.1. Одержання водню
- •7.4.2. Окислювальні і відновлювальні властивості пероксиду водню
- •7.4.3. Реакції катіона натрію
- •7.4.4. Реакція катіона калію
- •7.4.5. Реакції катіона магнію
- •7.4.6. Реакції катіона кальцію
- •7.5. Запитання і задачі
- •7.6. Література
- •8.2. Елементи ІІІА-підгруш (бор і алюміній)
- •8.3. Елементи ІVА-підгруп (вуглець і кремній)
- •8.4. Елементи VА-підгрупи (азот і фосфор)
- •8.6. Елементи VІА-підгрупи (кисень і сірка)
- •8.7. Елементи VІІА-групи (галогени)
- •8.8.2. Гідроліз бури
- •8.8.3. Якісний аналіз бору
- •8.8.4. Дія лугів і кислот на алюміній (під тягою)
- •8.8.8. Відновлювальні властивості вугілля
- •8.8.9. Гідроліз солей вугільної кислоти
- •8.8.10. Одержання і властивості кремнію
- •8.8.11. Одержання і властивості аміаку
- •8.8.12. Одержання і властивості кальцієвих солей ортофосфорної кислоти
- •8.8.14. Одержання кисню і вплив каталізатора на швидкість розкладу KСlO3
- •8.8.16. Реакція хлорид-іона
- •9.2. Біологічна роль деяких важливих d-елементів
- •9.2.1. Реакції катіона марганцю з лугами (NаОН і KOH)
- •9.2.2. Реакції катіона цинку
- •9.2.3. Реакції катіона кобальту
- •9.2.4. Реакції катіонів срібла
- •9.2.5. Реакції катіонів свинцю
- •9.2.6. Реакції катіонів ртуті (І)
- •9.2.7. Реакції катіонів міді
- •9.3. Література
15
матовою шкалою.
Великі зміщення урівноважуються переміщенням тарувальних гайок, що дозволяється тільки при аретованому стані вагів.
Шкала поділена на 100 частин; граничне відхилення стрілки шкали відбувається при навантаженні в 5 г, таким чином, ціна поділки шкали відповідає навантаженню в 5 мг. Чутливість можна перевірити так:, на шальку ставиться гиря вагою 5 г, а потім терези дезаретуються. Якщо шкала після попереднього встановлення нульової точки не знаходиться на поділці 500, то чутливість вагів треба підрегулювати. Це можна виконати підрегулюванням гайок, які переміщуються по вертикальному гвинту, що знаходяться поряд із опорним клином.
Порядок роботи
Сутність зважування полягає в тому, що з шальки знімають стільки гир, скільки важить зважувана речовина, покладена на шальку. Інакше кажучи, для відновлення положення рівноваги терезів необхідно зняти саме стільки гир, скільки важить зважуваний матеріал. При цьому нульова позначка проектованої шкали знову співпадає з нульовою позначкою матового віконця. На терезах можна зважувати і матеріал, маса якого більша маси знятих гир у межах 0-5 г. Дозування зважуваних речовин і порошкоподібних матеріалів допускається і в дезаретованому стані. Однак зняття і накладання гир допускається тільки при аретованих терезах. Зважувані матеріали по можливості покласти на середину шальки.
Дезаретування виконується швидким, обережним, але все ж визначеним рухом.
Ваги слід постійно тримати в чистоті. Розсипані при зважуванні матеріали можуть бути видалені м'якою щіточкою, пролиту рідину вибрати фільтрувальним папером. Щоразу перед зважуванням перевірити вивірку терезів по горизонталі і правильність поділок. По закінченні зважування не допускається залишати на терезах будь-які предмети чи матеріали; одночасно перевірити аретування терезів і покрити гирі захисним ковпаком (5).
1.5.3. Визначення еквівалента елемента
ЕКВІВАЛЕНТ ЕЛЕМЕНТА. Хімічним еквівалентом елемента нази-
вається така його кількість, яка в реакціях може приєднувати або заміщувати 1 моль (6,022 · 1023) атомів чи іонів водню.
Маса 1 еквівалента називається еквівалентною масою (розмірність – г/моль або кг/моль).
Поняття про еквівалент має велике значення в хімії, оскільки з його допомогою формулюється один з основних законів хімії – закон еквівалентів: хімічні елементи взаємодіють між собою в кількостях, пропорційних їх еквівалентам. Наприклад, 1,008 г/моль водню з'єднується з 8 г/моль кисню або 35,5 г/моль хлору, або з 23 г/моль натрію; 2,016 г/моль водню сполучаються з 16 г/моль кисню або 71 г/моль хлору, або 46 г/моль натрію і т.д.

16
Між еквівалентом Е, атомною масою А і стехіометричною валентністю елемента В існує залежність:
Е = А/В
За цією формулою визначається теоретичне значення еквівалента еле-
мента. Наприклад, ЕZn= 65,4/2 = 32,7; ЕAl = 27/3 = 9 і т.д.
Закону еквівалентів можна надати математичного виразу:
m1 = E1 , m2 E2
де: m1, m2 – маса першої і другої речовини; Е1, Е2 – еквівалент першої і другої речовини. Цією формулою користуються для обчислення хімічних еквівалентів простих і складних речовин. Наприклад, якщо відомо, що 1,44 г металу утворюють 2,72 г оксиду, то еквівалент цього металу обчислюють таким чином. Маса металу дорівнює 1,44 г, маса кисню – 2,72-1,44 = 1,28 г, еквівалент кисню Е2 дорівнює 8. Звідси еквівалент металу Е1 = 1,44 8/1,28 = 9.
Часто елементи утворюють один з одним по декілька сполук. У цьому випадку в різних сполуках один і той же елемент матиме різні еквіваленти. Наприклад, еквівалент одновалентної міді у сполуці Сu2O ECu(I) = 64/1 = 64, а
еквівалент двохвалентної міді у сполуці СuО ЕCu(II) = 64/2 = 32. Вміст вуглецю в окису і двоокису вуглецю відповідно становить 6 і 3 г/моль на 1 екві-
валент (8 г/моль) кисню. Еквіваленти азоту у сполуках N2O, NO, N2O3 , NO2, N2O5 мають значення відполвідно 28/2 , 14/2, 28/6, 14/4, 28/10, або 14; 7; 4,67; 3,5; 2,8.
Між різними еквівалентами одного й того ж елемента в різних сполуках з іншим елементом існує залежність, яка визначається законом кратних відношень: якщо два елементи утворюють між собою кілька сполук, то масові кількості одного елемента, які сполучаються з однією ж і тією кількістю іншого елемента, відносяться між собою як послідовний ряд цілих чисел. В наведеному прикладі еквіваленти азоту в різних сполуках його з киснем відносяться як 1:2:3:4:5.
Закон еквівалентів і закон кратних відношень експериментально підтвердили атомістичну теорію будови речовини.
Рівняння Е = А/В дає змогу обчислити атомну масу елемента, якщо відомі його еквівалент і валентність А = Е В, тобто атомна маса елемента дорівнює добутку його еквівалента на валентність.
Поняття про еквівалент поширюється і на складні речовини.
Хімічним еквівалентом складної речовини називають таку її масову кількість, яка в даній реакції взаємодіє без залишку з одним еквівалентом будь-якої іншої речовини.
Еквівалент складної речовини визначається так:
1) для оксидів – еквівалент дорівнює сумі еквівалентів кисню і елемента, що входить до складу оксиду:
ENa2O = 23 + 8 = 31;

17
EP2O5 = 6,2 + 8 = 14,2.
2) для основ – еквівалент дорівнює молекулярній масі, поділеній на число груп ОН (тобто на валентність металу):
ENaOH = 401 =40;
ECa(OH)2 = 742 =37.
3) для кислот – молекулярну масу ділять на кількість атомів водню, яка заміщується металом:
EHCl = 36,51 =36,5.
EH2SO4 = 982 =49.
4) для солей – молекулярну масу ділять на добуток валентності металу на число його атомів:
EAl2(SO4)3 = 33422 = 3426 =50,7.
Еквівалент складної речовини не є величиною постійною, а залежить від хімічної реакції, в якій бере участь дана сполука. Так, в реакцію з ортофосфорною кислотою Н3РО4 в залежності від умов можуть вступити одна, дві або три молекули їдкого натру. В залежності від цього і еквівалент ортофосфорної кислоти буде різним:
Н3РО4 + NaOH → NaH2PO4 + H2O
EH3PO4 = 981 =98;
Н3РО4 + 2NaOH → Na2HPO4 + 2H2O
EH3PO4 = 982 =49;
Н3РО4 + 3NaOH → Na3PO4 + 3H2O
EH3PO4 = 983 =32,7.
Фосфорна кислота веде себе відповідно як одно-, двоабо трьохосновна кислота.
Методи визначення еквівалентів
Експериментальне визначення еквівалентів може бути проведене різними методами.
Метод прямого визначення. Знаходять масову кількість елемента, яка
18
сполучається з 1,006 г/моль водню або з 8 г/моль кисню.
Приклад. При окисленні 8,71 г металу одержано 9,71 г оксиду. Еквівалентна маса метаду визначається із простого співвідношення:
на 8,71 г металу пішло |
9,71-8,71 г кисню |
Е г/моль |
8 г/моль |
Аналітичний метод. Еквівалент визначається за даними аналізу, коли відомий кількісний склад сполуки даного елемента з іншим елементом, еквівалент якого відомий.
Приклад. Для знаходження хімічного еквівалента золота, котре безпосередньо з воднем і киснем не сполучається і не витісняє водень із кислот, можна скористатися результатами аналізу його сполучення з хлором – хлориду золота (III) АuСl3. Дослід показує, що при утворенні цієї сполуки 197 г/моль золота взаємодіють із 106,5 г/моль хлору. Хімічний еквівалент хлору дорівнює 35,5. Звідси еквівалент золота:
ЕAu = 197 35,5/106,5 = 65,7.
Метод витіснення. Цей метод застосовується до металів, які розчиняються в кислотах або гідроксидах лужних металів із виділенням водню. В цьому випадку знаходять кількість металу, що витіснила 1 моль атомів водню або 11200 мл водню за нормальних умов.
Електрохімічним метод. Хімічні еквіваленти елементів визначаються на основі закону Фарадея, згідно з яким 96 500 Кл виділяють з електроліту один еквівалент речовини.
Приклад. Струм в 1А протягом 193 000 с виділив 18 г алюмінію з розчину його солі. Еквівалент алюмінію обчислюється із співвідношення:
193 000 Кл виділили |
|
18 г |
96 500 Кл |
|
Е |
E = |
18 96500 |
=9. |
|
193 000 |
|
19
Експериментальна частина Визначення хімічного еквівалента металу
за об'ємом витісненого водню Обладнання і реактиви: прилад для визначення еквівалента металів; по-
судина Ландольта з позначкою на одному коліні 5 мл; лійка для наливання кислоти в коліно посудини Ландольта; ваги з важками; кімнатний термометр; барометр; пластина цинку масою 0,06-0,12 г; соляна кислота (1:1).
Виконання роботи
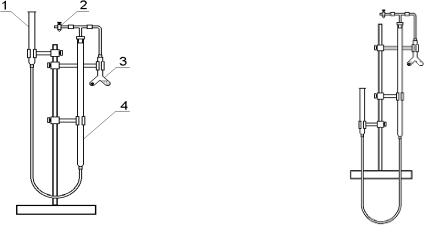
У штативі закріпіть бюретку 4 місткістю 50 мл і зрівняльну посудину, сполучені каучуковою трубкою (див. рис.1.3).
Бюретка і зрівняльна посудина заповнюються водою. Рівень води у бюретці повинен бути трохи вище нуля. Верхній кінець бюретки можна з'єднати з двоколійною посудиною Ландольта 3 через гумову трубку з добре припасованими пробками. Відкрийте кран 2. Рівень води у бюретці встановіть з допомогою зрівняльної посудини 1 на нульову поділку, закрийте кран 2.
В одне коліно посудини Ландольта покладіть шматочок цинку масою від 0,09 до 0,12 г, в друге налийте 5 мл соляної кислоти (1:1).
Посудину Ландольта з'єднайте і перевірте на герметичність, опустивши зрівняльну посудину на 15-20 мл нижче нульової поділки. Якщо прилад не пропускає повітря, рівень рідини в бюретці дещо знизиться. При поверненні зрівняльної посудини на колишнє місце в ній і бюретці рівень рідини повинен бути на тій же нульовій поділці. Якщо ж прилад не герметичний, то рівень рідини в бюретці буде знижуватися. В такому випадку перевірте всі пробки і трубки. Якщо потрібно, замініть їх.
Після того, як встановлено, що прилад герметичний і рівень рідини знаходиться на нульовій поділці, посудину Ландольта 2 нахиліть так, щоб кислота перелилася в коліно, де знаходиться цинк.
Реакція цинку з соляною кислотою протікає за рівнянням: Zn + 2H+ → Zn2+ + H2↑.
а |
б |
Рис. 1.3. Прилад для визначення еквівалента металів: а – на початку досліду; б – в кінці досліду; 1– зрівняльна посудина; 2 – скляний кран; 3 – двоколійна посудина Ландольта; 4 – бюретка на 50 мл

20
Коли реакція закінчиться (це встановлюється за припиненням виділення бульбашок газу у посудині Ландольта), прилад залиште в спокої на 3-5 хвилин для охолодження газу до кімнатної температури, після чого меніск води в бюретці і в сполучній посудині приведіть до одного рівня, проведіть відлік положення нижнього краю меніска в бюретці і запишіть об'єм з точністю до 0,1 мл. Занотуйте також показання термометра і барометра. За таблицею 1 знайдіть парціальний тиск водяної пари при температурі досліду.
Таблиця 1. Пружність насиченої водяної пари при різних температурах
° |
Пружність |
Температура, |
° |
С |
Пружність |
||
Температура, С |
|
|
|
|
|
||
|
мм рт.ст. |
Па |
|
|
|
мм рт.ст. |
Па |
15 |
12,8 |
1702 |
23 |
|
|
21,1 |
2806 |
16 |
13,6 |
1809 |
24 |
|
|
22,4 |
2979 |
17 |
14,5 |
1928 |
25 |
|
|
23,8 |
3176 |
18 |
15,5 |
2061 |
26 |
|
|
25,2 |
3351 |
19 |
16,5 |
2194 |
27 |
|
|
26,7 |
3551 |
20 |
17,5 |
2328 |
28 |
|
|
28,3 |
3763 |
21 |
18,6 |
2473 |
29 |
|
|
30,0 |
3990 |
22 |
19,8 |
2633 |
30 |
|
|
31,8 |
4229 |
Розрахуйте об'єм виділеного водню, приведений до нормальних умов, з урахуванням парціального тиску парів води. На підставі отриманих даних проведіть розрахунки по визначенню еквівалента цинку.
Форма запису |
|
Дата |
|
Назва роботи |
|
Маса цинку, кг |
m |
Абсолютна температура досліду, К |
273 |
Атмосферний тиск, Па |
P |
Об'єм водню, м3 |
|
при тиску Р і температурі Т |
V |
за нормальних умов |
V0 |
Обчислена із даних досліду еквівалентна маса цинку |
Ezn |
Абсолютна похибка, кг |
а |
Відносна похибка, % |
О |
Обчислення. Кінцева мета обчислень – визначити об'єм витісненого цинком водню. Знаючи об'єм водню і масу цинку, які беруть участь в реакції, визначте еквівалентну масу. Для обчислення використайте рівняння газового стану:
Vo Po = PV . 273 T
Розв'язуючи його відносно Vo, одержимо:
