
Актуальные вопросы современной гепатологии
.pdfПатогенез физиологической желтухи обусловлен накоплением в крови свободного (непрямого) билирубина, образующегося в результате повышенного гемолиза эритроцитов. При первом вдохе родившегося ребенка насыщаемость гемоглобина кислородом резко увеличивается и повышенная оксигенация эритроцитов вызывает их гемолиз. В результате в крови образуется повышенное количество свободного билирубина, превращение которого в связанный билирубин замедленно из-за незрелости ферментных систем новорожденного, и, в частности, снижения активности глюкуронилтрансферазы. Билирубин не связывается с глюкуроновой кислотой, не растворяется в воде и не выделяется с мочой. Важное значение имеет повышение проницаемости сосудистой стенки, свойственное новорожденным, что способствует проникновению пигмента в кожу.
Физиологическая желтуха характеризуется следующими основными признаками:
-появляется спустя 24-48 часов после рождения;
-состояние новорожденного остается удовлетворительным;
-подъем уровня билирубина не достигает критического уровня, при котором может развиваться «ядерная» желтуха.
В своем развитии процесс проходит 2 временные фазы. Первая охватывает первые 5 дней жизни и характеризуется относительно быстрым повышением уровня свободного билирубина до средней пиковой величины, составляющей приблизительно 5 мг/дл (85 мкмоль/л) на 3-й день жизни, и последующим снижением концентрации билирубина к 5-му дню, но без полной ее нормализации. Вторая фаза характеризуется медленным снижением уровня свободного билирубина до нормального к 11-14-му дню жизни.
У недоношенных детей восстановление глюкуронилтрансферазной системы наступает позже, чем у доношенных, вследствие чего физиологическая желтуха имеет пролонгированное течение (иногда сохраняется до 2-3 месяцев жизни).
В первую очередь при физиологической желтухе окрашивается лицо, затем шея, туловище и конечности; при уровне билирубина от 68 до 136 мкмоль/л окрашиваются только лицо и шея. У доношенных новорожденных с физиологической желтухой уровень свободного билирубина варьирует от 85 до 204 мкмоль/л, у недоношенных – до 225 мкмоль/л. Уровень билирубина выше, когда имеется задержка мекония, то есть возникают условия для кишеч- но-печеночной рециркуляции билирубина.
71
При умеренно выраженной физиологической желтухе нет необходимости проводить какое-либо лечение. При выраженной желтухе иногда используют внутривенное вливание растворов глюкозы, аскорбиновую кислоту, фенобарбитал, желчегонные средства для ускорения выведения билирубина. В настоящее время наиболее эффективным методом детоксикации при повышенном уровне билирубина у новорожденных является фототерапия.
Гемолитические желтухи
Гемолитические желтухи связаны с накоплением в крови преимущественно свободного билирубина вследствие повышенного разрушения эритроцитов. Гемолиз наблюдается при следующих заболеваниях и состояниях:
1.Гемолитической болезни новорожденных, связанной с несовместимостью крови матери и ребенка по Rh, АВ0 или другим факторам.
2.Наследственно обусловленных аномалиях форм эритроцитов.
3.Дефиците ферментных систем эритроцитов.
4.Гемоглобинопатии.
5.Трансфузии от плода к плоду при двойне, от матери к плоду.
6.Массивном кровоизлиянии.
7.Запаздывании с перевязкой пуповины (домашние роды).
8.Врожденной инфекции.
Гемолитическая болезнь новорожденных – гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам.
Несовместимость чаще связана с D-резус или АВОантигенами, реже имеет место несовместимость по другим резус - (С, Е, с, d, e) или М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов, проникая в кровь резус-отрицательной матери, вызывает образование в ее организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Различают три формы гемолитической анемии: отечную, желтушную, анемическую. Отечная наиболее тяжелая и характеризуется общим отеком при рождении, накоплением жидкости в полостях
72
(плевральной, сердечной сумке, брюшной), резкой бледностью с желтизной, увеличением печени, селезенки. В анализах крови резкая анемия (уровень гемоглобина менее 40 г/л), значительное количество нормо- и эритробластов. Средний уровень гематокритного числа составляет 10,2%. Сочетание резкой анемии и гипопротеинемии способствует развитию сердечной недостаточности, которая и приводит к смерти (внутриутробно или сразу после рождения).
Желтушная форма - самая частая клиническая форма; она проявляется на 1-2-й день жизни ребенка. Отмечается желтуха, увеличиваются печень и селезенка, наблюдается пастозность тканей. Дети вялые, адинамичные, плохо сосут. Рефлексы снижены. Выражена анемия (уровень гемоглобина ниже 60 г/л), псевдолейкоцитоз, ретикулоцитоз, эритро- и нормобластоз. Ярким признаком является увеличенное содержание непрямого билирубина в крови (265-342 мкмоль/л и более). Моча темная, кал обычной окраски. В дальнейшем может наблюдаться повышенное содержание и прямого билирубина. Билирубиновая интоксикация характеризуется вялостью, срыгиваниями, рвотой, патологическим зеванием, снижением мышечного тонуса. Затем появляются классические признаки ядерной желтухи: мышечный гипертонус, ригидность затылочных мышц, опистотонус, резкий "мозговой" крик, гиперестезия, выбухание большого родничка, подергивание мышц, судороги, положительный симптом заходящего солнца, нистагм, апноэ и полная остановка дыхания. Через 2-3 недели состояние больного улучшается, однако в последующем выявляются признаки детского церебрального паралича (атетоз, хореоатетоз, параличи, парезы, задержка психофизического развития, глухота, дизартрия и др.). К факторам риска билирубиновой энцефалопатии относятся:
низкая масса тела новорожденного (менее 1500 г); гипопротеинемия (содержание общего белка менее 50 г/л); гипогликемия (содержание глюкозы менее 2,2 ммоль/л); анемия (гемоглобин менее 140 г/л); появление желтухи в первые 12 часов жизни; внутриутробное инфицирование плода.
Анемическая форма - наиболее доброкачественная, встречается в 10-15% случаев и проявляется бледностью, плохим аппетитом, вялостью, увеличением печени и селезенки, анемией, ретикулоцитозом, нормобластозом, умеренным повышением билирубина.
73
Диагноз основывается на данных анамнеза и клинических симптомах, определении группы крови и резус-принадлежности матери и ребенка, общем анализе крови ребенка, определении уровня билирубина, титра резус-антител или α- и β- агглютининов в крови и молоке матери. С целью антенатальной диагностики определяют уровень билирубина в околоплодных водах и резус-антител.
Лечение может быть как консервативным, так и оперативным (заменное переливание крови). Показанием к последнему является гипербилирубинемия выше 342 мкмоль/л, с темпом нарастания билирубина выше 6 мкмоль/(л·ч) и при уровне его в пуповинной крови выше 60 мкмоль/л.
При отсутствии активной терапии, направленной на снижение уровня билирубина, отмечается ухудшение общего состояния: ребенок становится вялым, начинает хуже сосать. На 4-6-й день жизни появляются неврологические симптомы в виде судорог, глазодвигательных нарушений, ригидности затылочных мышц. Развивается такое осложнение чаще всего при уровне непрямого билирубина 300 – 350 мкмоль/л.
Наследственный микросфероцитоз (синдром Минковско- го-Шоффара).
Основной механизм, лежащий в основе гемолитической анемии, заключается в сокращении продолжительности жизни эритроцитов в кровеносном русле. В норме она составляет 100-120 дней. В ответ на сокращение продолжительности жизни эритроцитов в периферической крови активность костного мозга увеличивается и число ретикулоцитов превышает 2%.
Усиленный гемолиз эритроцитов связан с пониженной резистентностью к гипотоническим растворам натрия хлорида. Эритроциты имеют своеобразную форму (микроцитарные со сфероцитозом). Такая форма и свойство быстро разрушаться связаны с недостаточным развитием ферментных систем эритроцитов и дефектом спектринов мембраны.
Заболевание характеризуется триадой симптомов: анемия, желтуха, спленомегалия. У новорожденных детей заболевание может сопровождаться резко выраженной желтухой с чрезмерным накоплением неконъюгированного билирубина. В таких случаях следует применять заменные переливания крови.
74
Заболевание передается по аутосомно-доминантному типу. Аномальные клетки характеризуются повышенной проницаемостью для натрия и характерными морфологическими признаками. Преждевременные старение и разрушение эритроцитов связаны с чрезмерной метаболической нагрузкой на клетку и утратой его мембраны.
Селезенка, а не печень, принимает непосредственное участие в развитии заболевания. Сфероциты относительно ригидны и с трудом проходят через мельчайшие отверстия между каналами и синусами селезенки, что обусловливает их секвестрацию и разрушение.
Заболевание развивается в раннем возрасте. Степень анемии значительно варьирует в разные периоды младенчества и детства. Обычно у больного появляется слабая желтушность кожных покровов, пальпируется увеличенная селезенка. Уже на 4-5-м году жизни у ребенка могут формироваться пигментные камни в желчевыводящих путях, состоящие из билирубината кальция. Также у больных с наследственным сфероцитозом могут периодически наступать приступы недостаточности костного мозга. Эти апластические кризы характеризуются ретикулоцитопенией, анемия может перейти в тяжелую, угрожающую жизни форму.
К признакам гемолитической анемии относятся неконъюгированная билирубинемия, ретикулоцитоз и анемия. Уровень гемоглобина обычно составляет 60-100 г/л, число ретикулоцитов 5-20%. Основной дефект эритроцитов может быть продемонстрирован с помощью метода осмотической резистентности, выявляющего разрыв сфероцитов. Тест на аутогемолиз является значительным, так как гемолизируется от 15 до 50 % эритроцитов (в норме в течение 48 часов не более 5 %).
Основным эффективным методом лечения является спленэктомия, предупреждающая желчнокаменную болезнь и апластические кризы. После удаления селезенки быстро исчезают желтуха кожи и ретикулоцитоз, нормализуется уровень гемоглобина.
Повышенный гемолиз при дефиците ферментов эритроцитов (наследственные эритроцитопатии). Эритроциты содержат энзиматическую гликолитическую цепь, с помощью которой в них утилизируется до 90% глюкозы, проникшей через мембрану. Это ферменты глюкозо-6-фосфатдегидрогеназа, пируваткиназа, глютатионпредуктаза, 2-3-дифосфоглицераза, дифосфоглицеромутаза.
75
В связи с большим значением энзимных систем для процесса жизнедеятельности эритроцитов ферментная недостаточность (временная у новорожденных и особенно недоношенных, а также наследственно обусловленная) ведет к сокращению жизни эритроцита и к его более быстрому разрушению. Клинически такая недостаточность проявляется гемолитической анемией с накоплением в крови свободного билирубина.
Гемоглобинопатии и гемоглобинозы как причина повы-
шенного гемолиза. В настоящее время описано более 50 разновидностей патологических гемоглобинов. Наибольшее значение имеют гемоглобинозы, вызванные снижением синтеза нормального взрослого гемоглобина А (талассемия), и гемоглобинозы, обусловленные аномалией первичной структуры молекулы гемоглобина (серповидноклеточная анемия).
Особенностью патологии при талассемии является нарушение регулирования синтеза гемоглобина А с торможением синтеза α- и β-цепи, в связи с чем у больных в эритроцитах отмечается, наряду с гемоглобином А, наличие фетального гемоглобина (HbF) в количестве 15-60% и гемоглобина А2 в количестве 13-15%.
Важным симптомом заболевания является гемолитическая анемия, выявляемая с первых недель жизни. Кожные покровы вначале бледные, затем приобретают грязно-желтый оттенок. Отмечается нарастание размеров живота за счет гепатоспленомегалии. У ребенка выражен «седловидный» нос, имеется отставание в физическом развитии. При большой талассемии рано развивается печеночная недостаточность за счет гемосидероза печени (больные погибают в детском возрасте).
Значительные кровоизлияния (кефалогематома, ретропери-
то-неальная гематома, обширные кровоизлияния в кожу, мозг, надпочечники) могут быть причиной усиленного образования билирубина. У новорожденных, особенно недоношенных, это приводит к резко выраженной желтухе.
Усиленный гемолиз эритроцитов и желтуха могут возникать как при острых инфекциях, вызванных бактериальной флорой (колибациллами, стафилококком) или вирусами, так и при хронических инфекциях (цитомегалия, малярия, токсоплазмоз, листериоз). Эритроциты в подобных случаях разрушаются вследствие непосредственного токсического воздействия.
76
Дифференциальная диагностика доброкачественных гипербилирубинемий
Семейные негемолитические гипербилирубинемии (пигментные гепатозы) представляют собой группу наследственных или наследственно обусловленных энзимопатий, характеризующихся нарушением обмена билирубина и проявляющихся стойкой или перемежающейся желтухой при отсутствии выраженных изменений структуры и функции печени, а также явных признаков повышенного гемолиза и холестаза. Каждый из пигментных гепатозов вызван нарушением преимущественно одной из фаз внутрипеченочного обмена билирубина – захвата, конъюгации и экскреции билирубина.
К ним относятся семь врожденных синдромов: синдром Криглера – Найяра I и II типов; синдром Жильбера; синдром Дабина – Джонсона; синдром Ротора; синдром Люси – Дрисколл; доброкачественный семейный возвратный холестаз; болезнь Байлера. Последние три синдрома встречаются очень редко.
Глюкуронизация билирубина
Осуществляется в мембране эндоплазматической сети гепатоцита. Реакция глюкуронизации протекает под действием микросомального фермента уридиндифосфат-глюкуронилтрансферазы (УДФГТ), превращающего неконъюгированный билирубин в конъюгированный (прямой, связанный) – моно- и диглюкуронид билирубина.
УДФГТ является одной из нескольких изоформ фермента, обеспечивающих конъюгацию эндогенных метаболитов, гормонов и нейротрансмиттеров.
Ген УДФГТ билирубина находится на 2-й паре хромосом. Структура гена сложна (рис. 3). У всех изоформ УДФГТ постоянными компонентами являются экзоны 2-5 на 3* - конце ДНК гена. Для экспрессии гена необходимо вовлечение одного из нескольких первых экзонов. Так, для образования изоферментов билирубин – УДФГТ 1*1 и 1*2 необходимо вовлечение соответственно экзонов 1А и 1D. Изофермент 1*1 участвует в конъюгации практически всего билирубина, а изофермент 1*2 почти или вовсе не участвует в
77
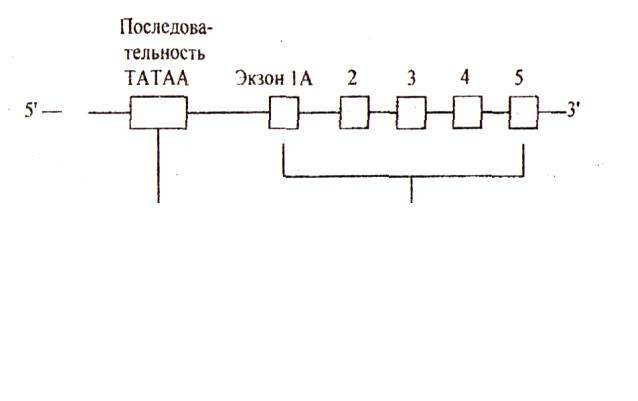
этом. Другие экзоны (1F и 1G) кодируют изоформы фенол-УДФГТ. Таким образом, выбор одной из последовательностей экзона 1 определяет субстратную специфичность и свойства ферментов.
Дальнейшая экспрессия УДФГТ 1*1 зависит также от промоторного участка на 5*- конце, связанного с каждым из первых экзонов. Промоторный участок содержит последовательность ТАТАА.
Детали строения гена важны для понимания патогенеза неконъюгированной гипербилирубинемии (синдромы Жильбера и Криглера-Найяра), когда в печени содержание ферментов, ответственных за конъюгацию, снижено или они вовсе отсутствуют.
Рисунок 3
|
Синдром |
Мутация |
Криглера-Найяра |
синдром Жильбера |
1-го и 2-го типа |
Строение гена УДФГТ 1*1, содержащего 5 экзонов и промоторный участок (последовательность ТАТАА). Всего может быть 10 экзонов
(показан только 1). Экзон 1А (называемый также экзоном 1*1) участвует в экспрессии УДФГТ 1 * 1 (основного активного фермента), экзон 1D (или 1*4) - в экспрессии УДФГТ 1*2.
Синдром Криглера – Найяра I типа
(Crigler J.F. – Najjar V.A.)
В 1952 году американские педиатры Дж. Криглер и В. Найяр описали 2 варианта нового синдрома. Синдром Криглера–Найяра I типа является врожденной патологией, развивающейся в первые часы жизни ребенка, с аутосомно-рецессивным типом наследования. Распространенность в популяции точно неизвестна, но встречается одинаково часто у мальчиков и девочек. К настоящему вре-
78
мени в литературе имеются описания около 50 наблюдений, что свидетельствует о редкости этой патологии.
Патогенез заболевания обусловлен полным отсутствием фермента уридин –5-дифосфатглюкуронилтрансферазы, необходимого для процесса конъюгации билирубина в гепатоците. На молекулярном уровне дефект локализуется в одном из пяти экзонов (1А – 5) гена УДФГТ 1*1. Концентрация билирубина в желчи минимальная, обнаруживаются лишь следы.
При синдроме Криглера–Найяра I типа происходит резкое увеличение концентрации неконъюгированного билирубина в плазме крови (более 200 мкмоль/л). В 1-е сутки после рождения ребенка проницаемость гематоэнцефалического барьера очень высока. Это способствует быстрому накоплению неконъюгированного билирубина в ядрах серого вещества головного мозга и развитию тяжелой картины ядерной желтухи. Билирубиновая энцефалопатия проявляется развитием мышечной гипертонии, нистагма, опистотонуса, атетоза, тонических и клонических судорог, которые могут закончиться летально.
При проведении печеночных проб и гистологического исследования печени изменений найти не удается. Билирубинурия и уробилиногенурия не выявляются, кал ахоличен из-за отсутствия конъюгированного билирубина в желчи больных. Проба с фенобарбиталом не дает положительного результата, что является отличительным признаком при проведении дифференциальной диагностики с синдромами Жильбера и Криглера – Найяра II типа (табл. 1).
Без проведения лечебных мероприятий в 1-е сутки после рождения больные умирают от тяжелейшего поражения ЦНС. Наиболее рациональным в лечении синдрома Криглера–Найяра I типа является назначение частой фототерапии (до 16 часов в сутки), с целью разрушить билирубин в тканях, что позволяет продлить жизнь пациентам. Также используется холестирамин или другие энтеросорбенты. Последующая трансплантация печени считается радикальным методом лечения данного заболевания. Предполагается, что наиболее перспективным будет метод генной терапии (пересадка гена УДФГТ билирубина).
79
Таблица 1
Диагностические критерии синдрома Криглера – Найяра
Показатели |
Синдром Криглера – |
Синдром Криглера – |
||||
Найяра I типа |
Найяра II типа |
|||||
|
|
|||||
Тип наследования |
Аутосомно- |
|
Аутосомно- |
|||
|
|
рецессивный |
|
рецессивный |
||
Патогенез |
|
Отсутствие УДФГТ |
Снижение активности |
|||
|
|
|
|
|
УДФГТ |
|
Развитие заболевания |
В первые часы жизни |
В первые месяцы жизни |
||||
Гипербилирубинемия |
300 – 600 мкмоль/л |
До 200 мкмоль/л |
||||
Энцефалопатия |
|
Доминирует всегда |
Отсутствует |
|||
Желчь |
|
Светлая |
|
Обычного цвета |
||
Глюкурониды |
билиру- |
Отсутствуют |
|
Присутствуют |
||
бина |
|
|
|
|
|
|
Концентрация |
билиру- |
Резко |
ограничена (до |
На уровне нормы |
||
бина в желчи |
|
исчезновения) |
|
|
||
Цвет кала |
|
Бледно-желтый (обес- |
Обычный |
|||
|
|
цвеченный) |
|
|
||
Патология у родителей |
Парциальный |
дефект |
Дефект глюкуронизации |
|||
|
|
(около 50%) конъюга- |
у одного из родителей |
|||
|
|
ции билирубина у обоих |
|
|||
|
|
родителей |
|
|
||
Лечение фенобарбита- |
Неэффективно |
|
Обычно эффективно |
|||
лом |
|
|
|
|
|
|
Прогноз |
|
Крайне |
неблагоприят- |
При адекватной терапии |
||
|
|
ный |
|
|
- благоприятный |
|
Синдром Криглера – Найяра II типа
При данном варианте УДФГТ гепатоцитами синтезируется, но ее активность значительно снижена. Мутация гена, как и в первом случае, отмечается в экзонах 1А-5, однако анализ гена УДФГТ позволяет предположить, что у таких пациентов имеется смешанная гетерозиготность: в одном из аллелей имеется мутация, свойственная синдрому Жильбера, а в другом синдрому Криглера – Найяра.
Концентрация общего билирубина при синдроме Криглера – Найяра II типа достигает 200 мкмоль/л, но более высокие цифры не наблюдаются. Поэтому у больных за счет повышения неконъюгированной фракции билирубина развивается менее выраженная би-
80
