
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
292 Гл. 5. Волоконные световоды для биомедицины
Важное значение для биологии и медицины имеют волоконно-оптические анализаторы микрочастиц, позволяющие осуществлять контроль геометрических и оптических параметров отдельной биочастицы в реальном масштабе времени [1168, 1169]. В [1168] описан прибор, использующий одновременную регистрацию рассеянного частицей света для 16 углов рассеяния. Прием излучения осуществляется с помощью волоконных световодов, вмонтированных в полусферическую оболочку, ограничивающую область взаимодействия лазерного пучка с пролетающей в газовом потоке частицей. Источниками излучения являются Не–Сd-лазер (λ = 441,6 нм, P = 10 мВт) или одноволновый Аr-лазер (P = 10 мВт). Диапазон диаметров частиц — 0,2–4,0 мкм, максимальная скорость счета достигает 200 частиц в секунду. В качестве примера регистрировались пять различных бактериальных клеток Bacillus subtilis, имеющих форму палочки диаметром около 0,5 мкм и длиной от 1,0 до 2,0 мкм. Обнаружены существенные изменения в индикатрисах рассеяния, вызванные как разницей в длинах, так и неоднородностью структуры бактерий. Последнее вызывает сильную асимметрию рассеяния и значительную деполяризацию.
Другой тип анализатора может обеспечить контроль размеров отдельной биочастицы, например микроорганизмов при воздействии на них лекарственных препаратов [1169]. Излучение лазера через одномодовый волоконный световод и градиентную линзу направляется поперек потока суспензии биочастиц, протекающего по цилиндрической кювете. Приемником рассеянного излучения является градиентная линза с пристыкованными к ней двумя волоконными световодами. Эта конструкция сделана так, чтобы по одному световоду на отдельный фотоприемник поступал свет, рассеянный под углом ϑi, а по другому — на другой фотоприемник свет, рассеянный под углом ϑi + ϑi, далее с помощью электронного устройства сигналы с фотоприемников делятся друг на друга и получившийся сигнал используется в качестве информационного. Для определенного соотношения показателей преломления частицы и окружающей жидкости (в [1169] соответственно 1,6 и 1,33) каждому размеру частицы соответствует свой угол ϑi, для которого отношение интенсивностей при ϑi и ϑi + ϑi имеет резкий максимум. Имея три таких детектора рассеянного излучения при ϑi = 30◦, 50◦, 70◦, ϑi = 13◦ и ϑs = 2◦ (определяется числовой апертурой волоконно-оптического датчика), оказывается возможным осуществить контроль размеров биочастиц в пределах от 0,3 до 0,8 мкм.
Подобные устройства могут оказаться полезными и при анализе характера пропускания лазерного излучения биотканями. Некоторые ВОД позволяют измерять трехмерное распределение интенсивности света в биотканях. В качестве облучателя биоткани обычно используется кварцевый ВС с диаметром сердцевины 2a = 400 мкм, торец которого делается плоским и хорошо отполированным. Например, на длине волны λ = 632,8 нм излучение с торца ВС имеет коническую форму с углом раскрыва 10,4◦ в воде и 9,7◦ в биоткани (показатель преломления биоткани равен примерно 1,43). Приемный ВС того же диаметра очищается от оболочки на длину 2 мм от торца и углубляется в биоткань, которая располагается в кубическом боксе с малыми отверстиями для подведения приемного ВС. Другой конец ВС направляется к фотоумножителю. Таким способом, например, была измерена длина изотропии рассеяния мышечной ткани быка. Экспериментальные данные приведены в главе 3 (см. табл. 3.1).
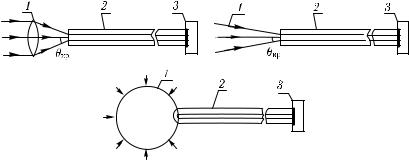
Три типа волоконно-оптических зондов для приема рассеянного излучения показаны на рис. 5.26. Два из них являются анизотропными и собирают либо параллельные, либо сходящиеся пучки света. Область «захвата» излучения такими приемниками определяется числовыми апертурами ВС и оптической системы на входе ВС. Третий тип зонда является изотропным [210, 211, 1192], т. е. в световод
5.5. Биомедицинские волоконно-оптические датчики и зонды |
293 |
попадает излучение в телесном угле, близком к 4π стерадиан. Шарик на конце ВС изготавливают из слабо поглощающего и сильно рассеивающего материала.
Рис. 5.26. Волоконно-оптические зонды для приема рассеянного в биоткани излучения. 1 — лазерный пучок; 2 — ВС; 3 — фотоприемник
ИК-световоды используются для наблюдения состояния внутренних органов по характеру их теплового излучения, максимум интенсивности которого для живых объектов лежит в области 10 мкм. Температурная разрешающая способность волоконного ИК-радиометра — около 0,1 ◦C, а пространственная определяется диаметром сердцевины и равна примерно 1 мм [1114, 1120, 1142]. Лучшими для радиометрических зондов являются ВС на основе галогенидов серебра, которые были использованы для контроля температуры биоткани в процессе воздействия на нее мощного лазерного или СВЧ-излучения. Такие же световоды в сочетании с высокочувствительными и быстродействующими методами ИК-спектроскопии (например, фурье-спектроско- пии) можно применять для детектирования газов и анализа биожидкостей внутри различных полостей человеческого тела, в частности для контроля содержания СО, СО2, СН4, Н2О, спиртов, концентрации анестезирующего газа, компонентов крови, мочи, патологических жидкостей и др. [46, 1134, 1135, 1193].
К оптическим ВОД относятся также разнообразные рефрактометры, основанные на измерении коэффициента отражения света на границе раздела торец ВС — исследуемая жидкость при изменении показателя преломления этой жидкости [1170] или изменении числовой апертуры ВС при погружении его конца в исследуемую биожидкость или биоткань [935]. В первом случае работа датчика описывается формулами Френеля. При использовании 2-милливаттного Не–Nе-лазера, одномодового ВС с диаметром сердцевины 2a = 4 мкм и синхронного детектора среднеквадратичная ошибка измерения n составила 0,2 %. Во втором случае дистальный конец ВС с диаметром сердцевины 2a = 1000 мкм освобождался от оболочки на глубину его погружения в биоткань, которая в данном случае служила оболочкой с новым показателем преломления n0. Регистрация углового распределения излучения на выходе ВС дала возможность рассчитать n0 при известном значении nc по формуле (5.1). Экспериментальные данные для тканей человека и животных приведены в главе 3 (см. табл. 3.2).
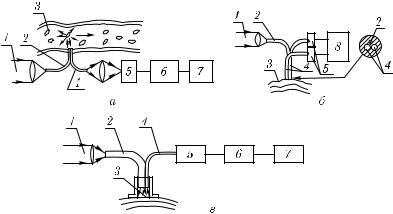
Измерение спектра флуктуаций интенсивности при квазиупругом рассеянии лазерного излучения от движущихся клеток позволяет определять скорость их движения и другие параметры [5, 403, 1138, 1163, 1164, 1175, 1176]. Схематически простейший гомодинный волоконно-оптический доплеровский измеритель скорости потока крови показан на рис. 5.27, а. Он может быть использован для неинвазивной оценки скорости движения потока крови, если излучение хорошо пропуска-
294 |
Гл. 5. Волоконные световоды для биомедицины |
ется стенкой сосуда, а также для измерения профиля скорости движения потока с пространственным разрешением 0,1 мм при введении волоконно-оптического зонда внутрь сосуда. Однако следует учитывать, что зонд внутри сосуда достаточно сильно возмущает поток [1176].
Рис. 5.27. Схемы волоконно-оптических доплеровских измерителей скорости кровотока в сосудах (а); в биотканях (б, в): 1 — лазерное излучение; 2 — облучающий ВС; 3 — кровеносный сосуд или биоткань; 4 — приемный ВС; 5 — фотоприемник (фотодиод или ФЭУ); 6 — анализатор спектра; 7 — компьютер; 8 — аналоговый процессор
Трехволоконный дифференциальный доплеровский измеритель микроциркуляции крови в биотканях (рис. 5.27, б) работает на двух длинах волн (λ = 633 и 780 нм) поочередно, что позволяет повысить надежность измерений in vivo [1163]. Усредненные характеристики кровотока в коже можно получить с помощью анализа временных свойств спекл-поля, образованного при отражении когерентного лазерного излучения от кожи (рис. 5.26, в) [403]. Лазерное излучение с λ = 633 нм поступает на поверхность кожи через многомодовый световод с диаметром сердцевины, равным 80 мкм, отраженное излучение (небольшой фрагмент спекл-поля) принимается одномодовым ВС и далее фотоумножителем с усилителем. Временные реализации спекл-поля, несущие информацию о характере кожного кровотока, обрабатываются с помощью анализатора спектра и компьютера.
Типичная схема дифференциального волоконно-оптического доплеровского измерителя скорости потока биожидкости показана на рис. 5.28. Характерной его особенностью является использование одномодовых ВС с сохранением поляризации и градиентных линз для получения интерференционных полос высокого качества
вобласти протекания жидкости. На данной схеме показана регистрация рассеянного вперед света, хотя можно использовать рассеяние назад и по другим направлениям
взависимости от решаемых задач и условий исследования [1138]. В качестве приемного ВС служит градиентная линза, состыкованная с многомодовым световодом.
Рассмотренная схема требует тщательной юстировки и в значительной мере подвержена влиянию внешних акустических возмущений [1138]. Влияние этих возмущений может быть снижено за счет использования многоканальных анизотропных одномодовых ВС с идентичными слабосвязанными каналами (сердцевинами) в общей оболочке из кварцевого стекла [1171]. Такие ВС обладают следующими свойствами, важными для построения доплеровских измерителей скорости: сохраняют взаимную когерентность излучения в каналах, т. е. дают стабильную интерференционную кар-
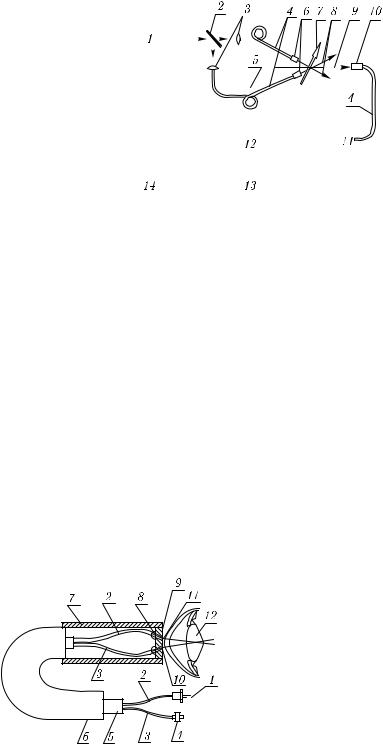
5.5. Биомедицинские волоконно-оптические датчики и зонды |
295 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5.28. Схема дифференциального волоконно-оптического доплеровского измерителя скорости потоков биожидкостей [1138]. 1 — лазер; 2 — расщепитель пучка; 3 — согласующая микролинза; 4 — одномодовый ВС; 5 — фазовый модулятор; 6 — выходная градиентная линза; 7 — исследуемый поток биожидкости; 8 — лазерный пучок; 9 — рассеянный свет; 10 — входная градиентная линза; 11 — фотоприемник; 12 — электронное управляющее устройство; 13 —
коррелятор; 14 — компьютер
тину на выходе; имеют одинаковую ориентацию осей двулучепреломления в диаметрально противоположных каналах; избирательны к направлению деформации.
Когерентный волоконно-оптический фотон-корреляционный спектрометр для ранней диагностики катаракты описан в [386]. В основе датчика — два волоконных световода: один одномодовый, служит для передачи гауссова пучка He–Ne или полупроводникового лазера к объекту, а другой — многомодовый или также одномодовый — для сбора обратно рассеянного излучения под определенным углом и передачи его на фотодетектор (рис. 5.29) и далее на электронный коррелятор. Мощность излучения Не–Ne-лазера (633 нм) порядка 1 мВт с размером пучка на хрусталике около 150 мкм, углы приема рассеянного излучения 155◦ (датчик 1) и 143◦ (датчик 2). Определение по измеренным автокорреляционным функциям флуктуаций интенсивности рассеянного света размеров рассеивателей в хрусталиках человека в зависимости от возраста показывает достаточно высокую чувствительность метода для мониторинга возрастных изменений в структуре хрусталика, связанных с ростом размеров агрегированных белковых компонентов. Возможен клинический вариант измерительной системы для ранней диагностики катаракты. Оценки показывают, что для времени измерения автокорреляционной функции флуктуаций интенсивности около 2 мин ожидаемое значение плотности мощности на ретине должно быть не
Рис. 5.29. ВОД для фотон-корреляционной спектроскопии хрусталика глаза человека: 1 — оптический разъем, соединяющий с гелий-неоновым или полупроводниковым лазером малой интенсивности; 2 — одномодовый ВС; 3 — принимающий ВС; 4 — оптический разъем, соединяющий с электронным автокоррелятором; 5 — тефлоновая трубка; 6 — внешняя защитная оболочка; 7 — корпус; 8 — клеевое крепление; 9 — фланец с прецизионными
отверстиями 10 и 11; 12 — хрусталик [386]
296 |
Гл. 5. Волоконные световоды для биомедицины |
более 0,05 мВт/мм2, что почти на три порядка ниже порога повреждения ретины. В дальнейшем этот датчик использовался для изучения действия лекарственных препаратов против катаракты, показав свою высокую чувствительность к малым изменениям рассеяния света в хрусталике экспериментальных животных [764].
Портативный волоконно-оптический фотон-корреляционный спектрометр на основе He–Ne-лазера (633 нм), одномодовых световодов, фотоумножителя, работающего
врежиме счета фотонов, 288-канального коррелятора, работающего в реальном времени с выборкой 200 нс, описан в [1195]. Он позволяет проводить исследования in vivo хрусталиков пациентов. В этой работе также была подтверждена бимодальность распределения рассеивателей в ткани хрусталика человека, например для здоровых глаз в возрасте 39–43 года (6 глаз, три пациента, женщины) мелкодисперсная фракция имеет средний радиус 4,25 (±1,7) нм, а крупнодисперсная — 497 (±142) нм. Для катарактальных хрусталиков средний радиус мелкодисперсной фракции стремится к 160 нм, а крупнодисперсной — к 1000 нм (см. главу 2). Волоконно-оптический спектрометр позволяет находить распределение частиц по размерам для разных локализаций измерительного объема.
Внастоящее время в литературе описано достаточно много схем волоконно-оп- тических когерентных томографов (ВОКТ) биотканей [1, 12, 13, 16, 19, 21, 29, 31, 33, 125, 432–438]. Типовая схема на основе волоконно-оптического интерферометра Майкельсона, собранного с использованием 50 %-го одномодового разветвителя Х-типа, представлена на рис. 5.30. В работе [436] описан ВОКТ, использующий
вкачестве низкокогерентного излучателя суперлюминесцентный диод (λ = 830 нм,
λ= 30 нм) и одномодовый волоконный интерферометр Майкельсона. Мощность ИК-излучения на поверхности ткани около 30 мкВт. Интерференционный сигнал на доплеровской частоте, определяемой скоростью сканирования зеркала в опорном плече f = 2ν/λ (см. рис. 5.30), пропорционален коэффициенту отражения нерассеянного компонента от оптической неоднородности внутри биоткани. Локализация неоднородности в продольном направлении определяется по равенству длин сигнального и опорного плеч интерферометра в пределах длины когерентности источника света ( 10 мкм), поперечное разрешение при сканировании пучка вдоль поверхности образца — радиусом фокального пятна зондирующего излучения w (обычно w 6 20
мкм, что должно соответствовать требуемой продольной длине зондируемой области, определяемой длиной перетяжки 2nπw2/λ). В зависимости от способа продольно-
Рис. 5.30. Волоконно-оптический когерентный томограф: 1 — источник низкокогерентного излучения (суперлюминесцентный диод или фемтосекундный лазер), 2 — одномодовый воло- конно-оптический интерферометр Майкельсона, 3 — сканируемый в поперечном направлении облучатель биоткани (отдельный слой ткани может быть представлен как диффузно отражающее «зеркало» в рабочем плече интерферометра), 4 — объект, 5 — фотодетектор, 6 — согласующая линза в опорном плече интерферометра, 7 — перестраиваемое в продольном направлении зеркало интерферометра, 8 — демодулятор, 9 — аналого-цифровой преобразователь,
10 — компьютер [1]

5.5. Биомедицинские волоконно-оптические датчики и зонды |
297 |
го сканирования (механический или пьезоэлектрический) двумерные изображения распределения коэффициента отражения ткани (томограммы) размером 4 × 1,5 мм (длина–глубина) с разрешением 15 мкм получали за время от 5 до 20 с. На рис. 5.31 в качестве примера представлены томограммы и соответствующие гистологические срезы нормальной и псориатической кожи человека [436]. Такие томографы хорошо сопрягаются со стандартными эндоскопами и позволяют получать томограммы поверхностных слоев внутренних органов (до нескольких миллиметров): желудка, шейки матки, простаты и пр. Более того, чувствительность метода к скорости движения рассеивающих объектов позволяет регистрировать скорость кровотока в отдельных поверхностных сосудах, распределение скорости поперек сосуда и даже направление скорости [433, 438, 832–836, 843].
Рис. 5.31. Двумерные ОКТ-томограммы кожи человека in vivo и соответствующие гистологические срезы: а — в норме (1 — роговой слой, 2, 3 — эпидермальные слои клеток, 4 — папиллярный слой дермы, 5 — поверхность кожи (ср. рис. 2.1)) (ОКТ-томограмма — сверху, гистологический срез — справа); б — при псориазе (ОКТ-томограмма — слева, гистологический срез — справа); на ОКТ-томограммах все размеры даны в миллиметрах [436]
Большие потенциальные возможности имеет метод лазерной микрофлуориметрии при использовании ВС для изучения тканей и клеток крови in vivo. Исследование флуоресценции НАДН используется для изучения биохимии и физиологии биотканей путем анализа протекания окислительно-восстановительных реакций. Во- локонно-оптический микрофлуориметр (ВОФ) позволяет исследовать микрообъемы тканей в различных областях их локализации [1134, 1135, 1161, 1162, 1165, 1181]. Одна из схем ВОФ показана на рис. 5.32 [1181]. Возбуждение флуоресценции
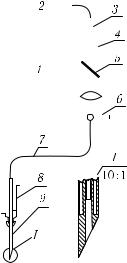
298 |
Гл. 5. Волоконные световоды для биомедицины |
осуществляется лазером на красителях с накачкой от азотного лазера. Длина волны лазера λ = 480 нм, частота повторения импульсов — 60 Гц, пиковая мощность — 25 кВт, средняя мощность — 8 мВт. Для эффективного подавления отраженного от биообъекта лазерного излучения и пропускания света флуоресценции использованы дихроичные фильтры.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Описываемый ВОФ позволяет изучать как однофо- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тонную, так и двухфотонную флуоресценцию. Благо- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
даря сильному синему сдвигу длины волны флуорес- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ценции двухфотонного процесса он обладает большей |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
спектральной селективностью, чем однофотонный. Ин- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тенсивность двухфотонной флуоресценции |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IΦ(2) |
P |
N , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где P — мощность лазерного излучения; s — площадь |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
поперечного сечения пучка в образце; N — концентра- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ция исследуемой примеси. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В установке использованы два типа дихроичных |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фильтров: для однофотонной методики — фильтр с про- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пусканием 40 % на длине волны возбуждения и 90 % на |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
длине волны флуоресценции; для двухфотонной методи- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ки — фильтр с пропусканием 2 и 70 % соответственно. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Флуоресценция при однофотонном возбуждении выде- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ляется с помощью отрезающего фильтра и монохрома- |
|||
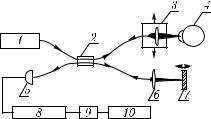
Рис. 5.32. |
Схема волокон- |
тора с полосой 6 нм, двухфотонная флуоресценция — |
|||||||||||||||||
с помощью трех фильтров и двухсантиметровой кюветы |
|||||||||||||||||||
но-оптического микрофлуо- |
|||||||||||||||||||
с раствором СuSО4 (полоса — около 50 нм с центром |
|||||||||||||||||||
риметра: 1 — лазер; 2 — |
|||||||||||||||||||
счетчик импульсов; 3 — фо- |
вблизи λ = 360 нм и пиковым пропусканием, равным |
||||||||||||||||||
тоумножитель; 4 — моно- |
20 %). Сигнал флуоресценции регистрируется с помо- |
||||||||||||||||||
хроматор |
или |
|
оптический |
щью фотоумножителя и счетчика импульсов. Поскольку |
|||||||||||||||
фильтр; 5 |
— |
дихроичный |
интенсивность двухфотонной флуоресценции мала, при- |
||||||||||||||||
фильтр; 6 — устройство для |
ходится охлаждать фотоумножитель сухим льдом, чтобы |
||||||||||||||||||
позиционирования ВС; 7 — |
снизить его шумы. |
||||||||||||||||||
ВС; 8 — |
волоконно-опти- |
Для фокусировки лазерного пучка на торец кварце- |
|||||||||||||||||
ческий зонд; 9 — передняя |
вого световода с диаметром сердцевины 200 мкм исполь- |
|
часть зонда |
||
зуется линза с фокальной длиной 25 мм. Один и тот же |
||
|
||
|
световод осуществляет передачу лазерного излучения, |
сбор и передачу излучения флуоресценции (угол приема ВС равен 25◦). В ВОФ предусмотрено точное позиционирование торца световода относительно сфокусированного лазерного пучка. ВС с целой оболочкой пропускается через пластиковый шприц; рабочий кончик ВС освобождается от оболочки вплоть до сердцевины и вставляется внутрь тонкой иглы; боковое отверстие шприца с ВС соединяет его с другим пластиковым шприцем объемом 3,0 мл. Забор и выпуск жидкости осуществляется синхронными движениями плунжеров обоих шприцев. Положение плунжера шприца с ВС определяет положение рабочего кончика ВС, удаление которого на некоторое расстояние формирует хорошо воспроизводимый измерительный объем (своеобразную кювету) внутри иглы. При удалении торца ВС на 3 мм от края иглы требуется всего 0,4 мкл жидкости для равномерного заполнения ею измерительного объема. Повышение чувствительности флуоресцентного зонда возможно при изготовлении рабочего кончика ВС в виде микролинзы или присоединения к нему
5.5. Биомедицинские волоконно-оптические датчики и зонды |
299 |
сапфирового шарика с целью фокусировки лазерного пучка и более эффективного сбора излучения флуоресценции.
Рассмотренный ВОФ был использован для определения концентрации антиопухолевых препаратов в свежей крови и спинномозговой жидкости. Для однофотонной флуоресценции предельный детектируемый уровень составил (1,3–2,5) · 10−7 моль, а для двухфотонной — (4–16) · 10−8 моль [1181]. ВОФ, предназначенные для исследования биологических тканей in vitro, описаны в [46] (см. также главу 8). ИК-волоконный микрофлуориметр для исследования сенсибилизированных здоровых
ипатологических тканей разработан авторами [310].
Вмедицине и экологии важное место занимают датчики ионизирующего излучения (потоков нейтронов, рентгеновского и гамма-излучения). ВОД ионизирующего излучения основаны на регистрации наведенных радиацией оптического поглощения, изменения показателя преломления и геометрических размеров, люминесценции
исвечения Вавилова–Черенкова [1183]. Их достоинствами являются высокая чувствительность 0,4–1,2 дБ/(км · рад) и дистанционность. При построении датчиков наиболее часто используют в качестве информационного сигнала наведенное оптическое затухание, возникающее за счет создания центров окраски в материале ВС под действием радиации. Величина затухания и скорость восстановления прежних потерь после прекращения действия радиации зависят от типа излучения, полной дозы, мощности, состава, типа и содержания примесей и легирующих добавок в материале ВС. Скорость спада затухания лежит в диапазоне 0,001–10 с.
Как правило, физические ВОД используют разнообразные преобразователи на рабочем конце ВС. Наибольший интерес для биомедицинских применений имеют датчики температуры и давления, которые оказываются наиболее разработанными в настоящее время [1161, 1162, 1165, 1182]. ВОД температуры находят применение, например, для контроля температуры биоткани при лечении раковых заболеваний с помощью СВЧ-терапии, когда электронные датчики оказываются не пригодными. Кроме того, малые размеры ВОД, достаточная чувствительность (±0,1◦С в физиологическом диапазоне температур), возможность одновременного контроля темпера-
туры в различных частях объекта делают их привлекательными во многих случаях. Лучшие ВОД-термометры имеют чувствительность порядка 10−5◦С и погрешность измерений 0,0025 %, что превышает потребности биомедицинских исследований сегодняшнего дня.
Один из наиболее простых температурных ВОД состоит из тонкой пленки жидкого кристалла на дистальном конце ВС. В зависимости от температуры пленки изменяется коэффициент отражения на определенной длине волны, что и является информационным сигналом. Такая жидкокристаллическая термометрия может быть использована и для определения параметров циркуляции крови. В некоторых температурных ВОД используется зависимость от изменения температуры форм мениска или показателя преломления жидкости, что регистрируется с помощью отраженного света, или температурная зависимость интенсивности флуоресценции флуорофора, размещенного внутри дистального конца катетера. В качестве эталонного температурного ВОД может служить датчик с миниатюрным оптическим резонатором на рабочем конце ВС, коэффициент отражения которого сильно изменяется при смещении резонансной частоты, обусловленном вариациями температуры. Возможны
идругие типы термометров, использующие зависимости от температуры спектра интенсивности флуоресценции, состояния поляризации и поглощения света разнообразных преобразователей на рабочем конце ВС [1161, 1162, 1165, 1182].
Для медико-биологических применений перспективен ВОД, который не имеет никаких преобразователей, а его чувствительность к температуре возникает за счет крутого изгиба ВС (рис. 5.33) [1131, 1132]. В области крутого изгиба с радиусом,

300 |
Гл. 5. Волоконные световоды для биомедицины |
меньшим некоторого критического, все излучение покидает сердцевину ВС и выходит
воболочку (нарушенное полное внутреннее отражение (см. (5.5)), затем падает на границу раздела «оболочка — исследуемая среда» и (в зависимости от соотношения коэффициентов преломления оболочки и среды) частично или полностью уходит
всреду (ход лучей в области крутого изгиба ВС показан на рис. 5.5). Чувствительность датчика к температуре может определяться как зависимостью показателя преломления, так и зависимостью коэффициента поглощения исследуемой среды от температуры. Возможно построение изогнутых датчиков и при полностью снятой оболочке в области изгиба (см. (5.6)) [1132].
ВОД давления успешно используют для контроля внутричерепного и внутрисердечного давления. Пробный зонд может быть локализован под твердой мозговой оболочкой или в области родничка у младенца. В основе работы таких ВОД лежит измерение степени натяжения мембраны, возникающее из-за изменения давления, путем регистрации изменений в распределении отраженного мембраной (или закрепленным на ней зеркалом) света с помощью систем из двух собирающих отрезков ВС. Возможны и другие варианты волоконно-оптических измерителей прогиба мембраны [1166, 1184] (см. рис. 5.34 и 5.35).
Рис. 5.33. Схема ВОД с крутым изгибом |
|
Рис. 5.34. Медицинский датчик давле- |
||||||||||||||||||||||||
ВС: 1 — лазерное излучение; 2 — ВС; |
|
ния: 1 — катетер; 2 — ВС; 3 — креп- |
||||||||||||||||||||||||
3 — исследуемая жидкость; 4 — фото- |
|
ление ВС; 4 — зеркало; 5 — стрелка, |
||||||||||||||||||||||||
приемник |
|
указывающая направление силы; 6 — |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
гибкая мембрана; 7 — плавающий стер- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
жень; 8 — крепление стержня |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5.35. Волоконно-оптический датчик на основе Х-разветвителя [532]. 1 — лазерное излучение; 2, 6 — одномодовые ВС; 3 — эпоксидная смола; 4 — толстая мембрана; 5 — сплавной разветвитель; 7 — фотодиоды; 8 — операционный усилитель; 9 — регистрирующее и отображающее устройства
Чувствительным элементом датчика (рис. 5.35) является сплавной Х-разветви- тель на основе одномодового ВС [1166]. Воздействие на толстую мембрану, на которой смонтирован разветвитель, приводит к разбалансу мощности в приемных ВС, что и является информационным сигналом. Отсутствие низкочастотных собственных шумов датчика позволяет проводить измерения акустических и механических колебаний тела в диапазоне 0–30 Гц. Полностью диэлектрический датчик был использован для контроля пульса в области груди, шеи и на запястье в условиях визуализации внутренних органов с помощью техники магнитного резонанса. Сигнал
5.5. Биомедицинские волоконно-оптические датчики и зонды |
301 |
с датчика запускал аппаратуру для визуализации в нужной фазе колебаний сердца, что позволило получать высококачественные изображения внутренних органов. Авторами [1166] была продемонстрирована универсальность датчика при регистрации перепадов давления в потоках, измерений влажности (при использовании специального сенсора на основе пористого стекла).
Наряду с мембранными ВОД давления разрабатываются поляризационные и интерферометрические. В основе поляризационных датчиков лежит зависимость степени двойного лучепреломления у некоторых материалов от давления. Один из вариантов интерферометрического ВОД давления представлен в главе 7 и работе [329]. Датчики давления используют также регистрацию изменений геометрических размеров ВС, их числовой апертуры или потерь света при микроизгибах. Например, микроизгибный датчик для регистрации венозного кровотока в конечностях описан в [1174].
ВОД на основе U-образного отрезка градиентного ВС длиной 10 см, служащего в качестве интерферометра Фабри–Перо, применяется как датчик деформаций внутренних органов человека ([1161], с. 357). Неинвазивный датчик быстрых перемещений стенки грудной клетки, основанный на изменении оптической связи двух отрезков ВС (излучающего и приемного) при отражении от движущейся поверхности
ииспользованный для высокочастотной принудительной вентиляции легких, описан в работе [1177].
Для измерений микроперемещений, деформаций и колебаний биотканей можно рекомендовать ВОД автогенераторного типа с оптической линией задержки (рис. 5.36) [1167]. Его существенным достоинством является частотная индикация полезного сигнала. В замкнутой в кольцо оптоэлектронной системе «лазер — воло- конно-оптическая линия задержки (два отрезка ВС) — фотодетектор — резонансный усилитель радиодиапазона — цепь питания лазера» возникают автоколебания интенсивности излучения, частота которых определяется длиной линии задержки
ичастотой резонансного усилителя. При длине линии задержки, равной 30 м, колебания интенсивности происходят в диапазоне частот 28–30 МГц. Перестройка частоты осуществляется регулированием числа возбужденных мод в многомодовом ВС (максимальное число мод равно примерно 500). Поперечное смещение относительно друг друга концов ВС двух частей оптической линии задержки позволяет легко регулировать число возбужденных мод. Таким способом формируется информационный сигнал (сдвиг частоты колебаний, пропорциональный относительному смещению концов ВС). Возможно совмещение такого ВОД с разнообразными типами биосенсоров. Автогенераторный ВОД позволяет измерять колебания поверхности тела и биомембран с амплитудой 0,01–9 мкм в диапазоне частот 0–2 кГц, точность измерения перемещений (деформации) биообъектов на уровне 0,01 мкм. Он был также использован для измерений показателя преломления растворов биожидкостей, перспективен для контроля температуры, счета частиц и пр. [1167].
Бесконтактные ВО биовиброметры и визуализаторы полей вибраций поверхности кожи, компонентов внутреннего уха, голосовых связок и пр. используют разнообразные интерферометры, спекл-интерферометры или сложную, зависящую от времени спекл-модуляцию отраженного пучка [176, 346, 1184]. В наиболее простой спекл-модуляционной схеме на основе отрезков многомодовых ВС излучение лазера пропускается через многомодовый ВС, который осуществляет доставку спекл-мо- дулированного излучения (за счет многомодовости ВС) на поверхность подвижной мембраны (поверхность кожи и пр.) через фокусирующую линзу с фокусом на поверхности объекта; рассеянное динамическое спекл-поле содержит информацию о различных компонентах движения мембраны (продольных, поперечных и угловых, вклад каждого из компонентов должен зависеть от взаимной ориентации падающего
