
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf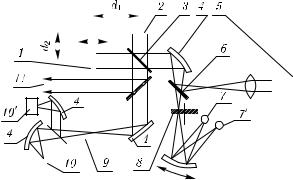
322 |
Гл. 6. Лазерная спектрофотометрия и фурье-спектроскопия |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6.8. Схема фурье-спектрометра при лазерном зондировании. 1 — подвижное зеркало интерферометра Майкельсона; 2 — неподвижное зеркало интерферометра; 3 — расщепитель пучка; 4 — вогнутые зеркала; 5 — широкополосный ИК-лазер с согласующей оптической системой (или рассеянное от биообъекта излучение); 6 — полупрозрачное зеркало; 7, 7′ — источники широкополосного ИК-излучения разных диапазонов; 8 — набор диафрагм; 9 — исследуемый биообъект; 10, 10′ — приемники ИК-излучения двух спектральных диапазонов;
11 — внешний зондирующий пучок спектрометра (оптический выход)
Итак, фурье-спектрометры в исследовании биообъектов обладают целым рядом существенных достоинств: возможностью исследования широкой спектральной области за время одного сканирования, длительность которого может быть очень малой, вплоть до долей секунды; относительно малым влиянием рассеянного света и паразитных засветок на результаты измерений; возможностью исключения этих эффектов при вычислении спектров [1253]. Кроме того, фурье-спектрометры позволяют измерять комплексные коэффициенты отражения или пропускания, т. е. определять показатель преломления среды, что важно для биологии. Фурье-спектрометры обладают значительным спектральным разрешением (0,002–4 см−1), высокой точностью определения волновых чисел (порядка 0,01 см−1), что также является следствием интерференционного принципа измерений. Спектральный диапазон промышленных ИК-фурье-спектрометров перекрывает область от 4 до 40 000 см−1.
Например, авторы [1231] использовали фурье-спектроскопию для исследования вторичной структуры белковых фракций (α-, β- и γ-кристаллинов) хрусталиков быка. Исследовались растворы белков, белки в твердой матрице и тонкие пленки биоткани, полученные из корковой и ядерной частей хрусталиков. Спектры регистрировались
спомощью ИК-фурье-спектрометра типа Nicolet 7199C (США) в диапазоне 1740– 1570 см−1. Было зарегистрировано более 1000 интерферограмм, обработка которых обеспечила получение высококачественных спектров с разрешением на уровне 2 см−1 и отношением сигнал/шум лучше чем 450 : 1.
ВИК-фурье-спектрометрии биообъектов большие перспективы имеет метод полного внутреннего отражения, который обеспечивает легко контролируемый объем исследуемого вещества, определяемый углом падения света на рабочую грань призмы и показателями преломления материала призмы и находящегося в соприкосновении
срабочей поверхностью призмы исследуемого вещества (рис. 6.9). При этом малость объема гарантирует малость влияния поглощения воды на результаты измерений, что очень важно для исследования водных растворов и суспензий биологических веществ и биотканей, содержащих значительное количество воды. Кроме того, отказ от плоской кюветы устраняет нежелательные интерференционные эффекты [1254]. Для биотканей важной также является возможность проведения измерений in situ
6.3. ИК-фурье-спектроскопия |
323 |
биообъектов разной формы и структуры при том, что удается получить однородный контакт с рабочей гранью призмы (исследовать спектры поверхностного слоя биомолекул) и тем самым сосредоточить внимание именно на структуре поверхности биообъектов [1250].
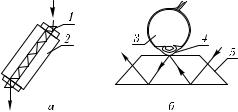
Рис. 6.9. Оптическая часть фурье-спектрометра, использующего нарушенное полное внутреннее отражение в области размещения биообъекта: а — кювета для биожидкостей и клеточных суспензий; б — ZnSe-призма для исследования биотканей (1 — стержень квадратного сечения из ZnSe; 2 — исследуемая биожидкость; 3 — глаз; 4 — роговица; 5 — призма [1250, 1251])
Показанные на рис. 6.9 кювета и призма для исследования биотканей могут быть легко совмещены с ИК-фурье-спектрометром, поскольку у большинства промышленных приборов, например типа IFS66 фирмы Брукер, имеется внешний выход (см. пучок 11 на рис. 6.8).
Представленная на рис. 6.9, а кювета со стержнем из ZnSe (n = 2,4 на λ = 5 мкм), имеющим параллельные входные грани, расположенные под углом 45◦ к продольной оси, была использована для исследования водных растворов глюкозы и сахарозы, а также раствора глюкозы в сахарозе в спектральном диапазоне 770–3290 см−1 [1254]. Авторами [1250] с помощью горизонтальной призмы
(рис. 6.9, б) и ИК-фурье-спектрометра типа Жаско 7000 ( νe = 4 см−1) получе-
ны ИК-спектры поглощения тканей глаза (роговицы, склеры, капсулы хрусталика), некоторых внутренних органов и биожидкостей. Аналогичная горизонтальная призма с рабочей поверхностью 20 × 30 мм и шестью отражениями применялась для получения ИК-спектров цельных растительных и дрожжевых клеток [1254].
Среди интенсивно развиваемых в последние годы методов микроспектрального анализа биообъектов (таких, как КР и КР-фурье-микроскопия, микроспектрофлуориметрия) ИК-фурье-микроскопия оказывается для многих применений наиболее приемлемой благодаря простоте, значительному быстродействию и высокой воспроизводимости результатов. ИК-фурье-микроскопия основана на сочетании двух методик и устройств — ИК-микроскопа и ИК-фурье-спектрометра — и позволяет изучать структуру биологических сред, включая отдельную клетку [1251]. Промышленностью выпускаются ИК-фурье-микроскопы, например Micro FTIR-100 японской фирмы Жаско. Описанный в работе [1251] ИК-фурье-микроскоп позволяет получать спектры пропускания отдельных раковых клеток с пространственным разрешением от 15 × 15 до 6 × 6 мкм. В случае исследования ИК-спектров отражения хрящевой ткани человека пространственное разрешение составляло 50 мкм.
Представленные выше исследования были проведены с использованием нелазерных широкополосных источников ИК-излучения.
Однако такие источники являются малоинтенсивными, и поэтому диапазон применений ИК-фурье-спектроскопии сужается; в частности, возникают трудности при исследовании быстропротекающих фотофизических и фотохимических процессов в биообъектах [1252]. В качестве широкополосных перестраиваемых источников лазерного излучения в ИК-фурье-спектрометрах могут служить СО- и СО2-лазеры
11*
324 |
Гл. 6. Лазерная спектрофотометрия и фурье-спектроскопия |
сквазинепрерывным спектром или полупроводниковые лазеры на основе соединений свинца (см. главу 4). В настоящее время проблема совмещения принципов лазерной абсорбционной спектроскопии с ИК-фурье-спектроскопией биологических объектов находится в центре внимания исследователей.
Благодаря высокому быстродействию за счет параллельного анализа и высокой чувствительности фурье-спектрометры оказываются весьма полезными при построении эффективных систем спектрального картирования биологических объектов (клеток) в видимой и ближней ИК-области спектра. Такая система описана в работе [1256], она содержит интерферометр Саньяка (трехзеркальный), сопряженный
сПЗС-камерой (512 × 512 пикселей). Коллимированный пучок света возбуждает интерферометр, получаемая на выходе интерференционная картина регистрируется на каждом пикселе ПЗС-камеры, а затем с помощью преобразования Фурье вычисляется спектр падающего на интерферометр излучения. Спектральный диапазон спектрометра составляет 400–1000 нм с разрешением в 5 нм на 400 нм и 12 нм на 600 нм.
6.4. Абсорбционная спектроскопия быстропротекающих процессов
Методы ультрабыстрой лазерной спектроскопии позволяют проводить исследования динамики внутреннего движения биомолекул. Во многом именно потребности исследований структурной динамики биомолекул стимулировали развитие пико-
исубпикосекундной спектроскопии, в том числе и абсорбционной спектроскопии быстропротекающих процессов [5, 53, 294, 551, 1224, 1257–1263]. С помощью этих методов исследуются сверхбыстрые процессы колебательного и электронного возбуждения биомолекул, а также динамика химических реакций с их участием.
Абсорбционные методы позволяют определять полное время релаксации биомолекул в основное состояние, время их колебательной релаксации, скорость передачи возбуждения в смеси биомолекул, скорость передачи заряда между биомолекулами в смеси акцепторов и доноров, динамику фотодиссоциации биомолекул в растворе, скорость конформационных изменений и пр. Исследуются первичные процессы фотосинтеза фотосинтезирующих организмов (пурпурных и зеленых бактерий); динамика фотосистем 1 и 2 в зеленых растениях и водорослях; первичные стадии преобразования энергии света родопсинами при изучении фотохимии зрения и биоэнергетики галофильных бактерий (бактериородопсин); фотообратимые фотохромные пигменты (фитохром), выполняющие биорегуляторные функции в клетках многих простейших и растений; динамика фотодиссоциации гемопротеинов (гемоглобина
имиоглобина); структура агрегатов фотосенсибилизаторов в опухолевых тканях и др. Характерные времена рассматриваемых процессов лежат в довольно широком диапазоне, 0,6–200 пс, требуемый диапазон длин волн лазерного излучения для их исследования составляет 460–880 нм.
Основная идея абсорбционной спектроскопии с использованием сверхкоротких импульсов заключается в том, чтобы «уйти» от прямых измерений длительности импульса, прошедшего поглощающую среду. Поэтому используют два последовательных световых импульса, первый из которых переводит биомолекулы из основного в возбужденное состояние, а второй, задержанный на пикоили субпикосекундный интервал времени, так называемый измерительный импульс, регистрирует изменение спектра поглощения исследуемого объекта. Принципиальная схема метода
показана на рис. 6.2, в. |
В данном случае инерционный фотодетектор фиксирует |
те изменения в спектре |
поглощения, которые произошли за время, определяемое |
6.4. Абсорбционная спектроскопия быстропротекающих процессов |
325 |
временной задержкой. Возможны самые разнообразные схемы, реализующие эту идею [5, 294, 1224, 1257–1263]. Возбуждающий и пробный импульсы могут иметь одинаковую и разные длины волн; возбуждающий и зондирующий лазерные пучки могут быть взаимноперпендикулярны и почти коллинеарны; в качестве регистрирующих элементов используются фотодиодные матрицы, видеокамеры, оптические многоканальные анализаторы и отдельные фотодетекторы. Реализованы схемы с одиночными возбуждающим и пробным импульсами, многократным их повторением, с широким спектром зондирующего излучения и пр.
Например, при исследованиях скоростей ориентационной и вращательной релаксации, а также скорости передачи электронной энергии молекул в жидкостях с помощью измерения поглощения пробного импульса для различной взаимной ориентации поляризации возбуждающего и пробного импульсов исследуют наведенную поляризованным возбуждающим импульсом анизотропию в среде [293]. Наибольшее распространение для изучения фотохимических процессов перестройки структуры биомолекул получил метод дифференциальной абсорбционной спектроскопии, который основан на регистрации дифференциальных спектров поглощения, представляющих собой разность между спектрами поглощения до возбуждения и спектрами, зарегистрированными в различные промежутки времени после возбуждения. Изменение оптической плотности исследуемого объекта, D(λ, t), определяется соотношением [294]
D(λ, t) = − lg(T /T0), |
(6.23) |
где T = Eпр/Eоп и T0 = Eпр/Eоп — отношения энергий пробного и опорного импульсов, прошедших через исследуемый образец при возбуждении и без возбуждения.
Вкачестве примера на рис. 6.10 и 6.11 представлены схемы двух типичных пико-
исубпикосекундных абсорбционных спектрометров, реализующих дифференциальную методику измерения спектров поглощения, почти коллинеарное распространение возбуждающего и пробного световых пучков, переменную оптическую линию задержки импульсов.
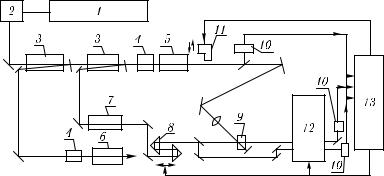
Первая схема [1257] построена на основе оптических параметрических генераторов (ОПГ), она позволяет проводить исследования широкого класса биообъектов при
Рис. 6.10. Схема пикосекундного абсорбционного спектрометра на базе оптических параметрических генераторов [1257]: 1 — генератор пикосекундных импульсов; 2 — система выделения моноимпульса; 3 — усилители пикосекундных импульсов; 4 — преобразователи основного излучения лазера; 5 — параметрический генератор на кристалле КDP; 6 — параметрический генератор на кристалле LiNbO; 7 — кювета с D2О; 8 — линия задержки; 9 — исследуемый образец; 10 — фотодатчики; 11 — электромагнитный затвор; 12 — монохроматор; 13 —
автоматизированная система управления спектрометром
326 |
Гл. 6. Лазерная спектрофотометрия и фурье-спектроскопия |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
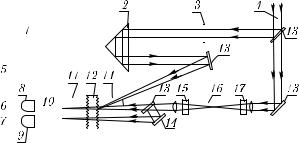
Рис. 6.11. Схема субпикосекундного абсорбционного спектрометра [294]: 1 — компьютер; 2 — оптическая линия задержки; 3 — шторка; 4 — лазерный пучок на λ = 615 нм, τи = 10−13 с; 5 — интерфейс; 6, 7 — цифровые вольтметры; 8, 9 — фотоумножители; 10 — монохроматор; 11 — нейтральные светофильтры; 12 — исследуемый образец; 13 — зеркала; 14 — сине-зеленый светофильтр; 15 — красный светофильтр; 16 — ВКР-кювета (Н2О); 17 — светофильтр КС-18
селективном возбуждении с высокой точностью измерения оптической плотности, вплоть до 2 · 10−4. Источником накачки является АИГ:Nd-лазер с усилителями, что определяет высокую надежность и стабильность работы спектрометра. Возможна замена задающего лазера на лазерную систему на фосфатном стекле, при этом на порядок увеличивается временное разрешение спектрометра. Источником возбуждающего излучения является пикосекундный ОПГ на кристалле КDР, накачиваемый второй гармоникой лазера на АИГ:Nd. При использовании удвоителя и сумматора частот такая система позволяет перекрыть широкий диапазон длин волн, от 330 до 1400 нм, и получать значительный уровень энергии E > 0,1 мДж.
В канале зондирования можно использовать два источника света: ОПГ на кристалле LiNbО3 с удвоителем частоты или источник пикосекундного континуума (ВКР-преобразователь на тяжелой воде). При измерениях кинетических характеристик поглощения в отдельных участках спектра применение ОПГ дает возможность повысить надежность и расширить диапазон измерений за счет высокой стабильности энергетических, спектральных и временных характеристик, широкого диапазона длин волн, включая УФ- и ИК-области спектра, высокой спектральной яркости
имонохроматичности излучения. Последнее позволяет работать без монохроматора
ииспользовать фотодиоды для регистрации сигнала. При снятии дифференциальных спектров нестационарного поглощения более удобным оказывается ВКР-преобразо-
ватель на D2О в сочетании с перестраиваемым монохроматором.
Принципиальным является следующее: импульсы, получаемые от ОПГ, имеют более крутые фронты, чем импульсы лазеров с синхронизацией мод, что позволяет увеличить временное разрешение за счет уменьшения временной области перекрытия возбуждающего и зондирующего импульсов. Рассматриваемый спектрометр допускает применение схемы с зондированием во встречном направлении по отношению к пучку возбуждения, что дает возможность значительно снизить попадание рассеянного света возбуждающего пучка в канал зондирования. Эта возможность особенно важна при исследованиях сильно рассеивающих биологических объектов.
Во второй схеме (рис. 6.11) импульс света гигаваттной мощности длительностью
τ = 100 фс на длине волны λ = 615 нм делится между каналами возбуждения и зондирования. В канале возбуждения импульс через оптическую линию задержки попадает на образец. В канале зондирования происходит преобразование излучения в субпикосекундный континуум (ВКР-преобразование в сантиметровой кювете с водой). Пучок далее делится на два: пробный и опорный. Пробный совмещает-
6.4. Абсорбционная спектроскопия быстропротекающих процессов |
327 |
ся с возбуждающим пучком, а опорный используется для получения информации о спектре поглощения среды в отсутствии возбуждения (см. (6.23)). Изменение временной задержки импульсов позволяет изучать кинетику процессов, а перестройка монохроматора — изменения в спектре наведенного поглощения на выбранных длинах волн. Набор длин волн определяется спектром субпикосекундного континуума, ограниченного в УФ- и ИК-областях спектра полосами поглощения воды. Сигналы после монохроматора принимаются фотоприемниками, оцифровываются и вводятся в управляющий компьютер, который осуществляет накопление данных по многим лазерным вспышкам, их усреднение и вычисление среднеквадратичной ошибки, а также управление работой всего спектрометра. Быстродействующие спектрометры последнего поколения используют титан-сапфировые лазеры фемтосекундной длительности, работающие в области длин волн 800–920 нм (см. главу 4).
В качестве примеров применения лазерной пикосекундной и фемтосекундной лазерной спектроскопии биообъектов, имеющих принципиальное значение для науки о живом, отметим работы [1258–1263]. Из них работы [1258, 1263] посвящены фемтосекундной абсорбционной спектроскопии первичных процессов в бактериальных реакционных центрах фотосинтеза и находятся в ряду интенсивных исследований, проводимых в последние годы в ведущих научных лабораториях мира. Работы [1259, 1261, 1262] посвящены пикосекундной спектроскопии гемоглобина и важны для понимания первичных стадий присоединения и отсоединения кислорода к гемоглобину, а также для установления электронной структуры гемоглобина и оксигемоглобина. Работа [1260] имеет отношение к изучению механизмов фотодинамической терапии и определению эффективности фотосенсибилизаторов, поскольку позволяет определять структуру агрегатов молекул фотосенсибилизатора с молекулами компонентов опухолевой ткани in situ.
Более детальное описание методов лазерной пико- и субпикосекундной абсорбционной спектроскопии биомолекул, лазерных спектрометров сверхвысокого временного разрешения, а также конкретных исследований динамики биомолекул можно найти в работах [294, 998, 999, 1096–1098, 1104, 1105, 1224].
Г л а в а 7
ОПТИКО-КАЛОРИМЕТРИЧЕСКАЯ СПЕКТРОСКОПИЯ БИООБЪЕКТОВ
7.1. Физические основы методов оптико-калориметрической спектроскопии
В основе оптико-калориметрических методов спектроскопии лежит поглощение света с возбуждением уровней энергии молекул вещества биообъекта, последующая безызлучательная релаксация уровней и нагрев объекта. Информационным параметром является изменение температуры образца T (см. рис. 6.1). Степень нагрева определяется величиной поглощающей способности вещества, интенсивностью света и эффективностью конкурирующих процессов (флуоресценции, фотохимического и фотоэлектрического эффектов). Главное достоинство оптико-калориметрических методов состоит в возможности регистрации спектров поглощения сильно рассеивающих сред, что очень важно для биологии и медицины. С помощью таких методов исследуются непрозрачные (оптически плотные) и слабо флуоресцирующие объекты, контролируется протекание фотохимических и фотоэлектрических процессов. Поскольку измеряемым параметром является изменение температуры, то в качестве детекторов применяются неселективные приемники, т. е. отсутствует ограничение по длинам волн со стороны приемника (принципиальная схема оптико-калориметричес- ких методов показана на рис. 6.2, г).
Оптико-калориметрические методы имеют много модификаций, отражающих способы регистрации изменения температуры [5, 12, 13, 31, 34, 41, 58, 150, 159, 329, 330, 363, 365–368, 372–380, 1223, 1274–1356]. Возможны непосредственные измерения температуры с помощью датчиков (оптико-термический метод) и сопутствующих изменений объема образца (оптико-геометрический метод). Перспективным, особенно при исследованиях биообъектов in vivo, представляется метод оптико-термической радиометрии, основанный на измерении теплового излучения нагретого лазерным излучением тела. Наиболее широкое распространение, благодаря своей простоте, надежности, высокой чувствительности и универсальности, получил
оптико-акустический (ОА) (или фотоакустический) метод, заключающийся в преобразовании тепловых колебаний в акустические, которые затем регистрируются микрофоном или любым другим приемником акустических колебаний. Сравнительно широкое распространение получили бесконтактный оптико-термический метод, когда измеряемым параметром является температура окружающего объект газа, и опти- ко-рефракционные методы (в которых измеряемым параметром являются вариации показателя преломления среды, вызванные температурными изменениями): метод тепловой линзы, метод тепловой дефлекции дополнительного (измерительного) лазерного пучка, разнообразные фазовые и интерферометрические методы, включая дифракционные (дифракция на индуцируемых светом тепловых решетках).
Пусть пучок лазерного излучения радиуса w проходит через кювету, заполненную жидкостью (длительность импульса света — τи, частота повторения импульсов — f , длина столба жидкости, освещаемой импульсом, — d). Приемник ОА-сигнала расположен на расстоянии R от оси лазерного пучка. Предположим, что длительность
7.1. Физические основы методов оптико-калориметрической спектроскопии |
329 |
импульса значительно больше времени безызлучательной релаксации τR, времени распространения акустического импульса поперек освещаемого столба жидкости τa и постоянной времени акустического детектора τd (τи τR, w/va ≡ τa, τd, где va — скорость распространения акустической волны в среде). При условии, что безызлучательная релаксация является основным процессом, определяющим ослабление светового пучка, а само ослабление не слишком велико, µad 1, выделяющаяся при поглощении энергия находится на основании закона Бугера:
ET = Eµad, |
(7.1) |
где E — энергия импульса света; µa — коэффициент поглощения.
Поглощение энергии сопровождается локальным повышением температуры T , которое находится из соотношения
T = |
ET |
V ρ = Eµa |
d |
V ρ, |
(7.2) |
|
|
||||
|
cp |
cp |
|
||
где cp — удельная теплоемкость при постоянном давлении; V = πw2d — освещаемый объем; ρ — плотность cреды. Предполагая, что процесс расширения освещаемого объема происходит адиабатически при постоянном давлении, можно подсчитать изменение этого объема:
2 |
2 |
|
|
d |
ρ, |
(7.3) |
V = π(w + w) |
d − πw |
d = βV |
T = βEµa |
|
||
cp |
где β — коэффициент объемного расширения вещества.
Такое расширение создает волну, распространяющуюся в радиальном направле-
нии со скоростью звука. Соответствующее изменение давления |
p пропорционально |
|||||
амплитуде механических колебаний |
x |
w: |
|
|||
p = 2πfavaρ |
x favaρ w, |
(7.4) |
||||
где fa — частота акустических колебаний. |
|
|
|
|||
Используя (5.3), при условии, что |
|
w w, окончательно получим |
||||
|
|
fa |
βva |
|
(7.5) |
|
p |
|
· |
|
Eµa. |
||
w |
cp |
|||||
Соотношения (7.2)–(7.5) дают представление о принципах калориметрических методов. Непосредственную информацию о коэффициенте поглощения cреды µa на определенной длине волны можно получить на основе измерений T (оптико-тер- мический эффект), V (оптико-геометрический эффект) или p (ОА-эффект). Используя связь фокусного расстояния «тепловой линзы» f , угла отклонения пробного
лазерного луча ϕ и сдвига фазы волны в измерительном интерферометре |
ψ с изме- |
||||||||||||
нениями температуры образца T , получим приближенные соотношения и для других |
|||||||||||||
методов [58, 1223, 1275, 1318]: |
|
|
|
|
|
|
|
||||||
«термолинзы» — |
|
|
|
|
T |
|
|||||||
|
|
|
|
dn |
|
|
|
|
|
||||
(1/f ) ≈ |
|
|
|
· |
|
d; |
(7.6) |
||||||
dT |
w2 |
||||||||||||
дефлекционного — |
|
|
|
|
|
|
|
||||||
ϕ ≈ |
1 |
· |
|
dn |
|
|
T ; |
(7.7) |
|||||
n |
dT |
|
|||||||||||
фазового — |
|
|
|
|
|
|
|
||||||
|
2πd |
|
dn |
|
T , |
(7.8) |
|||||||
ψ ≈ |
|
· |
|
|
|||||||||
λп |
dT |
|
|||||||||||
330 |
Гл. 7. Оптико-калориметрическая спектроскопия биообъектов |
где dn/dT — температурный градиент показателя преломления среды n; d — длина области пространственного совмещения возбуждающего и пробного пучков света; λп — длина волны пробного пучка.
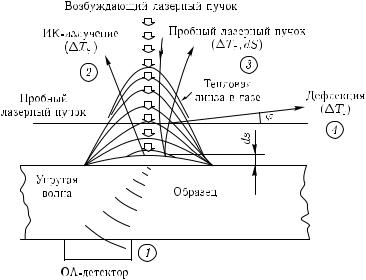
Рассмотренные явления возможны не только в жидкостях, но также в газах и твердых телах. Исследуемая жидкость (твердое тело) обычно окружена газом (воздухом или другими газами) или твердое тело может находиться в жидкости, поэтому возможны самые разнообразные проявления оптико-калориметрических эффектов за счет распространения оптических, тепловых и акустических волн в этих средах. В качестве примера на рис. 7.1 схематически показаны некоторые из обсуждаемых методов лазерной калориметрии образцов биологических тканей [1276].
Рис. 7.1. Схематическое представление некоторых |
методов лазерной калориметрии |
при |
ис- |
следовании биологических тканей [1276]: TS — |
изменение температуры образца; |
Tг |
— |
изменение температуры окружающего образец газа; dS — термоупругая деформация; ϕ — угол дефлекции пробного лазерного пучка; 1 — ОА-метод; 2 — ОТР-метод; 3 — метод тепловой линзы; 4 — дефлекционный метод
Важным параметром, который необходимо учитывать при практической реализации импульсного ОА-метода, является временная задержка между световым и акустическим импульсами. В простейшем случае
τd = |
R |
. |
(7.9) |
|
|||
|
va |
|
|
Инерционность метода «тепловой линзы» определяется временем распространения тепловой волны поперек возбуждающего лазерного пучка, τa ≈ ω/va (время тепловой релаксации среды). При условии, что длительность лазерного импульса τи гораздо меньше τa, фокусировкой лазерного пучка удается сделать метод «тепловой линзы» достаточно малоинерционным, чтобы исследовать широкий круг растворов биологически важных веществ с характерными временами релаксации порядка 0,1–500 мкс [1277].
Дальнейшее обсуждение проведем в основном на примере ОА-метода. В случае газообразных сред, в частности молекулярных газов, для которых скорость столк-
