
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
372 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
описана в работах [567, 568, 970]. Ее отличительной особенностью является сбор излучения с помощью системы из шести световодов, расположенных под разными углами к поверхности (примеры полученных спектров представлены на рис. 6.5).
Еще одна микроспектральная система была разработана для in vivo медицинских исследований, ее основу составляет волоконно-оптический катетер Y-типа [1269, 1361]. Свет от источника (лазера или лампы) поступает на объект по моноволоконному световоду, а отраженный свет или свет флуоресценции собирается шестью световодами, расположенными вплотную вокруг световода — источника, и далее направляется на щель компактного спектрографа с линейкой фотодетекторов (1024 элемента). Система совместима со стандартными эндоскопами, имеет регулируемое расстояние от дистального конца световода до объекта в пределах 0–100 мм, обеспечивает время регистрации спектра порядка 0,3 с, что вполне достаточно для измерений в реальном масштабе времени. Она использовалась для определения степени насыщения гемоглобина крови кислородом и относительного содержания гемоглобина в слизистой оболочке желудка у пациента через полгода после резекции части желудка по поводу рака и во многих других приложениях (см. рис. 6.6) [1269].
Простой, компактный и быстродействующий микроспектрофотометр для исследования спектров отражения, пропускания и флуоресценции рассеивающих биологических объектов описан в работе [1364]. Благодаря быстрому сканированию спектра за счет колебательных движений зеркала, значительной светосиле и возможности исследовать сильно рассеивающие среды он может составить в некоторых случаях альтернативу спектрометрам с многоканальными анализаторами (ОМА). Например, скорость записи спектра отражения слизистой оболочки ротовой полости человека
вдиапазоне 400–891 нм составляет всего 25 мс. Спектрометр имеет волоконно-оп- тическую систему для проведения локальных измерений отражения и пропускания.
Отражательная микроспектрофотометрия с использованием моноволоконных световодов оказывается полезной для in vivo исследований распределения фотосенсибилизаторов в биоткани и сдвигов их линий поглощения в живой ткани по сравнению со спектрами в растворах [1269]. При этом режим с разрешением во времени оказывается предпочтительным при определении сдвигов линий поглощения, поскольку позволяет более надежно отделить вклад поглощения от вклада рассеяния
вспектр отражения (см. главу 2). В работе [1362] использовался импульсный лазер на красителях с накачкой от аргонового лазера с синхронизацией мод (диапазон длин волн — 650–695 нм, длительность импульса меньше 10 пс), средняя мощность излучения на дистальном конце световода меньше 10 мВт, диаметр сердцевины облучающего и приемного световодов 1 мм, расстояние между центрами световодов 8 мм. Торцы обоих световодов непосредственно контактируют с кожей экспериментального животного. Для фотосенсибилизатора Al-фталоцианина был надежно зарегистрирован красный сдвиг линии поглощения порядка 10–15 нм в злокачественных опухолевых тканях. Сдвиг обусловлен взаимодействием препарата с внеклеточным биологическим субстратом, величина сдвига зависит от концентрации красителя. Такой сдвиг линии поглощения необходимо учитывать при проведении фотодинамической терапии.
Как было показано в главе 2, для надежного определения коэффициента погло-
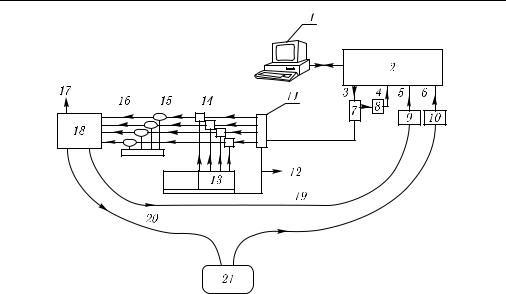
щения (µa) и приведенного коэффициента рассеяния (µ′s) можно измерять частотные зависимости амплитуды и фазы волн фотонной плотности при заданном расстоянии между источником и приемником оптического излучения. На этой основе для in vivo измерений был разработан портативный, многоволновый и многоканальный модуляционный микроспектрометр со сканированием частоты модуляции от 0,3 до 1000 МГц (рис. 8.1) [1366, 1367]. Быстрая перестройка частоты модуляции четырех полупроводниковых лазеров разных длин волн осуществляется анализатором сети
374 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
Рис. 8.1. Многоволновый, многочастотный и многоканальный модуляционный микроспектрометр [1367]: 1 — компьютер; 2 — анализатор сети; 3 — выход; 4 — опорный канал; 5 — канал B; 6 — канал A; 7 — делитель; 8 — аттенюатор; 9 — pin-фотодиод; 10 — лавинный фотодиод; 11 — модулятор тока инжекции лазеров; 12 — связь с компьютером; 13 — драйвер постоянного тока и контроля температуры; 14 — цепь питания лазеров; 15 — полупроводниковые лазеры; 16 — волоконные световоды; 17 — связь с компьютером; 18 — оптический мультиплексор;
19 — опорный ВС; 20 — измерительный ВС; 21 — объект
коэффициентов поглощения на этих длинах волн определяются на основе эксперимента.
Современные методы микроскопии развиваются в направлении обеспечения возможности исследования структуры отдельных клеток in vivo и in situ без их фиксации с одновременной регистрацией внутриклеточных динамических процессов, вызванных жизнедеятельностью клетки. Примерами таких микроскопов являются лазерные доплеровские микроскопы [5, 383, 1370] и быстродействующие фазовые и голографические микроскопы с ультравысоким пространственным разрешением [708–718, 884, 1370, 1371]. Другая тенденция развития микроскопии — это in vivo послойный анализ биотканей с высоким пространственным разрешением. Важным примером такого направления является конфокальная микроскопия [1, 12, 13, 15, 19, 20, 22, 31, 41, 439–446, 707, 785–792]. Основные идеи и методы когерентной микроскопии изложены в главе 2. Здесь мы остановимся только на описании некоторых конкретных схем и приложений.
Конфокальная лазерная сканирующая микроскопия, использующая для селекции пришедших от заданного объема рассеянных фотонов конфокальный принцип (две оптически сопряженные диафрагмы или щели малых размеров в плоскости предметов и изображений), является хорошо разработанным средством визуализации в медицинских исследованиях. Получены трехмерные изображения живой ткани, в частности кожи, с разрешением, позволяющим распознавать различные типы клеток, а также одновременно наблюдать движущиеся клетки крови в микрососудах [442]. С помощью конфокальной микроскопии реального времени успешно визуализируют ткани кожи и зуба in vivo, что уже начинает применяться в медицинской практи-

Т а б л и ц а 8.1. Результаты in vivo измерений оптических физиологических параметров здоровых и патологических тканей, расстояние между центрами излучающего и принимающего световодов равно 22 мм [1377, 1378]
Биоткань |
λ, нм |
µa, см−1 |
µs′, см−1 |
C |
|
, мкМ |
C |
, мкМ |
C |
, мкМ |
C |
H2O |
, М |
|
||
|
|
|
|
|
|
|
Hb |
|
|
HbO3 |
|
Hb+HbO2 |
|
|
|
|
Женская грудь (56 лет): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
здоровая ткань |
674 |
0,04 |
8,5 |
|
|
|
|
|
|
|
|
|
|
|
||
|
811 |
0,035 |
7,4 |
|
4,96 |
|
10,6 |
|
15,56 |
|
6,39 |
|
||||
|
849 |
0,035 |
7,0 |
|
|
|
|
|
|
|
|
|
|
|
||
|
956 |
0,085 |
6,5 |
|
|
|
|
|
|
|
|
|
|
|
||
фиброаденома с гиперплазией протоков |
674 |
0,055 |
|
9 |
|
|
|
|
|
|
|
|
|
|
.8 |
|
|
811 |
0,06 |
|
8 |
|
5,65 |
|
22 |
|
27,65 |
|
6,02 |
.2 |
|||
|
849 |
0,055 |
7,6 |
|
|
|
|
|
|
|
|
|
|
иМикроскопия |
||
|
956 |
0,09 |
9,7 |
|
|
|
|
|
|
|
|
|
|
|||
|
956 |
0,12 |
7,5 |
|
|
|
|
|
|
|
|
|
|
|
||
Женская грудь (27 лет): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
здоровая ткань |
674 |
0,035 |
11,1 |
|
|
|
|
|
|
|
|
|
|
|
||
|
811 |
0,03 |
9,6 |
|
4,1 |
|
8,13 |
|
12,23 |
|
9,4 |
|
||||
|
849 |
0,038 |
9,6 |
|
|
|
|
|
|
|
|
|
|
|
||
киста, заполненная жидкостью |
|
|
|
|
|
|
|
|
|
|
|
|
|
микроспектрофотометрия |
||
674 |
0,07 |
7,9 |
|
|
|
|
|
|
|
|
|
|
||||
|
811 |
0,07 |
7,0 |
|
8,1 |
|
23,6 |
|
31,7 |
|
11,3 |
|||||
|
|
|
|
|
|
|||||||||||
|
849 |
0,08 |
7,0 |
|
|
|
|
|
|
|
|
|
|
|
||
|
956 |
0,16 |
7,0 |
|
|
|
|
|
|
|
|
|
|
|
||
Подкожная аденокарцинома (муж. 62 г.): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
область живота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
здоровая ткань |
674 |
0,0589 (0,0036) |
8,94 |
(0,19) |
|
|
|
|
|
|
|
|
|
|
|
|
|
811 |
0,0645 (0,0032) |
8,82 |
(0,18) |
6,22 (0,64) |
23,9 (1,9) |
|
30,1 (2,0) |
4,09 (2,23) |
|
||||||
|
849 |
0,0690 (0,0025) |
8,77 |
(0,14) |
|
|
|
|
|
|
|
|
|
|
|
|
|
956 |
0,1110 |
(0,015) |
7,00 |
(0,62) |
|
|
|
|
|
|
|
|
|
|
|
опухолевая ткань |
674 |
0,169 |
(0,02) |
8,48 |
(0,73) |
|
|
|
|
|
|
|
|
|
|
|
|
811 |
0,190 (0,015) |
8,30 |
(0,49) |
17,4 (3,6) |
73,4 (8,3) |
|
09,8 (9,0) |
|
— |
|
|||||
|
849 |
0,276 |
(0,03) |
9,93 |
(0,87) |
|
|
|
|
|
|
|
|
|
|
|
|
956 |
— |
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
область спины |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
здоровая ткань |
674 |
0,0883 |
(0,006) |
10,7 (0,4) |
|
|
|
|
|
|
|
|
|
|
|
|
|
811 |
0,0892 |
(0,005) |
9,99 |
(0,27) |
9,68 (1,04) |
33,2 (2,7) |
|
42,9 (2,9) |
|
— |
|
||||
|
849 |
0,0915 (0,0030) |
9,65 |
(0,15) |
|
|
|
|
|
|
|
|
|
|
|
|
|
956 |
0,127 |
(0,03) |
6,3 |
(0,9) |
|
|
|
|
|
|
|
|
|
|
|
опухолевая ткань |
674 |
0,174 |
(0,02) |
10,4 (0,9) |
|
|
|
|
|
|
|
|
|
|
|
|
|
811 |
0,177 (0,013) |
9,23 (0,5) |
19,1 (3,7) |
66,0 (7,4) |
|
85,1 (8,2) |
|
— |
|
||||||
|
849 |
0,190 |
(0,01) |
9,20 |
(0,33) |
|
|
|
|
|
|
|
|
|
|
375 |
|
956 |
0,186 |
(0,16) |
4,7 |
(2,7) |
|
|
|
|
|
|
|
|
|
|
|
376 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
ке [445]. Трехмерное изображение клеток в различных слоях эпителия роговицы позволило установить характер их митоза [443]. При исследовании структуры дентина зуба получено разрешение на уровне сканирующей электронной микроскопии с дополнительной подповерхностной визуализацией ткани с разрешением в 1 мкм на глубину 30–50 мкм [444].
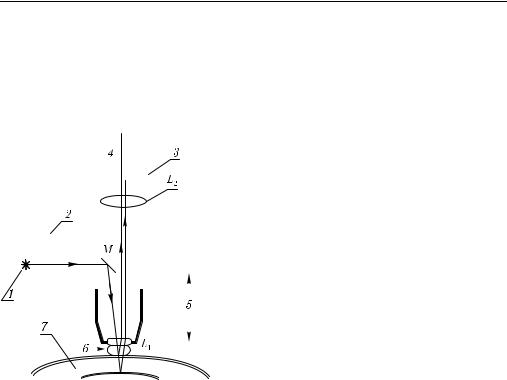
Типичная схема конфокального микроскопа со сканированием вдоль оси z (вдоль
светового луча) представлена на рис. 8.2 [1, |
443]. Микроскоп предназначен для |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
послойного анализа структуры глаза. Излуче- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ние подводится к микроскопу с помощью во- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
локонного световода. Микроскоп содержит две |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
оптически |
сопряженные щели. Изображение |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
одной из щелей проецируется на объект, вто- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рая щель расположена перед фотоприемником. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сканирование положения объектива вдоль оси |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
светового пучка осуществляется с помощью |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пьезопривода, управляемого от |
компьютера. |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Иммерсионная жидкость служит для оптиче- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ского согласования объектива и исследуемого |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глаза. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Другой тип щелевого сканирующего кон- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фокального микроскопа, позволяющего полу- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
чать изображения объекта на разных глу- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бинах, показан на рис. 8.3 [441]. Микро- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скоп работает в реальном времени и служит |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
для исследований тканей глаза in vivo. Глав- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ным элементом микроскопа является двусто- |
|||||
Рис. 8.2. Схема конфокального микро- |
роннее зеркало, которое осуществляет попе- |
||||||||||||||||||||
речное сканирование без смещения оси отра- |
|||||||||||||||||||||
скопа со сканированием вдоль оси све- |
|||||||||||||||||||||
женного пучка (такая схема впервые была |
|||||||||||||||||||||
тового пучка [1, 443]: 1 — источник |
|||||||||||||||||||||
предложена Г. М. Свищевым в 1969 году для |
|||||||||||||||||||||
света (лазер или лампа) с волоконным |
|||||||||||||||||||||
исследования прозрачных рассеивающих объ- |
|||||||||||||||||||||
световодом; 2, 3 — оптически сопря- |
|||||||||||||||||||||
ектов — живой нервной ткани). Для ис- |
|||||||||||||||||||||
женные щели; 4 — к ФЭУ; 5 — скани- |
|||||||||||||||||||||
руемый объектив; 6 — иммерсионная |
ключения |
влияния |
движения |
глаз |
пациен- |
||||||||||||||||
жидкость; 7 — роговица; L1, L2 — |
та на качество изображений использовалась |
||||||||||||||||||||
|
линзы; M — зеркало |
электронная схема, |
обеспечивающая |
необхо- |
|||||||||||||||||
димую частоту сканирования и фазовую синхронизацию всех элементов системы. В качестве примера на рис. 8.4 приведено изображение клеток эндотелия роговицы глаза человека [441]. Высокока-
чественные послойные |
изображения |
клеточных структур тканей глаза |
в нор- |
ме и патологических |
состояниях |
можно найти в работах [439–441, |
443]. |
В зависимости от используемого источника света, приемной системы и типа исследуемой ткани для получения удовлетворительного отношения сигнала к шуму необходимо усреднение по нескольким экспозициям (фреймам). Например, для слабо отражающих тканей глаза (как правило, меньше 1 %) обычно требуется от четырех до восьми фреймов, однако при использовании в качестве детектора высокочувствительной видеокамеры с широкополосным видеомагнитофоном нет необходимости в усреднении по фреймам, т. е. обеспечиваются измерения in vivo в реальном масштабе времени. Несмотря на то что конфокальные микроскопы могут работать с ртутными, ксеноновыми дуговыми или галогеновыми лампами, монохроматическое излучение от лазеров дает более четкие изображения благодаря устранению хроматической аберрации оптической системы. Однако выбор типа лазера должен включать
8.2. Микроскопия и микроспектрофотометрия |
377 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
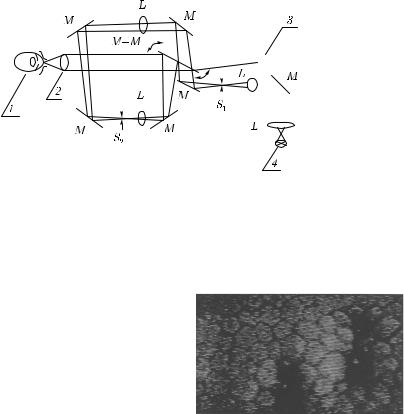
Рис. 8.3. Щелевой сканирующий конфокальный микроскоп, работающий в реальном масштабе времени [441]: 1 — глаз in vivo; 2 — перестраиваемый объектив; 3 — видеокамера; 4 — источник света; M — поворотные зеркала; L — линзы; S1 и S2 — сопряженные щели; M –M — сканирующее двустороннее зеркало
учет глубины проникновения излучения в ткань и пропускания оптической системы микроскопа.
Сравнительные исследования конфокаль- |
|
|
ного и гомодинного (подобного рассмотрен- |
|
|
ному выше фазовому микроскопу) сканиру- |
|
|
ющих микроскопов в приложении к изуче- |
|
|
нию рассеивающих объектов показали, что |
|
|
во многих случаях ограничения конфокальной |
|
|
техники связаны не столько с деградацией |
|
|
изображения за счет рассеянного света, сколь- |
|
|
ко с малым уровнем сигнала [446]. Действи- |
|
|
тельно, для получения удовлетворительного |
|
|
разрешения по глубине (селекции фотонов, от- |
|
|
раженных от определенного слоя, и устране- |
Рис. 8.4. Оптический «срез» роговицы |
|
ния влияния рассеянного света) конфокальная |
человека in vivo (изображение показы- |
|
система должна иметь сопряженные диафраг- |
вает клетки эндотелия на задней по- |
|
мы радиусом (в оптических единицах) νp 6 2, |
верхности роговицы, оптический «срез» |
|
νp = πdpa/λf , где dp — диаметр отверстия, |
сделан на 500 мкм вглубь от поверхно- |
|
сти роговицы, темные участки изобра- |
||
a и f — радиус и фокальная длина линзы, |
||
жения соответствуют патологии эндо- |
||
фокусирующей свет на диафрагму, которые |
||
телия) [441] |
||
пропускают не так много света. Например, |
||
|
при νp = 2 диафрагма пропускает лишь 40 % падающего в пределах ее апертуры света. В то же время интерференционная (гомодинная) схема при использовании узкополосного источника света позволяет значительно снизить это ограничение за счет оптического усиления и, в конечном итоге, получать изображения объекта при том же отношении сигнала к шуму, как и для конфокальной микроскопии, за более короткое время. Дополнительные преимущества интерференционной схемы, связанные с когерентностью света и использованием амплитудного отклика исследуемого объекта, заключаются в появлении нового механизма подавления рассеянного света и возможности регистрировать меньшие различия в отражательной способности различных слоев ткани. Ожидается, что совмещение двух рассмотренных принципов в одном микроскопе, а также использование широкополосных (низкокогерентных) источников света (см. главу 2) даст существенное увеличение селективности, необходимое для исследования рассеивающих тканей [446].
378 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
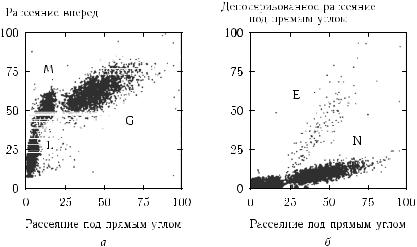
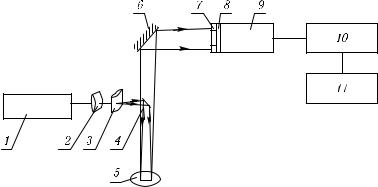
Лазерная и оптическая цитометрия является одним из важнейших направлений медицинской диагностики. Первые коммерческие оптические проточные цитометры появились около 1970 года и были использованы для исследования раковых заболеваний и дифференцирования лейкоцитов [159, 357, 712, 1372, 1373]. Современные оптические пролетные цитометры оборудованы аргоновым лазером небольшой мощности (порядка 15 мВт) или дуговой лампой, иногда добавляется еще один или несколько лазеров (Нe–Ne-, He–Cd-, Kr-лазеры или лазер на красителях). Лазерный пучок фокусируется в пятно малого диаметра внутри пролетной кварцевой ячейки (рис. 8.5). Суспензия клеток и буферная жидкость поступают в ячейку под внешним давлением или за счет прокачки насосом. Суспензия клеток инжектируется через специальное сопло в центр потока буферной жидкости, ускоряется и центрируется за счет гидродинамической фокусировки [357]. Отдельные клетки, пролетая через узкий световой пучок (перпендикулярно ему), индуцируют сигнал светорассеяния (их может быть много: под разными углами, с разными апертурами приема, состояниями поляризации) или сигнал флуоресценции. Обычно интенсивное рассеяние вперед регистрируется с помощью фотодиодов, а малоинтенсивное рассеяние под углом 90◦ и флуоресценция регистрируются с помощью фотоэлектронных умножителей (ФЭУ).
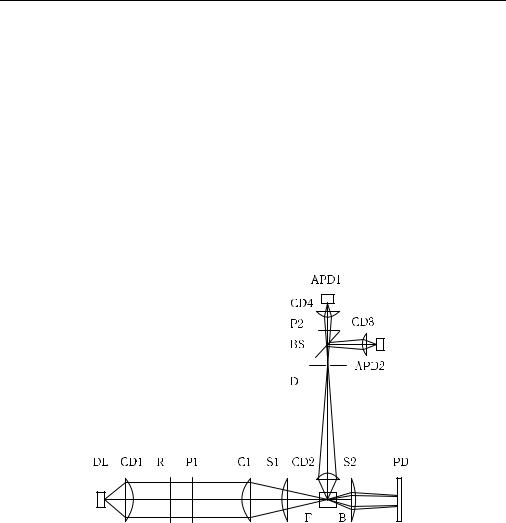
Рис. 8.5. Компактный пролетный цитометр на основе полупроводникового лазера (780 нм) и лавинного фотодиода [1363]: DL — лазер; CD1–CD4 — линзы от CD-проигрывателя; R — полуволновая пластинка; P1, P2 — поляроиды; C1, C2 — цилиндрические линзы; F — пролетная ячейка; B — заслонка для прямого луча; S1, S2 — сферические линзы; PD — фотодиод; D — диафрагма; BS — делитель пучка; APD1, APD2 — лавинные фотодиоды
Для типичных промышленных пролетных цитометров скорость анализа составляет порядка 10 000–100 000 клеток в секунду, минимальный размер анализируемой частицы 0,5 мкм и ошибка измерений (отношение стандартного отклонения к среднему значению величины) по всем параметрам не превосходит 0,5–1,0 %.
Огромное количество цитометрических методов было развито для иммунологии, исследования ДНК и клинических применений [159, 357, 712, 1372, 1373]. Дифференцирование клеток белой крови человека — один из наиболее часто применяемых методов цитометрии в клинических лабораториях.
В пролетной цитометрии рассеяние света используется для контроля многих параметров клеток, таких как их размер, форма, размер ядра, шероховатость мембраны,

380 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
18, 34, 41, 55, 64, 205, 249–253, 257–259, 261, 293–295, 309, 310, 326, 567, 568, 970, 972, 982, 1223, 1246, 1269, 1272, 1358–1361, 1372–1413]. Именно высокая чувствительность (на три порядка выше, чем у абсорбционно-трансмиссионных методов) позволяет осуществлять лазерную микрофлуориметрию биообъектов с очень высоким пространственным разрешением (до долей микрометра) без существенных фотохимических преобразований вещества. Как правило, используется так называемая быстрая флуоресценция, связанная с переходами возбужденной лазерным излучением молекулы из синглетного состояния в основное (см. рис. 6.1; 6.2, д). В этом случае длинноволновый участок спектра флуоресценции является почти зеркальным отражением спектра поглощения.
Помимо малости объема микропробы, флуоресцентный метод характеризуется повышенным отношением сигнала к шуму за счет возможности возбуждения флуоресценции при слабом фоне, а также пропорциональностью сигнала флуоресценции концентрации исследуемого вещества при малой интенсивности флуоресценции.
Флуоресценция характеризуется рядом параметров, изменение каждого из которых несет определенную взаимно дополнительную информацию об объекте. Это такие параметры, как интенсивность флуоресценции, измеренная на определенной длине волны, Iф(λ0); спектр излучения — зависимость интенсивности флуоресценции от длины волны излучения при фиксированной длине волны возбуждения, λв = const, Iф(λ); спектр возбуждения — Iф(λв) при λ = const; квантовый выход флуоресценции F — число излучаемых за секунду квантов Nф к числу поглощаемых за то же время Nв, F = Nф/Nв; время затухания флуоресценции τф — время, за которое интенсив-
ность флуоресценции уменьшается в e раз, Iф = Iф мах · e−t/τф , Iф мах — максимальная интенсивность флуоресценции во время возбуждения; степень поляризации излучения, Pф = (Ik − I )/(Ik + I ), где Ik и I — вертикальный и горизонтальный компоненты интенсивности флуоресценции, регистрируемой наблюдателем.
В настоящее время разработано и описано в литературе большое число лазерных микрофлуориметров, обладающих значительным пространственным, временным и спектральным разрешением, высокой чувствительностью и быстродействием, имеющих широкий диапазон длин волн возбуждения и регистрации флуоресценции различных биообъектов [4, 5, 8, 13, 17, 18, 34, 41, 55, 64, 205, 249–253, 257–259, 261, 293–295, 309, 310, 326, 567, 568, 970, 972, 982, 1223, 1246, 1269, 1272, 1358–1361, 1372–1419].
Лазерный микрофлуориметр собирается обычно на базе промышленных люминесцентных микроскопов, в качестве источника света такого микроскопа используются различные типы лазеров и лазерных систем, работающие в УФили видимой областях спектра (непрерывные и импульсные лазеры, в том числе и лазеры с модуляцией добротности и синхронизацией мод). С помощью импульсных лазеров изучают кинетику флуоресценции. Относительно простые микрофлуориметры работают с непрерывными или квазинепрерывными лазерами, чаще всего с Аr-, Не–Сd- и N2-лазерами. В более универсальных и сложных системах используются перестраиваемые лазеры на красителях с нелинейным преобразованием излучения
вУФ-диапазон длин волн, а для выполнения кинетических измерений — импульсные лазеры с синхронной накачкой или еще более сложные системы со сверхкороткой длительностью импульсов (см. главу 4). Применяются также разнообразные микрофлуориметры, построенные на базе твердотельных лазеров (обычно АИГ:Nd,
впоследнее время стали использоваться и полупроводниковые лазеры) с преобразованием частоты в видимую или УФ-область. Требуемый лазер или лазерную систему для оптимального возбуждения флуоресценции того или иного биообъекта можно подобрать на основании данных главы 4. Необходимо только учесть диапазон
8.3. Флуоресцентный микроанализ |
381 |
длин волн возбуждения, квантовый выход флуоресценции, ожидаемые скорости затухания флуоресценции, а также качество лазерного пучка (его однородность и расходимость), поскольку требуется высокая степень фокусировки (вплоть до долей микрометра).
Три схемы лазерных микроспектрофлуориметров представлены на рис. 8.7–8.9. Первая из них предназначена для повышения контраста при визуализации раковых опухолей путем регистрации флуоресценции накопленных в тканях эндогенных или эгзогенных хромофоров (ПГП, фталоцианинов, ALA-индуцированного протопорфирина IX) на трех длинах волн: λ1, λ2 и λ3 [295]. Например, при использовании ПГП флуоресценция регистрируется на длинах волн 470, 600 и 630 нм. Главная идея схемы заключается в создании с помощью двух цилиндрических линз ленточного лазерного пучка на объекте и приеме излучения флуоресценции от освещаемой УФ-лазером полоски на объекте одновременно тремя группами элементов фотодиодной линейки (ОМА) через три интерференционных фильтра с длинами волн пропускания на λ1, λ2 и λ3.
Рис. 8.7. Экспериментальная установка для пространственно-разрешенной флуоресцентной диагностики рака на трех длинах волн [295]: 1 — азотный лазер (λ = 337 нм); 2, 3 — цилиндрические линзы; 4 — дихроичное зеркало; 5 — объект; 6 — управляемое зеркало; 7 — три интерференционных фильтра на λ1, λ2 и λ3; 8 — линейка фотодиодов; 9 — ОМА; 10 — компьютер; 11 — графопостроитель
Типичный лазерный волоконно-оптический микроспектрофлуориметр (см. рис. 6.6 и 8.8), позволяет проводить исследования биотканей как in vitro, так и in vivo, включая эндоскопические исследования [1269, 1272, 1373, 1378, 1380, 1388–1393, 1396]. Основные его компоненты — это возбуждающий флуоресценцию лазер, семиили десятиканальный волоконно-оптический катетер-пробник, полихроматор и ОМА на основе ПЗС или фотодиодной линейки. В работах [1388, 1389] такой спектрофлуориметр был использован для диагностики внутриэпителиальной неоплазии шейки матки. Облучающий световод имел диаметр сердцевины 200 мкм, а каждый из девяти приемных световодов — 100 мкм. Дистальный конец пробника размещался в алюминиевом защитном корпусе с внешним диаметром около 3 мм, для обеспечения постоянного расстояния между тканью и активной частью пробника на его конец прикреплялся кварцевый цилиндр диаметром 3 мм и высотой 2 мм.
Третья схема реализует измерения флуоресценции с разрешением во времени (см. рис. 8.9) [251, 1409]. Короткие УФ-импульсы излучения третьей гармоники АИГ:Nd-лазера (355 нм) с модуляцией добротности (длительность импульса 2 нс, частота повторения 10 Гц) или импульсы излучения лазера на красителях
