
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf352 |
Гл. 7. Оптико-калориметрическая спектроскопия биообъектов |
в образцах пищевых жиров, детектирования гербицидов и пр. [1293]. Используются также специфические особенности ОА-метода, заключающиеся в изменении ОА-сигнала в зависимости от параметров буферных газов (непоглощающих газов), их молекулярного веса, изотопного состава, теплоемкости, теплопроводности и вязкости. Обычно применяют резонансные спектрофоны, для которых свойства буферных газов проявляются в смещении резонансной частоты, обусловленном изменением скорости звука в смеси, и изменении добротности акустического резонатора за счет различных механизмов затухания в буферных газах.
При анализе загрязнений атмосферы в полной мере реализуются достоинства ОА-метода: высокая чувствительность и чрезвычайно широкий динамический диапазон. Для газов, присутствующих в атмосфере, динамический диапазон по параметру µad составляет 10−7–10−1 при длине кюветы 10 см. Нижний предел определяется чувствительностью спектрофона, а верхний — процессами насыщения. Широкий динамический диапазон позволяет с помощью одного и того же устройства регистрировать следы веществ, загрязняющих атмосферу (малые уровни), и источники загрязнения (большие уровни). Поскольку метод позволяет регистрировать загрязнения в ограниченном объеме (локально) и в реальном масштабе времени, то обеспечивается возможность анализа динамики поступления и ухода примесей в исследуемом объеме. Например, используя дискретно перестраиваемые СО- и СО2-ла- зеры, оказывается возможным регистрировать многие из обычных индустриальных загрязнений атмосферы (СО, NО, NО2, NН3 и т. д.) на уровне их концентрации порядка нескольких частей на миллион (ppm).
В многоволновом газоанализаторе на основе внутрирезонаторной ОА-спектро- скопии с использованием СО-, СО2- и Не–Nе (3,39 мкм) лазеров для устранения фоновых сигналов была применена модуляция длины волны [1294]. В зависимости
от используемого лазерного модуля пределы обнаружения примесей (NО, NО , NН ,
P 3 2 3
С2Н4, СnН2n+2) в газе при атмосферном давлении составляют 0,1–10 ррb, дина-
мический диапазон газоанализатора — 102–105. С помощью компактного волноводного СО2-лазера с поперечной ВЧ-накачкой можно обеспечить диагностику загрязнений от гидразивного топлива и токсических индустриальных веществ на уровне 1–100 ррb.
Отсутствие плавно перестраиваемых лазеров с достаточной выходной мощностью
вИК-области спектра (2–15 мкм) несколько сдерживает широкое внедрение в практику ОА-метода анализа загрязнений атмосферы. В связи с этим перспективными считаются методы нелинейной фотоакустической спектроскопии, в частности активной спектроскопии комбинационного рассеяния. С их помощью определены пороги
обнаружения газов: СН4, СО2, NО2 и С2Н3Сl в атмосфере; они находятся в пределах 1–10 ррm [58, 329].
Применение ОА-метода перспективно также и для определения малых примесей
вжидкостях. Используются лазеры как непрерывного, так и импульсного действия. При работе двухволнового Аr-лазера и жидкостной ячейки (см. рис. 7.10, а) удалось зарегистрировать следы β-каротина в хлороформе на уровне 12 ррt (0,08 нг/мл). Аналогичная ячейка и Аr-лазер (514,5 нм) мощностью 0,5 Вт использовались для детектирования малых концентраций на уровне 14 ррt (0,02 нг/мл) Сd в пенициллине
после его экстракции в хлороформ, а также для анализа малых концентраций канцерогенных пищевых красителей в воде: 2,75 · 10−8 моль/л (0,7 ррb). Предел обнаружения витамина А в экстрактах из крови при возбуждении излучением импульсного азотного лазера (337,1 нм) составляет 1 ррt (2 пг/мл) [58, 329].
Считается, что импульсный метод может иметь более высокую чувствительность (порядка 1–10 ррt) при определении малых концентраций. Однако, чтобы


354 Гл. 7. Оптико-калориметрическая спектроскопия биообъектов
Метод «тепловой линзы», позволяющий проводить измерения с достаточно высоким временным разрешением, был использован для изучения квантового выхода Φ и времени жизни τ синглетного кислорода О2(1 g), сенсибилизированного гематопорфирином и его производными, растворенными в этаноле [1277], а также многими другими фотосенсибилизаторами, растворенными в бензоле. Квантовый вы-
ход синглетного кислорода Φ = S ΦISC, где S |
— доля неупругих взаимодействий |
|
кислорода и сенсибилизатора, приводящих к образованию О2(1 |
g), ΦISC — кванто- |
|
вый выход для процесса образования триплетных состояний фотосенсибилизатора |
||
(см. рис. 1.33). Так, для гематопорфирина в этаноле Φ = 0,53, τ |
= 29 ± 3 мкс, для |
|
других исследованных сенсибилизаторов Φ и S |
изменяются в широких пределах: |
|
Φ = 0,17–0,84; S = 0,25–1,00. |
|
|
ОА-диагностика аэрозолей, мутных и коллоидных растворов важна для качественного и количественного анализа загрязнений атмосферы и гидросферы микрочастицами природного и промышленного происхождения, для контроля за ходом разнообразных биохимических реакций, поскольку по сравнению с традиционно используемым для этих целей абсорбционно-трансмиссионным методом она дает возможность определять малые концентрации микрочастиц, обеспечивает локальность измерений и высокую точность за счет малого влияния эффектов светорассеяния.
Анализ атмосферных аэрозолей ОА-методом можно проводить непосредственно в газовом потоке или (с предварительной их концентрацией) на специальных фильтрах. В качестве источников излучения используют СО2-, Аr-, Не–Nе-, АИГ:Nd- и НF-лазеры, а также лазеры на красителях. Применяют резонансные и нерезонансные спектрофоны, дифференциальные схемы с двумя спектрофонами, калибровку осуществляют по эталонному молекулярному поглощению в газе. Исследовались аэрозоли в виде атмосферной, асбестовой и кварцевой пыли, ацетиленовых, дизельных и сигаретных дымов, выхлопов автомобильных двигателей. Характерные размеры частиц — 0,15–3 мкм. Порог обнаружения на λ = 514,5 нм приблизительно равен 10−6 г/м3 (ацетиленовые и дизельные дымы).
Анализ коллоидных растворов на примере количественного определения частиц ВаSО4 в воде показывает значительный динамический диапазон ОА-метода (почти три порядка величины) и его высокую чувствительность (5 нг/мл или 30 ррb) [58]. Применение ОА-зонда, подобного представленному на рис. 7.10, д, при импульсном его возбуждении излучением лазера на красителях позволило продемонстрировать возможность изучения седиментации частиц молекулярных или макроскопических размеров в гравитационном поле или в центрифуге [1296]. На примере исследования седиментации гуминовых кислот удалось определить динамику осаждения частиц разных размеров (0,08–0,50 мкм). С помощью спектрофона (см. рис. 7.15, в) можно регистрировать отдельные частицы пыли в сверхчистых растворителях.
Основные достоинства ОА-метода — высокая чувствительность и возможность работы в условиях значительного рассеяния света — реализуются при изучении поглощения света в порошках твердых тел и тонких пленках жидкостей. Наиболее чувствительные из рассмотренных выше методов регистрации ОА-сигнала позволяют измерять поглощение света по параметру µad на уровне 10−5–10−6, следовательно у веществ с коэффициентом поглощения порядка µa ≈ 103–102 см−1 можно регистрировать молекулярный монослой (d ≈ 10−8 см). Для анализа порошков необходим тщательный выбор технических условий эксперимента, способствующих устранению влияния рассеянного излучения. Газомикрофонный метод можно реализовать с помощью нерезонансного спектрофона (см. рис. 7.12, г). Для пьезоэлектрической регистрации сигнала наиболее подходят конструкции спектрофонов, представленные на рис. 7.12, а–в. Желательно, чтобы исследуемый образец был достаточно оптически

356 |
Гл. 7. Оптико-калориметрическая спектроскопия биообъектов |
Имеется возможность обнаружения бактерий и определения различных состояний
вих развитии оптико-калориметрическими методами. Так, если в спектре Bacillus subtilis наблюдается сильно поглощающая область, около 410 нм, то бактерии существуют в виде спор; если она отсутствует, то бактерии находятся в вегетативном состоянии. В клетках, выделенных из цианобактерий Anabaema 7120, ОА-методом изучены циклический транспорт электрона в фотосистеме 1, процессы фиксации азота и дыхания.
Спомощью ОА-метода изучают воздействие медикаментов на микроорганизмы, например, действие антималярийного препарата на лиофильные клетки малярийных паразитов. Он не требует специальной подготовки таких образцов и позволяет проводить исследования in vivo. Еще одно успешное применение ОА-спектроскопии — это исследование фотоцикла бактериородопсина. Материалом для изучения служат суспензии пурпурных мембран Halobacterium halobium. Исследования возможны
вшироком интервале температур (90–300 К). С помощью частотной зависимости амплитуды ОА-сигнала можно различать модели энергетики фотоцикла бактериородопсина [329].
Сиспользованием импульсной ОА-спектроскопии с временным разрешением, равным 1,4 мкс, были проведены прямые измерения процессов запасания фотохимической энергии в интактных клетках фотосинтетических бактерий Rhodospirillum rubrum [1299]. Из сравнения ОА-сигналов при возбуждении каротиноидов на λ = 532 нм и бактериохлорофилла на λ = 590 нм оказалось возможным определить, что от 14 до 54 % квантов, поглощаемых каротиноидами, идет на возбуждение бактериохлорофилла путем синглет-синглетного преобразования энергии в фотореакционном центре.
Исследования с бактериородопсином можно проводить методом температурного скачка, который заключается в быстром импульсном лазерном разогреве водных суспензий и растворов биообъектов и наблюдении кинетики фотохимических процес-
сов [1300]. Наилучшим образом для этих целей подходит излучение АИГ:Еr-лазера
с λ = 2,94 мкм, попадающее в полосу поглощения воды (µa ≈ 104 см−1). Длительности импульсов лежат в пико- и наносекундном диапазоне, разогрев объекта составляет от нескольких градусов до десятков, толщина разогреваемого слоя — от нескольких микрон до десятков микрон.
Абсорбционно-трансмиссионная спектроскопия при исследовании крови, как правило, не дает удовлетворительных результатов из-за светорассеяния, обусловленного наличием липидных материалов в плазме и красных кровяных клеток (такие исследования оказываются возможными при значительном усложнении методик измерения и решения обратной задачи рассеяния (см. главы 1, 2 и 6)). В ОА-спектроскопии рассеяние света не играет решающей роли, поэтому методика исследований оказывается более простой. Например, для регистрации ОА-спектров крови в качестве источника света использовались Аr-лазер (мощностью 30–300 мВт) или ксеноновая лампа (300 Вт) [1301]. ОА-ячейка имела сапфировое окно, через которое осуществлялось освещение и которое служило звукопроводом. На одной кромке окна монтировался пьезоэлектрический кристалл. Конструкция позволяла так размещать ОА-ячейку, что освещение исследуемого образца через сапфировое окно могло осуществляться снизу, сверху или сбоку. Особенность получения ОА-спектров образцов, способных осаждаться (к ним относится и кровь), заключается в том, что поскольку концентрация частиц (в которых происходит поглощение света) неодинакова по
глубине и меняется со временем, то амплитуда и фаза сигнала будут зависеть от направления освещения кюветы и меняться с течением времени, что позволяет исследовать процесс осаждения. При освещении кюветы сверху или снизу амплитуда и фаза ОА-сигнала сильно изменялись во времени, а при освещении сбоку оказались

7.4. Области применения оптико-калориметрических методов в биологии и медицине 357
сравнительно стабильными, что позволило получить ОА-спектры цельной крови, в том числе и спектры крови с добавлением токсических веществ. По ним можно судить о химических реакциях в образцах. Многие исследователи указывают на легко регистрируемые изменения в ОА-спектре крови, вызванные разной степенью насыщения ее кислородом. С помощью ОА-спектроскопии цельной крови и выделенных из нее эритроцитов показана возможность диагностики лейкемии (рис. 7.16) и ряда сердечно-сосудистых заболеваний [1302].
Разработаны практические схемы ОА- и ОТ-спектроскопии для гематологии, позволяющие контролировать степень оксигенации цельной крови [1338], процесс ее седиментации и характер патологий. Развиваются также методы ОА-контроля им- 


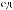

мунного отклика биологических компонентов в клеточных суспензиях на специфические белковые пробы, служащие индикатором ряда патологий, например злокачественных новообразований в тканях кост-
ного мозга или ревматоидных заболеваний. Первые исследования в дерматологии
ОА-методом были выполнены в основном на вырезанных эпидермальных образцах тка-
ней человека и животных [5, 329]. Была обнаружена полоса поглощения протеинов (λ = 280–290 нм), а также получена зависимость амплитуды ОА-сигнала от содержания воды в образце. Интересны эксперименты по контролю медикаментов в тканях,
изучению их действия на кожу, определению скорости их диффузии. Исследования, в частности, показали, что скорость диффузии тетрациклина в коже ладони в 25 раз меньше скорости диффузии воды. Удалось зафиксировать изменения гидратации тонкого рогового слоя (9–13 мкм). Спектр снимается в УФ-области. Увеличение влажности приводит к снижению спектральной кривой за счет изменения свойств рогового слоя (теплопроводности и удельной теплоемкости). Для определения влажности можно ограничиться только одной длиной волны, например в максимуме поглощения на λ = 280 нм. Глубинное профилирование содержания воды в эпидермисе осуществляют путем изменения частоты модуляции.
Другой подход для определения содержания воды в тканях связан с использованием спектра поглощения воды в ближней ИК-области. Такая методика была апробирована на примере синтетического белка и молочного порошка с помощью ОА-ИК-спектрометра. Оказалось возможным определять наличие свободной и связанной воды при измерении поглощения на λ = 1,9; 2,2 или 1,4 мкм. Такая методика определения влажности отличается быстротой проведения анализа, нечувствительностью к изменениям массы образца и размеров частиц.
Главная трудность ОА-измерений на коже in vivo состоит в чувствительности микрофона к движениям тела (мускульная активность, ток крови, нервные импульсы). Для преодоления этих трудностей служит спектрометр с дифференциальной ОА-ячейкой с открытым концом для измерения in situ (см. рис. 7.12, д). Свет на образец поступает по световоду, поэтому можно прикреплять ячейку к исследуемому образцу в любом удобном месте. Получены ОА-спектры кожи брюшной полости крысы, кожи предплечья человека, обработанной мербромином. Эксперименты показали, что ОА-сигналы могут быть зарегистрированы с удовлетворительным отношением сигнал/шум. Измерения глубины проникновения светозащитных препаратов в кожу

358 |
Гл. 7. Оптико-калориметрическая спектроскопия биообъектов |
||
человека in vivo можно осуществить с помощью резонансного микрофона открытого |
|||
типа (см. рис. 7.12, е) путем изменения частоты модуляции света в широких пределах |
|||
(0,18–1,20 кГц) [5, 329]. |
|
||
Таким же образом за счет подходящего выбора термодиффузионной длины (изме- |
|||
нением частоты модуляции) изучено проникновение в кожу поглощающего в УФ-об- |
|||
ласти спектра лекарственного препарата тизанидина — спазмолитика, вводимого |
|||
через кожу. Удалось зарегистрировать разницу в количествах препарата в поверх- |
|||
ностном роговом слое и более глубоких слоях, откуда он уже разносится кровью, |
|||
и тем самым оптимизировать процесс его введения в организм. Использование фа- |
|||
зового метода ОА-спектроскопии в сочетании с экзогенными красителями позволяет |
|||
разделить ОА-спектры β-каротина и гемоглобина и тем самым осуществить in vivo |
|||
глубинное профилирование β-каротина в эпидермисе. |
|||
|
|
ОА-спектроскопия может быть полез- |
|
|
|
ной при диагностике заболеваний глаза. |
|
|
|
С помощью ОА-методики можно получить |
|
|
|
спектр поглощения хрусталика, не разру- |
|
|
|
шая его (рис. 7.17). Максимум поглощения |
|
|
|
при λ = 280 нм обусловлен поглощением |
|
|
|
тирозина и триптофана. Хрусталик, пора- |
|
|
|
женный катарактой, имеет более сильное |
|
Рис. 7.17. |
Оптико-акустические спектры |
поглощение не только в области длин волн, |
|
приблизительно равных 280 нм, но и в ви- |
|||
нормального (1) и пораженного катарактой |
|||
димой и ИК-областях спектра. |
|||
|
(2) хрусталиков [5, 329] |
||
|
Импульсная ОА-спектроскопия с боль- |
||
|
|
||
|
|
шим временным разрешением (≈ 4 нс, ис- |
|
пользуется пленочный ОА-детектор, показанный на рис. 7.13) на трех длинах волн |
|||
(эксимерные лазеры: КrF (248 нм) и ХеСl (308 нм), вторая гармоника АИГ:Nd-лазера |
|||
(532 нм)) позволяет эффективно исследовать оптические, теплофизические и аку- |
|||
стические свойства нормальной и перерожденной ткани аорты человека, определять |
|||
порог разрушения ткани по энергии и временной экспозиции [1304]. Подобные |
|||
исследования важны для реализации методов лазерной ангиопластики, а также |
|||
выявления механизмов абляции биотканей под действием импульсного УФ-излуче- |
|||
ния. На рис. 7.18 представлена характерная зависимость нормированной амплитуды |
|||
ОА-сигнала от плотности энергии падающего на биологическую ткань лазерного |
|||
излучения ([46], с. 1772). На зависимости хорошо определяется пороговая плотность |
|||
энергии, необходимая для абляции. Установлено, что для ткани артериальной стенки |
|||
произведение коэффициента поглощения (см−1) и пороговой плотности световой |
|||
энергии (Дж · см−2) является константой, не зависящей от длины волны в диапазоне |
|||
193–351 нм. ОА-методика дает лучшую точность и большее быстродействие, чем |
|||
обычно используемые методики, основанные на измерении глубины кратера или |
|||
газовой хроматографии продуктов реакции для большого числа воздействующих на |
|||
биоткань лазерных импульсов. В основе ОА-методики лежит тот факт, что в режи- |
|||
ме до порога абляции амплитуда ОА-сигнала пропорциональна энергии падающего |
|||
излучения (см. (7.10)) (соответствует прямой линии, параллельной оси абсцисс на |
|||
рис. 7.18). В области энергии выше порога абляции ОА-сигнал резко возрастает |
|||
(повышается давление) за счет выброса молекул из образца. |
|||
На примере изучения тонких (порядка 30 мкм) срезов роговицы глаз кролика |
|||
при облучении АrF-лазером (λ = 193 нм) определена длительность процесса аб- |
|||
ляции (порядка 30 нс) [1291]. На рис. |
7.19 показаны осциллограммы лазерного |
||
и ОА-импульсов в режиме абляции. Измерения проведены с помощью пленочного |
|||
ОА-приемника (см. рис. 7.13). ОА-метод позволяет также осуществлять мониторинг |
|||

7.4. Области применения оптико-калориметрических методов в биологии и медицине 359
Рис. 7.18. Нормированная |
амплитуда |
Рис. 7.19. Осциллограммы лазерного (сплош- |
||
ОА-сигнала (p/E) для ткани аорты че- |
ная линия) и ОА-импульсов (пунктирная ли- |
|||
ловека в зависимости от плотности энер- |
ния). Использован ArF-лазер (λ = 193 нм), |
|||
гии падающего излучения |
ХеСl-лазера |
плотность энергии в импульсе — 366 Дж/см2; |
||
(λ = 308 нм) с длительностью импульса |
объект — тонкий срез (примерно 30 мкм) |
|||
|
Абляция |
роговицы глаза кролика [1291] |
||
7 нс (◦–◦–◦) и 300 нс (•–•–•). |
2 |
([46], |
||
имеет место для E ≈ 2 Дж/см |
|
|
||
с. 1772) |
|
|
|
|
температуры биоткани и ее коагуляции в процессе лазерной фототермической терапии или ее замораживания и размораживания [1320, 1330, 1331, 1336, 1337]. Контроль процесса абляции ткани (дентина зуба) можно осуществлять и с помощью метода оптотермической радиометрии [1309].
Вряде работ [1290, 1305, 1316] изучаются возможности применения сильных ОА-эффектов в биологии и медицине. В частности, дана классификация сильных ОА-эффектов с точки зрения их применения для деструкции и локальной диагностики биотканей (ОА-«квазигидростатические» эффекты в открытом пространстве
сформированием ударных волн, вызванных оптическим пробоем; «механический» ОА-эффект, который включает механическое движение вещества, а также высокоэффективное ОА-преобразование для ультразвуковой диагностики). Исследуются процессы деструкции желчных камней с помощью высокоэнергетического (до 12 Дж) излучения АИГ:Nd-лазера с λ = 1060 нм, которое доставлялось в область взаимодействия волоконным световодом.
При анализе возможности снижения опасности разрушения окружающих биотканей были проведены исследования влияния сфокусированного излучения АИГ:Nd-ла-
зера с τи = 10 нс и 10 пс с соответствующей энергией 80 и 50 мДж на клеточные структуры клеток типа луковичной кожицы [1305]. Оказалось, что при возникающем вблизи области пробоя давлении порядка 2 · 103 атм не обнаруживается деструкция клеточных структур (также и тканей), что можно связать с близостью акустических свойств клеток и воды. Отметим, что регистрация давления внутри исследуемых тканей была осуществлена с помощью лазерного шлирен-метода.
Вработе [1290] рассматривался процесс фрагментации мочевых и желчных камней с помощью видимого импульсного излучения микросекундной длительности. Для мониторинга процесса абляции камней и выявления роли воды в формировании волн напряжения использовались дефлекционный (см. рис. 7.7) и пьезоэлектрический пленочный приемники акустических волн. Оказалось, что в воде эффективность фрагментации камней в 10 раз выше за счет иммерсионных свойств воды по отношению к волнам напряжения, проходящим через камень в период лазерной абляции.
Значительные возможности в изучении оптических и теплофизических параметров биотканей имеет метод импульсной оптико-термической радиометрии [1279, 1280, 1282–1284, 1287]. Данный метод также оказался достаточно эффектив-

7.4. Области применения оптико-калориметрических методов в биологии и медицине
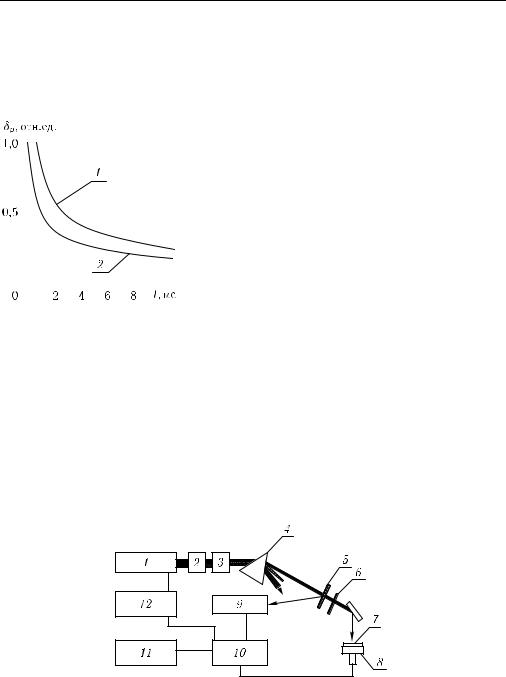
Рис. 7.22. Акустический преобразователь: 1 — биоткань, 2 — лазерный пучок, 3 — облучаемый объем, 4 — акустическая волна, 5 — акустический проводник, 6 — покрытие, согласующее акустические импедансы, 7 — акустический LiNbO3-детектор, 8 — электрод, 9 — к цифровому осциллографу
давления по глубине образца для z > µ−d 1 определяется соотношением [1310]
p(z) = µakE0 exp(−µdz), |
(7.21) |
= βva2/cp; k — коэффициент, учитывающий эффект обратного рассеяния, который увеличивает освещенность верхних слоев ткани; µd — диффузионный коэффициент (см. (2.7)); E0 — плотность энергии лазерного импульса на поверхности образца (Дж/см2), остальные параметры представлены в (7.5). Для оптически толстых об-
разцов
k ≈ (1 + 7,1Rd),
где Rd — коэффициент диффузного отражения.
Соотношение (7.21) справедливо для случая, когда процесс нагрева существенно быстрее скорости расширения среды. Параметр является зависящим от температуры безразмерным параметром, пропорциональным части тепловой энергии, преобразованной в механическое давление. Для воды
= 0,0043 + 0,0053T ,
где T — температура, ◦C; для T = 37◦С ≈ 0,2.
В работе [1310] представлены результаты измерений оптических параметров для ряда биотканей человека и животных, выполненные с помощью ОА-спектрометра, показанного на рис. 7.21. В дополнение к данным табл. 3.1 приведем здесь лишь данные для атеросклеротической аорты человека: µa = 16,5; 3,53 и 0,15 см−1, а µ′s = 72,1; 36,5 и 4,85 см−1, соответственно на длинах волн 355, 532 и 1064 нм, при этом толщина исследуемых образцов была соответственно — 3, 7 и 12 мм, а среднеквадратичная ошибка измерений оценивалась как 10, 15 и 50 %.
