
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
8.4. КР-микропроба |
403 |
Та б л и ц а 8.5. Колебательные полосы, наблюдаемые для тканей груди в норме, для инфильтрирующей карциномы протоков (ИКП) и соответствующих биологических компонентов [63]
Норма |
Метил- |
Тип колебаний, |
ИКП |
Коллаген, |
Тип колебаний, |
|
олеат |
вещество |
|
тип I |
вещество |
|
|
|
|
|
|
727 |
728 |
Плоские =С–H |
817 |
814 |
С–С валентные |
849 |
856 |
|
856 |
855 |
С–С валентные |
870 |
868 |
|
876 |
874 |
С–С валентные |
890 |
887 |
|
920 |
920 |
С–С валентные |
972 |
973 |
Неплоские дефор- |
937 |
934 |
С–С валентные |
|
|
мационные =C–H |
|
|
|
10051 |
|
Каротиноиды |
10043 |
1002 |
Фенилаланин |
1066 |
1067 |
Валентные С–С |
1043 |
1032 |
Пролин |
1079 |
1082 |
Валентные С–С |
1125 |
1127 |
|
1119 |
1118 |
Валентные С–С |
11571 |
|
Каротиноиды |
11571 |
|
Каротиноиды |
1167 |
1166 |
|
11901 |
|
Каротиноиды |
11901 |
|
Каротиноиды |
|
|
|
1206 |
1206 |
Оксипролин, тирозин |
|
|
|
1247 |
1247 |
Амид III |
1265 |
1268 |
Плоские =C–H |
1267 |
1269 |
Амид III |
1303 |
1304 |
Крутильные CH2 |
1303 |
1319 |
CH3, CH2 крутильные |
|
|
|
1343 |
1343 |
CH3, CH2 веерные |
13702 |
|
Миоглобин |
13582 |
|
Миоглобин |
1439 |
1442 |
CH2 ножничные |
1450 |
1451 |
CH3, CH2 |
|
|
|
|
|
деформационные |
15231 |
|
Каротиноиды |
15251 |
|
Каротиноиды |
|
|
|
1554 |
1554 |
|
1654 |
1655 |
Валентные С=С |
1657 |
1665 |
Амид I |
1743 |
1743 |
Валентные С=О |
|
|
|
1 Эти полосы каротиноидов наблюдаются только при видимом возбуждении.
2 Эта полоса миоглобина наблюдается только при видимом возбуждении.
3 Эта полоса относится к коллагену при ИК-возбуждении и к каротиноидам при видимом возбуждении.
(белки, липиды, ДНК и пр.), но и характером окружения и взаимодействия молекул между собой. Именно из-за значительной вариабельности окружения молекул — индикаторов патологии в объемных тканях — возникают трудности в идентификации специфических конформационных изменений молекул, связанных с возникновением патологии. Эти трудности могут быть преодолены за счет получения новой информации о биохимических процессах, происходящих в здоровых и патологических биотканях, полученной, в том числе, другими независимыми методами. Тем не менее, уже сейчас требуются широкие клинические исследования, продвижение в этом направлении обусловлено не только результатами фундаментальных биохимических и спектроскопических исследований, но и наличием простой и доступной экспериментальной базы. В связи с развитием и доступностью новых типов мощных полупроводниковых лазеров, спектрографов изображения, высокочувствительных и быстродействующих ПЗС- и КМОП-камер оказывается возможным построить


8.5. Эмиссионная спектроскопия лазерной микропробы и метод LАММА |
405 |
Рис. 8.21. КР-спектр здоровой ткани молочной железы, снятый с помощью портативного спектрометра на полупроводниковом лазере (782 нм) с воло- конно-оптическим пробником. Измерения с полосой разрешения спектрометра 6,7 см−1, мощность излучения возбуждения 7 мВт, время интегрирования 60 с. Полосы, отмеченные как SR, соответствуют КР-полосам кремния волоконно-оптического пробника: 1 — спектрометр; 2 — ПЗС-камера; 3 — лазер;
4 — ВО-пробник [1255]
компактный спектрометр ИК КР-микропробы с регистрацией спектров за достаточно короткое время. Один из прототипов такого прибора показан на рис. 8.21 [1255]. Современные технологии КР-микроскопии для применений в клинической медицине и микробиологии представлены в специальных выпусках журнала J. Biophotonics [1422, 1423].
КР-технология с возбуждением в ближнем ИК-диапазоне стала настолько доступной и совершенной, что начались интенсивные исследования и разработки по неинвазивному мониторингу содержания глюкозы в коже с целью создания глюкометра — прибора широкого медицинского применения [352]. Метод резонансного КР нашел свое применение в дерматологии для мониторинга антиоксидантов в коже в ее нормальном состоянии и при различных воздействиях на кожу, включая инфракрасное излучение и косметические препараты [343, 345, 349].
8.5.Эмиссионная спектроскопия лазерной микропробы
иметод LАММА
Эмиссионная спектроскопия лазерной микропробы относится к методам лазерной аналитической спектроскопии, использующим эффекты лазерного фотовозбуждения
ифотоионизации предварительно подготовленных проб биообъектов (локальное испарение или распыление лазерным, электронным или ионным пучками или другими средствами) [293, 982, 1223, 1424–1432]. Данные методы обладают высокой чувствительностью и позволяют получить количественную информацию о содержании различных элементов в биообъектах.
Биообъект предварительно тем или иным способом атомизируется или обеспечивается десорбция молекул с его поверхности. Наряду с лазерными используются
инелазерные способы атомизации и десорбции. После подготовки образца, используя различные методы однофотонной или многофотонной ионизации лазерным излучением, получают поток ионов, который анализируют разнообразными способами, включая масс-спектрометрию. Конечно, в конкретных исследованиях фазы подготовки объекта и ионизации его компонентов могут быть совмещены во времени и обеспечены одним и тем же лазером, однако такое совмещение приводит к снижению чувствительности. Схематически фотоионизационные методы показаны на энергетической диаграмме (см. рис. 6.1). Принципиальные схемы устройств атомно-фото- ионизационной спектроскопии и лазерной масс-спектрометрии даны на рис. 6.2, е, ж.
Влазерном микроспектральном анализе для исследования вещества, переведенного с помощью лазера в газовую фазу, можно использовать любые подходящие методы спектроскопии. Наиболее часто применяют эмиссионную и абсорбционную спектроскопию и масс-спектрометрию.
406Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
Влазерном варианте эмиссионная спектроскопия, сохраняя все свои достоинства, связанные с высокой чувствительностью, приобретает принципиально новое свойство — возможность отбора микропроб. При отборе микропроб используется высокоинтенсивное импульсное излучение лазера, которое жестко фокусируется на объект. Вещество, выброшенное из области фокуса при испарении, обычно вводится в дуговой разряд, где происходит его довозбуждение (хотя и сама лазерная плазма может быть источником излучения для спектрального анализа). Эмиссионный спектр излучения исследуется разными способами в зависимости от решаемых задач. Например, в приборе LМА-10 используется дифракционный спектрограф с фотографической регистрацией спектра. Прибор обеспечивает минимальные размеры проб,
10· 10 мкм2, при аналитической чувствительности, равной 10−11–10−13 г. В качестве лазерного источника применяется рубиновый лазер с модуляцией добротности.
Анализ спектра лазерной плазмы может быть проведен также с помощью оптических многоканальных спектральных анализаторов с фотоэлектрической регистрацией (ОМА). Важное достоинство таких схем регистрации заключается в мгновенной обработке данных одновременно по нескольким различным элементам.
Взависимости от решаемых задач микроанализ производят в различных усло-
виях: в вакуумированной камере (p 6 10−3 Па), в атмосфере буферного газа (p ≈ 102–104 Па), а также при облучении образцов на открытом воздухе. Разработанные и используемые на практике приборы для лазерного микроспектрального анализа обеспечивают высокую абсолютную и относительную чувствительности, селективность отбора микропроб, высокую избирательность по отношению к исследуемым элементам, возможность одновременного определения группы элементов, не требуют предварительной подготовки объектов (возможны измерения in situ) и пр.
необходим для прогнозирования состояния гла- |
||
за и соответствующей лекарственной терапии |
||
для устранения химических повреждений глаза |
||
(металлоз), особенно рецепторов сетчатки. |
||
|
Имеются сообщения о применении микро- |
|
анализа в гистохимии для определения содер- |
||
жания тяжелых металлов, в частности золота, |
||
в клетках тканей. Была также предпринята по- |
||
пытка сделать стандартные методики для опре- |
||
деления Fe, Co, Ni, Cu и Zn в биоматериалах |
||
лазерно-эмиссионным методом. |
|
|
|
Индуцированный лазером |
эмиссионный |
спектр атеросклеротической бляшки показан на |
||
рис. 8.22, он был зарегистрирован через 0,6 мкс |
||
после воздействия лазерного импульса от лазера |
||
на |
красителях, работающего на |
λ = 690 нм |
и имеющего длительность импульса, равную |
||
0,8 |
мкс. Видна широкополосная подставка |
|
в полосе длин волн 350–500 нм, обусловленная |
||
Рассмотрим несколько примеров применения эмиссионной спектроскопии лазер- |
||
ной микропробы в медицине. Первый пример относится к применению промыш- |
||
ленного прибора LМА-10 для анализа микроскопических металлических инородных
тел, извлеченных из глаза пациента. Анализ элементного состава инородного тела |
||
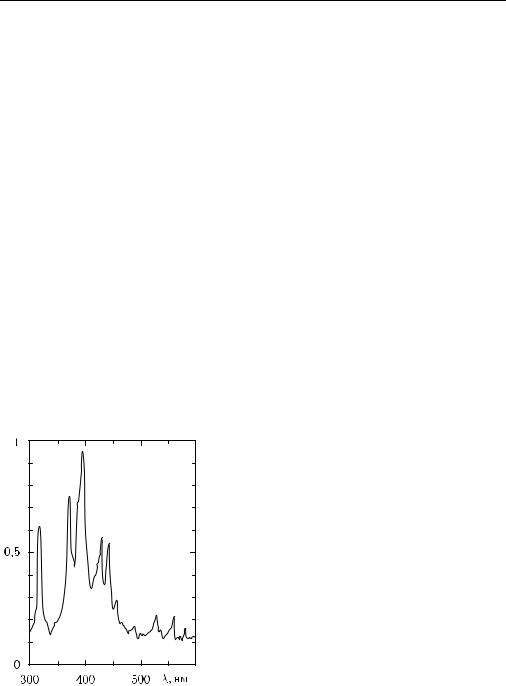
Рис. 8.22. Эмиссионный спектр атеро- |
тормозным излучением, и наложенные отчетли- |
|
склеротической бляшки в обызвеств- |
||
вые эмиссионные линии. Для длин волн короче |
||
ленном состоянии при лазерной абля- |
||
400 нм эти линии обусловлены ионами кальция |
||
ции на λ = 690 нм [46, с. 1783] |
||
(Са II), а для более длинных волн — эмиссией |
||
|
||
8.5. Эмиссионная спектроскопия лазерной микропробы и метод LАММА |
407 |
нейтрального кальция (Са I). Характер спектра свидетельствует о возникновении плазмы при лазерной абляции биоткани и может служить в качестве контроля процесса абляции. Порог абляции заизвесткованной атеросклеротической бляшки по энергии лазерного импульса составляет примерно 100 мДж. Эмиссионный спектр регистрировался в любой момент времени после начала лазерного импульса с помощью дифракционного спектрометра и ОМА. К концу вызванного лазером свечения в области взаимодействия излучения с веществом широкополосная подставка в спектре уменьшалась по амплитуде, а эмиссионные линии становились более отчетливыми.
Совмещение лазерного испарения вещества с последующим абсорбционно-транс- миссионным анализом паров позволяет сочетать достоинства обеих методик, т. е. получать высокую степень локальности и значительную чувствительность [982]. Например, при работе со стандартными образцами, содержащими следовые концентрации Сd, Нg и Zn, оказалось возможным определять концентрации, меньшие чем 10 ррm, для диаметра кратера около 40 мкм, образованного лазерным импульсом (абсолютная чувствительность 0,1 пг вещества). Были проведены также исследования распределения содержания Сd в корковом веществе почки человека. Образцы ткани были приготовлены в виде тонких срезов толщиной 4 мкм. Калибровка осуществлялась по таким же срезам с известной концентрацией Сd. При измерениях диаметр лазерного кратера в образце составлял примерно 50 мкм. Измерения содержания Сd в различных функциональных областях коркового слоя почки человека дали такие значения: 45 ± 8 ррm (в области почечного клубочка), 80 ± 30 ррm (вблизи области прикрепления мочевых канальцев) и 60 ± 6 ррm (на периферии мочевых канальцев). Анализ после растворения в кислоте показал, что исследуемая почка содержит Сd на уровне 43 ррm во всем корковом веществе.
Фемтосекундные лазеры имеют свои особенности проведения микроспектрального анализа, которые связаны с генерацией гармоник лазерного излучения
ирентгеновского излучения, что позволяет проводить дополнительную калибровку
иполучать новую информацию о составе вещества объекта [1432]. Спектральный анализ плазмы дентина зуба человека, создаваемой при взаимодействии
сфокусированного излучения форстеритового лазера ( |
= 1250 нм, |
τ |
|
2 |
110 фс, |
||
λ |
13 |
15 |
|
|
и |
вблизи |
|
fи 10 Гц, Emax 400 мкДж) с интенсивностью I 10 –5 · 10 |
|
Вт/см |
|||||
поверхности образца, показал наличие спектральных линий следующих элементов C, O, Ca, Zn, Na, Cu (рис. 8.23). Генерация жесткого рентгеновского излучения с энергиями E > 30 кэВ наблюдалась при интенсивностях I 5 · 1015 Вт/см2 внутри абляционного кратера или канала. Скорость абляции при этом была 4 мкм на импульс, глубина канала достигала 480 мкм в образце толщиной 1 мм.
Принцип масс-спектрометрии заключается в ионизации молекул исследуемого вещества, разделении ионов и анализе их по отношению массы к заряду m/z. Принципиальная схема масс-спектрометра показана на рис. 6.2, ж. Использование лазерной фотоионизации обеспечивает повышенную селективность анализа, высокий выход ионов (до 100 %) и возможность исследования короткоживущих продуктов [293]. Образование ионов под действием лазерного излучения происходит при интенсивностях в диапазоне 10–1011 Вт/см2. Используются СО2-, рубиновые, неодимовые, азотные, эксимерные лазеры, лазеры на красителях и другие высокоинтенсивные лазеры.
Масс-спектр представляет собой распределение массовых пиков по интенсивности и является характеристикой исследуемого биообъекта. Качество масс-спектромет- рической системы определяется разрешающей способностью, Rm = m/ m (m — средняя масса ионов; m — минимальная разность масс ионов, регистрируемых отдельно), и светосилой (отношением количества ионов, дошедших до детектора, к общему числу ионов, образованных в источнике ионов) [1433]. Светосила в конеч-

408 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
Рис. 8.23. Экспериментальная установка на основе ИК фемтосекундного форстеритового ла-
зера (λ = 1250 нм, τи 110 фс, fи 10 Гц, Emax 400 мкДж) (а): ДЗ — дихроичное зеркало отражающее излучение лазера с длиной волны и пропускающее видимое излучение
на спектрометр; ФЭУ — два фотоэлектронных умножителя с NaI сцинтиллятором для регистрации рентгеновского излучения с фронтальной и задней сторон образца; спектры обратно рассеянного излучения плазмы дентина при интенсивности возбуждения лазера 1015 Вт/см2 от образца дентина толщиной 200 мкм; хорошо видны линии элементов, а также сигналы второй (2ω) и третьей (3ω) гармоник излучения лазера (б) [1432]
ном итоге определяет абсолютную и концентрационную чувствительности (пределы обнаружения) прибора. Абсолютный предел обнаружения — это количество вещества в граммах, которое необходимо, чтобы зарегистрировать один из элементов данного вещества. Концентрационная чувствительность представляет собой минимальную относительную концентрацию регистрируемого примесного элемента.
В лазерной масс-спектрометрии наиболее широкое применение нашли времяпролетные системы с селекцией ионов в секторных электрических или магнитных полях, статические системы с двойной фокусировкой и динамические масс-спектрометры типа «масс-рефлектрон» [293, 1433].
8.5. Эмиссионная спектроскопия лазерной микропробы и метод LАММА |
409 |
Лазерная масс-спектрометрия используется для детектирования атомарных и молекулярных кластеров, примесных молекул и радикалов в газах, с ее помощью исследуются различные соединения, важные для биологии, медицины, фармакологии. Например, близкая к 100 % эффективность двухступенчатой фотоионизации молекул нафталина излучением КrF-лазера (248 нм) позволяет детектировать одиночные молекулы в объеме облучения за один лазерный импульс [293]. В результате чувствительность анализа соответствует регистрации молекул нафталина при их парциальном давлении на уровне 10−12 Па или относительной концентрации в воздухе, равной 10−9.
Существенным недостатком масс-спектрометрии является необходимость проведения анализа при низких давлениях (6 10−3 Па), что при очень малых концентрациях примеси (порядка 10−9) в пробе может привести вообще к отсутствию детектируемых частиц в объеме фотоионизации [293].
Достоинства лазерной масс-спектрометрии проявляются при изучении труднолетучих и неустойчивых к нагреванию органических и биоорганических молекул, которые трудно перевести в газовую фазу. В таком случае объект в виде твердого образца или молекул, адсорбированных на поверхности подложки, размещают непосредственно в ионизационной камере масс-спектрометра. Под действием переднего фронта УФ-лазерного импульса происходит десорбция молекул и далее их двухступенчатая резонансная фотоионизация. Число образовавшихся ионов определяется соотношением [293]
Nи = N0 · Pдесηф,
где N0 — число облучаемых молекул; Pдес — вероятность десорбции; ηф — выход многофотонной ионизации. Вероятность десорбции определяется температурой нагрева поверхности, которая при постоянном потоке лазерного излучения пропорциональна коэффициенту поглощения вещества. Поэтому селективность в данном случае определяется не только процессом ступенчатой фотоионизации, но и зависи-
мостью Pдес(λ).
Масс-спектры, полученные при облучении молекулярных кристаллов аденина излучением КrF-лазера (249 нм), показывают отсутствие фрагментации аденина [293]. Дополнительно были обнаружены лишь примеси щелочных металлов Na+ и K+ и слабый пик кластера аденин–катион натрия. Отсутствие или малая степень фрагментации молекул объясняется очень малым нагревом образца (100◦С для аденина), так как используются малые уровни плотности энергии лазерного излучения ( 10−3 Дж/см2), вполне достаточные для десорбции необходимого количества молекул, которые практически без потерь преобразуются в ионы. В [293] представлены также масс-спектры молекулярных кристаллов антрацена, гуанина, тимина, урацила, цитозина и трипептида.
Оптимизация рассматриваемого процесса возможна при разделении функций по десорбции и фотоионизации молекул между двумя лазерами. Поскольку процесс десорбции носит тепловой характер, то на первом этапе используют излучение ИК-ла- зеров, а на втором, как обычно, — излучение УФ-лазеров [293]. Таким способом осуществлялось детектирование молекул нафталина и антрацена, адсорбированных на поверхности графита. Использовались СО2 (10,6 мкм) и КrF (249 нм) лазеры. Чувствительность регистрации молекул нафталина на поверхности оказалась равной 106 молекул/см2 (поверхностная концентрация) или около 10−8 молекулярного слоя. При оптимизации процессов десорбции и фотоионизации возможно достижение чувствительности на уровне 10−10 монослоя.
В ряде случаев селективность масс-спектрометрического анализа оказывается вполне достаточной, поэтому можно отказаться от второй ступени и использовать


