
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
362 Гл. 7. Оптико-калориметрическая спектроскопия биообъектов
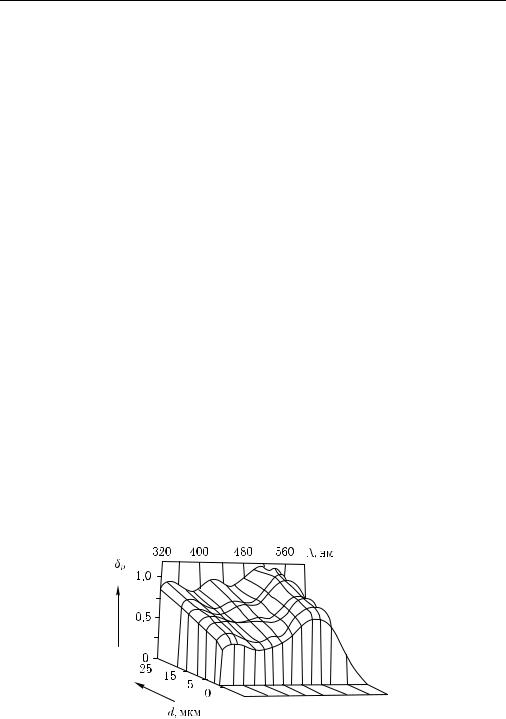
Импульсная оптотермическая радиометрия рассеивающих и слоистых сред позволяет контролировать распределение индуцируемой температуры по глубине биоткани (кожи, зуба и пр.) и тем самым профилировать подповерхностные неоднородности с высоким поглощением (сосудистые образования, меланомы, кариес и пр.) [1283, 1285, 1286, 1288, 1303, 1332–1335]. Пример измеренных in vivo распределений температуры по глубине для нормальной и патологической кожи человека c использованием лазера на красителях с ламповой накачкой (577 нм, τ = 1 мкс,
плотность энергии 5 мДж/мм−2) показан на
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рис. 7.23. Аналогичное профилирование за- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
известкованной ткани возможно и с исполь- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зованием ОА-методик [1308]. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные принципы ОАили фотоаку- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стической микроскопии (ФАМ) достаточно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
просты [58]. Если в качестве зондирующе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
го пучка используется пространственно-ко- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
герентное излучение лазера, то существу- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ет возможность его фокусировки до 1 мкм. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сканирование сфокусированного пучка по |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
поверхности объекта и регистрация с помо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
щью микрофона или пьезодатчика акусти- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ческого сигнала дают локальную информа- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цию об оптических, тепловых и акустических |
Рис. 7.23. Распределение температуры: |
свойствах биообъекта. Одновременное ска- |
|||||||||||||||||||||||||||||||||||||||||
нирование длины волны излучения позволя- |
||||||||||||||||||||||||||||||||||||||||||
а — по глубине здоровой части кожи; |
ет получать локальные спектры поглощения. |
|||||||||||||||||||||||||||||||||||||||||
б — по части кожи с «портвейновым |
Амплитуда ОА-сигнала связана обратной за- |
|||||||||||||||||||||||||||||||||||||||||
пятном» (виден температурный |
пик на |
висимостью с интенсивностью люминесцен- |
глубине 80 мкм) [1303] |
|
|
|
ции исследуемого вещества следовательно, |
|
|
|
|
|
|
возможно построение аналога люминесцент- |
ного микроскопа или микроскопов, основанных на изучении локализованных в пространстве фотовольтаического и фотохимического процессов.
С помощью ФАМ обеспечивается сканирование объекта по его глубине. Изменяя длину волны лазера, регулируют глубину проникновения света в вещество и возбуждают ОА-сигнал на разных глубинах. Другой путь — изменение частоты модуляции лазерного пучка. Данное свойство является уникальным и выделяет ФАМ из других способов микроскопии. Глубина зондирования определяется величиной термодиффузионной длины для данной частоты модуляции. Например, для непрозрачного образца (µa ≈ 106 см−1) ОА-сигнал можно возбудить на разных глубинах (от 10−1 до 103 мкм), если изменить частоту модуляции от 100 МГц до 1 Гц. Как уже было сказано, фазовый метод также позволяет разделить поверхностное и объемное поглощения. Однако и в фазовом методе для непрерывного сканирования по глубине необходимо изменение частоты модуляции.
Технические решения в области применения ФАМ проанализированы в работе [58]. Достигнутая разрешающая способность ФАМ в видимой области спектра не превышает 7–15 мкм; поэтому устройства, реализующие ОА-метод, пока не могут составить конкуренцию оптическому микроскопу. Однако по информативности ФАМ существенно превосходит оптическую микроскопию, так как позволяет визуализировать детали микроструктуры непрозрачных для зондирующего света объектов. В связи с этим ФАМ существенно дополняет и расширяет традиционные методы микроскопии и имеет значительные перспективы применения в биологии и медицине. Например, эффекты возбуждения акустических волн мощным лазерным импульсом
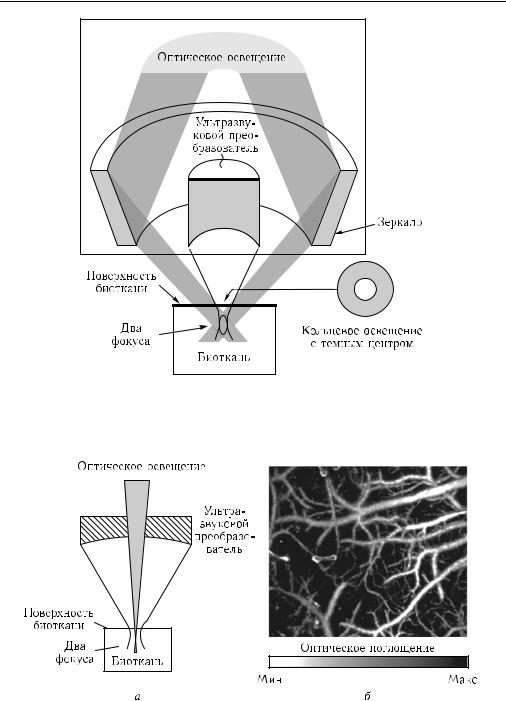

7.4. Области применения оптико-калориметрических методов в биологии и медицине 369
Помимо впечатляющих результатов в области ФАМ и фотоакустической томографии (ФОТ) живых объектов, которые в принципе позволяют получить оптическое разрешение на уровне нескольких микрометров на глубинах зондирования в несколько сантиметров [1348], успешно развивается фотоакустическая (ФА) и фототермическая (ФТ) цитометрия, которые позволяют обеспечить дифференциацию нормальных
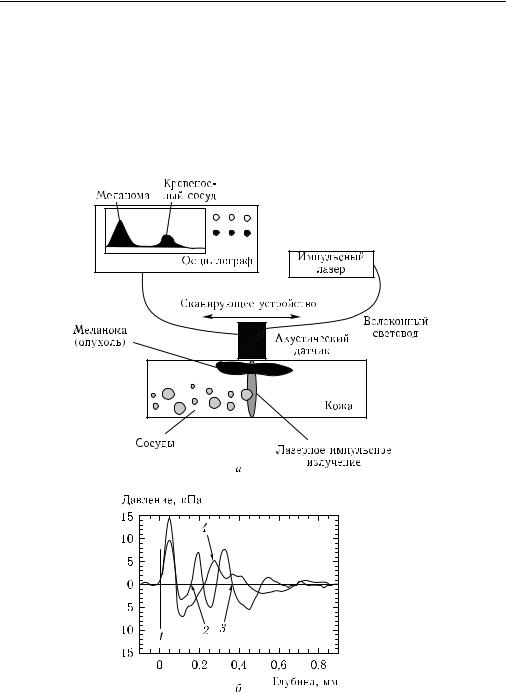
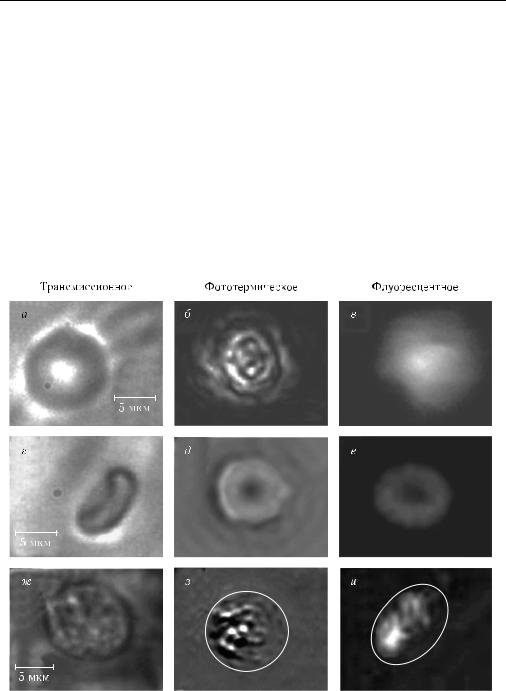
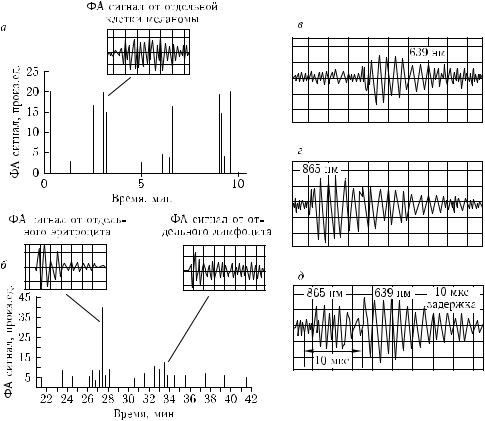
ипатологических клеток при их движении непосредственно в сосудах с разрешением, которое превышает дифракционный предел [159, 1356]. На рис. 7.28 схематически представлены принципы волоконно-оптической ФА-проточной цитометрии in vivo
иФА-лимфографии, которые сопровождаются селективной ФА-лазерной терапией [380]. После обнаружения раковой клетки ФА-методом, энергетические параметры лазера быстро изменяют и уже следующий более мощный и короткий импульс убивает клетку, пока она не успела выйти их поля лазерного пучка. В принципе, уничтожение клетки можно произвести и другим специальным лазером, настроенном на эту процедуру. При определенной длительности импульса разрушение клетки происходит как за счет действия света, так и акустических ударных волн, рождаемых этим импульсом. На этом же рисунке показан типичный вид цифровых сигналов от
клеток меланомы, циркулирующих в лимфатической системе уха мыши, возбужда-
емых диодным лазером (λ = 905 нм, τи = 15 нс, 90 мДж/см2) с высокой частотой повторения импульсов (9 кГц).
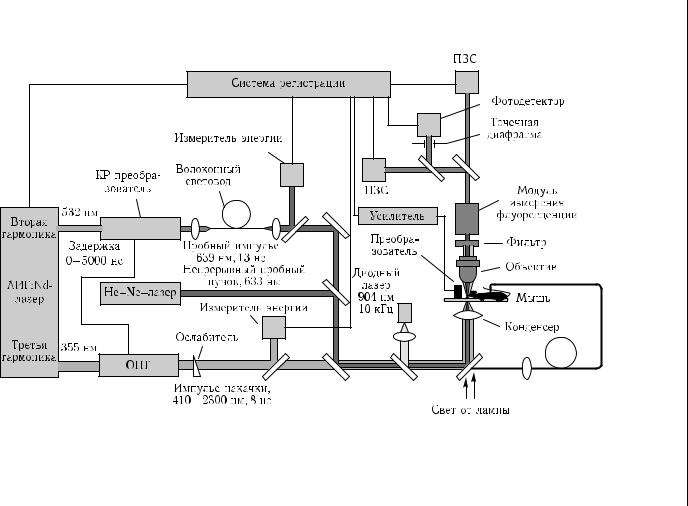
На рис. 7.29 показан многофункциональный проточный цитометр in vivo на основе ФТ, ФА, флуоресцентной и трансмиссионной микроскопии [372, 379]. Примеры соответствующих сигналов и изображений клеток в процессе их движения по сосудам представлены на рис. 7.30 и 7.31. Для повышения контраста изображения клеток хорошо подходит их маркирование нетоксичными или малотоксичными наночастицами, которые благодаря значительному поглощению их материала дают сильные ФТ- и ФА-сигналы [159, 372, 379, 380, 1349–1356]. Эти же частицы могут быть использованы и для селективного уничтожения раковых клеток непосредственно в сосудах или тканях, например в «сторожевых лимфоузлах» и других тканях [159, 283–286, 372, 379, 380, 1351, 1352, 1356, 1357].
Г л а в а 8
ЛАЗЕРНЫЙ МИКРОСПЕКТРАЛЬНЫЙ АНАЛИЗ
ВБИОМЕДИЦИНСКИХ ИССЛЕДОВАНИЯХ
8.1.Введение
Вэтой главе рассмотрим особенности микроспектрального анализа. Наряду
сфотометрическим методом существуют другие широко используемые в медицине неинвазивные оптические диагностические технологии, такие как конфокальная микроскопия, лазерная цитометрия, флуоресцентный микроанализ, КР-микропроба и их комбинации. Они объединяются по признаку взятия «пробы» (оптической биопсии), которая берется из очень малого объема биоткани, вплоть до отдельных частей
клетки. Объем пробы определяется используемыми освещающей и приемной оптическими системами; как правило, наименьший объем на уровне λ3 (λ — длина волны в веществе) достигается при использовании микроскопов, включая конфокальные микроскопы, а наибольший — при использовании многомодовых световодов и пучков световодов (от одного до нескольких миллиметров).
Данные методы диагностики являются неразрушающими, в этом их главное достоинство, однако из-за сложности объекта зачастую удается получить лишь качественную информацию о составе вещества, наличии примесей и пр., в связи
счем развиваются методы лазерной аналитической спектроскопии, основанные на эффектах лазерной фотоионизации предварительно подготовленных проб биообъектов путем локального испарения или распыления сфокусированным лазерным пучком. Эти методы обладают высокой чувствительностью и позволяют получить количественную информацию о содержании различных, например токсических, примесей в биообъектах. Из-за малого объема лазерной микропробы и возможности проведения диагностики in vivo или in situ некоторые из таких методов могут быть отнесены к неразрушающим, поскольку в целом биообъект сохраняется живым и имеют место лишь его микроповреждения.
8.2.Микроскопия и микроспектрофотометрия
Воснове спектроскопии упругого рассеяния биотканей и клеток лежат два явления — это рассеяние света, вызванное неоднородностью показателя преломления среды, и поглощение света, обусловленное присутствием различных метаболических хромофоров (см. главы 1 и 2). Локальные измерения характеристик рассеяния (отражения) и поглощения на одной или нескольких длинах волн являются основой лазерной микроскопии и цитометрии, а локальные измерения спектров обратного рассеяния (полного или диффузного отражения) лежат в основе микроспектрофотометрии [1, 12, 13, 15, 19, 20, 22, 31, 41, 80, 159, 358–361, 439–446, 567, 568, 785–792, 902, 970, 971, 1269–1272, 1358–1369].
Микроспектрофотометрия биотканей представляется одной из наиболее простых и доступных оптических технологий для in vivo и in situ диагностики широкого спектра патологий. Две схемы микроспектрофотометров отражения и измеренные спектры нормальной и патологической ткани показаны на рис. 6.4 и 6.6. Расстояние
8.2. Микроскопия и микроспектрофотометрия |
371 |
между центрами облучающего и принимающего световодов не должно быть большим, типично меньше 1 мм, в противном случае в измеряемых спектрах теряется информация о морфологических особенностях ткани. Важным также является исключение отражения поверхности ткани, что реализуется за счет оптического контакта торца световода с объектом непосредственно или через иммерсионную жидкость. При выполнении этих условий измеряемые спектры несут информацию как о линиях поглощения, лежащих в диапазоне длин волн 350–1000 нм, так и о рассеивающих свойствах ткани. Вклады рассеяния и поглощения могут быть разделены, если обеспечены измерения для различных расстояний между световодами (см. главы 2 и 6), однако для многих практических методик диагностики нет необходимости в таком разделении и измерения проводятся для фиксированного небольшого расстояния между световодами, поскольку смешанный спектр отражения хорошо коррелирует с различиями в типах ткани и их состоянием.
Возможности метода для in vivo диагностики успешно продемонстрированы для тканей мочевого пузыря с чувствительностью до 100 % и хорошей специфичностью, до 97 %, а также для диагностики рака толстой и прямой кишок [1360]. В последнем случае 60 оптических проб было взято у 16 пациентов. Для восьми проб с участков, которые в последующем были определены гистологически как дисплазия, аденома или аденокарцинома, спектральные области, соответствующие линиям поглощения гемоглобина 400–440 и 540–580 нм, оказались показательными для эффективного дифференцирования злокачественных и доброкачественных изменений слизистой (чувствительность 100 %, специфичность 98 %). Для дифференцирования колита
инормальной ткани оптимальным был спектральный диапазон 435–440 нм.
Вряде случаев используют волоконные датчики, которые оказывают регулируемое давление на ткань. В этом случае спектры отражения существенным образом трансформируются (см. рис. 6.5) и несут дополнительную информацию, необходимую для разделения вкладов рассеяния и поглощения в измеряемый спектр [250, 1269, 1365, 1368].
К существенным достоинствам спектрофотометрического метода следует также отнести значительное быстродействие (время измерения, записи и получения изображения спектра менее 1 с) и возможность работы с нелазерными источниками белого света (соответственно малая стоимость и простота устройства).
Авторы [1359] разработали ряд экспериментальных установок для in vitro и in vivo измерений локальных оптических характеристик кожи человека. Одна из них, содержащая микроскоп с источником белого света, используется для локальных измерений спектра пропускания образцов биоткани (срезов кожи толщиной 10 мкм). Сопряжение прошедшего образец пучка света со спектральным прибором с помощью многомодового световода с диаметром сердцевины 1 мм для проекционной линзы микроскопа с увеличением 2,5 и объектива, собирающего свет от объекта в световод, с увеличением 10 позволило обеспечить измерительное пятно, равное 40 мкм (1000 мкм/(2,5 · 10)). Локальные спектры пропускания регистрировались с помощью спектрографа, сопряженного с оптическим многоканальным анализатором (ОМА). Далее эти спектры сравнивались со спектрами флуоресценции, возбуждаемыми излучением He–Cd-лазера в тех же областях объекта.
Другая установка со специальным волоконным пробником использовалась для исследований спектров диффузного отражения и флуоресценции кожи in vivo, ее особенностью было то, что размер освещающего пятна на объекте был значительно меньше области, с которой регистрируются рассеянный сигнал и сигнал флуоресценции, что дает возможность избежать сильного влияния зеркального отражения
исущественно увеличивает слабый сигнал флуоресценции. Близкая по своим параметрам система in vivo регистрации спектров отражения и флуоресценции кожи
