
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf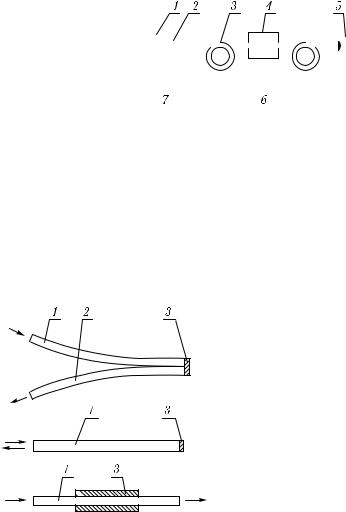
302 |
Гл. 5. Волоконные световоды для биомедицины |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5.36. Автогенераторный ВОД перемещений с оптической линией задержки [1167]: 1 — полупроводниковый лазер; 2 — оптический разъем; 3 — волоконно-оптическая линия задержки на основе многомодового ВС; 4 — сенсор; 5 — быстродействующий фотодиод; 6 — высокочастотный резонансный усилитель; 7 — устройство питания лазера
ирегистрируемого пучков света). Временные реализации флуктуаций интенсивности рассеянного поля, зарегистрированные с помощью еще одного многомодового ВС
исопряженного с ним фотоприемника, соответствуют временным перемещениям исследуемой мембраны. Датчик чрезвычайно прост, однако требует калибровку и в ряде случаев использования специальных покрытий поверхности объекта исследований
сзаданными статистическими свойствами, поскольку связь измеряемых величин
среальным движением объекта является нелинейной и статистической. Такой датчик
был разработан для получения пульсограмм человека в области запястья [400, 407].
Типичные схемы химических ВОД показаны на рис. 5.37–5.39 [1134, 1135, 1152, 1185, 1193]. Успешная работа ВОД заклю-
чается в подборе устойчивого химического индикатора (колориметрического или флуоресцентного) и нанесении его на дистальный торец ВС или боковую стенку световода или помещении индикатора в сопряженный
с осветительным и измерительным ВС контейнер с полупроницаемыми стенками или другой тип контейнера, в который обеспечи-
вается подача исследуемого вещества. В ка-
честве контейнера широко используют пористое стекло. Изготовляют также и сам ВС на основе пористого стекла, что обеспечивает высокую чувствительность химических ВОД и хорошее сопряжение с исследуемым объек-
том. В настоящее время разработано огромное количество химических индикаторов, применяемых в различных областях биомедицинской практики, которые можно использовать при конструировании новых типов химических ВОД.
Одним из первых применений химических ВОД в медицине было определение растворенных в крови газов in vivo [1193]. Например, для определения рН в качестве индикатора был взят краситель фенол красный, который имеет две таутомерические формы, каждая со своим спектром поглощения. Краситель является слабо ионизированной кислотой, соотношение его щелочного компонента (поглощение в зеленой области) и кислотного (поглощение в синей области) изменяется с изменением рН. В датчике используется зеленое излучение с λ = 560 нм и красное с λ = 600 нм. Зеленое излучение поглощается щелочным компонентом красителя и дает информацию о рН среды, а поглощение красного излучения не связано с рН среды и является

5.5. Биомедицинские волоконно-оптические датчики и зонды |
303 |
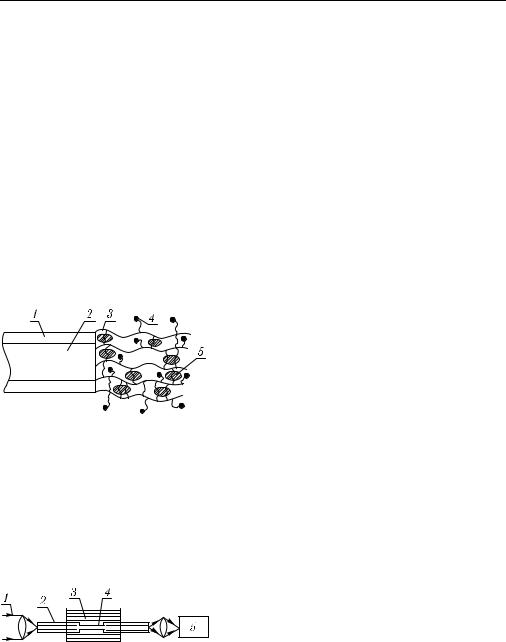
Рис. 5.38. Химический ВОД: 1 — |
Рис. 5.39. Многоканальный пробник газо- |
ВС-осветитель; 2 — защитная оболоч- |
вого состава крови: 1 — корпус катетера; |
ка; 3 — полупроницаемая оболочка; 4 — |
2 — термопара; 3 — ВС; 4 — флуоресцирую- |
защитный колпачок; 5 — индикаторная |
щие вещества, каждое из которых является |
система красителей; 6 — измеритель- |
отдельным индикатором рН, рСО2 и рО2; |
ный ВС (передача излучения к измери- |
5 — полупроницаемая оболочка |
тельному устройству) |
|
опорным. В качестве материала полупроницаемой оболочки используется целлюлоза. Датчик позволяет измерять рН в физиологической области (7,0–7,4) с точностью порядка ±0,01 рН. Усовершенствование процедуры измерений с привлечением более точной калибровки и компьютерной обработки данных позволяет повысить точность до ±0,001 рН [1162, 1193].
Содержание газов О2 и СО2 в биосистемах определяется с помощью аналогичных датчиков, использующих изменяющуюся в присутствии этих газов флуоресценцию соответствующих красителей [1134, 1135, 1162, 1193]. По О2 диапазон измерений составляет (0,5–300) · 133 Па с точностью 133 Па, а по СО2 диапазон измерений равен (0,5–100) · 133 Па (табл. 5.7). Многоканальный волоконно-оптический флуоресцентный пробник позволяет одновременно определять парциальные давления газов Н, СО2 и О2 в крови (см. рис. 5.39).
Т а б л и ц а 5.7. Примеры применения медицинских ВОД
Определяемый |
Диапазон измерений |
Принцип работы |
|
параметр |
|||
|
|
||
|
|
|
|
Количество O2 |
(0,5–300,0) · 133 Па |
Тушение флуоресценции |
|
Количество SO2 |
70–500 ррm |
Тушение флуоресценции |
|
Количество CO2 |
(0,5–100,0) · 133 Па |
Индикация pH в матрице |
|
Количество CO |
1–100 % в атмосфере N2 |
Химический индикатор в матрице |
|
|
|
полимерного ВС |
|
Количество CH4 |
0,01–100 % |
ИК-поглощение на частоте 3016 см−1 |
|
Влажность |
0,01–80,00 % относительной |
CoCl2 в пористом стекле |
|
|
влажности |
|
|
Количество глюкозы |
2,8–27,8 мМ |
Иммобилизованный фермент |
|
|
|
и регистрация флуоресценции |
|
|
|
|
|
Количество |
0,1–100,0 мM |
Фермент с чувствительным к pH |
|
пенициллина |
|
флуоресцирующим красителем |
|
|
|
|
|
Ионизирующее |
10−4–108 рад |
Поглощение центров окраски |
|
излучение |
|
|
304 Гл. 5. Волоконные световоды для биомедицины
Волоконно-оптический датчик парциальных давлений О2 и СО2 в жидких и газообразных биологических средах, использующий целый ряд современных оптических методов и технологий, описан в [1196]. Во-первых, он использует фазовый метод (см. гл. 2, на примере исследования оптических свойств биотканей) анализа флуоресцентного отклика химического маркера исследуемого газа в среде, т. е. реагирует на изменение временных характеристик флуоресценции, что повышает надежность измерений. Во-вторых, для возбуждения флуоресценции используется полупроводниковый лазер с удвоением частоты, с результирующей длиной волны 425 нм, это излучение эффективно возбуждает одномодовые световоды и достаточно простыми средствами модулируется по интенсивности до частот порядка 200 МГц, что необходимо для реализации методик измерений флуоресценции с временным разрешением.
Определение влажности возможно с помощью ВОД на основе пористого стекла, пропитанного хлоридом кобальта. Измеряемой величиной является коэффициент отражения пористого стекла в диапазоне длин волн 500–700 нм, который существенно зависит от относительной влажности (см. табл. 5.7). Время измерений определяется скоростью проникновения воды в стекло и составляет несколько минут.
Биохимические датчики служат для определения концентрации глюкозы, белков, пенициллина, токсинов и микроорганизмов. Их работа основана на принципе специфического связывания компонентов биохимической системы и оптической индикации
|
этого процесса [1134, 1135, 1162, 1178, 1179] |
|
|
(см. также табл. 5.7). Принцип работы биохи- |
|
|
мического ВОД с ферментативным активато- |
|
|
ром исследуемого вещества и флуоресцентной |
|
|
индикацией основан на изменении рН среды |
|
|
под действием фермента, внедренного в по- |
|
|
лиакриламидную матрицу на торце ВС (рис. |
|
|
5.40). В свою очередь, увеличение рН приво- |
|
Рис. 5.40. Ферментативный оптический |
дит к тушению флуоресценции, внедренного |
|
в эту матрицу красителя. Рассмотренный дат- |
||
пробник. 1 — оболочка ВС; 2 — серд- |
чик был применен к определению содержания |
|
цевина ВС; 3 — полиакриламид; 4 — |
пенициллина (см. табл. 5.7). |
|
индикаторный флуоресцирующий кра- |
В биохимических ВОД используются раз- |
|
ситель; 5 — фермент |
||
нообразные типы взаимодействия (поглоще- |
||
|
||
|
ние, упругое и неупругое рассеяние, флу- |
оресценция, нелинейные преобразования) волноводных мод, распространяющихся в тонкой пленке на границе «сердцевина ВС — исследуемая жидкость» [1178, 1179, 1186, 1187]. На рис. 5.41 показан один из вариантов такого датчика, рабочий участок которого получен за счет удаления материала оболочки на некоторой
Рис. 5.41. Один из вариантов иммунного ВОД: 1 — лазерное излучение; 2 — ВС; 3 — исследуемая жидкость; 4 — рабочий участок ВС; 5 — фотоприемник
длине ВС. Он был применен для создания методики иммунной пробы без разделения компонентов образца. Антитела из образца садятся на рабочей поверхности сердцевины ВС. Появление в результате специфической реакции антиген–антитело соответствующих компонентов в образце приводит к изменению спектральных характеристик излучения на выходе ВС (поглощение, флуоресценция, КР и пр.), что служит мерой локально протекающей иммунной реакции с минимальным влиянием остального раствора. Такая идея использования нарушенного полного внутреннего
5.5. Биомедицинские волоконно-оптические датчики и зонды |
305 |
отражения (НПВО) оказалась очень плодотворной и широко используется в ВОД, включая эллипсометрические [1187], разнообразные конические и многоканальные датчики [1178, 1179]. Отметим, что датчик с крутым изгибом (см. рис. 5.33) также может выполнять указанные задачи.
Использование иммобилизованных люминесцирующих ферментов позволяет построить простые биолюминесцентные ВОД без источника света для определения концентрации АТФ, НАДН и Н2О соответственно в диапазонах 2,8 · 10−10–1,4 · 10−6, 3 · 10−10–3 · 10−6 и 2 · 10−8–2 · 10−5 М, а также контролировать протекание реакций антиген–антитело в объектах in vitro [1185, 1189].
Перспективными для биохимических исследований являются ВОД с биосенсорами в виде ориентированных монослоев органических молекул, полученных методом Ленгмюра–Бложетта.
Очевидно, что микроструктурные световоды (МСС) являются перспективными чувствительными элементами для биосенсоров [1202, 1207–1209, 1213–1215, 1217–1222]. Многие из известных методов волоконно-оптической биосенсорики, кратко изложенные выше, постоянно совершенствуются и осваивают новые приложения в биомедицине и могут быть реализованы с помощью МСС. Важными достоинствами МСС являются их высокая нелинейность на единицу длины, что дает компактность при использовании нелинейных явлений в сенсорах и возможность использования полых МСС в качестве интеллектуальных микрокювет/нанокювет со сравнительно большой длиной взаимодействия. В простейшем случае такие кюветы позволяют легко управлять спектром пропускания МСС при их заполнении жидкими средами с определенной дисперсией и зависящим от длины волны поглощением. Очевидно, что и характерное для исследуемого вещества зависящее от длины волны рассеяние (например, возникшее в результате биохимической или иммунологической
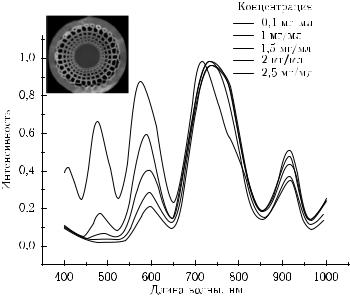
Рис. 5.42. Спектры пропускания идентичных микроструктурных световодов (МСС), заполненных водным раствором белка — холерогена при разных концентрациях, в интервале от 0,1 до 2,5 мг/мл; структура МСС показана на врезке, диаметр полой сердцевины составляет 150 мкм, а наружный диаметр — 750 мкм [1215]
306 |
Гл. 5. Волоконные световоды для биомедицины |
реакции) также влияет на спектр пропускания МСС. В качестве примера на рис. 5.42 представлены спектры пропускания идентичных полых МСС (диаметр полой сердцевины 150 мкм), заполненных водным раствором белка — холерогена при разных концентрациях в интервале от 0,1 до 2,5 мг/мл [1215]. В данном случае деформация спектра пропускания при разных концентрациях белка в основном связана с изменением показателя преломления среды. Поэтому такой сенсор может быть квалифицирован как широкополосный рефрактометр, однако для решения обратной задачи и восстановления дисперсии исследуемого вещества требуются модельные представления о взаимодействии света разных длин волн с МСС, заполненным дисперсионной средой.
Пока не так много разработано биосенсоров с использованием МСС, есть газовые сенсоры на метан, интерферометрические сенсоры механических напряжений, сенсоры, использующие методы нелинейной спектроскопии биомолекул и др., однако эта область исследований представляется перспективной [1202, 1207–1209, 1213–1215, 1217–1222].
Г л а в а 6
ЛАЗЕРНАЯ СПЕКТРОФОТОМЕТРИЯ И ФУРЬЕ-СПЕКТРОСКОПИЯ
6.1. Введение
При решении многих диагностических задач в биологии и медицине хорошо себя зарекомендовали абсорбционные методы, которые широко применяются в лазерной аналитической спектроскопии или спектроскопии ультрабыстрых процессов [1–3, 5, 9, 10, 12, 13, 17, 18, 25, 34–36, 40, 41, 53, 57, 80, 83, 88, 130–148, 151, 157–161, 205, 293, 294, 530, 551, 564–568, 712, 902, 968, 971, 1223–1273]. Они являются методами микродиагностики, так как дают информацию об атомной и молекулярной структуре исследуемого вещества биообъекта либо среды его обитания. К абсорбционным методам, использующим эффект поглощения света в веществе, относятся как абсорбционно-трансмиссионные методы, так и методы, основанные на регистрации поглощенной энергии путем измерения нагрева биообъекта T (оптико-калориметрические методы) или интенсивности его флуоресценции Iфл (лазерный флуоресцентный анализ) (рис. 6.1, 6.2). Применительно к биотканям, особенно при исследованиях in vivo, не всегда возможно обеспечить условия измерений на пропускание из-за сильного рассеяния (см. главы 1 и 2), поэтому абсорбционная спектроскопия реализуется в виде исследования обратно рассеянного (прошедшего толщу ткани туда и обратно) излучения, возможны и более сложные геометрии спектроскопических исследований (под одним или несколькими углами, при разной толщине, или добавлении дополнительных слоев с известными поглощающими и рассеивающими свойствами и пр.). Все это делается для того, чтобы исключить или, наоборот, учесть влияние рассеяния и неоднородности распределения поглотителей в среде, что необходимо для восстановления истинных спектров поглощения хромофоров и определения их локализации.
Методы абсорбционной спектроскопии пропускания и обратного рассеяния можно разделить на ряд групп по типу решаемых задач и используемой методики измерений. К первой группе можно отнести все спектрофотометрические методы, с помощью которых, в конечном итоге, получают спектр поглощения объекта (µa(λ)), который, в свою очередь, можно использовать для определения концентрации отдельных хромофоров и тем самым контролировать ход метаболических процессов, развития патологий и пр. Спектрофотометрия включает в себя методы дифференциальной (разностной), производной, поляризационной и модуляционной спектроскопии, использует многопроходные методы исследования (для слабо поглощающих объектов и газов) и пр. В частности, временной и фазово-модуляционный методы диагностики биотканей, подробно описанные в главе 2, относятся именно к спектрофотометрии, так как в конечном итоге дают спектр поглощения (µa(λ)), а временное разрешение используется для разделения вкладов поглощения и рассеяния.
Специфически лазерной является так называемая внутрирезонаторная спектроскопия [1228], которая может быть реализована в виде методов внесенных линейных потерь, индуцированной конкуренции мод или нелинейного поглощения. Казалось бы, что при исследовании биотканей и других биологических сред хорошо раз-

308 |
Гл. 6. Лазерная спектрофотометрия и фурье-спектроскопия |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6.1. Схема процессов возбуждения, ионизации и релаксации биомолекул M , лежащих в основе методов микродиагностики [5, 293, 294]: S0, S1 — основное и возбужденное синглет-
ные состояния молекулы M ; hν1, hν2 — энергии квантов возбуждающего и ионизирующего |
|
излучений; M +, e−, (M + C)+ |
— продукты ионизации; C — молекула другого типа; hνф — |
энергия кванта флуоресценции; |
Iф — интенсивность флуоресценции; T — приращение |
|
температуры биообъекта |
витые в аналитических исследованиях методы внутрирезонаторной спектроскопии [293, 1225, 1226] являются непрактичными и сложными для реализации, однако использование автодинного эффекта (вариант внутрирезонаторной спектроскопии с внешним резонатором, когда поверхность или внутренние слои биоткани образуют внешнее дополнительное «зеркало» лазера) для исследования гемодинамики [390, 1264] или контроля абляции биотканей [1229], а также возможность получения индуцированного излучения на сенсибилизированных красителями биотканях [1230] позволяют считать этот вид лазерной спектроскопии вполне полезным и практичным. Более того, описанные в главе 5 волоконные лазеры являются по сути дела высокочувствительными датчиками разнообразных возмущений, действующих (со стороны живого объекта) непосредственно на потери в резонаторе. Эффекты конкуренции мод и поляризации в волоконном лазере также могут быть использованы для построения компактных биомедицинских датчиков.
Фурье-спектроскопия в принципе дает информацию, аналогичную спектрофотометрии, однако существенная светосила и быстродействие фурье-спектрометров делают такой метод очень полезным в ИК-диапазоне длин волн именно в биомедицинских исследованиях [1231].
Методы абсорбционной спектроскопии с временным разрешением основаны на дискриминации отдельных хромофоров не по их спектрам поглощения, а по временам, отвечающим за внутреннюю динамику молекул. Помимо концентрации отдельных компонентов исследуемой среды временные методы дают принципиально иную информацию, например о скорости протекания биохимических процессов, скорости передачи возбуждения между молекулами и пр. [293, 294]. Методы абсорбционной
|
|
|
|
|
|
|
|
|
|
|
6.2. Спектрофотометрия |
309 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
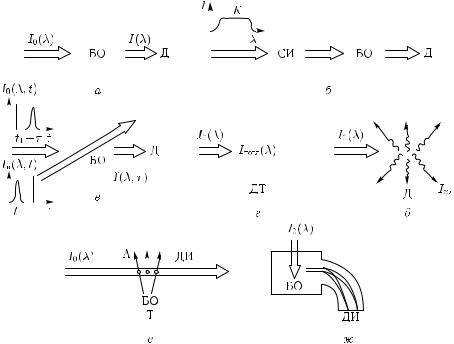
Рис. 6.2. Схемы устройств для микродиагностики: а — абсорбционно-трансмиссионный спектрометр; б — фурье-спектрометр; в — абсорбционный спектрометр с временным разрешением; г — оптико-калориметрический спектрометр; д — флуоресцентный спектрометр; е — атом- но-фотоионизационный анализатор; ж — масс-спектрометр с фотоионизацией. БО — биологический объект; Д — детектор фотонов; К — континуум; СИ — сканирующий интерферометр; ДТ — датчик температуры; ДИ — детектор ионов; I0, I, Iв, Iпогл, Iфл — интенсивности падающего, прошедшего, возбуждающего, поглощенного и флуоресцентного потоков излучения; Т — нагревательный тигель; А — поток атомов; τ — время задержки зондирующего импульса
света относительно возбуждающего [5, 293, 294]
спектроскопии с временным разрешением имеют различные модификации, включая использование широкополосных лазерных источников для создания пробных пучков, переменных линий оптической задержки, одиночных возбуждающего и пробного импульсов, дифференциальные и поляризационные методики.
6.2. Спектрофотометрия
Измерение спектров пропускания веществ в различных агрегатных состояниях является основой спектрофотометрии, отличающейся чрезвычайной простотой, универсальностью, сравнительно высокой чувствительностью и точностью анализа, вполне достаточных при решении многих задач фундаментальной и прикладной медицины. Измерение спектров пропускания основано на регистрации интенсивности падающего I и прошедшего в поглощающей среде путь z света I в зависимости от длины волны λ:
I(λ, z) ≡ I0(λ) · exp[−µa(λ)z], |
(6.1) |
µa(λ) = σa(λ)N , |
(6.2) |

310 Гл. 6. Лазерная спектрофотометрия и фурье-спектроскопия
где µa(λ) — коэффициент поглощения; σa(λ) — эффективное поперечное сечение поглощающих частиц, см2; N — их плотность, см−3. Предполагается, что интенсивность падающего света очень мала. Для небольших коэффициентов поглощения, когда exp[−µa(λ) · z] ≈ 1 − µa(λ) · z, легко найти, что
µ (λ) |
≈ |
I0(λ) − I(λ, z) |
· |
z |
≡ |
I(λ, z) |
. |
(6.3) |
||
|
||||||||||
a |
I0(λ) |
|
I0(λ) |
· |
z |
|
||||
|
|
|
|
|
|
|
|
|
|
|
В нелазерных спектрофотометрах используются широкополосные источники света, а перестройку по длинам волн осуществляют с помощью призм или дифрак-
ционных решеток. Они имеют разрешающую способность, |
λ, от нескольких до |
сотых долей нанометра. Если ширина линии поглощения равна δλ, а I0(λ) несильно |
|
меняется в интервале λ, то |
|
I/I0 µa(λ)δλ/ λ, |
(6.4) |
где µa(λ) — коэффициент поглощения, усредненный по всей линии поглощения [980]. Отсюда следует вывод, что для узких линий поглощения чувствительность зависит не только от способности прибора зарегистрировать малые изменения I на фоне значительного прошедшего сигнала, но и от разрешающей способности прибора. Обычно предельная чувствительность достигается при I/I > 10−4–10−5.
Отметим, что методы измерения пропускания или поглощения света веществом, как правило, являются дифференциальными, так как в процессе измерений происходит сравнение свойств исследуемого объекта с контрольным образцом, которое реализуется как в однолучевых, так и двулучевых дифференциальных спектрометрах [551, 1224].
Большинство биологических объектов представляет собой гетерогенные вещества со сложными спектрами поглощения, в которых спектральные линии отдельных компонентов сильно перекрыты и имеют различные параметры, что затрудняет количественное определение концентрации этих компонентов. В качестве примера на рис. 1.12 [209] представлен спектр пропускания 3 мм слоя ткани молочной железы; видны линии поглощения оксигемоглобина, жировой ткани и воды. Для разделения вкладов отдельных компонентов в результирующий спектр используются методы производной спектрофотометрии, основанные на применении разнообразных алгоритмов, аналоговых и цифровых устройств дифференцирования спектров, позволяющие существенно повысить информативную способность спектрофотометрии при изучении биообъектов [1224, 1227, 1232].
Более тонкие разновидности абсорбционно-трансмиссионной спектроскопии биообъектов связаны с исследованиями поляризационных характеристик их поглощения. Они дают информацию о взаимной ориентации поглощающих молекул, конформации биомолекул, путях миграции энергии и пр. Основу поляризационных методов составляют методы линейного и кругового дихроизма и дисперсии оптического вращения [1224].
Прежде чем обсуждать преимущества использования лазеров при снятии спектров пропускания, отметим, что в распоряжении исследователей имеется широкий набор лазеров, перекрывающих весь мыслимый диапазон длин волн от рентгеновского до дальнего ИК-излучения (см. главу 4). Лазеры имеют чрезвычайно узкие линии и высокие значения спектральной плотности мощности излучения, на многие порядки величины превосходящие аналогичные характеристики для тепловых источников. Для многих применений, особенно когда речь идет о простых устройствах медицинской диагностики, перспективны лазеры, работающие на фиксированных длинах волн, особенно те из них, которые работают на нескольких длинах волн одновременно.
6.2. Спектрофотометрия |
311 |
Итак, использование лазеров позволяет: 1) существенно повысить спектральную разрешающую способность метода, определять даже форму и структуру линий поглощения молекул; 2) для узких линий поглощения несколько повысить чувствительность; 3) в некоторых случаях упростить и удешевить экспериментальную установку, поскольку монохроматор (обычно составляющий наиболее объемную и дорогую часть установки) при наличии лазера оказывается ненужным (следует, однако, помнить, что некоторые перестраиваемые лазеры также представляют собой технически сложные и дорогие устройства); 4) за счет высокой спектральной плотности излучения лазеров снизить влияние шумов фотоприемного устройства (сам лазер из-за нестабильности выходной мощности и частоты может внести погрешности в результаты измерений, поэтому необходим контроль или стабилизация параметров лазера, что довольно просто реализуется на практике); 5) за счет высокой направленности
ипространственной когерентности лазерного излучения осуществить дистанционные
итрассовые измерения поглощения. В случае слабого поглощения в газах и жидкостях можно применять многоходовые кюветы, насчитывающие 30–100 проходов [293], а также полые стеклянные и кварцевые волокна длиной до 150 м [1223]. Преимущества лазерных источников света особенно проявляются в ИК-области спектра при исследованиях отдельных вращательных линий колебательных полос, которые обычными спектральными приборами не разрешаются.
Итак, пороговая чувствительность абсорбционного метода определяется способ-
ностью аппаратуры определять наименьшее значение отношения |
Imin/I (см. (6.3)). |
Порог чувствительности может быть охарактеризован по оптической плотности [293]: |
|
Dmin ≡ (µad)min ≈ Imin/I, |
(6.5) |
или по коэффициенту поглощения: |
|
(µa)min = (1/d)ΔImin/I, |
(6.6) |
где d — длина образца. Обычно система регистрации с использованием лазеров обеспечивает Imin/I = 10−5. Минимальное количество детектируемых на пути лазерного пучка радиусом w примесных молекул
|
|
|
Mmin = (πw2/σa)(ΔImin/I), |
|
|
|
|
|
(6.7) |
||||
их абсолютная концентрация определяется соотношением |
|
|
|
|
|
|
|||||||
|
|
|
Nmin = (1/σad)(ΔImin/I), |
|
|
|
|
|
(6.8) |
||||
а относительная (минимально обнаружимая) концентрация |
|
|
|
|
|
|
|||||||
|
|
|
cmin = (1/σa dN0)(ΔImin/I). |
|
|
|
|
|
(6.9) |
||||
При w = 0,6 см, σ |
a |
= 10−17 см2, d = 10 см, N = 1018 см−3 |
(полное число молекул |
||||||||||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
смеси), |
Imin/I = 10−5, Mmin |
≈ |
1012, N |
min ≈ |
1011 см−3 |
, |
c |
min |
≈ |
10−7 (100 |
ppb), |
||
(µa)min |
≈ 10−6 см−1. |
|
|
|
|
|
мето- |
||||||
Применение многоходовых |
кювет, модуляционных и дифференциальных |
||||||||||||
дик измерения полезного сигнала позволяет существенно повысить чувствительность [293]. Если амплитудная модуляция интенсивности зондирующего излучения и модуляция поглощения могут быть реализованы при использовании любых источников света, то многократное прохождение среды (до 100 раз) и частотную модуляцию зондирующего излучения можно осуществить только при использовании лазеров. Таким способом была получена рекордная для ИК-спектрометров на инжекционных лазерах пороговая чувствительность (µa)min = 3 · 10−10 см−1. Для лазерных спектрометров из-за высокой когерентности света сильным мешающим
