
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf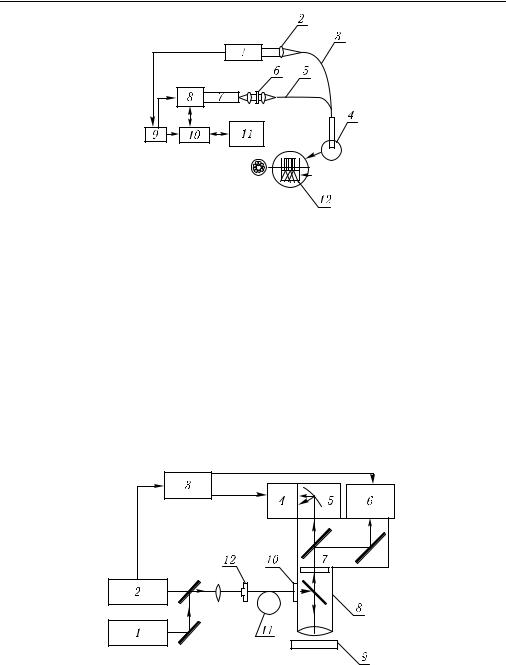
8.3. Флуоресцентный микроанализ |
383 |
анализаторами позволяет обеспечить высокое временное разрешение, вплоть до пикосекундного и субпикосекундного диапазона длительностей.
Значительные перспективы в микрофлуориметрии имеет метод фазовой модуляционной флуориметрии, основанный на измерении глубины модуляции и соответствующего сдвига фаз сигнала, пропорционального интенсивности флуоресценции в широком диапазоне модулирующих частот возбуждающего излучения [77, 249, 551, 1402]. Фазовый метод позволяет анализировать многокомпонентные вещества с короткими временами жизни, с малым стоксовым сдвигом между линиями поглощения и флуоресценции. Типичные фазовые флуориметры работают вплоть до частот модуляции, равных 0,3–30,0 ГГц.
Микрофлуоресцентный метод используется для количественного аминокислотного анализа и определения содержания ДНК в клетках бактерий, идентификации
иизучения свойств пигментов и красителей в модельных системах (липосомы, тени эритроцитов) и внутри живых клеток (культура клеток почки свиньи, фибробластов человека и пр.), изучения внутриклеточного транспорта, в том числе и методом лазерного фотообесцвечивания. В практической медицине возможны флуоресцентная диагностика рака (при фотосенсибилизации опухолевых клеток различными красителями), ишемии сердечной мышцы (в нормальных физиологических условиях); флуоресцентное сопровождение операции на сердце (контроль метаболизма сердечной мышцы), лазерная ангиопластика при атеросклерозе [5].
Возможность применения флуоресцентной спектроскопии для диагностики патологических состояний биотканей основана на том, что в процессе соответствующих биохимических реакций в ткани меняется относительное содержание основных хромофоров (флуорофоров): НАДH, триптофана, эластина, коллагена, кератина и флавинов. Однако исследования в биотканях существенно затруднены из-за сильного рассеяния и поглощения нефлуоресцирующими компонентами (гемоглобином, меланином). Поэтому успех той или иной флуоресцентной методики диагностики зависит от корректности учета этих факторов.
Многие ранние работы по флуоресцентной диагностике относились в основном к анализу флуоресценции естественных флуорофоров под воздействием УФ-излуче- ния лазеров [295, 1366, 1384]. Были проведены исследования автофлуоресценции при одноволновом возбуждении многих типов биотканей in vitro, включая ткани желудка, пищевода, кишечника, шейки матки, легких, почек, тимуса и зубов. Многие из этих исследований показали, что участки ткани с патологией имеют меньшую интенсивность свечения, чем здоровая ткань.
Эти работы получили развитие в последующих исследованиях по разработке флуоресцентных методик диагностики in vivo. В качестве источников излучения, как правило, использовались азотные лазеры (337 нм), эксимерные лазеры (308 нм), лазеры на красителях (370, 410 нм) с накачкой от азотного лазера. Типичная экспериментальная установка показана на рис. 8.8. Обследовались пациенты с патологиями пищевода, шейки матки (внутриэпителиальная неоплазия [1388, 1389])
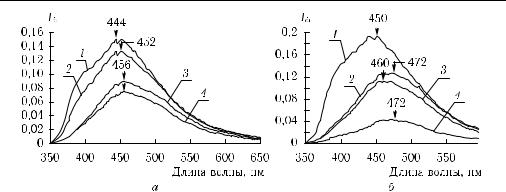
ипрямой кишки (рак, полипы). На достаточно большом материале (десятки пациентов и в некоторых случаях более ста проб по каждому исследованию) показано, что чувствительность методики лежит в диапазоне 86–100 %, а специфичность составляет 73–98 % в зависимости от типа диагностики, меньшие значения соответствуют дискриминации близких по природе образований, например неопластических и гиперпластических полипов. В качестве примера представлены спектры автофлуоресценции шейки матки двух пациенток: одной с хроническим воспалением и вирусной инфекцией (HPV-папиллома вирус человека) (рис. 8.10, а), другой с различными стадиями внутриэпителиальной неоплазии и вирусной инфекцией (рис. 8.10, б), за-
384 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
Рис. 8.10. Спектры автофлуоресценции шейки матки двух пациенток [1388]: 1, 2 — здоровая ткань, 3 — воспаленная ткань, 4 — вирусная инфекция (HPV) (а); 1 — здоровая ткань, 2 — HPV, 3 — внутриэпителиальная неоплазия (II степень), 4 — внутриэпителиальная неоплазия (III степень) (б)
регистрированные с помощью микроспектрофлуориметра (см. рис. 8.8) с азотным лазером.
Другое направление исследований вызванной лазерным излучением автофлуоресценции биотканей — это диагностика атеросклеротических изменений сосудов, что важно для сопровождения лазерной ангиопластики сосудов [295, 326, 1366, 1380, 1395, 1396]. Имеется возможность дифференцировать ткани по частичному преобразованию эластина нормальной ткани в коллаген атеросклеротической бляшки при возбуждении на λ = 337 нм [295]. При возбуждении на λ = 308 нм идентифицируется накопление модифицированных липопротеинов в стенке сосуда, что может быть индикатором ранней стадии атеросклероза [1396]. Флуоресцентное исследование ткани миокарда позволяет устанавливать статус сердечной мышцы [295]. При этом в исследованиях in vitro измерение двух отношений интенсивности флуоресценции на длинах волн 390/465 нм и 465/525 нм дает возможность достаточно надежно дифференцировать нормальную, жировую и зарубцованную ткань.
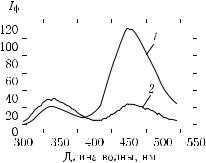
Лазерная автофлуоресценция находит применение при исследованиях естественной микрофлоры кожи, в частности микроорганизмов Propionibacterium acne, которые продуцируют флуоресцирующие порфирины и являются источниками появления вульгарных угрей [1401]. Автофлуоресцентная спектроскопия перспективна для мониторинга заживления ран и ожогов [1385, 1413]. В качестве примера на рис. 8.11 представлены два спектра флуоресценции кожи экспериментального животного (крысы), снятые в области нормальной кожи и в области раны.
Возбуждение спектров на нескольких (или многих) длинах волн позволяет исследовать поведение многих хромофоров одновременно и тем самым более надежно различать здоровую и патологическую ткань. Такие измерения были проведены in vivo для тканей мозга [1366] и кожи [1391] человека, для экспериментального животного (крыса) при исследовании заживления дермальных ран и ожогов [1385], а также ex vivo и in vitro при разработке методик диагностики рака прямой кишки [1397], шейки матки [1366] и мочевого пузыря [1378]. Следует отметить, что исследования in vivo здоровой кожи и кожи в области опухоли (злокачественная меланома, доброкачественная пигментированная опухоль и др.) в широком диапазоне длин волн возбуждения и излучения не выявили каких-либо специфических особенностей флуоресценции опухолевой ткани, в основном из-за сильных пространственных вариаций оптических свойств как здоровой, так и патологической кожи, что в настоящее

386 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
добровольцев в возрасте от 23 до 75 лет. Использовались следующие пары линий для возбуждения и регистрации автофлуоресценции: 364/495, 434/495 и 485/515 нм. Также была найдена почти линейная зависимость интенсивности флуоресценции от возраста для здоровых пациентов и существенное ускорение этой зависимости для больных диабетом, что связывается с образованием коричневых флуоресцирующих белковых аддуктов и перекрестных сшивок белковых молекул с участием глюкозы. Прибор предлагается для массовых обследований населения по поводу диабетической болезни.
Отметим, что калибровка флуоресцентных измерений с помощью одновременно регистрируемых спектров отражения успешно используется в исследованиях сильно рассеивающих тканей in vivo, таких как кожа, слизистые внутренних органов [250, 567, 568, 1358–1361].
Для повышения контраста свечения опухолей или других локализованных патологических образований часто используют эгзогенные флуорофоры или индуцирующие препараты типа ALA [4, 6, 55, 205, 295, 309, 1382, 1386, 1390, 1392, 1393]. В этом случае методика диагностики может строиться как на исследовании спектров флуоресценции эгзогенных красителей, так и комбинации спектров эндогенных и экзогенных флуорофоров. Например, для слизистой оболочки ротовой полости при длине волны возбуждения 400 (±30) нм наблюдалось возрастание интенсивности как автофлуоресценции, так и флуоресценции, вызванной индуцируемым протопорфирином IX, в ряду: здоровая ткань, новообразование, злокачественное образование [1392]. В то же время для кожи только введение ALA позволяло наблюдать надежно регистрируемое увеличение интенсивности флуоресценции по мере преобразования ткани в сторону злокачественных изменений. При этом методика двойного отношения интенсивностей флуоресценции разных диапазонов длин волн дала возможность устранить сильное влияние пространственных неоднородностей оптических свойств кожи и зависимость измерений от цвета исследуемой ткани. Отношение интенсивностей флуоресценции в красной области (660–750 нм) к желтой (550–600 нм) при возбуждении на λ = 405 нм делится на отношение интенсивностей этих же полос при возбуждении на λ = 435 нм [1393]. Эти линии возбуждения соответствуют максимуму полосы Соре для порфиринов и некоторой отстройке от ее максимума.
Для иллюстрации возможности наблюдения патологических изменений ткани и сопровождения фотодинамической терапии за счет флуоресценции ALA-индуцируе- мых протопорфиринов на рис. 8.12 показаны спектры флуоресценции кожи пациента с эритроплазией Кейра, снятые через 6 часов после местного введения ALA (мазь, содержащая 20 % ALA) в процессе фотодинамической терапии. В области введения препарата (область патологии) интенсивность флуоресценции достаточно сильная, при этом не обнаружено флуоресценции фотопродуктов ALA в соседних участках,
Рис. 8.12. Спектры флуоресценции кожи пациента с эритроплазией Кейра через 6 ч после местного введения ALA (крем с 20 % содержанием ALA) в процессе фотодинамической терапии (облучение на длине волны 633 нм, 3 Дж/см2): 1 — спектр, снятый в области патологии; 2 — спектр соседнего здорового участка
кожи, где крем не наносился [1379]
388 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
[295]. Или другой пример, под действием излучения эндогенные протопорфирины частично преобразуются в фотопродукты, называемые фотопротопорфиринами, при этом из-за многокомпонентного состава протопорфиринов временной отклик флуоресценции имеет по крайней мере два характерных времени затухания: для необлученного объекта 1 и 6 нс, а для облученного, соответственно, 0,63 и 3,4 нс [1401].
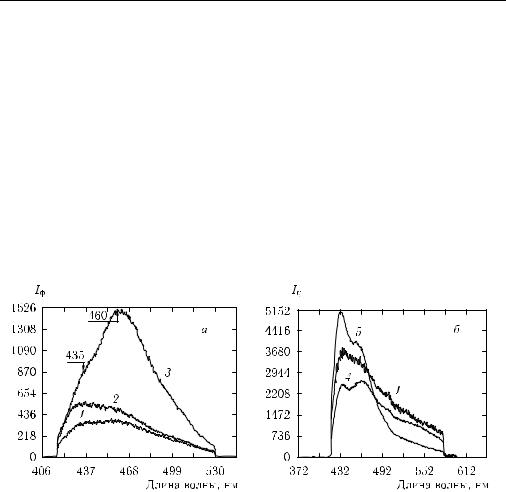
С использованием микроспектрофлуориметра с временной выборкой спектров (см. рис. 8.9) можно анализировать вклады различных компонентов биоткани в формирование спектра флуоресценции. Спектры автофлуоресценции тканей мочевого пузыря человека и ряда выделенных компонентов биоткани наглядно иллюстрируют такую возможность (рис. 8.13). Оба типа исследуемой ткани показали повышенную интенсивность излучения в области 430–435 нм, что может отражать вклад связанной НАДH (для данной временной выборки спектр суспензии дрожжей определяется спектром флуоресценции свободной (максимум 460 нм) и связанной (максимум 435 нм) НАДH). Свечение соединительной ткани в красной области может быть объяснено только присутствием эластина, он же должен давать определенный вклад и в свечение ткани в области λ = 465 нм. Роль коллагена остается пока невыясненной.
Рис. 8.13. Спектры задержанной во времени автофлуоресценции тканей стенки мочевого пузыря человека: 1 — соединительная ткань (подслизистая), 2 — эпителиальная ткань (опухоль), 3 — суспензии дрожжей (НАДH), 4 — образцов эластина, 5 — коллагена; возбуждение на длине волны 355 нм. Измерения в периоды времени 0–5 нс (а) и 5–10 нс (б) после начала действия импульса лазера [1409]
Задержанная во времени флуоресценция фталоцианинового красителя (AlS2Pc) при малоинтенсивном возбуждении (< 100 мкВт/см2) в красной области (610, 650 и 670 нм) позволяет надежно визуализировать внутридермальные опухоли (у экспериментальных животных) [1400].
Для диагностики рака предлагается лазерная эндоскопическая система, построенная на принципе визуализации биоткани с помощью измерения пространственных распределений фазы и амплитуды модуляции интенсивности флуоресценции, вызванной модулированным по интенсивности излучением лазера [1402]. Такие измерения с разрешением во времени позволяют визуализировать пространственное распределение того или иного флуорофора по его времени жизни. Для возбуждения флуоресценции использовались лазеры аргоновый, криптоновый и на красителях, интенсивность излучения лазеров модулировалась с помощью электрооптического
8.3. Флуоресцентный микроанализ |
389 |
модулятора, измерялись модуляционные характеристики как флуоресценции, так
иобратно отраженного излучения (см. рис. 8.1). Распределение флуорофоров определялось по временам их жизни. Например, для тканей мочевого пузыря здоровая слизистая имела время затухания флуоресценции 2,6 ± 0,2 нс, эритематозный уротелий — 1,65 ± 0,4 нс, изъязвленная ткань — 1,25 ± 0,4 нс. В этом примере, по-видимому, основным флуорофором является НАДH (длина волны возбуждения 363 нм). И время жизни, и интенсивность флуоресценции уменьшались при эритеме
ив случае патологии. Для нормальной слизистой ротовой полости характерное время
жизни составляло 2,5 ± 0,2 нс, а для саркомы in situ время жизни возрастало до 3,44 ± 0,7 нс. В этом случае имел место вклад от многих хромофоров, однако вклад от порфиринов, по-видимому, преобладал, так как длина волны возбуждения была равна 417 нм.
Лазерная микроспектрофлуориметрия является уникальным инструментом не только для рассмотренных выше прикладных биомедицинских исследований, с ее помощью успешно решаются проблемы фундаментальной медицины и биологии. Одним из важнейших направлений таких исследований является микроспектрофлуориметрия отдельных клеток и их компонентов [55].
Разработаны новые эффективные методы исследования метаболических процессов внутри отдельных клеток, в качестве только двух примеров отметим работы [1256, 1398]. В первой из них описан метод многоточечной спектроскопии и спектральной визуализации отдельных клеток, использующий фурье-спектрометр для регистрации интенсивности флуоресценции (см. главу 6). С помощью этого метода и разработанного авторами спектрометра была исследована локализация, специфика внутриклеточного взаимодействия и первичные фотобиологические реакции эндогенного ALA-индуцированного протопорфирина в отдельной живой клетке меланомы B16. Спектры флуоресценции регистрировались от каждой из 100 · 100 точек внутри клетки, что обеспечивало пространственное разрешение при локализации исследуемых процессов порядка 0,3 мкм.
Во второй работе описан новый способ удержания исследуемого объекта — клетки с помощью так называемого оптического пинцета (лазерного пучка достаточной мощности и необходимой геометрии для компенсации сил, приводящих частицу
вдвижение). Было показано, что удержание клетки лазерным пучком с длиной волны 1064 нм и плотностью мощности до 70 МВт/см2 и дозе облучения до 100 ГДж/см2 не изменяет спектра автофлуоресценции клетки (под действием УФ-источника), в то же время удержание клетки лазерным излучением с длиной волны 760 нм даже при меньших уровнях плотности мощности и дозы облучения существенно влияет на автофлуоресценцию (возможно, за счет двухфотонного поглощения в клетке). Эти результаты открывают новые возможности в исследовании флуоресценции отдельных клеток.
Отметим, что лазерные микрофлуоресцентные методы широко распространены
впролетной цитометрии [357, 1372, 1373]. Возможно, что описанный выше лазерный способ удержания отдельных клеток окажется полезным для некоторых методик цитометрии, включая флуоресцентную.
Новым направлением в лазерной микроскопии биологических объектов является двухфотонная флуоресцентная сканирующая микроскопия, позволяющая осуществлять визуализацию функциональных состояний объекта или в сочетании с автокорреляционным анализом сигнала флуоресценции определять внутриклеточную подвижность в малых объемах [15, 19, 20, 41, 260–269, 707, 722, 732–738, 1404, 1405]. Для двухфотонного возбуждения, так же как и для конфокальной микроскопии, свойственно возбуждение малых объемов и дискриминация по глубине, однако без использования малых диафрагм, ограничивающих светосилу. Более того, явления

390 Гл. 8. Лазерный микроспектральный анализ в биомедицинских исследованиях
фотодеструкции и фотовысвечивания, зачастую сопровождающие исследование биологических материалов с помощью конфокальной микроскопии, не свойственны двухфотонной микроскопии. Для конфокальной схемы сбора фотонов в формировании полезного сигнала участвуют лишь баллистические фотоны, которых очень мало в рассеивающей среде, и поэтому приходится облучать объект достаточно интенсивным светом. В то же время в двухфотонной методике используются как баллистические, так и рассеянные фотоны на длине волны флуоресценции, вызванной светом второй гармоники излучения возбуждения, приходящие на широкоапертурный детектор строго из области фокуса пучка возбуждения.
Уникальным достоинством двухфотонной микроскопии является возможность исследования трехмерного распределения возбуждаемых в УФ-свете хромофоров
втолстых образцах. Такая возможность обеспечивается тем, что для возбуждения хромофоров (например, поглощающих на длине волны 350 нм) можно использовать существенно более длинноволновое лазерное излучение, соответствующее значительной прозрачности биоткани (700 нм), которое проникает до глубоких слоев и
вгораздо меньшей степени повреждает ткани, а излучение флуоресценции опять лежит в видимом диапазоне (> 400 нм); оно сравнительно легко выходит из ткани к фотодетектору, регистрирующему только полезный сигнал из фокального объема без какого-либо постороннего фона (см. раздел 1.6.2).
При исследованиях биотканей и клеток методом двухфотонной микроскопии типичными являются следующие параметры источников излучения — лазерных систем: длина волны 700–960 нм, длительность импульса порядка 150 фс, частота повторения импульсов 76–80 МГц, средняя мощность менее 10 мВт. Такие параметры обеспечиваются лазерами с синхронизацией мод — на красителях с накачкой от АИГ:Nd-лазера или титан-сапфировым с накачкой от аргонового лазера. Перспективными для целей двухфотонной микроскопии считаются твердотельные лазеры с диодной накачкой. Примерно такие же параметры лазеров требуются и для трехфотонной флуоресцентной микроскопии биообъектов, которая обладает всеми достоинствами двухфотонной микроскопии с несколько большим пространственным разрешением и возможностью возбуждать коротковолновые хромофоры [1406].
8.4. КР-микропроба
Спектроскопию комбинационного рассеяния (КР) или резонансного КР (РКР) можно также отнести к микроспектральным методам, поскольку для возбуждения КРили РКР-спектров вещества требуется достаточно высокая плотность
мощности, что достижимо только при жесткой |
фокусировке |
лазерного пучка |
[5, 63, 102, 107–109, 331–355, 1255, 1374, 1420–1423]. |
|
|
Один из вариантов лазерной КР-микропробы |
хрусталика |
глаза показан на |
рис. 8.14 [333]. В данном случае для фокусировки лазерного пучка Аr-лазера (λ = 514 нм) применяется оптический микроскоп со встроенной внутри него поворотной призмой. Лазерный пучок попадает в микроскоп через полупрозрачное поворотное зеркало. Рассеянное объектом излучение идет по тому же пути в обратном направлении и попадает на входную щель спектрометра. Для наблюдения сфокусированного лазерного пучка на объекте используется сильно ослабленный отраженный свет, прошедший поворотную призму; свет попадает или в бинокуляр для визуального наблюдения, или на цветную видеокамеру для просмотра изображения на мониторе. Для фокусировки применяется 20-кратный объектив, который при размещении объекта в иммерсионной жидкости (рис. 8.14, б) позволяет получать диаметр сфокусированного пучка порядка 2 мкм на расстоянии 4 мм от края объектива. Существуют и другие системы взятия КР-микропробы с диаметром сфокусирован-

|
|
|
|
|
|
|
|
|
|
|
|
8.4. КР-микропроба |
391 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 8.14. Схематическое представление КР-микропробы хрусталика глаза [333]: а — общая схема (1 — хрусталик; 2 — микроскоп; 3 — видеокамера; 4 — лазерный пучок; 5 — спектрометр); б — область фокусировки лазерного пучка (1 — иммерсионная жидкость, 2 — лазерное и рассеянное излучения; 3 — микрообъектив; 4 — хрусталик; 5 — столик)
ного пучка 6 0,5 мкм, например с использованием конфокального принципа (рис. 8.15) [333, 347]. Для конфокальных КР-спектрометров оптимальным является выбор не очень малых диафрагм. Например, для диафрагмы диаметром около 100 мкм при возбуждении на длине волны 660 нм измерительный объем оказывается достаточно малым для проведения исследований внутри клетки (поперечный размер ≈ 0,45 мкм, продольный ≈ 1,3 мкм), а КР-сигнал при этом практически не теряется [333]. Высокое пространственное разрешение при значительной амплитуде КР-сигнала без 


опасности разрушения объекта можно получить, используя узкие ленточные пучки и щель вместо диафрагмы для реализации конфокального приема рассеянного излучения от объекта [333] (см. также рис. 8.3).
В качестве КР-спектрометров используются как традиционные спектрометры со сканированием спектра во времени, так и полихроматоры, совмещенные с ОМА.
ОМА позволяет существенно повысить быстродействие КР-микропробы.
Напомним некоторые принципиальные моменты из области КР-спектроскопии [332, 982] (см. также раздел 1.8). Если молекулы облучаются монохроматическим светом с частотой ω, то рэлеевское рассеяние происходит на той же частоте ω, и интенсивность его значительна. При КР
Рис. 8.15. Схематическое представление
появляются новые частоты: ωc = ω0 − ωк — |
конфокального принципа регистрации КР- |
|
стоксовы компоненты и ωac = ω0 + ωк — ан- |
спектров при исследовании водного обме- |
|
тистоксовы компоненты, ωк — комбинаци- |
||
на в хрусталиках глаза человека [347]: |
||
онная частота молекулы. Комбинационные |
||
1 — объектив микроскопа; 2 — хрусталик; |
||
частоты соответствуют переходам между |
||
3 — фосфатный буферный раствор на ос- |
||
колебательными и вращательными уровня- |
||
нове D2O; 4 — кювета; 5 — измерительный |
||
ми. Однако это не обязательно те частоты, |
||
объем (увеличено); 6 — фильтр; 7 — точеч- |
||
которые наблюдаются в инфракрасных аб- |
ная диафрагма; 8 — направление от лазера; |
|
сорбционных спектрах молекул. Похожесть |
9 — направление к спектрометру |
