
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf172 |
Гл. 2. Распространение света в биологических тканях |
Детектирование интерференционных сигналов для ортогонально поляризованных составляющих детектируемого излучения при различных состояниях поляризации освещающего пучка позволяет определить параметры Стокса рассеянного объектом света и тем самым измерить оптическую анизотропию биоткани в зависимости от глубины сканирования. Визуализация структуры осуществляется путем реконструкции двумерных и трехмерных распределений разности фаз двух ортогонально поляризованных составляющих рассеянного объектом излучения. В результате анализ наклона зависимости разности фаз от глубины позволяет определить толщину пораженного ожогом слоя. В монографии [27] дан обзор результатов многих других исследований in vitro и in vivo биотканей (зубной эмали и дентина человека, свиной и куриной сердечной мышцы и др.) на основе измерений двулучепреломления на различных глубинах с помощью поляризационно-чувствительной ОКТ.
Объединение принципов ОКТ и лазерной доплеровской диагностики позволяет создать многофункциональные диагностические системы для анализа и визуализации как морфологических особенностей биотканей, так и гемодинамики в биотканях на различных глубинах. К настоящему времени метод доплеровской ОКТ хорошо разработан и описан во многих статьях и монографиях [33, 438, 832, 833, 835, 836, 843]. Физические основы селективного по глубине зондирования нестационарных рассеивающих сред с динамикой рассеивающих центров, существенно различающейся на различных глубинах, с использованием частично когерентного излучения рассматривались в работе [835]. В работе [836] рассмотрена возможность доплеровской ОКТ биотканей на различных глубинах с использованием пикосекундных зондирующих импульсов лазерного излучения.
Оптическая томография со свипированием частоты излучения отличается от традиционной ОКТ использованием зондирующего излучения с длиной когерентности, существенно превышающей максимальную разность хода между интерферирующими опорным и объектным пучками [875]. Дискриминация рассеянного излучения по глубине достигается за счет непрерывной перестройки частоты зондирующего излучения по линейному закону в течение цикла сканирования. Обратное фурье-преобразование зависимости выходного сигнала детектора от мгновенной частоты зондирующего излучения позволяет получить автокорреляционную функцию распределения коэффициента отражения объекта по глубине. Свипирование частоты зондирующего излучения обеспечивается применением электрически управляемого лазерного диода (диапазон перестройки по длинам волн 0,8 нм около 852 нм) или применением полупроводникового лазера с дифракционной решеткой в качестве внешнего зеркала резонатора (диапазон перестройки 771–791 нм) [875].
Построены более широкополосные лазерные свипируемые системы с довольно большой выходной мощностью, анализ которых дан в монографии [33]. Например, промышленно выпускаемая, построенная на базе свипируемого источника ОКТ-сис- тема OCM 1300SS Thorlabs имеет высокую скорость сканирования (получения изображений), порядка 16 кГц, выходную мощность 10 мВт, среднюю длину волны 1325 нм и полосу на уровне 10 дБ больше 130 нм [33]. В работе [876] описана фазочувствительная ОКТ со свипируемым лазерным источником и ее применение для количественного определения параметров газовых пузырьков в жидкостях и моделях биотканей. При этом структурные изображения газовых пузырьков были получены с помощью обычной системы со свипированием, а для обеспечения фазовых измерений применялась система с общим оптическим путем. Система работала на средней длине волны 1315 нм с полосой ±55 нм, фазовые измерения обеспечивали чувствительность на уровне 0,03 рад, глубина зондирования на воздухе до 6 мм и скорость сканирования для одного продольного скана (z- или A-скана) — 20 кГц. Если пространственное разрешение структурных изображений пузырьков

2.7. Особенности взаимодействия лазерного излучения с биотканями |
173 |
было порядка 10 мкм, то временной отклик фазы обеспечивал точность порядка 0,01 мкм. Метод имеет хорошее быстродействие и позволяет получать изображения движущихся пузырьков.
2.7.6. Цифровая голографическая и интерференционная микроскопия.
Еще одним примером применения лазеров и когерентных источников света в биологии и медицине является цифровая голографическая микроскопия, которая использует классический принцип голографии, но в которой в качестве регистрирующего элемента применяется цифровая камера, например ПЗС-камера [708–713]. Рис. 2.44 представляет концепцию построения инвертированного цифрового голографического микроскопа (ЦГМ), разработанного на основе промышленного исследовательского микроскопа для изучения прозрачных образцов, таких как живые клетки [713]. В качестве источника света используется лазер (вторая гармоника АИГ:Nd-лазера, λ = 532 нм), излучение которого делится на объектную волну (освещающую объект) и опорную волну. Для удобства транспортировки когерентного света используются одномодовые волоконные световоды (ВС) с сохранением поляризации. При этом для освещения объекта излучение направляется через конденсор микроскопа. Опорная волна направляется прямо в интерференционный блок, который сопряжен с одним из портов микроскопа, предназначенных для подключения камеры. Делитель пучка вносит небольшой относительный сдвиг между волновыми фронтами объектной и опорной волн. Формируемая за счет наложения этих волн голограмма регистрируется ПЗС-камерой и передается в систему обработки изображений для реконструкции цифровых голограмм и дальнейшей работы с ними. Время регистрации голограммы зависит от используемого матричного фотоприемника, которое для ПЗС-камеры обычно меньше или равно 1 мс.
В литературе описаны разнообразные методы для численной реконструкции цифровых голограмм (см., например, [877]). Голографический метод с пространственным фазовым сдвигом (ПФС) оказался вполне подходящим для использования при реконструкции цифровых голограмм, снятых в описанной выше геометрии для слегка несовпадающих волновых фронтов объектной и опорной волн [713]. Численный алгоритм ПФС позволяет устранять влияние интенсивности нулевого порядка и двойного изображения и обеспечивает компенсацию аберраций объектного волнового фронта по отношению к опорной волне. Метод ПФС в приложении к реконструкции цифровых голограмм был успешно применен для визуализации и исследования живых клеток [708, 711, 713]. Распределение интенсивности IHP(x, y, z0) в плоскости голограммы HP, находящейся в плоскости z = z0, формируется за счет интерференции объектной волны O(x, y, z = z0) и опорной волны R(x, y, z = z0) [713]:
IHP(x, y, z0) = O(x, y, z0)O (x, y, z0) + R(x, y, z0)R (x, y, z0)+
+ O(x, y, z0)R (x, y, z0) + R(x, y, z0)O (x, y, z0) = = IOq(x, y, z0) + IR(x, y, z0)+
+ 2 IO (x, y, z0)IR(x, y, z0) cos ϕHP(x, y, z0) (2.118)
где IO = OO = |O|2 и IO = RR = |R|2 (* обозначает комплексно-сопряженные
величины). Параметр ϕHP(x, y, z0) = ϕR(x, y, z0) − ϕO (x, y, z0) представляет собой разность фаз между волнами O и R в плоскости z = z0. При наличии объек-
та на оптическом пути волны O распределение фазы определяется соотношением ϕO (x, y, z0) = ϕO0 (x, y, z0) + ϕS(x, y, z0), где ϕO0 (x, y, z0) — фаза самой объект-

174 |
|
|
|
|
|
Гл. 2. Распространение света в биологических тканях |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.44. Оптическая схема цифрового голографического микроскопа на основе инвертированного микроскопа; HP: плоскость голограммы (плоскость ПЗС) (z = z0), zIP – локализация изображения (z = z0 + z) [713]
ной волны, а ϕs(x, y, z0) — изменение фазы за счет объекта. Для областей не занятых объектом ϕHP(x, y, z0) определяется математической моделью [713, 878]:
ϕHP(x, y, z0) = ϕR(x, y, z0) − ϕO0 (x, y, z0) =
= 2π(Kxx2 + Ky y2 + Lxx + Ly y). (2.119)
Параметры Kx, Ky в уравнении (2.119) описывают расходимость объектной волны и свойства объективов микроскопа. Константы Lx, Ly определяют линейную разность фаз между O- и R-волнами за счет несоосной геометрии эксперимента. Для количественных фазовых измерений на основе измерений величины IHP(x, y, z0) на первом этапе комплексная объектная волна O(x, y, z = z0) в плоскости голограммы определяется попиксельно путем решения системы уравнений, получающейся при подстановке уравнения (2.119) в уравнение (2.118). Для этого учитываются интенсивности соседних участков, например в пределах площади 5 × 5 пикселей вокруг данного голограммного пикселя, путем применения алгоритма для расчета пространственного фазового сдвига (см. [878]). Этот алгоритм основан на предположении, что только величина фазового сдвига между объектной O(x, y, z0) и опорной
R(x, y, z0) волнами ϕHP(x, y, z0) = ϕR(x, y, z0) − ϕO0 (x, y, z0) быстро меняется в пространстве в области плоскости голограммы. В дополнение, интенсивность объ-
ектной волны предполагается постоянной в области вокруг заданной точки голограммы, для которой производится численная оценка. Это условие хорошо выполняется

2.7. Особенности взаимодействия лазерного излучения с биотканями |
175 |
в случае оптимального соотношения между увеличением микроскопа и используемым матричным приемником. По этой причине увеличение микроскопа выбирается из соображений, чтобы наименьшие изображаемые структуры объекта, размеры которых определяются разрешающей способностью оптической системы в соответствии с критерием Аббе, регистрировались ПЗС-камерой с некоторым запасом по занимаемой ими площади на детекторе.
Параметры Kx, Ky , Lx, Ly не могут быть получены с необходимой точностью непосредственно из анализа геометрии эксперимента, поэтому перед основными измерениями они определяются с помощью итерационной процедуры подгонки на основании предварительных исследований в отсутствии образца (см. [708]).
Также как и в случае обычного микроскопа с освещением белым светом, ЦГМ требует обеспечения условий получения резкого изображения. Однако в ЦГМ, если объект при получении голограммы не изображается резко в голографической плоскости HP, например вследствие механических или тепловых нестабильностей, можно сделать корректировку резкости изображения уже на втором этапе в процессе дальнейшего распространения объектной волны к плоскости изображений. В процессе распространения параметр z выбирается таким образом, чтобы голографическое амплитудное изображение было резким, в соответствии с микроскопическим изображением в белом свете. Следующим критерием для получения резкого изображения объекта является устранение влияния дифракционных эффектов при когерентном освещении, которые минимизируются алгоритмически. В результате применения этих алгоритмов и параметрической модели для разности фаз ϕHP в уравнении (2.119) реконструированные голографические изображения уже не содержат вклада сигналов двойного изображения и нулевого порядка.
Из объектной волны O(x, y, zIP), в дополнение к модулю амплитуды |O(x, y, zIP)|, который определяет обычное изображение объекта, одновременно реконструируется
ифазовая информация ϕS(x, y, zIP) об объекте:
ϕS(x, y, zIP) = ϕO (x, y, zIP) − ϕO0 (x, y, zIP) =
= arctg |
Im{O(x, y, zIP)} |
(модуль 2π). (2.120) |
|
Re{O(x, y, zIP)} |
|
После устранения неопределенности, обусловленной фазой 2π [709], данные, полученные из уравнения (2.120), могут быть использованы в количественной фазо- во-контрастной микроскопии.
В режиме пропускания, как это показано на рис. 2.44, измеряемая фазовая информация полупрозрачного объекта определяется его толщиной и показателем преломления, а также показателем преломления окружающей среды. Для многих типов живых клеток информация о показателе преломления в литературе отсутствует, поэтому в последние годы разрабатываются новые интерферометрические
иголографические методы измерения показателя преломления компонентов живых клеток и изучения связи рефракции с функциональным состоянием клетки [708–718, 879–882]. Например, методом ЦГМ были измерены интегральные значения показателя преломления нейронов [879]. В таких измерениях необходимо контролировать толщину образца [708]. Аналогичные проблемы с контролем толщины имеют место и в фазовой микроскопии на основе преобразования Гильберта при использовании микрожидкостного оборудования [880]. В работах [713, 881] были получены ЦГМ-изображения сферических клеток в суспензии и определен их радиус
иинтегральный показатель преломления. В работе [882] показатель преломления и размер клеток были измерены независимо с помощью двухволновой системы ЦГМ в комбинации с управлением дисперсией окружающей среды за счет добавления
176 |
Гл. 2. Распространение света в биологических тканях |
внешнего красителя. В работе [710] описан метод ЦГМ-томографической рефрактометрии клеток путем регистрации множественных фазово-контрастных изображений вращающегося образца. Аналогичные результаты были получены с помощью фазовой фурье-микроскопии [714] и дифракционной микроскопии [883], когда плотный клеточный объект просвечивался в различных направлениях. Тем не менее, во всех этих случаях не было возможности провести независимые измерения толщины (размеров) и показателя преломления.
Для случая, когда клетки находятся в среде с показателем преломления n0, а интегральный показатель преломления клетки ncell считается известным, геометрическая толщина клетки H(x, y, zIP) может быть определена на основе измерений разницы значений оптической длины пути ( ϕcell) при прохождении света через клетки и через окружающую клетки среду [708]:
H(x, y, zIP) = |
λ ϕcell(x, y, zIP) |
· |
1 |
, |
(2.121) |
2π |
ncell − n0 |
где λ — длина волны света. В принципе, по измеренному параметру dcell можно оценить форму клеток. Тем не менее, уравнение (2.121) нужно использовать с осторожностью, поскольку, например, разнообразные токсины и осмотические реакции могут воздействовать как на размеры, так и показатель преломления клеток (см. [22, 708]).
Рисунок 2.45 иллюстрирует процесс обработки и представления зарегистрированных цифровых голограмм. Рисунки 2.45, а и б показывают цифровую голограмму живой клетки карциномы поджелудочной железы человека (Patu8988T), полученную с помощью инвертированного ЦГМ (рис. 2.44), работающего в режиме просвечивания (объектив микроскопа 40×, NA = 0,65), и реконструированное голографическое амплитудное изображение, которое соответствует изображению в микроскопе светлого поля при когерентном лазерном освещении. Рисунок 2.45, в представляет одновременно реконструированное изображение фазового контраста с учетом модуля 2π (уравнение (2.120)). Данные для непрерывного фазового распределения с исключенной 2π-неопределенностью, представляющие собой изменения оптической длины пути при прохождении света через клетку по сравнению с окружающей средой, представлены на рис. 2.45, г. Рисунок 2.45, д показывает псевдотрехмерное изображение клетки в шкале градаций серого. Рассчитанная на основании уравнения (2.121) толщина клетки вдоль отмеченной пунктирной линии на рис 2.45, г, при ncell = 1,38, n0 = 1,337 и λ = 532 нм показана на рис. 2.45, е. Первая производная по координате x данных, представленных на рис. 2.45, г, определяет дифференциальное интерференционное фазово-контрастное ЦГМ. Этот метод сравним с хорошо известным методом дифференциального интерференционного фазового контраста Номарского, но с дополнительными достоинствами цифровой настройки фокуса и управления чувствительностью за счет цифровой подстройки сдвига.
Интерференционный фазовый микроскоп для высокоточных количественных исследований отдельных клеток представлен на рис. 2.46. Так же как и описанный выше голографический микроскоп, он построен на базе инвертированного микроскопа с одномодовыми волоконно-оптическими элементами и ПЗС-камерой в качестве детектора [884]. В качестве когерентного источника света применяется гелий-неоно- вый лазер с длиной волны 632,8 нм. Для обработки сигнала и получения значений оптической (или фазовой) толщины в этом микроскопе используется преобразование Гильберта — это так называемая гильбертова фазовая микроскопия (ГФМ). Концепция преобразования Гильберта в пространственном масштабе позволяет получать количественные фазовые изображения с использованием записи только одной пространственной интерферограммы. Благодаря одномоментной природе регистрации, ГФМ имеет малое время сбора данных, ограниченное только регистрирующей ап-

|
2.7. Особенности взаимодействия лазерного излучения с биотканями |
177 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.45. Пример обработки и представления результатов цифровой голографической микроскопии (ЦГМ): а — цифровая голограмма клетки карциномы поджелудочной железы человека (Patu8988T); б — ее реконструированное голографическое амплитудное изображение; в — количественное фазово-контрастное изображение (модуль 2π); г — развернутое распределение фазы; д — псевдотрехмерное изображение развернутого фазового изображения в шкале градаций серого; е — расчетная толщина клетки вдоль пунктирной линии изображения г; ж — дифференциальное интерференционное фазово-контрастное ЦГМ изображение клетки [713]
178 |
Гл. 2. Распространение света в биологических тканях |
паратурой, и поэтому обеспечивает точные измерения сдвигов оптической (фазовой) длины на нанометровом уровне в миллисекундном или даже меньшем временн´ом масштабе, характерных для многих биологических явлений.
В микроскопе с объективом 100× выходное поле одномодового ВС является полем освещения объекта. Все ВС зафиксированы механически, чтобы не создавать дополнительных фазовых шумов в системе. Линза настроена таким образом, чтобы изображение объекта, проходя через делительный кубик, формировалось в плоскости ПЗС-камеры. В опорном плече выходное поле другого одномодового ВС коллимируется и расширяется за счет телескопической системы, состоящей из другого объектива и той же линзы. Опорный пучок представляет собой плоскую волну, которая интерферирует с полем изображения. Опорное поле немного расстроено по направлению по отношению к объектному полю, так что однородные интерференционные полосы формируются под углом 45◦ по отношению к осям x и y. ПЗС-камера (C7770, Hamamatsu Photonics) имеет скорость регистрации 291 кадров/с при полном разрешении 640 × 480 пикселей при времени экспозиции 1–1,5 мс. Полосы регистрировались при использовании 6 пикселей на период. Пространственное распределение интенсивности, связанное с интерферограммой в одном направлении дается хорошо известным выражением:
I(x) = IR + IS(x) + 2[IRIS(x)]1/2 cos[qx + ϕ(x)], |
(2.122) |
где IR и IS — соответственно распределения интенсивности опорного и объектного полей, q — пространственная частота модуляции полос, а ϕ(x) — пространственно неоднородная фаза, обусловленная объектом, что является предметом исследования. При использовании фильтрации высоких пространственных частот и преобразования Гильберта, величина ϕ(x) определяется в каждой точке одномоментного изображения. В качестве иллюстрации на рис. 2.46, б представлены динамические изображения эритроцита. Продемонстрирована возможность получения динамических изображений клеток для их морфометрии в нанометровом пространственном и миллисекундном временном масштабах. Динамический профиль геометрической толщины клетки может быть прямо получен из фазовых измерений,
H(x, y, t) = (λ/2π n)ϕ(x, y, t), где n = (ncell − n0) — разность среднего показателя преломления клетки и окружения, которую называют контрастом показателя
преломления [884] или рефракторностью [715]. Отсюда следует возможность определения мгновенного объема клетки из ГФМ-данных, V (t) = H(x, y, t)dx dy.
Таким образом, для исследования внутриклеточной динамики перспективными являются интерференционные и голографические методы и их новые модификации [708–718, 877–890]. Фундаментальное значение для диагностики функционального состояния является связь измеряемой интерференционным методом оптической разности хода с макроскопическим параметром среды — показателем преломления. Перспективность использования методов когерентной интерферометрии для исследования внутриклеточной динамики, детально обсуждается в обобщающих работах В. П. Тычинского [715–717]. Измерения рефрактерности клеток подтвердили диагностическое значение показателя преломления. Например, изменения рефрактерности при гипотоническом стрессе были обнаружены при исследованиях нейронов методом цифровой голографической микроскопии [879] (рис. 2.45). Методом гильбертовой фазовой микроскопии [884] были показаны пространственно-временные изменения фазовой толщины эритроцитов (рис. 2.46, цветная вклейка). В этой же работе при исследовании гемолиза отдельного эритроцита, было показано, что объем клетки при гемолизе снижается довольно медленно, на 50 % за 4 с, что определяется ригидностью мембраны эритроцита, что также имеет диагностическую ценность.
2.7. Особенности взаимодействия лазерного излучения с биотканями |
179 |
Как мы уже обсуждали выше (см. соотношения (2.118)–(2.121)), эквивалентная модель биообъекта имеет принципиальное значение для применений интерференционных методов, для диагностики и интерпретации полученных результатов. Обычно оптически неоднородный реальный объект представляют однородной сферой с эквивалентным показателем преломления. В немногих случаях удается разделить структурные элементы и определить их рефрактерность. Вклад в оптическую разность хода (ОРХ) дают геометрическая толщина H и рефрактерность n, поэтому их разделение и точность определения показателя преломления объекта имеют существенное значение для обнаружения слабых эффектов. Для разделения вкладов в ОРХ геометрической толщины H и показателя преломления объекта можно, например, использовать две иммерсионные среды с известными показателями преломления [879]. Ячейка, в которой содержатся клетки, изготовленная из материала с известным показателем преломления, по сути является эталонным объектом, как по форме, так и показателю преломления. Такой подход, примененный в ГФМ с общим путем обеспечил высокую точность результатов измерений, малую чувствительность к вибрациям и миллисекундное временное разрешение [886].
Когерентные интерференционные методы из-за отсутствия необходимости использования маркеров являются существенно менее инвазивными, чем, например, флуоресцентные методы с применением красителей или наночастиц. Органеллы клеток легко различаются по фазовому контрасту. Размеры органелл, как правило, меньше или соизмеримы с длиной волны, поэтому для амплитудных оптических методов пространственное разрешение ограничено дифракцией на апертуре объектива, в то время как когерентные интерферометрические методы при исследовании фазовых объектов потенциально имеют пространственное сверхразрешение, существенно меньшее дифракционного предела [716, 890–892].
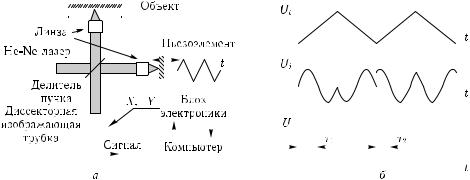
Исследования В. П. Тычинского с соавторами [715–717, 890–894] производились на разработанном ими когерентном фазовом микроскопе (КФМ) «Эйрискан», оптическая схема которого приведена на рис. 2.47. Микроскоп является модификацией микроинтерферометра Линника, в котором в качестве источника когерентного излучения используется гелий-неоновый лазер (λ = 632,8 нм). Для регистрации интерференционного сигнала и его преобразования в локальные значения фазы производилась линейно-периодическая модуляция фазы опорной волны. В качестве детектора использовался координатно-чувствительный фотоприемник (диссектор) и электронный блок с аналогово-цифровым преобразователем. Принципиальное отличие от других интерференционных методов получения фазовых изображений заключается в том, что измерения ОРХ производится последовательно в каждой точке изображения. Периодичность выборки и скорость ввода изображения определяется частотой модуляции 1 кГц (или 1 мс на пиксель), что ограничивало быстродействие системы. Полученные фазовые изображения имели высокое пространственное разрешение (до 100 нм) при получении статических фазовых изображений [715, 716, 890, 891] и до 25 нм — динамических [892]. Существенное достоинство метода состоит также в возможности произвольного доступа к точкам изображения. Рабочее поле микроскопа могло изменяться в пределах 5–50 мкм в зависимости от используемого объектива, максимальная размерность изображения по одной координате достигала 1024 пикселя. Ограниченная шумами чувствительность по оптической толщине была
около hmin = 0,5 нм.
Интерпретация фазовых изображений основана на представлении объекта в виде оптической пространственно неоднородной среды с показателем преломления n(r, t) в ограниченной области пространства. Измеряемая величина — ОРХ в приближении эйконала [715] или геометрической оптики для тонкой, прозрачной и пространственно неоднородной среды (клетки) зависит от ее физической толщины H и от
180 |
|
|
|
|
|
|
Гл. 2. Распространение света в биологических тканях |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.47. Когерентная фазовая микроскопия [715]: а — когерентный фазовый микроскоп «Эйрискан» на основе интерферометра Линника и He–Ne-лазера (λ = 633 нм) с использованием линейно-периодической модуляции фазы опорной волны; фаза в каждом пикселе интерференционного изображения определяется при последовательном его сканировании координатно-чувствительным фотоприемником — диссектором ЛИ-620 («Электрон», СПб); б — представление сигналов модуляции и отклика интерферометра. При модуляции фазы опорной волны U (t) происходит изменение интенсивности фототока I(t) [Ui(t)]; локальное значение фазы определяется по длительности импульса τ (показаны два значения τ1 и τ2); периодичность выборки и скорость ввода изображения определяется частотой модуляции 1 кГц (или 1 мс на пиксель); ограниченная шумами чувствительность была около hmin = 0,5 нм
рефрактерности — разности показателей преломления n(r, t) и внешней среды n0 (см. соотношение (2.121)). На рис. 2.48, а (цветная вклейка) показана модель клетки в виде локальной неоднородности с поперечными размерами d и H. Проходящая через клетку волна от когерентного источника испытывает искривление волнового фронта (пространственную модуляцию), которая в интерференционном микроскопе преобразуется в распределение ОРХ или фазовой толщины. Эта исходная информация в цифровом виде закодирована в топограмме (см. рис. 2.48, б). На рис. 2.48, в, г показаны топограмма и профиль фазовой толщины клетки культуры ткани человека НСТ 116 вдоль выбранной линии сечения. В топограмме (см. рис. 2.48, в) псевдоцветом выделены области различной оптической толщины, видно контрастное ядро
иподчеркнута контурной линией граница клетки. В типичном сечении фазового изображения неокрашенной клетки (рис. 2.48, г) ядро и ядрышко хорошо различаются по оптической толщине (фазовой толщине). Цитоплазма клетки в профиле фазовой толщины имеет слабый, иногда даже отрицательный контраст, что связано с одновременным проецированием вкладов элементов многослойной структуры клетки
иразличных органелл в плоскость фазового изображения клетки. По этой же причине ширина области, прилегающей к границе клетки, значительно больше реальной толщины цитоплазматической мембраны.
Выше отмечалось, что фазовое изображение в плоскости (x, y) представляет собой двумерное распределение оптической разности хода h(x, y, t) = (n(x, y, z, t) −
− n0)dz, которое зависит в основном от разности показателей преломления объекта n(x, y, z, t) и внешней среды n0. Контраст фазовых изображений органелл растет с их рефрактерностью n, которая равна средней разности показателей объекта
hn(x, y, z, t)i и n0 иммерсионной среды. Однако это соотношение может быть использовано только в том случае, если есть априорная информация о размерах неоднородности и объеме, в котором определено среднее значение hn(x, y, z, t)i. В том случае, когда усреднение предполагается по всему объему объекта, максимальная фазовая
толщина h может быть представлена как h = nH = (hn(x, y, z, t)i − n0)H.
2.7. Особенности взаимодействия лазерного излучения с биотканями |
181 |
Во многих случаях приближение сферической или цилиндрической форм неоднородности вполне корректно и измеряемый в фазовом изображении поперечный размер d может использоваться в качестве «эквивалента» геометрической толщины H [879, 880]. Для определения рефрактерности как информационной величины, можно
|
|
h/d, где h — |
использовать приближение H = d [715], для которого |
n = h/H = |
максимальная фазовая толщина, d — поперечный размер в фазовых изображениях. Интенсивные флуктуации регистрируемых сигналов во времени наблюдались обычно на крутых участках профиля фазовой толщины и были связаны с метаболической активностью клетки [715]. Регистрация во времени таких флуктуаций для определенной локальной области клетки является основой метода динамической фазовой микроскопии. Иллюстрация метода представлена на рис. 2.49 (цветная вклейка) [715]: на фазовом изображении (топограмме) производятся периодически
втечение времени порядка десятков секунд измерения профиля фазовой толщины вдоль скан-линии с фиксированным интервалом (от единиц до сотен миллисекунд) и данные записываются в виде матрицы h(x, t) (трек-диаграммы) в память компьютера. Как следует из данных рис. 2.49, например, в сечении трек-диаграммы наблюдаются характерные флуктуации в окрестности ядерной мембраны и в области ядрышка.
2.7.7.Генерация второй гармоники. Использование лазерного излучения принципиально для генерации второй гармоники (ГВГ) в биологических тканях и клеточных структурах. В настоящее время это один из новых высокоразрешающих нелинейно-оптических методов визуализации для изучения интактных тканей и клеточных структур [719–737, 895]. Так же как и в случае многофотонной флуориметрии, метод ГВГ имеет несколько важных преимуществ перед методами линейной спектроскопии и визуализации, поскольку возбуждающий свет лежит в ближнем инфракрасном диапазоне длин волн, который сравнительно мало рассеивается тканью, а генерация второй гармоники происходит уже в самой среде в локальной области сфокусированного лазерного пучка. Тем самым достигается высокое пространственное разрешение, приемлемая во многих случаях глубина зондирования и развязка сигнала возбуждения и детектирования. Жестко сфокусированные лазерные пучки с высокой плотностью мощности и с очень короткой длительностью импульса в диапазоне десятков и сотен фемтосекунд позволяют обеспечить генерацию гармоник
вживой ткани практически без какого-либо ее повреждения, благодаря малому времени взаимодействия излучения с тканью и малой энергии, недостаточной для ионизации молекул (см. рис. 2.50, цветная вклейка).
ГВГ представляет собой нелинейный оптический процесс второго порядка, который может происходить только в средах, не имеющих центральной симметрии. Метод может использоваться для получения изображений высокоупорядоченных структурных белков без каких-либо экзогенных меток, а также для зондирования биологических мембран с высокой специфичностью к типу мембраны.
Коллаген, являющийся основным компонентом соединительных тканей, обладает заметной нелинейной восприимчивостью для ГВГ. Было показано, что в нелинейной восприимчивости второго порядка у коллагена доминирующей является компонента вдоль оси волокна. В таких многокомпонентных средах, как кожа, ГВГ происходит главным образом внутри дермы, а не в таких клеточных слоях, как эпидермис или подкожный жир.
В общем случае нелинейная поляризация среды выражается как [723]
P = χ(1)E + χ(2)EE + χ(3)EEE + ... , |
(2.123) |
