
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
182 |
Гл. 2. Распространение света в биологических тканях |
где P — индуцированная поляризация среды, χ(n) — нелинейная восприимчивость n-го порядка, E — вектор напряженности электрического поля падающего света. Первый член описывает линейное поглощение и отражение света, второй — ГВГ, генерацию суммарных и разностных частот, а третий — двух- и трехфотонное поглощение и генерацию третьей гармоники.
В отличие от двухфотонной флуоресценции (см. подраздел 1.6.2) ГВГ не возникает в результате процесса поглощения. Вместо этого интенсивное поле лазера индуцирует нелинейную поляризацию второго порядка в ансамбле молекул, в результате чего получается когерентная волна точно на удвоенной частоте (или с половинной длиной волны) падающего света. Для ГВГ и спектральные, и временные характеристики зависят от лазерного источника: ширина полосы равна 1/√2 от ширины полосы возбуждающего лазера и, благодаря когерентности процесса, импульс ГВГ во времени развивается синхронно с возбуждающим импульсом.
Упрощенное выражение для интенсивности сигнала ГВГ имеет вид [723]
(ω |
) |
2 |
|
|
|
||
I(2ω) χ(2) Eτp |
τp, |
(2.124) |
где χ(2) — нелинейная восприимчивость второго порядка материала ткани или клетки, E(ω) и τp — энергия и длительность лазерного импульса соответственно. Сигнал квадратичен по пиковой мощности, и поскольку ГВГ — мгновенный процесс, сигнал генерируется только на протяжении лазерного импульса. Макроскопическое значение χ(2) выражается через молекулярную гиперполяризуемость β как
χ(2) = ρMhβi, |
(2.125) |
где ρM — плотность числа молекул, а угловые скобки означают усреднение по ориентациям. Поскольку hβi обнуляется для изотропного распределения дипольных моментов, то соотношение (2.125) отлично от нуля только в случае отсутствия центра симметрии в среде. Как следует из (2.124) и (2.125), сигнал ГВГ зависит от квадрата плотности числа молекул.
Одна из последних разработанных схем ГВГ-визуализации представлена на рис. 2.50. Она существенно отличается от известных схем возможностью возбуждения ГВГ-сигнала в произвольной точке по выбору оператора, тем самым возможностью осуществлять оптический мониторинг локальных быстропротекающих процессов, связанных с изменениями мембранных потенциалов, одновременно с наблюдениями в пределах большого поля зрения микроскопа. Система построена на базе фемтосекундного волоконного лазера и электронно-управляемых акустооптических дефлекторах лазерного пучка. Такой ГВГ-микроскоп позволяет регистрировать метаболические процессы с характерными длительностями порядка 1 мс и получать сигналы потенциала активности нескольких нейронов одновременно в пределах широкого поля зрения (150 × 150 мкм) и с достаточно большой глубины срезов живого мозга.
2.7.8. Терагерцовая спектроскопия. Терагерцовый частотный диапазон, занимающий промежуточное положение между ИК и микроволновым диапазоном (1 ТГц → 1 пс → 300 мкм → 33 см−1 → 4,1 мэВ → 47,6◦К) частот, сравнительно мало исследован во всей шкале электромагнитных волн, от радиочастотного до рентгеновского диапазона (см. рис. 1.2). Эффективные источники излучения появились только в последние два десятилетия, в основном благодаря развитию лазеров со сверхкороткими импульсами. Возбуждаемое лазерными импульсами терагерцовое (ТГ) излучение является перспективным для применений в биологии и медицине, поскольку: 1) многие колебательные переходы важных биомолекул находятся именно
2.7. Особенности взаимодействия лазерного излучения с биотканями |
183 |
в этом диапазоне; 2) неоднородности, характерные для биотканей и приводящие к сильному рассеянию электромагнитного излучения в видимой и ближней инфракрасной области, не дают значительного рассеяния; 3) рефракция компонентов биотканей сильно различается между собой; 4) возбуждение сверхкороткими импульсами позволяет исследовать широкий диапазон частот за одно измерение
иобеспечивать высокое разрешение по времени [896–901]. Поэтому разработка спектроскопических методов исследования биологических тканей в ТГ-диапазоне частот, обеспечивающих детектирование и визуализацию метаболических и патологических процессов, вызывает в последние годы высокий интерес. Кроме того, ТГспектроскопия позволяет в одном измерении определять комплексный показатель преломления исследуемой среды, что важно для создания функционального ТГтомографа с высокой чувствительностью к изменению концентрации метаболитов
иточным маркированием границ патологического процесса.
Известно достаточно много методов генерации импульсного ТГ-излучения, в которых используют фотопроводящие антенны, поверхность полупроводника или нелинейные кристаллы в качестве преобразователя коротких импульсов лазерного излучения в ТГ-диапазон. В первых двух случаях генерация излучения обусловливается созданием нестационарной электронно-дырочной фотопроводимости полупроводника под действием импульсов света и всплеском фототока под действием внешнего или внутреннего электрического поля [898]. В последнем случае происходит генерация разностной частоты (оптическое выпрямление) в нелинейном кристалле [899]. Детектирование ТГ импульса (ТГИ) производится в аналогичной фотопроводящей антенне или на основе электрооптического эффекта в нелинейном кристалле [899]. Поле ТГИ наводит двулучепреломление в кристалле, при этом, изменение поляризации пробного лазерного импульса пропорционально амплитуде поля ТГИ в данный момент времени. В эксперименте измеряется разница в мощности ортогональных компонент поляризации пробного лазерного импульса либо ток, наведенный в антенне в зависимости от временной задержки между ТГ и пробным оптическим импульсом. Чувствительность детектора, так же как и эффективность генератора ТГИ, определяется параметрами фазового синхронизма, величиной нелинейной восприимчивости, длиной кристалла и длительностью лазерного импульса. При замене полупроводниковых устройств на нелинейно-оптические диапазон оптимальной работы спектрометра (0,5 ± 0,45 ТГц) сдвигается в высокочастотную область (2 ± 1,5 ТГц).
Одна из схем ТГ импульсного спектрометра представлена на рис. 2.51 [900]. Тип детектора и генератора ТГИ выбирались в зависимости от характера поглощения образца и интересующего диапазона частот [901]. Например, для измерений в диапазоне 2,5–3,5 ТГц использовалось излучение лазера на длине волны λ = 790 нм
сдлительностью импульса τ = 90 фс, а в качестве генератора и детектора, соответственно, поверхность полупроводника, выращенная при низкой температуре LT-GaAs, и электро-оптический детектор на основе кристалла ZnTe h110i толщиной 0,3 мм. С помощью преобразования Фурье из измеренного временного профиля ТГИ вычисляется комплексный спектр, содержащий информацию о показателях преломления и поглощения среды, через которую прошел ТГИ. Например, в работе [897] использовалась временная выборка из 1024 точек, длительностью 50 пс, со временем накопления сигнала в каждой точке 300 мс. Это позволяло проводить измерения
ссоотношением сигнал/шум больше 102 для частот в спектральном диапазоне от 0,3 до 2,5 ТГц и со спектральным разрешением порядка 10 ГГц. Лазерные (и ТГ)
импульсы следуют с интервалом 12 нс, при этом энергия ТГИ, который зондирует биологическую ткань, составляет порядка 10−13 Дж; такая малая энергия импульса не должна оказывать воздействия на ткань. Даже в случае резонансного поглощения малая доля спектральных компонент импульса поглощается в образце.

184 |
|
|
|
Гл. 2. Распространение света в биологических тканях |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.51. Схема импульсного терагерцового спектрометра при возбуждении фемтосекундным излучением лазера [897]
Отличительной особенностью импульсной ТГ-спектроскопии является возможность непосредственного измерения величины и направления электромагнитного поля, что дает возможность получать информацию об амплитуде и фазе поля прошедшего импульса и далее вычислять показатели преломления, поглощения и дисперсию исследуемой среды. Чтобы вычислить оптические свойства ткани нужно провести реконструкцию оптических параметров по измеренным спектрам пропускания T (ω). Из эксперимента, после преобразования Фурье временных профилей импульсов получают амплитуду поля ТГИ, падающего на образец, Eпад(ω) и прошедшего через него, Eпр(ω), и рассчитывают спектральный коэффициент пропускания образца:
|
Eпад |
|
|||
T (ω) = |
|
|
= T0(ω) · FP(ω) · RL(ω), |
(2.126) |
|
Eпр |
|||||
где T0(ω) содержит основную информацию о среде, через которую прошел ТГИ |
|||||
(коэффициенты поглощения и преломления образца): |
|
||||
T0(ω) = exp{−i(nобр − nвоз)dω/c}; |
(2.127) |
||||
FP(ω) описывает импульсы переотражения в параллельной пластинке — моды Фаб- |
|||||
ри–Перо: |
|
||||
FP(ω) = {1 − R(ω)2 exp(−i2nобр dω/c)}−1; |
(2.128) |
||||
RL(ω) описывает потери на отражение на границах образца: |
|
||||
|
|
|
4nобрnвоз |
|
|
RL(ω) = |
|
= 1 − R(ω)2. |
(2.129) |
||
(nобр + nвоз)2 |
|||||
Здесь использованы комплексные показатели преломления, обозначенные как n(ω) = = n′(ω) − i · n′′(ω) для соответствующей среды, где поглощение учтено в мнимой ча-
сти n′′(ω) = α(ω) · c/ω; ω = 2πf — циклическая частота, R(ω) = (nобр − nвоз)/(nобр + + nвоз) — комплексный коэффициент отражения, c — скорость света, nобр и nвоз —
показатели преломления образца и воздуха, соответственно; nвоз ≈ 1; α — показатель поглощения для поля, который вдвое меньше показателя поглощения для мощности.
В предположении, что RL(ω) ≈ const, FP(ω) ≈ 1, из уравнения (2.126) можно
получить [897] |
|
ln[1 − (Rcp)2] |
|
|
|
α(ω) = |
ln |T (ω)| |
+ |
, |
(2.130) |
|
|
d |
|
d |
|
|
где Rcp = (ncp − 1)/(ncp + 1) — коэффициент отражения, для действительной части показателя преломления образца усредненной в диапазоне измеряемых частот.
2.7. Особенности взаимодействия лазерного излучения с биотканями |
185 |
|||
Усредненный показатель преломления ncp |
определяется по задержке импульса t |
|||
при распространении через образец: |
|
|
|
|
ncp = 1 + |
t · |
c |
, |
(2.131) |
d |
||||
а частотная зависимость показателя преломления n′(ω) рассчитывается из соотношения
n′(ω) = arg[T (ω)] · |
c |
+ 1. |
(2.132) |
ω · d |
В более строгом приближении необходимо учитывать переотражения на гранях образца — моды Фабри-Перо [900], это важно в случае большого показателя преломления и тонких пластинок исследуемых образцов, например при измерении спектров срезов зубов и спектров прессованных таблеток сахаров и других биологически важных веществ.
Для анализа характеристических линий поглощения веществ, содержащихся в биотканях или биожидкостях, можно привлечь простую модель для диэлектрической проницаемости в виде суммы лоренцевских осцилляторов [897]:
X |
− |
− |
|
|
|
|
fj ωj2 |
|
|
ε(ω) = ε0 + |
(ωj2 |
ω2) iγj ω |
, |
(2.133) |
j |
|
|
|
|
где ωj , γj , fj — суть собственные частоты, коэффициенты затухания и силы осцилляторов соответственно, ε0 — диэлектрическая проницаемость вещества на низких частотах, j — номер резонанса в выбранном диапазоне частот.
Для ряда объектов спектроскопия пропускания плохо применима из-за сильного поглощения (например, ткани содержащие воду) или из-за больших размеров объекта (in vivo). В таком случае обычно используют спектроскопию отражения, когда
измеряется комплексный коэффициент отражения R |
(ω), содержащий информацию |
|||||||||
о показателях поглощения и преломления среды: |
ep |
|
|
|
|
|
||||
Rp(ω) = |
n2 |
(ω) cos(ϑ) − q |
n2(ω) − sin2 |
(ϑ) |
|
, |
(2.134) |
|||
|
|
|
|
|
||||||
n2 |
(ω) cos(ϑ) + qn2(ω) − sin2 |
|
|
|||||||
e |
(ϑ) |
|
||||||||
характеризуемый амплитудой R и фазой ϕ; Rp |
= R · eiϕ, где индекс p обозначает |
|||||||||
поляризацию излучения в плоскости падения, ϑ |
— угол падения луча, отсчитанный |
|||||||||
от нормали. Здесь использованы формулы |
Френеля, с учетом комплексной составля- |
|||||||||
e |
|
|
|
|
|
|
||||
ющей показателя преломления.
При исследовании биотканей важна глубина зондирования и учет слоистости среды. Соотношение (2.134) позволяет получить информацию только о границе раздела (эффективная глубина, где формируется отраженный сигнал, — десятки микрон). Однако при исследовании слоистых тканей, таких как кожа, например, при толщинах слоев порядка 100 мкм и более можно разделять отраженные от разных поверхностей импульсы во времени. Далее можно применять соотношение (2.134) для каждого слоя со своим коэффициентом отражения и учетом объемных параметров среды (слоя) между поверхностями, через которую дважды проходит излучение. В видимом диапазоне частот такая методика развита, например, для трехслойной модели кожи [902], которая вполне может быть адаптирована для терагерцового диапазона.
Для исследования мягких тканей или водных растворов можно использовать спектроскопию отражения в условиях полного внутреннего отражения (ПВО), которая использует именно нарушение условий ПВО за счет взаимодействия с исследуемым веществом, поэтому метод называется «нарушенное ПВО» или НПВО.

186 Гл. 2. Распространение света в биологических тканях
В такой схеме можно обеспечить зондирование по глубине за счет изменения проникновения поля в вещество. Для реализации метода НПВО можно использовать
призму Довэ, |
изготовленную из кремния с параметрами: основание 1,5 |
× |
2 см, |
|
◦ |
|
|
||
угол при вершине 90 |
[897]. Коэффициент преломления у кремния в терагерцо- |
|||
вом диапазоне составляет 3,42, дисперсия и поглощение практически отсутствуют. Данная призма помещается в параллельный пучок терагерцового излучения, при этом она не меняет направления пучка. В качестве опорного сигнала используется отражение от чистого основания призмы, а в качестве измерительного — сигнал, полученный, когда исследуемый объект плотно соприкасается с основанием призмы. Основное преимущество метода НПВО перед отражательной спектроскопией заключается в простоте измерения опорного спектра (без вещества), кроме того амплитуда коэффициента отражения близка к единице. Основная сложность метода НПВО — это необходимость решения проблемы оптического контакта при исследовании твердых образцов, поскольку наличие прослойки воздуха всего в 10 мкм уже критично. Формулы Френеля, описывающие спектр отражения, остаются применимыми и для случая НПВО, только нужно учесть показатель преломления материала призмы nпр, и заменить n на n/nпр в формуле (2.134).
На рис. 2.52 показаны спектры отражения кожи человека, снятые in vivo методом НПВО. Поскольку высокая чувствительность метода обеспечивается в поверхностном слое ткани до 10 мкм, то кожа зондируется только на глубину рогового слоя. В этом слое содержание воды минимально и равно 15 % (вес/вес), а основное содержание составляют белки (70 %) и липиды (15 %) [189], поэтому спектр отражения кожи существенно отличается от спектра отражения воды.
Рис. 2.52. Терагерцовые спектры для амплитуды и фазы коэффициента отражения кожи руки волонтера (мужчина, 32 года, белый, ладонь у основания большого пальца), измеренные методом НПВО [897]
Отметим хорошую прозрачность жиров, слабовыраженную дисперсию и характерные особенности в спектре поглощения в районе 2–2,5 ТГц. Отсюда следует, что с помощью импульсной ТГ-спектроскопии, по задержке ТГ-импульсов, отраженных от границ слоя, по-видимому, можно будет измерять толщину жирового слоя [897]. Исследования ряда биологических тканей (рис. 2.53) показали высокое и сравнимое между собой поглощение, но довольно значительное различие в показателе преломления в исследуемом диапазоне частот. Существенная дифференциация по
2.7. Особенности взаимодействия лазерного излучения с биотканями |
187 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.53. Терагерцовые спектры поглощения некоторых биотканей, измеренные in vitro [897]
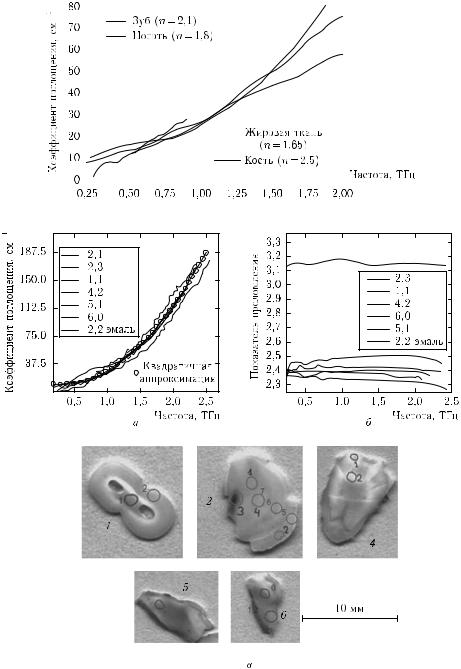
Рис. 2.54. Спектры поглощения (а) и показателя преломления (б) различных участков образцов зубов человека, рассчитанные на основе измерений спектров пропускания с использованием спектрометра, представленного на рис. 2.51; диметр пучка ТГ-излучения в области образца порядка 2 мм. Первая цифра соответствует номеру образца, а вторая обозначенному на этом образце участку (в) [897]
188 |
Гл. 2. Распространение света в биологических тканях |
показателю преломления различных тканей дает возможность измерять амплитуды импульсов отраженных от границ различных слоев, что важно как для идентификации сигналов, несущих спектроскопическую информацию, так и для построения томографических схем.
Мониторинг патологических изменений тканей зуба можно провести с помощью ТГ-спектроскопии. В качестве примера на рис. 2.54 приведены спектры поглощения и показателя преломления различных участков зуба образцов человека, рассчитанные на основе измерений спектров пропускания с использованием спектрометра, представленного на рис. 2.51. Усредненный (по измеряемым частотам) показатель преломления практически одинаков (n = 2,4) для всех участков дентина и существенно отличается для эмали (n = 3,2). При этом дисперсия показателя преломления [900] имеет небольшие отличия в разных областях зуба. Спектр поглощения может быть аппроксимирован квадратичной зависимостью α(f ) = A + B1 · f + B2 · f 2 (в диапазоне 0,2–2,5 ТГц). Усредненные величины коэффициентов A, B1, B2 соответственно равны 13, −21 и 36, если f измеряется в ТГц, а α — в см−1. Показатель преломления для многих приложений можно считать постоянным.
Г л а в а 3
ИЗМЕРЕНИЕ И УПРАВЛЕНИЕ ОПТИЧЕСКИМИ СВОЙСТВАМИ БИОТКАНЕЙ
3.1. Методы измерения оптических параметров биотканей
Существует много разнообразных методов определения оптических параметров биотканей [1–3, 12, 13, 30–32, 73, 250, 682, 903–937]. Эти методы можно разделить на два больших класса: прямые и косвенные. К прямым методам относятся методы, в основе которых лежат базовые понятия и определения, например закон Бугера–Бера (см. (1.1)), фазовая функция однократного рассеяния (см. (2.5)) для тонких образцов или эффективная глубина проникновения света для объемных сред. Измеряемыми параметрами являются коллимированное пропускание и индикатриса рассеяния для тонких образцов или освещенность внутри объемной среды. Достоинства этих методов заключаются в чрезвычайной простоте аналитических выражений, используемых при обработке данных: соответственно формулы (1.1) и (2.5) при нахождении коэффициента экстинкции и фактора анизотропии рассеяния или формулы (2.20) и (2.21) при нахождении диффузионной длины свободного пробега фотона. Недостатки прямых методов связаны с необходимостью строгого выполнения условий эксперимента, соответствующих модели: однократности рассеяния для тонких образцов, исключения влияния поляризации света и преломления света на гранях кюветы и т. п.; для объемных сред с многократным рассеянием детектор, регистрирующий освещенность (обычно волоконный световод с изотропно-рассеивающим шариком на торце), должен быть расположен вдали от источника света и границ среды.
Косвенные методы предполагают решение обратной задачи рассеяния на основе использования той или иной теоретической модели распространения света в среде. В свою очередь, косвенные методы делятся на итерационные и неитерационные. Неитерационные методы используют уравнения, в которых оптические свойства определяются через параметры, непосредственно связанные с измеряемыми величинами. Модели Кубелки–Мунка, трех-, четырех- и семипотоковые [1–3, 12, 31, 73, 79, 89, 245, 426, 450, 474] лежат в основе косвенных неитерационных методов. В косвенных итерационных методах оптические свойства выражаются неявно через измеряемые параметры. Величины, определяющие оптические свойства рассеивающей среды, перебираются до тех пор, пока расчетные значения отражения и пропускания не будут с заданной точностью совпадать с измеренными. Эти методы являются громоздкими, однако используемые оптические модели могут быть существенно более сложными, чем в случае неитерационных методов, примерами являются диффузионная теория [1–3, 12, 13, 31, 73, 245, 907], инверсный метод добавления–удвоения (adding–doubling) [905] или инверсный метод Монте-Карло [214, 426–429, 474, 906, 910, 911].
Для измерений оптических параметров биотканей (µa, µs и g) используют различные методы. Наибольшее распространение при измерениях параметров образцов биотканей in vitro имеет метод двух интегрирующих сфер в сочетании с измерениями коллимированного пропускания [90, 903–907, 911]. Схематически метод измерения представлен на рис. 3.1, он заключается в последовательном или одновременном

190 |
Гл. 3. Измерение и управление оптическими свойствами биотканей |
измерении трех параметров: коллимированного пропускания Tc, определяемого соотношением (1.1), полного пропускания T = Tc + Td (Td — диффузное пропускание) и диффузного отражения Rd. Для определения оптических параметров ткани из этих измерений можно использовать различные теоретические соотношения или численные методы (двух- и многопотоковые модели, инверсные методы Монте-Карло), устанавливающие связь µa, µs и g с измеряемыми параметрами. В простейшем случае берут двухпотоковую модель Кубелки–Мунка, которая базируется на следующих соотношениях [70, 73]:
|
1 |
ln h |
1 |
Rd(a |
|
|
b) |
i ; |
|
|
|
|
|
|
|
||
S = |
|
|
− 2 |
|
−2 |
|
|
|
|
|
|
|
|
||||
bd |
|
Td |
|
|
p |
|
|
|
|
|
|||||||
1 ; |
|
|
1 |
|
Td |
+ Rd |
; |
|
|
= |
a2 |
|
1 ; |
|
|||
|
|
|
|
|
|
|
|
|
|
||||||||
K = S(a − ) |
a = |
|
−32Rd |
|
|
|
b |
1 |
|
− |
|
|
(3.1) |
||||
K = 2µa; S = 4µs(1 − g) − 4µa; µt = µa + µs; µ′s = µs(1 − g) > µa.
Определение µt из измерений коллимированного пропускания на основании соотношения (1.1) позволяет с помощью экспериментальных данных для Td и Rd найти все три параметра ткани: µa, µs и g.
Рис. 3.1. Схематическое представление метода интегрирующих сфер для измерения параметров биотканей in vitro [90]
Любые три измерения из последующих пяти вариантов достаточны для определения всех трех оптических параметров [73]:
1)полное (или диффузное) пропускание для коллимированного или диффузного облучения,
2)полное (или диффузное) отражение для коллимированного или диффузного облучения,
3)поглощение образца, помещенного внутри интегрирующей сферы,
4)коллимированное пропускание (нерассеянного света),
5)угловое распределение рассеянного образцом излучения.
Итерационные методы обычно включают учет несогласованности показателей преломления на границах образца и многослойности самого образца. Источниками
|
|
|
|
|
|
|
3.1. Методы измерения оптических параметров биотканей |
191 |
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
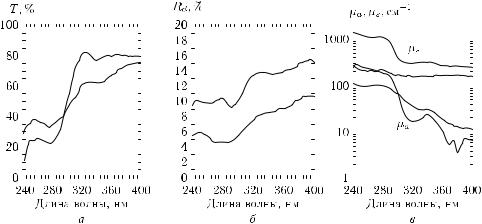
Рис. 3.2. Экспериментальные спектры полного пропускания (а) и диффузного отражения (б) отрывов эпидермиса человека и соответствующие спектральные зависимости коэффициентов поглощения (µa) и рассеяния (µs) (в), рассчитанные с использованием четырехпотоковой модели. Сплошные линии — кожа в норме, пунктирные линии — псориатическая кожа [426, 474]
погрешностей при подсчете значений оптических коэффициентов являются следующие причины, которые необходимо иметь в виду при сравнительном анализе значений оптических параметров, полученных различными авторами [73]:
—физиологическое состояние биологических образцов: уровень гидратации, гомогенность, видовая вариантность, замороженное — незамороженное состояние, in vivo — in vitro измерения, фиксированный — нефиксированный образец, гладкость его поверхности;
—геометрия облучения;
—согласованность — несогласованность показателя преломления на границах;
—ориентация регистрирующих волоконных световодов внутри образца по отношению к световоду — источнику;
—значения числовой апертуры регистрирующих световодов;
—угловое разрешение фотодетекторов;
—отделение рассеянного вперед излучения от нерассеянного;
—теория, используемая для решения обратной задачи.
Проиллюстрируем на примере определения оптических параметров эпидермиса кожи человека некоторые из обсуждаемых методов измерений. Исследования оптических параметров кожи представляют большой интерес с точки зрения совершенствования методов фото- и фотохимиотерапии кожных заболеваний, а также для развития методов диффузной оптической томографии и диафаноскопии. Для получения воспроизводимых результатов в дозиметрии и диагностике необходимо иметь надежные данные для всего набора оптических параметров кожи (µa, µs, g), для всех слоев кожи, в том числе и эпидермиса. Возможности получения надежных данных определяются не только выбранной методикой измерений, но также технологией приготовления образцов ткани, адекватных решаемой задаче. Технология изготовления образцов эпидермиса (вид биопсии ткани) на основе отрывов эпидермиса с использованием специальных медицинских клеев и стеклянных или кварцевых подложек разработана С. Р. Утцем [426, 474]. Эта технология позволяет получать высококачественные образцы верхних слоев эпидермиса толщиной 20–50 мкм, удобные для спектрофотометрических, нефелометрических, флуоресцентных и других
