
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf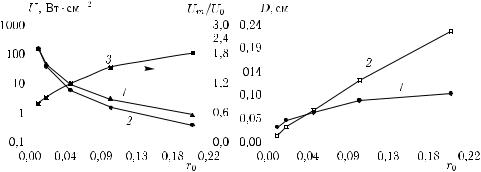
102 |
|
|
|
Гл. 2. Распространение света в биологических тканях |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.3. Зависимости параметров области максимальной освещенности от радиуса падающего пучка. Пучок с гауссовым профилем, длина волны 633 нм, мощность 25 мВт: а — полная освещенность падающего пучка, 1 — в центре U0, 2 — в максимуме Um, 3 — Um/U0; б — размер области максимальной освещенности (по уровню 1/e2), 1 — вдоль оси пучка, 2 — перпендикулярно оси пучка [426]
Т а б л и ц а |
2.1. Оптические параметры кожи: |
числитель |
|
λ = 633 |
нм, знаменатель |
|||||||||||
|
|
|
λ = 337 нм [426] |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ |
|
Слой |
µa, см−1 |
µs, см−1 |
|
g |
n |
d, мкм |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1. |
|
Эпидермис |
4,3 |
|
107 |
0,79 |
1,5 |
100 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
32 |
|
165 |
0,72 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2. |
|
Дерма |
2,7 |
|
187 |
0,82 |
1,4 |
200 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
23 |
|
227 |
0,72 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
3. |
|
Дерма с поверхностным |
3,3 |
|
192 |
0,82 |
1,4 |
200 |
|
|
|||||
|
|
сплетением сосудов |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
40 |
|
|
246 |
0,72 |
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
4. |
|
Дерма |
2,7 |
|
187 |
0,82 |
1,4 |
900 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
23 |
|
227 |
0,72 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
5. |
|
Дерма с глубинным |
3,4 |
|
194 |
0,82 |
1,4 |
600 |
|
|
|||||
|
|
сплетением сосудов |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
46 |
|
|
253 |
0,72 |
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
для биотканей лежат в диапазоне 1–5 и в значительной степени зависят от диаметра лазерного пучка (1–20 мм) [210, 211]. Глубина проникновения света в биоткань может быть оценена из соотношения
le = ld(ln q + 1). |
(2.21) |
Увеличение радиуса падающего пучка приводит также к росту размеров освещаемой области внутри ткани, причем для излучения с длиной волны 633 нм скорость увеличения поперечных размеров области выше, чем вдоль лазерного пучка (рис. 2.3, б).
С практической точки зрения подобные расчеты необходимы для корректного определения дозы облучения при фотохимической, фотодинамической или фототермической терапии онкологических и ряда других заболеваний, а также при коагуля-

2.2. Распространение коротких импульсов |
103 |
ции лазерным излучением поверхностных сосудов [2, 3, 12–14, 17, 18, 25–28, 30–32, 41–46, 55, 62, 65, 66, 75, 90, 161, 205, 208, 479–487].
2.2. Распространение коротких импульсов
Используя нестационарную теорию переноса излучения, можно проанализировать временной отклик рассеивающих тканей. Такой анализ оказывается важным для обоснования неинвазивных оптических медицинских технологий, которые используют измерение отражения или пропускания биоткани с разрешением во времени, высокочастотные амплитудно-фазовые измерения, а также когерентные методы, основанные на баллистических (прямопрошедших) или отраженных фотонах [1, 3, 12, 13, 18, 27, 30–32, 64, 75, 77, 78, 162, 488–507].
В общем виде нестационарное уравнение ТПИ может быть записано в виде [488]
∂ |
I(r, s, t) + t2 |
∂ |
I(r, s, t) = |
|
|
|
||
∂S |
∂t |
|
|
I(r, s′, t′)f (t, t′)dt′ p(s, s′)dΩ′. (2.22) |
||||
|
|
|
|
|
||||
|
|
= −µtI(r, s, t) + 4π |
t |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
µs |
−∞ |
|
||
|
|
|
|
|
4π |
|||
|
В дополнение к стационарному уравнению (2.1) здесь введены следующие обо- |
|||||||
значения: t — время; t2 = 1/(µtc) — среднее время между взаимодействиями; c — |
||||||||
скорость света в среде; |
f (t, t′) описывает временную деформацию δ-образного им- |
|||||||
пульса после единичного акта рассеяния. |
|
|
|
|
||||
Представим f (t, t′) в виде экспоненциально затухающей функции: |
|
|||||||
|
f (t, t′) = |
|
1 |
exp |
− |
t − t′ |
, |
(2.23) |
|
|
|
||||||
|
|
t1 |
t1 |
|
|
|||
где t1 может быть функцией r; t1 |
— это первый момент функции распределе- |
|||||||
ния f′(t, t′) и означает′ |
длительность индивидуального акта рассеяния, при t1 → 0 |
|||||||
f (t, t ) → δ(t − t ). |
|
|
|
|
|
|
|
|
Лучевая интенсивность I(r, s, t) в (2.22) содержит два компонента: ослабленное падающее излучение и рассеянное. Уравнение (2.22) удовлетворяет граничным условиям (2.2) при (r, s) → (r, s, t).
При зондировании плоскопараллельного слоя рассеивающей среды ультракоротким лазерным импульсом прошедший импульс состоит из баллистического (когерентного) компонента, группы фотонов с зигзагообразными траекториями и значительного по интенсивности диффузного компонента (рис. 2.4). Интенсивность баллистического компонента (состоящего из фотонов, движущихся вдоль лазерного пучка по прямой линии) определяется как нерассеянными фотонами, так и фотонами рассеянными вперед. Этот компонент ослабевает экспоненциально с ростом толщины образца (см. (1.1)) [508], такое ослабление накладывает серьезные ограничения на практическое использование баллистических фотонов в медицинской диагностике.
Группа фотонов с зигзагообразными траекториями состоит из фотонов, испытавших всего несколько столкновений, они движутся по траекториям, лишь слегка отклоняющимся от направления падающего пучка, и формируют первопришедшую часть диффузного компонента. Эти фотоны несут информацию как об оптических свойствах случайной среды, так и о параметрах некоторого чужеродного объекта, расположенного на их пути.
Диффузный компонент существенно уширен, имеет значительную интенсивность, так как состоит из основной массы падающих фотонов, которые испытали многократные акты рассеяния, следовательно имеют различные направления движения

104 |
Гл. 2. Распространение света в биологических тканях |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.4. Схематическое представление распространения сверхкороткого лазерного импульса в случайной среде [489]: 1 — падающий импульс, 2 — случайная среда, 3 — диффузный компонент, 4 — группа фотонов с зигзагообразными траекториями, 5 — баллистические фотоны
и различные длины путей. Диффузный компонент также несет информацию об оптических свойствах рассеивающей среды, а его деформация определяет наличие локальных неоднородностей в среде. При значительной светосиле разрешающая способность такого метода существенно ниже, чем у метода прямо прошедших фотонов. Возможны две схемы зондирования объекта — в режиме на просвет и в режиме обратного рассеяния (рис. 2.5).
Рис. 2.5. Типичные схемы для исследования биотканей с разрешением во времени [489]: а — режим просвечивания; б — режим обратного рассеяния. A — зондирующий пучок, B — регистрируемое излучение. Затемненный участок в центре рассеивающего слоя — локальная неоднородность (опухоль). Показаны распределения фотонов в среде
Прямое зондирование позволяет использовать оба метода, основанных на регистрации прямопрошедших и диффузно-рассеянных фотонов, и при использовании лазеров ближнего ИК-диапазона может быть применено для исследования сравнительно объемных тканей, таких как, например, молочная железа или мозг головы. Метод обратного рассеяния имеет более широкий спектр применений, так как не требует просвечивания объекта. Он широко используется при измерениях in vivo оптических параметров биотканей и модельных рассеивающих сред — фантомов биотканей.

2.3. Диффузионные волны фотонной плотности |
105 |
В диффузионном приближении (справедливом при µa µ′s) при условии, что ткань однородна и полубесконечна, размеры источника и приемника излучения на поверхности ткани малы по сравнению с расстоянием rsd между ними, а импульс может быть рассмотрен как одиночный, распространение света описывается временным диффузионным уравнением [491, 492]:
2 − cµaD−1 − D−1 ∂t∂ · U (r, t) = −Q(r, t), (2.24)
которое является обобщением стационарного уравнения (2.6) с функцией источника
Sd(r, t) и Q(r, t) = D−1 · Sd(r, t). Отметим, что в отсутствии потерь фотонов (µa = 0) диффузионное уравнение эквивалентно уравнению для теплопроводности [504]. Ре-
шение уравнения (2.24) дает следующее соотношение для числа обратно рассеянных фотонов на поверхности в единицу времени и с единицы площади R(rsd, t) [491, 492]:
|
z0 |
− |
rsd2 + z02 |
exp(−µact), |
|
|
R(rsd, t) = |
|
t−5/2 exp |
|
(2.25) |
||
(4πD)3/2 |
2Dt |
|||||
где z0 = (µ′s)−1.
На практике µa и µ′s оцениваются путем сравнения (2.25) с формой импульса, измеренного методом счета фотонов с разрешением во времени. Результаты экспериментальных исследований оптических параметров многих биотканей и модельных сред импульсным методом можно найти в [1, 3, 12, 13, 18, 27, 30–32, 43–45, 64, 206, 207, 491–495, 505–512]. Важным достоинством импульсного метода по сравнению с описанным выше методом непрерывного излучения является то, что он более просто обеспечивает измерения in vivo, так как µa и µ′s разделяются в процессе одного измерения в режиме обратного рассеяния. Отметим, что продолжаются поиски более адекватного описания импульсного отклика биотканей [496, 497, 509–528]. Много работ посвящено проблеме переноса изображения
вбиоткани и оценкам разрешающей способности оптических томографических схем, использующих в том числе и первопрошедшие фотоны ультракоротких импульсов [1, 3, 12, 13, 18, 27, 30–32, 120, 121, 162, 489, 490, 498–503, 510, 511].
При использовании ультракоротких лазерных импульсов в обратном рассеянии
впределах узкого телесного угла формируется локальный пик интенсивности, возникающий за счет интерференции света, рассеянного различными частями импульса
вобратном направлении [172, 173]. В строго обратном направлении интенсивность рассеянного света обычно примерно в два раза выше интенсивности диффузного компонента. Профиль углового распределения так называемого когерентного пика
зависит от средней транспортной длины ltr (2.10) и коэффициента поглощения µa. Ширина углового распределения пика прямо связана с ltr [173]:
ϑ ≈ |
λ |
. |
(2.26) |
2πltr |
Для многих мягких и твердых биотканей, таких как жировая и мышечная сердечная ткань, нормальный и катарактальный хрусталики, ткань молочной железы, раковая ткань легких, ткань зубов, когерентный пик в обратном рассеянии наблюдается при длительности зондирующего лазерного импульса короче 20 пс [173].
2.3. Диффузионные волны фотонной плотности
Для исследований миграции фотонов в рассеивающей среде эффективным оказался модуляционный метод (frequency-domain), основанный на регистрации динамического отклика интенсивности рассеянного света при модуляции интенсивности
106 |
Гл. 2. Распространение света в биологических тканях |
падающего лазерного пучка в широком диапазоне частот модуляции (0,1–10 ГГц) [1, 3, 10–13, 30–32, 91–98, 120, 121, 127, 129–133, 135–137, 143, 144, 163, 502, 504, 509–511, 529–563]. Параметрами, измеряемыми в модуляционным методе, являются глубина модуляции интенсивности рассеянного света ms и соответствующий сдвиг фаз относительно фазы модуляции падающего света ΔΦ. По сравнению с описанными выше временными измерениями такой метод более прост и надежен, с точки зрения интерпретации результатов, имеет большую помехозащищенность и использует измерительную аппаратуру, разработанную для целей оптической связи и исследования дисперсии волоконных световодов [558]. Известные измерительные схемы используют принципы гетеродинирования оптических и преобразованных сигналов [1, 3, 10–13, 30–32, 91–98, 120, 121, 162, 163, 504, 509–511, 530–553]. Значительные успехи в исследовании биотканей и ансамблей биологически важных молекул модуляционным методом послужили основой для создания и промышленного выпуска спектрометров нового типа. Существуют также модели компактных и сравнительно недорогих приборов — модуляционных спектрофотометров — для неинвазивного количественного определения насыщения гемоглобина крови кислородом, для фазовой локализации поглощающих или сильно рассеивающих неоднородностей внутри биоткани [1, 162, 551].
Теоретическое развитие метода привело к установлению нового типа волн — волн фотонной плотности, которые являются сильно затухающими волнами огибающей плотности фотонов. Микроскопически отдельные фотоны совершают случайные блуждания в рассеивающей среде, но коллективно они формируют волну фотонной плотности на частоте модуляции ω, которая распространяется от источника излучения. Диффузионные волны такого типа хорошо известны в других областях физики; например, тепловые волны возбуждаются при поглощении модулированного лазерного излучения различными средами, в том числе и биологическими [5, 58]. Волны фотонной плотности обладают типичными для волн свойствами: они преломляются, дифрагируют, интерферируют, обладают дисперсией и затухают [1, 3, 12, 13, 30–32, 162, 163, 537–540, 543–545].
Всильно рассеивающих средах с малым поглощением, вдали от стенок, источника
иприемника излучения распространение света может быть рассмотрено как затухающий диффузионный процесс, который описывается временным диффузионным уравнением для плотности фотонов (2.24). При использовании точечного источника света с гармонической модуляцией интенсивности, расположенного в точке r = 0,
I(0, t) = I0[1 + mI exp(jωt)]. |
(2.27) |
Решение диффузионного уравнения (2.24) для однородной бесконечной среды может быть представлено в виде [162]
|
U (r, t) = Udc(r) + Uac(r, ω) exp(jωt), |
(2.28) |
|||||||||||||||
где |
|
|
Udc = (I0/4πDr) exp − |
|
|
, |
|
|
|
||||||||
|
|
|
r |
|
|
(2.29) |
|||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
ld |
|
|
||||||||||||
|
Uac(r, ω) = Uac(r, ω) exp{−ikr(ω)r}, |
(2.30) |
|||||||||||||||
|
|
|
r, |
|
m |
|
I0 |
|
|
|
|
(ω)r |
|
, |
(2.31) |
||
|
Uac( |
|
4πDr exp{−iki |
} |
|||||||||||||
|
|
ω) = e I |
|
|
|
|
|||||||||||
|
модуляции; |
|
−1 — диффузионная глубина проникновения |
||||||||||||||
ω = 2πν — частота |
e |
|
|
|
ld = µd |
|
|
|
|
|
|
|
|
||||
(см. (2.7)); kr(ω) и ki(ω) — действительная и мнимая части волнового вектора: |
|||||||||||||||||
|
|
|
|
|
|
= −i |
+ iω |
|
0,5 |
|
|
|
|||||
|
|
k = kr − iki |
µac |
|
, |
|
|
(2.32) |
|||||||||
|
|
D |
|
|
|
||||||||||||
2.3. Диффузионные волны фотонной плотности |
107 |
волн фотонной плотности,
−1 |
|
[1 + (ωτa)2]0,5 |
± |
1 |
|
0,5 |
|
|
kr, i = ld |
−1 |
2 |
|
, |
(2.33) |
|||
|
τa |
= µac. |
|
|
|
|
(2.34) |
|
Переменная составляющая полученного решения представляет собой уходящую сферическую волну с центром в точке r = 0, осциллирующую на частоте модуляции ν и имеющую сдвиг фазы по отношению к значению фазы в точке r = 0:
ΔΦ = kr(ω)r. |
(2.35) |
Постоянная и переменная составляющие плотности фотонов ослабляются с расстоянием как exp(−r/ld) и exp{−ki(ω)r} соответственно. Длина волны ΛΦ диффузионной волны фотонной плотности определяется соотношением
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2π |
|
|
2π |
|
|
|
2 0,5 |
|
0,5 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ΛΦ = |
|
= |
|
|
|
|
{2cDµa(1 + [1 + (ωτa) ] |
)} |
|
|
|
, |
|
|
|
|
(2.36) |
||||||||||
|
|
|
|
|
|
|
|
|
|
kr |
|
|
ω |
|
|
|
|||||||||||||||||||||||||
а ее фазовая скорость |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
VΦ = ΛΦν. |
|
|
|
|
|
(2.37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Отсюда следует, что волны фотонной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
плотности обладают дисперсией и, как уже |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
отмечалось выше, им присущи и другие вол- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
новые свойства, такие как затухание, прелом- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
ление, дифракция и интерференция. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
Имея |
в виду |
медицинские |
примене- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
ния, в частности оптическую маммогра- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
фию, |
нетрудно |
|
оценить, |
что |
|
|
при ω/2π = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
= 500 МГц µ′ |
= 15 см−1, µ |
|
= 0,035 см−1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
и |
|
|
|
(3 |
|
s |
|
|
|
|
|
|
|
|
a |
|
|
длина |
|
вол- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
c |
= |
· 1010/1,33) |
см/с, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
ны |
|
Φ |
|
5,0 |
|
|
|
см, |
а |
|
фазовая |
скорость |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
Λ |
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
V |
Φ |
1,77 |
· |
109 см/с. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
Для сред с малым поглощением, когда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
ωτa 1 |
|
|
|
|
|
|
|
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Λ2 |
= 8π2 |
, |
V 2 |
= 2Dω, |
|
(2.38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
Φ |
|
|
|
|
|
|
ω |
Φ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
mU (r, |
ω) |
|
|
Uac(r, ω) |
= |
|
|
|
|
|
|
|
|
|
|
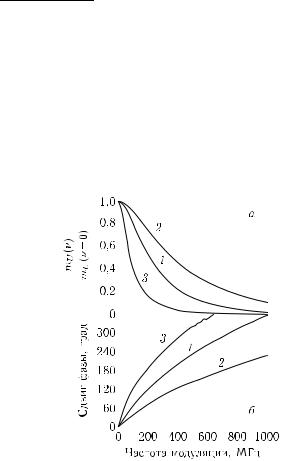
Рис. 2.6. Амплитудный (а) и |
фазовый |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
≡ eUdc(r) |
|
|
|
|
|
|
|
|
|
|
|
(б) отклики модельной среды (цельное |
||||||||||||||||||||||||
|
= mI exp rr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
D |
|
|
|
|
|
|
ω |
|
|
|
(1, 3) и разбавленное (40 %) (2) моло- |
||||||||||||||||||||||||||||
|
|
exp −r |
|
|
|
, |
(2.39) |
ко), полученные путем фурье-преобразо- |
|||||||||||||||||||||||||||||||||
|
cµa |
|
2D |
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
ΔΦ(r, ω) = r |
|
q0,5 |
|
|
|
вания экспериментальных импульсных |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
ω |
|
|
|
|
|
(2.40) |
чивания (кювета |
1толщиной 2 см), 3 — |
|||||||||||||||||||||||||||
|
|
|
|
|
|
2D . |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
откликов среды: |
, 2 — режим просве- |
||||||||||||||
|
|
Измерения |
|
величины |
|
|
|
|
(r, ω) |
и |
|||||||||||||||||||||||||||||||
|
|
|
mU |
режим обратного рассеяния |
(большой |
||||||||||||||||||||||||||||||||||||
ΔΦ(r, ω) позволяют определять |
коэффици- |
объем цельного молока) при расстоянии |
|||||||||||||||||||||||||||||||||||||||
ент диффузии D, следовательно |
раздельно |
rsd = 2 см между облучающим и прием- |
|||||||||||||||||||||||||||||||||||||||
находить транспортный коэффициент рассея- |
ным волоконными световодами [162] |
||||||||||||||||||||||||||||||||||||||||
ния µ′ (см. (2.8)), коэффициент поглощения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
µa |
|
и |
распределение |
|
этих |
|
|
параметров |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
в пространстве. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Очевидно, что обе представленные методики исследований оптических свойств биотканей с разрешением во времени тесно связаны друг с другом. При импульсном зондировании рассеивающей среды фурье-анализ рассеянного импульса, ко-
108 |
Гл. 2. Распространение света в биологических тканях |
торый может быть сделан аппаратно или программно, позволяет получить одновременно амплитудно-фазовый отклик среды для непрерывного набора гармоник [1, 3, 30–32, 162, 504, 509, 510, 531, 532, 541]. Рис. 2.6 иллюстрирует на примере модельной рассеивающей среды (цельное и разбавленное молоко) типичное поведение амплитудно-фазового отклика биотканей [162]. Такие характеристики используются в спектроскопии биотканей, например при определении in vivo степени оксигенации гемоглобина крови [551] или содержания глюкозы в крови или ткани [34, 564–566].
Взадачах визуализации макронеоднородностей важное значение имеет пространственное разрешение, которое можно получить при использовании волн фотонной плотности. Теоретические данные для двух поглощающих макронеоднородностей, находящихся в рассеивающей среде, показывают, что для их раздельного обнаружения достаточно обеспечить точность измерения фазы не хуже 1,0 % и амплитуды волн не хуже 2,0 % (рис. 2.7) [91, 540, 560]. Прогнозируемая пространственная разрешающая способность диффузионной томографии на основе волн фотонной плотности приближается к 1 мм, что сравнимо с разрешающей способностью позитронной эмиссионной
имагнитно-резонансной томографии [163]. При этом важными достоинствами оптической томографии являются простота устройств, возможность дополнительного контрастирования объектов молекулами красителей, а также возможность визуализации локальных метаболических процессов.
Вкачестве примера на рис. 2.8 приведены восстановленные изображения мо-
лочной железы с опухолью в виде контурных линий для µa и µ′s, полученные при просвечивании ткани модулированным видимым и ближним ИК-излучением [162]. Хорошо видна область локализации опухоли с повышенными значениями коэффициентов поглощения и рассеяния.
При использовании интерференции волн фотонной плотности, возбуждаемых разнесенными в пространстве источниками, возможно достижение рекордной разрешающей способности, меньшей 1 мм [543, 561]. Однако не только разрешающая способность влияет на качество изображения, необходимо также обеспечить условия
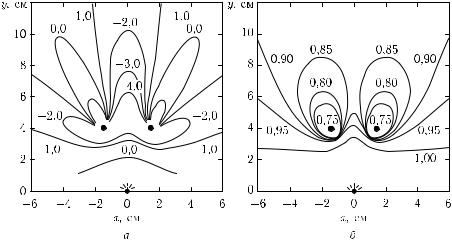
Рис. 2.7. Теоретические пространственные x–y-распределения относительного сдвига фазы (а) и модуляции интенсивности (б) на частоте 200 МГц, полученные при облучении системы из двух абсолютно поглощающих шариков диаметром 0,5 см, находящихся в рассеивающей однородной среде (µ′s = 10 см−1, µa = 0,02 см−1). Источник расположен в начале координат (0, 0), а поглотители в точках (−2, 4) и (2, 4) [540, 560]

|
|
|
|
|
|
|
|
2.3. Диффузионные волны фотонной плотности |
109 |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.8. Восстановленные оптические изображения молочной железы с опухолью, полученные при просвечивании ткани модулированным излучением в видимой и ближней ИК-области спектра. Слева дано изображение в виде контурных линий для коэффициента поглощения µa (10−2 см−1), а справа — для транспортного коэффициента рассеяния µ′s (см−1). Опухоль локализована вблизи точки (70, 10), значения коэффициентов относительные [162]
получения достаточно высокого контраста и малую чувствительность к движению и геометрии объекта. Иммерсия объекта (например, молочной железы) в жидкость с примерно такими же, как у исследуемой ткани, рассеивающими и поглощающими свойствами позволяет устранить сильное влияние граничных условий и геометрии образца, облегчает оптическое согласование пробного лазерного пучка, значительно ослабляет влияния небольших перемещений объекта (влияние дыхания, сердечных биений и пр.) в процессе измерений, а также дает возможность калибровать результаты измерений по хорошо известным стандартным параметрам рассеивающей иммерсионной жидкости [537, 554]. В ряде случаев такая достаточно простая методика является альтернативой для более сложных способов визуализации биоткани с использованием измерений на одной частоте модуляции для большого числа расстояний между источником и приемником излучения (см., например, [555]) или измерений для многих частот модуляции (см., например, [537, 554]).
Кроме визуализации макронеоднородностей молочной железы, метод позволяет исследовать другие ткани, включая мозг и легкие, а также целый ряд физиологических процессов, связанных с гемодинамикой, обусловленной потребностью ткани или органа в кислороде. Одним из наиболее важных примеров является изменение распределения кислорода в функционирующем мозге, особенно в процессе его активности [163]. Другим примером является возможный мониторинг свойств, связанных с ростом опухоли: больший объем крови из-за большей плотности и большего объема кровеносных сосудов, прорастающих в опухоль; дезоксигенация крови за счет относительно высокой метаболической активности внутри опухоли; возрастание концентрации внутриклеточных органелл, продуцирующих дополнительную энергию для поддержания быстрого роста клеток; известкование ткани, сильно увеличивающее рассеяние света. Некоторые из этих свойств могут быть полезными при определении типа опухоли — доброкачественная, злокачественная и т. п. [163].
В заключение этого раздела отметим, что довольно значительная плотность биотканей определяет в ряде случаев необходимость учета длительности индивидуального акта рассеяния t1 (см. (2.23)), которое может оказаться сравнимым со
110 |
Гл. 2. Распространение света в биологических тканях |
средним временем между взаимодействиями t2 (см. (2.22)) [557]. Кроме того, широко используемое диффузионное приближение имеет существенные ограничения при анализе оптических свойств биотканей фазово-частотным методом, поэтому развиваются более универсальные методы моделирования распространения волн фотонной плотности, основанные на использовании оригинальных алгоритмов Монте-Карло [557, 562, 563].
2.4.Принципы оптической диффузионной спектроскопии
итомографии
2.4.1.Диффузионная оптическая спектроскопия. Подводя итог рассмотрению оптических свойств биотканей с многократным рассеянием, следует кратко остановиться на перспективных приложениях этих исследований, многие из которых уже упоминались при обсуждении проблем распространения света в сильно рассеивающих средах. Итак, оптическая диагностика и мониторинг патологических или физиологических изменений биоткани, крови и других биологических жидкостей может быть осуществлен спектроскопически (в данном случае спектрофотометрически). При этом возможно зондирование объекта на многих или, в крайнем случае, на двух длинах волн для того, чтобы оказалось возможным зарегистрировать изменения в спектре поглощения исследуемого хромофора (гемоглобина, билирубина
ипр.), появление или исчезновение линий поглощения веществ — продуктов метаболизма или химических препаратов, введенных для проведения диагностики или терапии (цитохром оксидаза, глюкоза, гематопорфирин, индоцианин зеленый и пр.) [12, 13, 22, 30–32, 34, 95–97, 103, 124, 130, 131, 133, 135, 136, 144, 157, 185, 551]. Часто, по аналогии с обычной инвазивной биопсией, оптический спектральный метод называют оптической неинвазивной биопсией, или просто оптической биопсией.
Важно, что для биологических объектов для правильной интерпретации результатов по измерениям поглощения необходимо учесть (или исключить) влияние рассеяния света. При измерениях in vitro возможно полное восстановление истинного спектра поглощения (µa(λ)), если используются метод двух интегрирующих сфер
иадекватная методика решения обратной задачи. Регистрация in vivo спектров отражения в видимой или ближней ИК-области спектра позволяет, например, осуществлять мониторинг кровенаполнения кожи человека [250, 567, 568] или локализовывать внутричерепную гематому [569].
С другой стороны, сами спектры пропускания, а также поляризационные и угловые характеристики рассеяния дисперсных сред (при слабом поглощении) несут обширную информацию об их структуре, размерах и форме рассеивателей [12, 13, 24–41, 171, 180, 565, 570–574], что используется, например, для определения степени агрегации эритроцитов крови [572, 574].
Описанные в предыдущих разделах методики измерений с разрешением во времени дают дополнительную возможность реализовать спектроскопические схемы для измерений in vivo как спектров поглощения (или мониторинга поглощения на отдельных длинах волн), так и спектров обратного рассеяния за счет временной или фазовой селекции рассеянных и нерассеянных фотонов. Такие методики успешно используются, например, для неинвазивного количественного определения степени оксигенации гемоглобина крови в ткани [511, 531, 532, 575, 576] (см. табл. 2.2–2.4) или чрескожного определения содержания глюкозы в крови [34, 564–566].
Отметим, что длинноволновая видимая и ближняя ИК-область спектра 750– 850 нм оказывается предпочтительной в спектроскопии in vivo биотканей как с точки зрения возможности более глубокого зондирования ткани, так и в ряде случаев более простых алгоритмов решения обратной задачи.

Т а б л и ц а 2.2. Основные измеряемые параметры и характеристики спектрофотометров и визуализаторов тканей мозга ближнего ИК диапазона [600]
Измеряемые параметры |
Непрерывные фотометры |
|
|
|
|
|
|
|
|
||
с фиксированным расстоянием между |
Одноили двух-канальные оксиметры |
|
Визуализаторы |
|
|||||||
и характеристики |
источником и приемником |
|
|
|
|
|
|
|
|
||
прибора |
|
|
|
|
|
|
|
|
|
|
|
|
|
Широкополосные, |
|
|
|
|
|
|
|
|
|
|
Дискретные |
спектроскопия |
ДВС |
ПРС НР |
ФМС МД |
ФМС МЧ |
ВРС |
НР |
ФМС |
|
ВРС |
|
длины волн |
второй |
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
производной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
да, |
|
|
да, |
да, |
да, |
|
да, |
|
да, |
HbО , Hb, tHb |
да |
абсолютные |
нет |
да |
абсолютные |
абсолютные |
абсолютные |
да |
абсолютные |
|
абсолютные |
2 |
|
значения |
|
|
значения |
значения |
значения |
|
значения |
|
значения |
|
|
|
|
|
|
||||||
Скорость кровотока |
нет |
нет |
да, относи- |
нет |
нет |
нет |
нет |
нет |
нет |
|
нет |
тельная |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
µa, µs и СДПФ |
нет |
да, СДПФ |
нет |
нет |
да |
да |
да |
нет |
да |
|
да |
|
|
|
|
|
|
|
|
|
|
|
|
Насыщение гемоглобина |
|
|
|
|
|
|
|
|
|
|
|
кислородом в ткани |
нет |
да |
нет |
да |
да |
да |
да |
нет |
да |
|
да |
(SO2, %) |
|
|
|
|
|
|
|
|
|
|
|
Глубина зондирования |
|
|
|
малая, |
|
|
|
|
|
|
|
малая |
малая |
малая |
но для |
большая |
малая |
малая |
малая |
большая |
|
малая |
|
для rsd = 4 см |
SO2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
большая |
|
|
|
|
|
|
|
Скорость опроса, Гц |
6 100 |
1 |
> 5 |
6 6 |
6 100 |
6 1 |
6 6 |
6 100 |
6 50 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
Пространственное |
О |
О |
возможно |
О |
О |
О |
О |
6 1 |
6 1 |
|
6 1 |
разрешение, см |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стабильность |
критично |
критично |
критично |
некритично |
некритично |
критично |
некритично |
критично |
критично |
|
некритично |
оптического контакта |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дискриминация между |
|
|
|
|
|
|
|
|
|
|
|
тканью мозга |
О |
О |
возможно |
О |
возможно |
О |
возможно |
О |
возможно |
|
возможно |
и окружающими тканями |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
(скальп, череп, ЦСЖ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исследование глубоких |
возможно |
возможно |
возможно |
возможно |
возможно |
возможно |
возможно |
возможно |
возможно |
|
возможно |
для ново- |
для ново- |
для ново- |
для ново- |
для ново- |
для ново- |
для ново- |
для ново- |
для ново- |
|
для ново- |
|
структур мозга |
|
||||||||||
рожденных |
рожденных |
рожденных |
рожденных |
рожденных |
рожденных |
рожденных |
рожденных |
рожденных |
|
рожденных |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ЦСЖ — цереброспинальная жидкость, НР — непрерывный режим, ДВС — диффузионно-волновая спектроскопия, HbО2 — оксигемоглобин, Hb — дезоксигемоглобин, tHb = = (HbО2 + Hb) — полный гемоглобин, МД — многодистантная геометрия, МЧ — многочастотные измерения, О — отсутствует, ФМС — фазово-модуляционная спектроскопия, ПРС — спектроскопия c пространственным разрешением, ВРС — спектроскопия c разрешением во времени, СДПФ — средняя длина пути фотона, — дифференциальный фактор длины пути (ДФДП) фотона включен в расчет СДПФ в ткани [= ДФДП × (расстояние между источником и приемником)].
111 томографии и спектроскопии диффузионной оптической Принципы .4.2
