
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf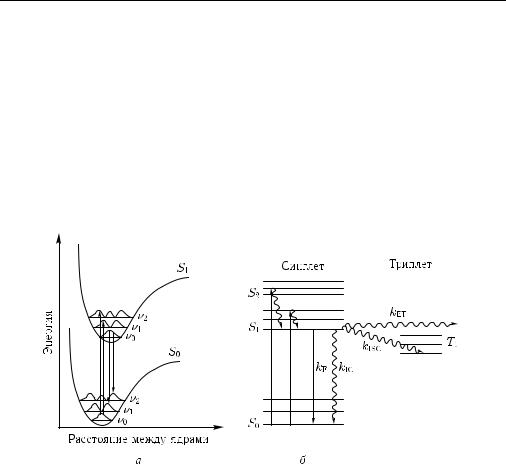
42 Гл. 1. Основы лазерной биомедицины
ядер не успевает измениться (принцип Франка–Кондона). Электронные переходы обычно происходят из основных вибронных состояний (для возбуждения S0 и ν0, для флуоресценции S1 и ν0). Вероятность каждого перехода пропорциональна квадрату дипольного момента перехода и определяется перекрыванием соответствующих колебательных волновых функций в основном и возбужденном электронных состояниях молекулы. Таким образом, спектры поглощения и флуоресценции получаются в результате наложения нескольких переходов, что часто приводит к образованию широких спектральных полос. Рисунок 1.22, а показывает, что так называемый 0–0- переход между самыми низкими колебательными уровнями лишь слегка выражен, поскольку перекрывание соответствующих волновых функций мало. По этой причине спектр флуоресценции всегда сдвинут в сторону более низких энергий W , что соответствует большим длинам волны λ = W/hc, по сравнению со спектром поглощения или возбуждения (h — постоянная Планка, c — скорость света). Это явление называется стоксовым сдвигом.
Рис. 1.22. Формирование спектров флуоресценции [251]: а — диаграмма потенциалов электронных состояний S0, S1 и колебательных уровней νi; показаны колебательные волновые функции и оптические переходы (возбуждение: S0ν0 → S1νn; флуоресценция: S1ν0 → S0νn); б — диаграмма Яблонского энергетических уровней молекулы и скоростей переходов; прямые линии — радиационные переходы, волнистые линии — безызлучательные переходы
Если не рассматривать зависимость энергии электронных состояний от координат ядер, то различные состояния молекулы можно проиллюстрировать с помощью диаграммы Яблонского, как показано на рис. 1.22, б. Возбуждение обычно происходит из основного синглетного состояния S0 на различные вибронные уровни возбужденных синглетных электронных состояний Sn, откуда быстрые безызлучательные переходы («внутренняя конверсия») за времена порядка фемтосекунд переводят молекулу в наинизшее возбужденное синглетное состояние S1. Из состояния S1 могут осуществляться различные переходы: переход в основное состояние S0 с излучением флуоресценции (включая его колебательные подуровни) со скоростью kF, внутренняя конверсия в основное состояние S0 (скорость kIC), интеркомбинационный переход из синглетного в триплетное состояние T1 (скорость kISC) и безызлучательный перенос энергии на соседнюю молекулу (скорость kET). Все эти скорости складываются:
k = kF + kIC + kISC + kET = 1/τ , |
(1.44) |
1.6. Флуоресценция |
43 |
определяя время жизни τ возбужденного состояния S1. Отношение kF/k соответствует квантовому выходу флуоресценции ηF. Хотя оптическая спектроскопия позволяет напрямую регистрировать только излучательные переходы, тем не менее, из результатов измерения времени жизни флуоресценции можно определить скорости kIC или kET. Отметим, что радиационный переход T1 → S0 запрещен по спину, и проявляется лишь у небольшого числа отдельных молекул.
Дипольные моменты переходов имеют определенную ориентацию относительно молекулы. При возбуждении линейно поляризованным светом преимущественно возбуждаются те молекулы, у которых дипольные моменты переходов параллельны вектору электрического поля падающего света. Это селективное возбуждение определенным образом ориентированных молекул приводит к частичной поляризации флуоресценции, которая описывается степенью поляризации [249]:
PF = |
|
IFk − IF |
|
(1.45) |
|
|
IFk + IF |
||||
|
|
|
|
||
или анизотропией флуоресценции |
|
|
|
|
|
rF = |
|
IFk − IF |
, |
(1.46) |
|
|
|
||||
|
IFk + 2IF |
|
|||
где IFk и IF — интенсивности компонент флуоресценции, поляризованных параллельно или перпендикулярно электрическому вектору возбуждающего поля соответственно. Обычно PF и rF зависят от интервала времени между возбуждением и регистрацией флуоресценции, поскольку за время жизни возбужденных состояний многие молекулы меняют свою ориентацию за счет вращения («вращательная диффузия»). Из измерений анизотропии флуоресценции с временным разрешением можно определить постоянную времени вращательной диффузии, связанную с объемом молекулы VM и вязкостью окружающей среды η соотношением
τr = |
ηVM |
, |
(1.47) |
|
|||
|
kBT |
|
|
где kB — постоянная Больцмана, а T — абсолютная температура. Постоянная времени вращательной диффузии около 13 нс соотносится с молекулярным весом белков около 50 000 Да [249], а около 300 пс — протопорфирину с диаметром агрегатов порядка 1,6 нм [251].
При возбуждении биологических объектов ультрафиолетовым светом (λ 6 370 нм) можно наблюдать флуоресценцию как белков, так и нуклеиновых кислот — это так называемая автофлуоресценция (АФ) или собственная флуоресценция биологического материала. Квантовый выход флуоресценции всех составляющих нуклеиновых кислот имеет величину около 10−4–10−5, что соответствует временам жизни возбужденных состояний порядка пикосекунд. Автофлуоресценция белков определяется аминокислотами, фенилаланином, тирозином и триптофаном с максимумами поглощения соответственно на 257 нм, 275 нм и 280 нм и максимумами испускания между 280 нм (фенилаланин) и 350 нм (триптофан) [249–251]. В спектре излучения белков обычно доминирует триптофан. Флуоресценция коллагена и эластина возбуждается между 300 и 400 нм и демонстрирует широкие полосы испускания между 400 и 600 нм с максимумами около 400 нм, 430 нм и 460 нм. В частности, флуоресценция коллагена и эластина может использоваться для распознавания различных типов биотканей [64, 251–253].
Восстановленная форма кофермента никотинамидадениндинуклеотида (НАД·H) селективно возбуждается в диапазоне длин волн между 330 и 370 нм. Кофермент НАД·H сконцентрирован, в основном, в митохондриях, где он окисляется внутри дыхательной цепи, локализованной во внутренней митохондриальной мембране,
44 |
Гл. 1. Основы лазерной биомедицины |
ипоэтому его флуоресценция является индикатором ишемических или опухолевых тканей [251, 253]. Было показано, что флуоресценция свободного или связанного c белком НАД·H чувствительна к концентрации кислорода. Флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД) с максимумами возбуждения около 380 нм и 450 нм также дают вклад в собственную флуоресценцию клетки [251].
Молекулы порфиринов, например протопорфирин, копропорфирин, уропорфирин или гематопорфирин имеют отношение к биосинтезу гемоглобина, миоглобина и цитохромов. Аномалии синтеза гема, возникающие в случаях порфирии и некоторых других гемолитических заболеваний, могут вызывать значительное повышение уровня порфирина в биотканях. Многие бактерии, например Propionibacterium acnes, или бактерии зубного налета, такие как Porphyromonas gingivalis, Prevotella intermedia и Prevotella nigrescens, накапливают значительные количества протопорфирина [254, 255]. Поэтому автофлуоресценция оказывается перспективным методом диагностики и мониторинга кожного акне (угревой сыпи), поражений ротовой полости
изубов.
Внастоящее время для исследования анатомии и физиологии клеток можно применять разнообразные экзогенные флуоресцирующие красители [251, 256–259]. На человеке такие красители, как флуоресцеин и индоцианин зеленый, применяются для флуоресцентной ангиографии и определения объема крови. Недавно описаны новые флуоресцентные контрастные агенты для оптической визуализации опухолей in vivo на основе платформ векторной доставки красителя к опухолевым клеткам, такие как рецептор-нацеленные конъюгаты краситель–пептид [257] и белки, флуоресцирующие в зеленой области [258]. Исследованы флуоресцентные свойства таких красителей, как альбуминовый синий 633 и 670 в плазме и цельной крови [256]. В работе [259] исследованы экзогенные специфические флуоресцентные маркеры для количественного трехмерного определения локализации опухолей in vivo.
Спектры флуоресценции часто содержат подробную информацию о флуоресцирующих молекулах, их конформации, сайтах связывания и взаимодействии в клетках
итканях. Интенсивность флуоресценции можно измерять либо как функцию длины волны испускаемого света, либо как функцию длины волны возбуждения. Спектр
испускания флуоресценции IF(λ) специфичен для каждого флуорофора и обычно используется во флуоресцентной диагностике.
1.6.2. Многофотонная флуоресценция. Новое направление в лазерной спектроскопии и визуализации биологических объектов связано с многофотонной (двух-
итрехфотонной) флуоресцентной сканирующей микроскопией, которая позволяет отображать функциональные состояния объекта или, в сочетании с автокорреляционным анализом сигнала флуоресценции, определять внутриклеточную подвижность в малых объемах [15, 20, 260–269]. Метод многофотонной флуориметрии использует как баллистические, так и рассеянные фотоны на длине волны излучения, приходящие точно из фокальной области возбуждающего пучка (см. рис. 1.23, б) [269]. Уникальными преимуществами многофотонной микроскопии является возможность исследования трехмерных распределений хромофоров, обычно возбуждаемых ультрафиолетовым излучением в сравнительно объемных образцах, а также возможность использования широкоапертурных фотоприемников. Например, для двухфотонной микроскопии излучение хромофоров (на длине волны 350 нм) возбуждается лазерным излучением, длина волны которого (700 нм) попадает в область высокой прозрачности биоткани. Возбуждающее излучение может достигать глубоко лежащих слоев и меньше повреждает биоткань. Излучение флуоресценции в этом случае лежит в видимом диапазоне (> 400 нм) и сравнительно легко выходит из биоткани
идостигает приемника, который регистрирует только нужный сигнал от фокального

1.6. Флуоресценция |
45 |
объема без какого-либо постороннего фона. При этом для повышения отношения сигнал/шум сигнал из фокального объема можно собирать по многим направлениям. Пример, приведенный на рис. 1.23, б, соответствует ситуации, характерной при исследовании биотканей, когда ИК-излучение лазера на длине волны 960 нм, хорошо проникающее в ткань, преобразуется в фокальной области лазерного пучка во вторую гармонику 480 нм, которая уже возбуждает излучение флуоресценции соответствующего хромофора в локальной области фокального пятна лазера.
Рис. 1.23. Многофотонная флуоресценция: сравнение однофотонной флуоресценции (а) (яркий конус свечения с перетяжкой примерно в центре кюветы) при возбуждении излучением с длиной волны 488 нм с двухфотонной (б) (светящаяся точка в центре кюветы, отмеченная белой стрелкой) при возбуждении ИК-излучением с длиной волны 960 нм [269]. Схема переходов показывает процессы поглощения и флуоресценции для молекулы: однофотонное поглощение (в), двухфотонное поглощение (г), трехфотонное поглощение (д). Сплошными и штриховыми горизонтальными линиями изображены, соответственно, реальные и виртуальные молекулярные энергетические состояния; сплошные вертикальные стрелки — поглощение
фотона, волнистые стрелки — флуоресценция
Скорость двухфотонного возбуждения пропорциональна среднему квадрату плотности фотонов. Эта квадратичная зависимость вытекает из требования, чтобы флуорофор одновременно поглощал два фотона в каждом акте возбуждения. Процессы многофотонного поглощения показаны на рис. 1.23, в, г, д. Чтобы убедиться в многофотонном характере возбуждения, нужно измерить интенсивность флуоресценции как функцию интенсивности возбуждающего света. Двухфотонный процесс возбуждения характеризуется угловым коэффициентом 2 на графике, по осям которого отложены логарифмы измеренных интенсивностей, трехфотонное возбуждение характеризуется наклоном 3 и т. д.
Скорость двухфотонного возбуждения можно выразить аналитически [264]:
|
2 |
σf |
|
π(N A) |
2 |
|
2 |
|
n2f ≈ |
P0 |
|
, |
(1.48) |
||||
τpfp2 |
hcλ |
|
||||||
где τp — длительность импульса, fp — частота повторения импульсов, P0 — средняя падающая мощность, σf — сечение поглощения фотона, h — постоянная Планка, c — скорость света, N A — числовая апертура фокусирующей линзы, а λ — длина волны. Эта скорость выражается как число фотонов, поглощенных флуорофором за импульс, и является функцией длительности импульса, частоты повторения импульсов, сечения поглощения фотона и числовой апертуры объектива микроскопа,
46 |
Гл. 1. Основы лазерной биомедицины |
фокусирующего свет. Вывод этого уравнения предполагает пренебрежимо малое насыщение флуорофора и справедливость параксиального приближения.
Лазерный свет в микроскопе с многофотонным возбуждением фокусируется объективом микроскопа в фокальный объем. Только в этом объеме интенсивность сфокусированного излучения достаточна для существенного возбуждения. Низкая плотность потока фотонов вне фокального объема приводит к пренебрежимо малому сигналу флуоресценции. Способность микроскопа с многофотонным возбуждением оптически выделять тонкие слои обусловлена нелинейной зависимостью процесса возбуждения от интенсивности и сильной фокусирующей способностью объектива микроскопа. Большинство образцов сравнительно прозрачно в ближней инфракрасной области. Фокусировка объективом микроскопа приводит к многофотонному возбуждению поглощающих в ультрафиолетовом диапазоне флуорофоров в малом фокальном объеме. Сканирование фокального пятна в трех измерениях позволяет получить трехмерные изображения объекта в виде соответствующего распределения сигнала флуоресценции при многофотонном возбуждении. Таким образом, в микроскопе с многофотонным возбуждением неразрушающее оптическое секционирование (аналогичное гистологическим срезам) происходит в процессе возбуждения.
Итак, исследования биотканей и клеток с помощью двухфотонной микроскопии характеризуются следующими типичными параметрами лазерных систем: длина волны от 700 до 960 нм, длительность импульса порядка 150 фс, частота повторения импульсов 76–80 МГц, средняя мощность менее 10 мВт. Такие параметры могут быть обеспечены при использовании лазера на красителе с синхронизацией мод и накачкой Nd:YAG-лазером или титан-сапфирового лазера с накачкой аргоновым лазером. Твердотельные лазеры с диодной накачкой также перспективны для задач двухфотонной микроскопии [260]. Практически такие же параметры лазеров требуются для трехфотонной флуоресцентной микроскопии, которая обладает теми же преимуществами, что и двухфотонная, но гарантирует несколько более высокое пространственное разрешение и обеспечивает возможность возбуждать хромофоры с более короткими длинами волн поглощения [262].
1.7.Действие лазерного излучения на биоткань
1.7.1.Виды фотовоздействий. Взаимодействие света с живой материей определяется как параметрами источника света (интенсивность, длина волны, длительность и частота повторения импульсов и т. д.), так и параметрами биообъекта (степенью его однородности и пигментации, тепловыми и упругими свойствами и т. д.) [1–4, 42, 83–85]. Для выявления степени и характера воздействия излучения на биообъект необходимо учитывать не только значения коэффициентов поглощения и рассеяния соответствующей ткани, но и влияние систем кровеносных и лимфатических сосудов, обусловливающих теплоотвод, и колебательных процессов, связанных
сжизнедеятельностью, например влияние циркадных (биологических) ритмов [270]. Взаимодействие света с молекулами биообъекта приводит к их возбуждению
(см. рис. 1.2) и последующему (через некоторое время) переходу в основное состояние за счет безызлучательных переходов с выделением тепла. Увеличение температуры приводит к разрыву водородных связей и других ван-дер-ваальсовых связей, к нарушению конформации биомолекул и, следовательно, жизненных функций биообъекта. Происходит коагуляция белковых образований. Дальнейшее повышение температуры при росте мощности излучения приводит сначала к испарению жидких сред (в первую очередь тканевой воды), а затем обугливанию органических компонентов живой материи и выгоранию карбонизированного каркаса.

1.7. Действие лазерного излучения на биоткань |
47 |
Локальное повышение температуры за счет воздействия импульсного излучения большой энергии вызывает кипение перегретой жидкости в ограниченном объеме, образование высокого давления (порядка 107 Па) и разрушение ткани. Это так называемый безожоговый абляционный механизм разрушения ткани [61, 271, 272]. Возможны и другие механизмы разрушения [2, 7, 42–46, 61, 62, 85]: лавинная ионизация в поле короткого или сверхкороткого лазерного импульса — оптический пробой; ударные акустические (механические) волны, возникающие в тканях при их термическом расширении и образовании пара и плазмы; электрострикция в световом поле.
На рис. 1.24 и 1.25 схематически показаны области существования различных типов взаимодействия лазерного излучения с биообъектами, которые определяются тремя связанными параметрами: плотностью мощности (интенсивностью) I (Вт/см2), плотностью энергии W (Дж/см2) и длительностью воздействия τи (с) [62]. Линейные некогерентные эффекты существуют в широкой области значений длительности и интенсивности излучения, при этом плотность энергии для τи = 103 с не превышает 1 Дж/см2. Многофотонные процессы происходят лишь в области значительных интенсивностей и сравнительно малых длительностей импульсов при плотности энергии 10−3–103 Дж/см2. Линейные и нелинейные когерентные эффекты возможны лишь при сверхмалых длительностях импульсов, соизмеримых с временами релаксации биомолекул, τ 6 10−13 с. Нелинейные явления возникают при I > 109 Вт/см2, а требуемые энергии сравнительно невелики: не превышают 0,1 Дж/см2 при I 6 1012 Вт/см2. Представленные диаграммы показывают, какие типы фотовоздействий следует ожидать для выбранного режима работы лазера.
Рис. 1.24. Области доминирующего типа взаимодействия лазерного излучения с биообъектами (схема В. С. Летохова [62])
Регулирование длительности лазерного импульса позволяет осуществить любой из видов воздействия на биоткань. Длительность импульса определяет размеры области теплового воздействия излучения, которые зависят от скорости тепловой диффузии биоткани. Для типичной биоткани лазерные импульсы длительностью τи = 1 мкс дают размеры области теплового воздействия dT ≈ 1 мкм (т. е. практически не выходят за область, занимаемую сфокусированным лазерным пучком, диаметр которой 10–50 мкм), а при τи = 10 мс dT = 100 мкм [46]. Фототепловое разрушение биоткани

48 |
Гл. 1. Основы лазерной биомедицины |
Рис. 1.25. Области доминирующего типа взаимодействия лазерного излучения с биообъектами (схема Д. Слайни [62]) (пунктирная линия соответствует дозе облучения около 3 Дж/см2)
происходит |
при |
τи ≈ |
10−6–102 |
с и |
I |
2= |
1–106 |
Вт/см2, взрывная абляция — при |
||
−8 |
|
−6 |
7 |
9 |
|
|
|
|||
τи = 10 |
–10 |
с и I = 10 –10 |
|
Вт/см , а повреждение оптическим пробоем — при |
||||||
τи = 10−11–10−7 с и I = 109–1012 Вт/см2 (см. рис. 1.24, 1.25) [43–46, 62]. Очевидно, что характер фотовоздействия высокоинтенсивного лазерного излуче-
ния на биоткань определяется ее составом и коэффициентом поглощения на длинах волн облучения. Существенные различия в коэффициентах поглощения мягких и твердых тканей для высокоинтенсивных лазеров, излучающих в ИК- и УФ-диапа- зоне длин волн, следуют из данных табл. 1.9 [273].
1.7.2. Тепловые эффекты. При поглощении лазерного излучения в биоткани генерируется тепло. Это тепло индуцирует целый ряд эффектов, которые соответствуют различным уровням вкладываемой мощности и приводят либо к некоторому нагреву ткани в пределах физиологических температур, либо к обратимым или необратимым изменениям ее состояния.
Генерируемое тепло, описываемое как источник тепла S в точке r, пропорционально интенсивности светового потока ϕ(r) (мВт/см2) и коэффициенту поглощения
µa(r) в этой точке [2, 3, 14, 75, 148, 275, 276]: |
|
S(r) = µa(r)ϕ(r). |
(1.49) |
Биотепловое уравнение записывается исходя из энергетического баланса в системе, и оно описывает временные´ изменения температуры биоткани в заданной точке пространства r:
|
|
ρc |
∂T (r, t) |
= [km T (r, t)] + S(r) + ρcw(Ta − Tv), |
|
|
(1.50) |
|||||||||||
|
|
|
|
|
||||||||||||||
где |
|
∂t |
|
г |
||||||||||||||
ρ — плотность ткани (г/см |
3); |
|
— удельная теплоемкость ткани (мДж |
|
· |
◦C ); |
||||||||||||
|
|
◦ |
|
c |
|
|
|
|
|
/( |
|
) |
||||||
T (r, t) — температура ткани ( |
C) в момент времени t; km — коэффициент теп- |
|||||||||||||||||
лопроводности ткани (мВт |
/( |
см |
· |
◦C |
); |
S( |
r |
) |
— член, описывающий источник тепла |
|||||||||
|
3 |
), определяемый |
|
|
|
) |
|
|
|
скорость |
||||||||
(мВт/см |
скоростью |
выделения тепла в точке r; w — |
||||||||||||||||
перфузии крови в ткани (г/(см3 · с)); Ta — входящая артериальная температура (◦C), а Tv — выходящая венозная температура (◦C); все в точке r ткани.

Т а б л и ц а 1.9. Состав и коэффициенты поглощения, см−1, некоторых биотканей [194, 197, 273]
Тип |
Мяг- |
|
Кость [273] |
|
|
|
Зуб (эмаль) |
|
Зуб (дентин) [197] |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
лазера, |
кие ткани |
13–20 % |
20–27 % |
|
50–60 % |
4 % |
|
1 % |
95 % |
10 % |
18 % |
72 % |
длина |
(80 ± 10 % |
H2O |
белки |
|
минералы |
H2O |
|
белки |
минералы |
H2O |
белки |
минералы |
волны |
H2O) [273] |
|
(коллаген) |
Ca5OH(PO4)3 |
|
|
(коллаген) |
Ca5OH(PO4)3 |
|
(коллаген) |
Ca5OH(PO4)3 |
|
CO2, |
|
820 |
220 |
|
3475 |
|
|
|
|
|
|
|
10,6 мкм |
700 |
|
2250 |
|
|
|
3340 [273]; 800 [194] |
|
800 [194] |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2, |
|
580 |
560 |
|
5490 |
|
|
|
|
|
|
|
9,6 мкм |
580 |
|
3520 |
|
|
|
5240 [273]; 8000 [194] |
|
6500 [194] |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Er:YAG, |
|
11850 |
1330 |
|
650 |
|
|
|
|
|
|
|
2,94 мкм |
9700 |
|
2290 |
|
|
|
1105 [273]; 800 [194] |
|
2200 [194] |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
KrF, |
100–600 |
0,018 |
900 |
|
120 |
|
|
— |
|
|
— |
|
248 мкм |
|
|
320–350 |
|
|
|
— |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
биоткань на излучения лазерного Действие .7.1
49
50 |
Гл. 1. Основы лазерной биомедицины |
В этом уравнении не учтены такие явления, как конвекция, излучение, выпаривание, метаболические тепловые эффекты, поскольку во многих практических случаях они пренебрежимо малы. Член, описывающий источник, предполагается неизменным во временном интервале, когда происходит нагрев. Первый член справа от знака равенства описывает проводимость тепла (обычно из точки r), а член источника учитывает генерацию тепла за счет поглощения фотонов. Обычно, при воздействии лазерного излучения на ткань, перенос тепла за счет перфузии крови (последний член в уравнении) пренебрежимо мал.
Для решения этого уравнения должны быть учтены начальные и граничные условия, соответствующие решаемой задаче. Начальным условием является температура ткани в момент времени t = 0, а граничные условия зависят от структуры ткани и геометрии лазерного нагрева. Методы решения биотеплового уравнения можно найти в работах [2, 3, 75, 148, 275–278].
Биологическая ткань повреждается при действии на нее высоких температур
втечение некоторого времени [2, 3, 75, 275–277]. Функция повреждения выражается
втерминах интеграла Аррениуса:
τ
|
C(0) |
= A e− |
Ea |
|
||
Ω(τ ) = ln |
RT (t) |
dt, |
(1.51) |
|||
C(τ ) |
||||||
|
|
|
|
|
||
|
|
0 |
|
|
|
|
где τ — полное время нагревания (с); C(0) — изначальная концентрация неповрежденной ткани; C(τ ) — остаточная концентрация неповрежденной ткани после периода времени τ ; A — эмпирическая константа; Ea — определяемый эмпирически порог энергии активации (Дж/моль); R — универсальная газовая постоянная (8,32 Дж/моль · K); а T — абсолютная температура (K).
В случае использования лазерного излучения для неинвазивной диагностики или фототерапии необходимо удерживать температуру ниже порога повреждения ткани, ниже так называемой критической температуры Tcrit. Эта температура определяется как температура, при которой скорость накопления повреждений, dΩ/dt, равна еди-
нице [276]: |
Ea |
|
|
|
Tcrit = |
. |
(1.52) |
||
R ln(A) |
||||
|
|
|
Константы A и Ea могут быть рассчитаны на основе экспериментальных данных при воздействии на ткань некоторой постоянной температуры [275]. Например, для кожи
свиньи A = 3,1 · 1098, а Ea = 6,28 · 105 Дж/моль, что дает Tcrit = 59,7 ◦C.
При воздействии непрерывных лазеров, из-за постоянного нарастания разности температур между облучаемой и окружающей тканью, возрастает перенос тепла из области нагрева в соседние участки ткани. В этом случае при больших уровнях энергии излучения могут быть повреждены значительные объемы ткани, а при малых — ожидаются потери тепла в нагреваемых областях. При импульсном нагреве потери тепла обычно существенно меньше за счет того, что поглощение света является очень быстрым процессом, а тепло распространяется существенно медленнее, поэтому оказывается возможным более прецизионное и управляемое повреждение ткани.
При повышении температуры выше критической, Tcrit, возможны следующие виды необратимых повреждений ткани: коагуляция (денатурация клеточных и тканевых белков), является основой для лазерного сваривания ткани; выпаривание (дегидратация ткани и образование пузырьков пара (вакуолизация), T > 100 ◦C), является основой для механической деструкции ткани; и пиролиз (при температурах T ≈ 350–450 ◦C). Комбинация выпаривания, вакуолизации и пиролиза при-

1.7. Действие лазерного излучения на биоткань |
51 |
водит к тепловой абляции ткани — основы для лазерного хирургического удаления ткани.
Итак, вызванные лазерным излучением тепловые эффекты в биотканях соответствуют следующим диапазонам температур, ◦С, [61]:
Отсутствие необратимых изменений |
37–43 ◦C |
Разделение слоев ткани (отек) |
45–48 ◦C |
Сваривание ткани, денатурация белков |
45–60 ◦C |
Коагуляция, некроз, обезвоживание |
60–100 ◦C |
Испарение тканевой воды |
100 ◦C |
Пиролиз, выгорание |
100–300 ◦C |
Карбонизация твердых компонентов ткани |
> 200 ◦C |
Испарение твердых компонентов ткани |
> 300 ◦C |
Для коротких лазерных импульсов все эти процессы развиваются взрывным образом. Во время тепловой абляции возникает сильное давление в ткани, что ведет к образованию ударных волн и наряду с тепловой абляцией имеет место механическое повреждение ткани. Эти два тесно связанных явления определяют как фототермический и фотомеханический механизмы абляции ткани. Пример взрывного абляционного разрушения ткани в процессе воздействия лазерного импульса показан на рис. 1.26 [274].
Рис. 1.26. Ранние фазы абляции ткани печени под действием излучения Er:YAG-лазера при плотности энергии 5,4 Дж/см2 и размере пучка 0,5 мм; стрелка показывает направление лазерного пучка [274]
Многие годы мощное оптическое излучение ламповых источников, лазеров, а теперь и мощных светодиодов, используется для лечения различных патологий в офтальмологии, дерматологии, урологии, отоларингологии и других разделах медицины. Применяется также электромагнитное излучение других диапазонов длин волн, в частности терагерцового или микроволнового. Например, в дерматологии лазеры обеспечивают большое разнообразие косметических и дерматологических операций, связанных с удалением пигментных пятен, поверхностных вен, морщин, нежелательных волос, татуировок и пр. Для выполнения таких процедур необходимо нагреть с помощью соответствующего излучения естественные (эндогенные) или специально введенные в ткань (экзогенные) поглотители. Эндогенные поглотители включают воду, меланин, гемоглобин, белки, липиды и прочие компоненты биотканей; экзогенные — различные красители, цветные туши, карбоновые частицы, в последние годы наночастицы — от карбоновых (фуллерены) до плазмонных золотых.
В том случае, если биологическая мишень и поглотитель занимают одну и ту же область в ткани, то процессы фотодеструкции хорошо описываются в рамках теории селективного фототермолиза (СФТ) [279]. Эта теория позволяет количественно
