
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf122 |
|
Гл. 2. Распространение света в биологических тканях |
|
|
|
|
равно |
ωc ≈ |
2,14 ГГц. При |
ω0 ωc коэффициент затухания фотонных волн |
слабо |
||
|
|
|
0,5 |
|
||
зависит от частоты и может быть приближенно оценен как {3µa[µa + (1 − g)µs]} |
|
. |
||||
Как уже отмечалось выше для затухающих волн фотонной плотности характерны отражение и преломление на границе раздела двух сред с различающимися рассеивающими характеристиками, интерференция волн от двух и более источников и дифракция на локальных неоднородностях внутри рассеивающей среды. Наличие многократно рассеивающей среды принципиально для рождения и распространения таких волн [163, 537, 538, 543, 562].
Частотные зависимости волнового числа и коэффициента затухания для волн фотонной плотности определяют взаимосвязь между пространственным разрешением модуляционного метода и максимальной толщиной зондируемого слоя рассеивающей среды. Для большинства практических приложений в медицинской диагностике оптимальное значение частоты модуляции находится в диапазоне от 50 до 1000 МГц.
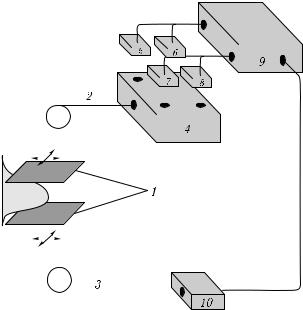
Основные направления клинического применения модуляционной ДОТ связаны с томографией головного мозга (обнаружение внутричерепных гематом, функциональная диагностика головного мозга, в частности — анализ гемодинамики) и диагностикой рака молочной железы (оптическая маммография). На рис. 2.12 представлена схема оптического томографа, разработанного фирмой Siemens AG Medical Engineering (Эрланген, Германия) [596, 603]. В качестве источников излучения используются 4 диодных лазера с длинами волн 690 нм (частота модуляции 69,50 МГц), 750 нм (69,80 МГц), 788 нм (70,20 МГц) и 856 нм (70,45 МГц). Доставка излучения к объекту и прием рассеянного излучения осуществляется с помощью световодов. Синхронное механическое сканирование объекта передающим
иприемным световодами позволяет получить двумерные проекции внутренней структуры объекта. Время сканирования, необходимое для получения одного двумерного изображения, составляет 2 мин. Сравнение рентгеновских и оптических томограмм одного и того же объекта позволяет сделать вывод о том, что при достаточно высоком контрасте оптических томограмм, позволяющих с уверенностью диагностировать наличие новообразований, они характеризуются меньшим пространственным разрешением, что обусловлено диффузионным характером распространения света в биоткани. Несмотря на это оптическая диффузионная томография остается весьма перспективным направлением клинической диагностики, прежде всего благодаря биологической безопасности зондирующего ИК-излучения.
Одно из перспективных направлений развития модуляционной томографии связано с использованием многоэлементных фазированных излучателей (метод амп- литудно-фазовой компенсации) [12, 31, 91]. Данный подход позволяет увеличить пространственное разрешение за счет интерференции волн фотонной плотности от различных источников. При использовании двух источников, испускающих волны фотонной плотности одинаковой амплитуды и частоты с фазовым сдвигом 180◦,
идетектора, расположенного в зоне, где разность хода волн от источников равна нулю, амплитуда детектируемого сигнала для изотропной рассеивающей среды равна нулю. Наличие неоднородности в области распространения волн фотонной плотности приводит к нарушению фазового согласования. Эксперименты с модельными средами показали, что пространственное разрешение в случае локализации поглощающей неоднородности достигает приблизительно 1 мм; аналогичное значение ожидается в случае рассеивающих неоднородностей.
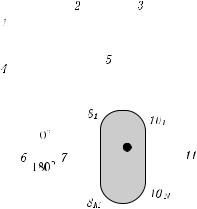
На рис. 2.13 приведена схема модуляционной системы с использованием амп- литудно-фазовой компенсации [604]. При формировании зондирующего излучения
идетектировании рассеянного света использован принцип гетеродинной обработки сигналов, что позволяет осуществлять точные фазовые измерения в низкочастотном диапазоне с высокой точностью. Источниками служили 8 диодных лазеров с длиной
2.4. Принципы оптической диффузионной спектроскопии и томографии |
123 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.12. Схема оптического маммографа фирмы Siemens AG (Германия): 1 — устройство фиксации объекта; 2 — световод для передачи излучения к объекту; 3 — световод для приема рассеянного излучения; 4 — волоконно-оптический мультиплексор 4 × 1; 5–8 — набор лазерных диодов; 9 — блок управления и обработки; 10 — детектор (ФЭУ) [603]
волны 780 нм. Несущая (модулирующая) частота равна 50 МГц, выделяемая частота — 1 кГц. В качестве приемников использованы четыре ФЭУ. Излучатели и приемники объединены в блок размером 9 × 4 см. Циклы измерений, соответствующих 16 различным комбинациям источников и приемников, повторяются с периодичностью 16 с.
Использование вместо каждого излучателя в блоке нескольких с различными длинами волн позволяет расширить функциональные возможности системы. Например, для набора из двух лазеров с длинами волн 750 нм и 830 нм в каждом источнике получается более чем двукратное увеличение амплитуды детектируемого сигнала вследствие уменьшения затухания зондирующего излучения [12, 13, 31]. Такие системы позволяют получить высококачественное изображение объекта исследований при времени выборки данных порядка 8 с и используются для функциональной диагностики мозга новорожденных и рака молочной железы.
Простая и универсальная исследовательская система была разработана в Саратовском университете [641]. Эта система включает квантово-размерные лазеры (длины волн 790 и 840 нм), гарантирующие высокоэффективную модуляцию лазерного излучения по цепи питания с низким уровнем шумов в диапазоне 100–1000 МГц, набор оптических волокон и управляемый компьютером оптический стол, позволяющий обеспечить различную геометрию эксперимента. Приемный блок содержит лавинный фотодиод с высокочастотным усилителем (20 дБ). Полный динамический диапазон приемного блока вместе со спектроанализатором или сетевым анализатором составляет 70 дБ.
В работах [642, 643] описан образец модуляционного томографа, позволяющий осуществлять визуализацию протяженных (размером до 140 мм) рассеивающих объ-
124 |
Гл. 2. Распространение света в биологических тканях |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.13. Схема оптического томографа с фазовой компенсацией: 1 — генератор радиодиапазона; 2 — фазовый детектор; 3 — гетеродин; 4 — модулятор; 5 — блок обработки; 6 — фазорасщепитель; 7, 11 — коммутаторы; 81, ..., 8M — диодные лазеры; 9 — объект; 101, ..., 10N — фотоумножители [604]
ектов с параметрами, типичными для биологических тканей в окне их прозрачности. Источниками служили диодные лазеры с длинами волн 775, 808 и 818 нм, с мощностью излучения 15–30 мВт и частотой модуляции интенсивности 100 МГц. Для подачи излучения на объект исследования и приема рассеянного света использована система световодов с диаметром сердцевины 600 мкм (12 световодов для подачи и 32 для приема). Детектирование рассеянного излучения осуществлялось ФЭУ (Hamamatsu R636-10) в режиме счета фотонов. Для обработки последовательностей фотоотсчетов применен метод времяразрешенного счета фотонов, позволяющий получать гистограммы распределений фотоотсчетов по периоду модуляции, в результате анализа которых находятся амплитудно-фазовые характеристики детектируемого сигнала. Для восстановления изображений разработан быстрый проекционный алгоритм; время реконструкции для объекта размером до 140 мм составляло 5–10 мин.
На разработанном в Институте прикладной физики РАН (Н. Новгород) модуляционном ДОТ с параллельной геометрией были проведены успешные клинические исследования на 5 здоровых добровольцах и 5 пациентах с диагнозом карцинома молочной железы [613]. Томограф работал на трех длинах волн: 684 нм, 794 нм и 850 нм. Эти длины волн лазерных источников были выбраны из следующих соображений, длина волны 684 нм близка длине волны 700 нм, где дезоксигемоглобин имеет максимальный вклад в поглощение, длина волны 794 нм соответствует примерному равенству поглощения дезокси- и оксигемоглобина, а на длине волны 850 нм оксигемоглобин имеет максимум поглощения. Излучение всех трех лазеров направлялось с помощью волоконного жгута на объект. Частота модуляции интенсивности лазеров составляла 140 МГц. Рассеянный в направлении вперед свет (режим просвечивания) детектировался ФЭУ (Hamamatsu) с автоматическим управлением усиления, что существенно увеличивало динамический диапазон измерительной системы и позволяло избегать насыщения сигнала при движении источника и приемника к краю молочной железы, где ее толщина существенно меньше, чем в центре. Отметим, что ФЭУ работал в непрерывном режиме, а не в режиме счета фотонов. Для обеспечения измерений фазы модуляционного сигнала с высокой точностью для гетеродинирования сигналов использовались температурно-стабилизированные генераторы с разностью в частотах, равной 1 кГц. Оба низкочастотных сигнала (опорный и детектируемый)
2.4. Принципы оптической диффузионной спектроскопии и томографии |
125 |
оцифровывались с помощью АЦП. Расчеты разности амплитуд и фаз этих сигналов производились с помощью преобразования Гильберта, поскольку оно более устойчиво в условиях дрейфа частоты, по сравнению с обычно используемым преобразованием Фурье. Независимое сканирование источника и приемника в определенной плоскости обеспечивалось компьютерно-управляемыми шаговыми двигателями, область сканирования составляла 15 × 15 см2. Считывание информации осуществлялось автоматически для каждого нового шага сканирования при фиксированном расстоянии между источником и приемником последовательно для каждой из трех длин волн. При исследованиях молочная железа располагается между двумя прозрачными пластинами, которые соответствуют плоскостям источника и приемника, и слегка сжимается. 2D-изображения для коэффициентов поглощения и рассеяния на трех длинах волн, рассчитанные на основе решения обратной задачи рассеяния, показали существенные различия между нормальной и злокачественной тканью. Соответственно, существенно различны и реконструированные пространственные распределения значений концентрации полного гемоглобина (tHb = Hb + HbO2), дезоксигенированного гемоглобина Hb, оксигенированного гемоглобина HbO2 и степени насыщения кислородом (StO2 = [HbO2]/[tHb]). Чувствительность установки позволяла обнаруживать опухоли молочной железы на глубине до 8 см.
Результаты клинических исследований по диагностике рака молочной железы, томографии мозга новорожденных и изучению патофизиологии мышечной ткани при физических упражнениях, а также промышленные и экспериментальные установки на основе метода фазово-модуляционной спектроскопии (ФМС) представлены в работах [510, 592–600, 613–615, 621, 637, 638, 641–643] (см. табл. 2.2–2.4).
2.4.2.5. Алгоритмы решения обратных задач. Разработано значительное количество алгоритмов решения обратных задач ДОТ [163, 502, 540, 541, 549, 561, 605–612]. Остановимся здесь лишь на общих принципах и приведем несколько примеров. В частности, применительно к модуляционной томографии в работе [540] предложен метод реконструкции изображений по измеренному набору значений амплитуды и фазы модуляции рассеянного излучения при различных положениях источника и детектора относительно объекта. В основе алгоритма лежат методы теории возмущений, в соответствии с которыми пространственные распределения µa и µ′s в зондируемом объеме представляются в следующем виде:
µa(r) µa0 + µa(r); µs′(r) µs′0 + µs(r). |
(2.45) |
Уравнение Гельмгольца вида (2.41) в этом случае должно быть заменено уравнением для возмущенных значений интенсивности диффузной составляющей:
2 |
2 |
|
δ(r) |
+ ξ · Ξ(r)U (r), |
(2.46) |
( |
+ K |
)U (r) = |
|
||
D0 |
где ξ — параметр; значения K и D0 соответствуют невозмущенным параметрам объекта, функция Ξ(r) определяется возмущениями µa и µ′s. Комплексное значение амплитуды волны фотонной плотности может быть представлено как разложение в ряд по степеням параметра ξ:
|
U (r) = U |
|
(r) + ξU |
|
(r) + ξ2U |
AC 2 |
(r) + ... , |
(2.47) |
|||
|
AC |
AC 0 |
|
AC 1 |
|
|
|
||||
где член порядка N определяется следующим рекуррентным соотношением: |
|
||||||||||
|
U |
(r |
) = |
G(r, r |
)Ξ(r)U |
|
(r)d3r; |
(2.48) |
|||
|
AC N |
d |
|
|
d |
|
AC N −1 |
|
|
|
|
rd |
определяет положение приемника, G(r, rd) — функция Грина для уравнения |
||||||||||
Гельмгольца. |
|
|
|
|
|
|
|
|
|
|
|

126 |
Гл. 2. Распространение света в биологических тканях |
|
Для многих приложений коэффициент µs′ можно считать постоянным по объему, |
а флуктуации µa — малой и плавно изменяющейся величиной (например содержание |
|
гемоглобина в ткани). В данном случае Ξ(r) ≈ c µa(r)/D0, и только линейный член |
|
в разложении (2.47) может рассматриваться при определении амплитуды и фазы |
|
волны фотонной плотности. Разбивая зондируемый объем на n элементов размером h, можно свести задачу восстановления µa(r) к решению системы линейных уравнений:
U1 |
( |
s, |
|
d)2 |
= T21 |
...T2n |
µ.a.(. |
2) , |
(2.49) |
||||
U1 |
(rs, |
rd)1 |
|
T11 |
... |
T1n |
|
|
µa(r1) |
|
|||
|
r |
|
r |
|
|
Tm1 |
... |
|
· |
|
r |
|
|
U1(r.s.., rd)m |
... Tmn |
µa(rn) |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где матричные элементы Tkm могут быть представлены следующим образом:
h3
Tkm = G(rdk, rm)U0(rsk − rm) cD0 .
В работах [524, 608–610, 644–647] рассмотрены эффективные алгоритмы решения обратных задач ДОТ с использованием метода «средних траекторий». Этот метод базируется на фундаментальном свойстве решения уравнения диффузии, выражающемся во взаимосвязи функций U (r, t) и U1(rl, τ ) в форме интегрального преобразования с функцией Грина диффузионного уравнения в качестве ядра, где τ характеризует момент времени, когда фотон, мигрирующий из точки пространст- ва–времени для источника в точку пространства–времени приемника, окажется в точке пространства с координатами rl. Эта взаимосвязь позволяет представить относительное изменение оптического сигнала I/I, обусловленное наличием неоднородности в объекте (опухоль, например), в форме криволинейного интеграла по траектории, описывающей положение центра фотонного облака, распространяющегося в среде от источника к детектору:
− ln 1 − |
|
|
|
|
Lph |
|
|
|
|
|
I |
= |
c |
|
h |
δµa(l) |
i |
dl, |
(2.50) |
||
I |
n |
0 |
v(l) |
где Lph — среднестатистическая траектория фотонов; l — расстояние вдоль этой траектории; v(l) — мгновенное значение скорости распространения облака вдоль траектории; hδµa(l)i — изменение коэффициента поглощения вдоль траектории. Имеет место некоторая аналогия диффузионной и абсорбционной томографии, когда затухание сигнала обусловлено поглощающими включениями вдоль траектории зондирующего пучка. Интегральное уравнение (2.50) является аналогом преобразования Радона и может быть обращено с помощью быстрых алгоритмов рентгеновской томографии [646]. Правда, в отличие от преобразования Радона, интегрирование в (2.50) осуществляется не по прямой, а по кривой линии Lph.
В работах [611, 612, 642, 643] рассмотрены нелинейные статистические алгоритмы решения обратных задач ДОТ, способные работать в режиме реального времени. В основе алгоритмов лежит гипотеза о взаимосвязи вероятности Pij′ нахождения неоднородности по результатам ij-измерения и по разности детектируемых потоков фотонов при наличии и отсутствии неоднородности в объекте: Pij′ Fij′ − Fij . Пространственное распределение Pij′ определяется плотностью
′ ′ ′
вероятности pij Pij fij (r), где fij (r) — трехмерное распределение вероятности
прохождения фотонов, зарегистрированных в ij-измерении, через точку объекта с координатой r.
2.5. Взаимодействие поляризованного излучения с биологическими объектами |
127 |
Реконструкция изображения структуры объекта сводится к нахождению полного трехмерного распределения вероятности нахождения неоднородностей в различных точках объекта, определяемого через произведение Q Pij′ fij′ (r). Необходимые для
этой процедуры′ |
ij |
значения Fij = Fij′ − Fij получаются в результате эксперимента, |
а значения fij (r) определяются с использованием моделирования методом Мон- те-Карло или приближенных аналитических методов. Эксперименты с модельными объектами с поглощающими неоднородностями продемонстрировали высокое быстродействие алгоритма при приемлемом качестве восстанавливаемых изображений.
Алгоритмы на основе нейронных сетей для определения оптических параметров и восстановления изображения внутренней структуры сильно рассеивающих сред по измерениям пространственного профиля рассеянного назад излучения представлены в [648, 649]. Применение методов обращения нейронной сети и нечеткой системы с последующим обращением позволяет определять коэффициент поглощения в рассеивающей среде с погрешностью 20 %, а коэффициент рассеяния и параметр анизотропии рассеяния на уровне 5–10 % [648]. С использованием моделирования пространственно-углового распределения обратно рассеянного оптического излучения методом Монте-Карло, сочетающим в себе две схемы моделирования эффективных оптических путей и статистических весов, показано, что метод искусственной нейронной сети достаточно эффективен при решении обратных задач по определению размера рассеивателей и восстановлению изображения локальных макронеоднородностей в биотканях [649].
Влияние преломления света на границах исследуемых объектов на восстановление изображения в трансмиссионной оптической томографии рассеивающих сред исследовано в [650]. Показано, что без коррекции преломления на границах цилиндрического объекта наблюдаются значительные искажения в изображении. Другим способом уменьшения искажений, связанных с преломлением света, может служить помещение объекта в иммерсионную среду, что используется на практике [22].
2.5.Взаимодействие поляризованного излучения
сбиологическими объектами
2.5.1.Анизотропия биотканей. Многие биологические ткани обладают оптической анизотропией [12, 13, 27, 31, 57]. Двулучепреломление тканей обусловлено главным образом линейной анизотропией волокнистых структур, характерных для соединительных тканей. Для таких структур усредненный показатель преломления вдоль направления волокон больше, чем поперек волокон, а моделью является набор параллельных цилиндров, образующих двулучепреломляющую среду с оптической осью, параллельной оси цилиндров. Это так называемое двулучепреломление формы, которое характерно для большого разнообразия биологических тканей, включая роговицу, склеру и сетчатку глаза, хрящ, сухожилие, твердую мозговую оболочку (dura mater), мышечную, нервную, зубную и костную ткани. Ткани могут содержать одноосные и/или двуосные двулучепреломляющие структуры.
Например, в костной и зубной тканях — это минерализованные структуры, содержащие кристаллы гидроксиапатита. В частности, эмаль зуба представляет собой упорядоченный набор таких кристаллов, окруженных белково-водно-липидным матриксом [191, 193–195, 199]. Хорошо ориентированные гексагональные кристаллы гидроксиапатита диаметром 30–40 нм и длиной до 10 мкм упакованы в органический матрикс и образуют эмалевые призмы (или стержни) диаметром 4–6 мкм. Эмалевые призмы ориентированы приблизительно перпендикулярно поверхности зуба. В свою очередь, дентин зуба пронизан дентиновыми тубулами в виде полых органических

128 Гл. 2. Распространение света в биологических тканях
цилиндров с сильно минерализованной оболочкой. Диаметр тубул равен 1–5 мкм, а их плотность лежит в диапазоне (3–7) · 106 см−2 [191, 193, 199].
Сухожилие состоит в основном из параллельных плотно упакованных коллагеновых волокон, образующих параллельные пучки с вкраплением длинных эллипсоидальных фибробластов. В общем случае волокна сухожилия имеют цилиндрическую форму с диаметром от 20 до 400 нм.
У артерии наружный адвентициальный слой состоит, в основном, из коллагеновых волокон диаметром 1–12 мкм и более тонких эластиновых волокон диаметром 2–3 мкм. Как и у сухожилия, цилиндрические коллагеновые и эластиновые волокна ориентированы преимущественно вдоль одной оси, что обусловливает двулучепреломление. С другой стороны, миокард содержит волокна, ориентированные вдоль двух различных осей. Миокард состоит преимущественно из волокон сердечной мышцы, образующих ленты, вьющиеся вокруг желудочков и предсердия. Для миокарда типично двулучепреломление, поскольку показатель преломления вдоль оси мышечного волокна отличается от показателя преломления в поперечном направлении.
Двулучепреломление формы возникает, когда оптическая разность фаз между двумя ортогонально поляризованными компонентами отлична от нуля для света, рассеянного вперед. После многократных актов рассеяния вперед накапливается относительная разность фаз и между ортогонально поляризованными компонентами образуется запаздывание (δое) аналогичное тому, которое возникает при двойном лучепреломлении. Для упорядоченных линейных структур рост фазовой задержки можно характеризовать разностью эффективных показателей преломления для света, поляризованного вдоль и поперек длинной оси линейной структуры ( nое). Влияние двулучепреломления ткани на распространение линейно поляризованного света
зависит от угла между направлением поляризации падающего света и оптической осью вещества ткани. Фазовая задержка δoe между ортогонально поляризованными компонентами пропорциональна расстоянию d, пройденному в двулучепреломляющей среде [652]:
δое = |
2πd nое |
. |
(2.51) |
|
|||
|
λ0 |
|
|
Среда из параллельных цилиндров является положительной одноосной двулучепреломляющей средой ( noe = (ne − no) > 0) с оптической осью, параллельной осям цилиндров. Поэтому луч, у которого электрический вектор направлен параллельно осям цилиндров, будет называться «необыкновенным», а луч, у которого электрический вектор перпендикулярен осям цилиндров, — «обыкновенным». Электрический вектор необыкновенного луча лежит в главной плоскости, т. е. в той же плоскости, что и оптическая ось. Разность (ne − no) между показателями преломления необыкновенной и обыкновенной волн является мерой двулучепреломления среды, состоящей из цилиндров. В рэлеевском пределе, когда диаметр цилиндра λ, двулучепреломление формы определяется соотношением [653, 654]
n |
|
= (n |
e − |
n |
) = |
f1f2(n1 − n2)2 |
, |
(2.52) |
|
ое |
|
o |
|
f1n1 + f2n2 |
|
|
где f1 — объемная доля цилиндров; f2 — объемная доля базового вещества, а n1, n2 — соответствующие показатели преломления. При заданной разности показателей преломления максимальное двулучепреломление ожидается для примерно равных объемных долей тонких цилиндров и базового материала. Для систем с большими диаметрами цилиндров ( λ) двулучепреломление стремится к нулю.
Двулучепреломление формы используется в микроскопии биообъектов как средство изучения структуры ткани. Для разделения двулучепреломления формы и мате-
2.5. Взаимодействие поляризованного излучения с биологическими объектами |
129 |
риала средние показатели преломления материала волокон и окружающего вещества должны быть сделаны равными, поскольку двулучепреломление формы исчезает
при n1 = n2.
Линейный дихроизм (двойное поглощение или ослабление), т. е. различное поглощение (ослабление) для двух ортогональных поляризаций, в системах, образованных длинными цилиндрами, определяется разностью между мнимыми частями соответствующих эффективных показателей преломления. В зависимости от соотношения между размерами и оптическими константами материала цилиндров, эта разность может принимать как положительные, так и отрицательные значения [218].
Известные из литературы значения двулучепреломления для сухожилий, мышечной ткани, коронарной артерии, миокарда, склеры, хряща и кожи имеют noe 10−3 (см., например, работы [652, 655–661]). Измеренные вариации показателя преломления для быстрой и медленной осей роговицы кролика показывают, что ее двулучепреломление меняется в пределах от 0 в вершинной точке роговицы до 5,5 · 10−4 в основании, где она присоединяется к склере [662]. Преобладающая ориентация коллагеновых волокон приводит к двулучепреломлению и дихроизму [237].
Поляризационно-чувствительная оптическая когерентная томография позволяет измерять линейное двулучепреломление в рассеивающей ткани с высокой точностью. Были получены такие данные: noe = 1,4 · 10−3 для мышечной ткани грызунов [652, 661]; (4,2 ± 0,3) · 10−3 для сухожилия поросенка в норме и (2,24 ± 0,07) · 10−3 для термически обработанной ткани (90 ◦C, 20 с), 1,5 · 10−3–3,5 · 10−3 для кожи свиньи
и3,0 · 10−3 для хряща быка [663]; и (3,7 ± 0,4) · 10−3 для сухожилия быка [659]. Такое двулучепреломление обеспечивает 90 %-фазовую задержку на глубине порядка нескольких сот микрометров.
Двулучепреломление и дихроизм связаны с плотностью и некоторыми другими свойствами коллагеновых волокон ткани, тогда как ориентация быстрой оси отражает ориентацию коллагеновых волокон. Плотность коллагеновых волокон в коже
ихряще не так однородна, как в сухожилии, поэтому распределение ориентаций коллагеновых волокон не столь упорядоченно, а значит и распределение параметров двулучепреломления [663].
Кроме линейного двулучепреломления и дихроизма, многие ткани показывают оптическую активность. Так называемая хиральность молекул, возникающая из-за несимметричной их структуры, приводит к ряду характерных оптических эффектов под общим названием оптической активности [218]. Хорошо известным проявлением оптической активности является способность вращать плоскость поляризации линейно поляризованного света вокруг направления его распространения. Угол поворота зависит от концентрации хиральных молекул, толщины слоя среды и длины волны света. Ткани, содержащие хиральные компоненты, демонстрируют оптическую активность [662, 664, 665]. Интерес к хиральными рассеивающим средам стимулируется потенциальной возможностью неинвазивного in situ оптического мониторинга глюкозы у больных диабетом [27, 34, 109, 123, 664, 665].
Всложных тканевых структурах агрегаты частиц, в частности сферических частиц, могут быть ответственными за оптическую активность ткани. Можно построить и более сложные модели анизотропных тканей. Например, роговица глаза может быть представлена как система плоских анизотропных слоев (пластинок или ламелл), каждый из которых образован плотно упакованными длинными цилиндрами (фибриллами), оптические оси которых ориентированы по спирали. Такая волокнис- то-слоистая структура роговицы отвечает за линейный и круговой дихроизм и его зависимость от угла между пластинками [237].
5 Тучин

130Гл. 2. Распространение света в биологических тканях
2.5.2.Описание поляризованного излучения. Слабо рассеивающие биоткани. До сих пор мы игнорировали векторный характер излучения, распространяющегося в рассеивающих средах, таких как биоткани, поскольку считали, что в силу случайного характера неоднородных сред происходит быстрая деполяризация света при его распространении в среде. Однако в ряде случаев (неплотные биоткани, такие как ткани глаза; монослои клеток; поверхностные слои тка-
ни, например кожи, и т. п.) степень поляризации прошедшего или отраженного света оказывается вполне измеряемой. При этом информативными параметрами, характеризующими структуру биотканей и ансамблей клеток, являются как степень деполяризации первоначально поляризованного света, характер преобразования поляризации из одного вида в другой, так и появление поляризованного компонента в рассеянном свете при облучении объекта неполяризованным излучением [3, 12, 13, 19, 27, 30–35, 41, 164, 171, 431, 571, 572, 666–680].
Рассмотрим преобразование состояния поляризации любого типа (линейной, круговой или эллиптической) в рассеивающей среде с типичными для биотканей параметрами. Для этого проанализируем взаимодействие монохроматической плоской волны с изолированным рассеивателем [76, 217, 358, 676]. Состояние поляризации
рассеянного света описывается вектором Стокса: |
|
|
Is = M · Ii, |
(2.53) |
|
где M — 4 × 4-матрица рассеяния (или матрица Мюллера); Ii |
— вектор Стокса |
|
падающего излучения. |
|
|
Вектор Стокса определяется как |
|
|
I |
|
|
Q |
|
|
V |
(2.54) |
|
I = U |
, |
|
|
|
|
где |
|
|
I, Q = hExEx ± Ey Ey i, |
(2.55) |
|
U , V = hExEy ± Ey Exi |
|
|
Ex и Ey — ортогональные компоненты вектора электрического поля, h i скобки означают усреднение по времени.
В результате рассеяния на частице свет в общем случае становится эллиптически поляризованным. Для сферически симметричных частиц из оптически неактивного материала
|
|
M11 |
M12 |
|
|
0 |
|
0 |
. |
|
|
M = |
M12 |
M11 |
|
|
0 |
|
0 |
(2.56) |
|||
|
|
0 |
0 |
|
M33 |
M34 |
|
|
|||
|
|
0 |
0 |
|
|
M |
34 |
M |
33 |
|
|
|
|
|
|
− |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Элементы матрицы рассеяния света |
(МРС) |
|
зависят от угла рассеяния |
, длины |
|||||||
|
|
|
|
|
|
|
|
|
|
|
ϑ |
волны, геометрических и оптических параметров рассеивателей.
Степень линейной поляризации рассеянного света через параметры Стокса опре-
деляется как |
|
PL = Qs/Is, |
(2.57) |
а круговой как |
(2.58) |
PC = M33/M11. |
2.5. Взаимодействие поляризованного излучения с биологическими объектами |
131 |
Для ансамбля взаимодействующих частиц в приближении однократного рассеяния [5, 27] элементы МРС имеют вид
Mij (ϑ) = Mij0 (ϑ)N F (ϑ), |
(2.59) |
где Mij0 — элементы МРС изолированной частицы; N — число рассеивателей; F (ϑ) — интерференционный член, учитывающий пространственную корреляцию частиц.
Отметим, что нормированные элементы МРС (Mij /M11) не зависят от учета пространственной корреляции рассеивателей и совпадают с элементами МРС для изолированных частиц (предполагается монодисперсная система частиц).
2.5.3. Сильно рассеивающие биоткани. Состояние поляризации многократно рассеянного света анализируется либо в условиях пространственной диффузии фотонов, когда угловой спектр излучения практически изотропен [448, 674, 676, 677], либо при малоугловом рассеянии в средах с крупномасштабными неоднородностями [171, 671, 674, 678].
Следуя [171], отметим, что анализ состояния поляризации при малоугловом многократном рассеянии важен для многих задач из оптической диагностики биологических сред, которые могут быть представлены в виде случайных систем с дальнодействующими корреляциями флуктуаций диэлектрической проницаемости, которые показывают когерентные эффекты рассеяния [172, 173] или от которых следует ожидать флуктуации поляризации рассеянного света как от неупорядоченных сред
скрупномасштабными неоднородностями [680].
Впрактическом плане ожидается, что поляризационные методы должны привести к более простым, по сравнению с временными и фазово-частотными, методам и схемам оптической медицинской томографии, а также дать новую информацию о структуре биотканей [27, 658, 659, 666, 668–673, 675, 681].
Рассмотрим сначала распространение линейно поляризованного излучения в биотканях и модельных средах. Одно из первых исследований степени деполяризации
лазерного излучения при распространении в различных биотканях представлено в [667]. Измерялось отношение интенсивности компонентов прошедшего слой биоткани света, поляризованного параллельно плоскости поляризации падающего излучения (Ik) и перпендикулярно ей (I ). Измерения проводились в узком телесном
угле ( 10−4 ср) в направлении падающего света на длинах волн аргонового (476, 488 и 514 нм) и гелий-неонового (633 нм) лазеров при диаметре пучка порядка 1 мм. Излучение считалось деполяризованным, когда Ik/I = 2. В зависимости
от толщины образца ткани и ее типа это отношение изменялось от 300 до 1. Длина пути света в ткани lp, на которой происходит деполяризация света (Ik/I = 2),
является характеристикой ткани. Оказалось (рис. 2.14), например, что значения lp сильно различаются для белого вещества мозга и ткани его корковой области и составляют 0,19 и 1,0 мм (476–514 нм) и 0,23 и 1,3 мм (633 нм) соответственно. Дерма кожи человека (без крови) имеет длину деполяризации lp = 0,43 мм (476–514 нм) и 0,46 мм (633 нм).
Длина деполяризации уменьшается при патологическом изменении ткани стенки аорты: lp = 0,54 мм (норма), 0,39 мм (стадия известкования) и 0,33 мм (стадия некротической язвы), λ = 476–514 нм. Цельная кровь с низким гематокритом имеет значительную длину деполяризации на λ = 633 нм, lp = 4,0 мм.
Очевидно, что длина деполяризации должна быть близка к средней транспортной длине пробега фотона ltr (см. (2.10)), так как она характеризует расстояние, на котором направление рассеянного света становится полностью случайным, а следовательно случайной становится и плоскость поляризации линейно поляризованного света [666, 669]. Поскольку ltr определяется значением редуцированного коэффициента
5*
