
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
142 Гл. 2. Распространение света в биологических тканях
мости для M11, M22, M33, M21 в большей степени зависят от формы рассеивателей, чем от их концентрации. Показана возможность определения показателя преломления эритроцитов на основе измерений величины элемента M12 для углов рассеяния ϑ ≈ 140–160◦. В [572] показана высокая чувствительность угловых зависимостей элементов МРС M11 и M12 к степени агрегированности эритроцитов в плазме крови.
Техника измерений МРС была также использована для исследований образования комплексов липосом с капсульным антигеном чумного микроба. Измерения показали, что для исходной суспензии липосом рассеиватели обладают оптической активностью, что подтверждается неравенством нормированных элементов M44 и M33, отличием от нуля элементов M23 (M32) и M13 (M31) при достаточно точном выполнении равенств M23 = −M32 и M13 = −M31. В предположении монодисперсности систем рассеивателей с диаметром 0,03 мкм показатели преломления для лево- и право-циркулярно поляризованных волн следующие: nL = 1,39 и nR = 1,41. В то же время оптическая активность липосом возрастает при взаимодействии с антигеном чумного микроба (образование комплексов), измерения дают nL = 1,38 и nR = 1,42. Предложено использовать разницу в величинах элементов M33 и M44 для ϑ 6 90◦ в качестве оценки процентного содержания антигена в липосомах [10].
Применения измерений МРС для исследований суспензий различных частиц, включая спиральные головки сперматозоидов, несколько видов бактерий, описаны в [76, 358]. Регистрация элементов МРС перспективна и для более эффективного дифференцирования клеток крови в пролетной цитометрии [358, 359]. Эти измерения не так просты, поскольку амплитуды информативных элемен-
|
|
|
|
|
|
|
|
|
тов матрицы, таких как M34, малы из-за случайной ориента- |
|
|
|
|
|
|
|
|
|
|
ции рассеивателей в прозрачных растворах. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Угловые зависимости нормированного элемента M34 для |
|
|
|
|
|
|
|
|
|
|
различных бактерий представляют собой осциллирующие |
|
|
|
|
|
|
|
|
|
|
функции (подобные представленным на рис. 2.25), положе- |
|
|
|
|
|
|
|
|
|
|
ние максимумов которых очень чувствительно к изменени- |
|
|
|
|
|
|
|
|
|
|
ям размеров бактерий, что позволяет следить за их ростом |
|
|
|
|
|
|
|
|
|
|
[165, 701, 702]. |
|
|
|
|
|
|
|
|
|
|
Помимо угловых зависимостей для биотканей характер- |
|
|
|
|
|
|
|
|
|
|
ными являются спектральные и пространственные зависимо- |
|
|
|
|
|
|
|
|
|
|
сти поляризационной анизотропии и оптической активности. |
|
|
|
|
|
|
|
|
|
|
Например, для роговицы глаза поляризационные характери- |
|
|
|
|
|
|
|
|
|
|
стики соответствуют неидеальной фазовой пластинке и в зна- |
|
|
|
|
|
|
|
|
|
|
чительной мере зависят от координаты [5]. В центре рого- |
|
|
|
|
|
|
|
|
|
|
вица близка к изотропной среде, а на краях ее анизотропия |
|
Рис. 2.26. Зависимость |
максимальна и возрастает с уменьшением длины волны (см. |
|||||||||
видности интерферен- |
рис. 2.18). В результате в зависимости от азимута колебаний |
|||||||||
ционной картины υ от |
линейно поляризованного излучения пропускание роговицы |
|||||||||
толщины прозрачного |
в видимой области изменяется в пределах от 10 до 25 % при |
|||||||||
(1) и мутного (ядер- |
уменьшении длины волны от 700 до 400 нм. Зубные ткани |
|||||||||
ная катаракта) (2) хру- |
||||||||||
также обладают поляризационной анизотропией [191, 192]. |
||||||||||
сталиков глаза челове- |
||||||||||
Дифракционные и интерференционные явления достаточ- |
||||||||||
ка. Измерения выпол- |
||||||||||
но широко используются в лазерной диагностике биотканей |
||||||||||
нены для постоянного |
||||||||||
[1, 5, 175, 181–183, 703], поэтому важно знать влияние |
||||||||||
расстояния между ин- |
||||||||||
оптической неоднородности и упорядоченности биотканей на |
||||||||||
терферирующими пуч- |
||||||||||
ками (Не–Nе-лазер с |
формирование картин дифракции и интерференции, образую- |
|||||||||
λ = 632,8 нм) [703] |
щихся при когерентном лазерном облучении. В качестве при- |
|||||||||
|
|
|
|
|
|
|
|
|
мера на рис. 2.26 показаны зависимости видности интерфе- |
|
2.7. Особенности взаимодействия лазерного излучения с биотканями |
143 |
ренционной картины, υ = (Imax − Imin)/(Imax + Imin), образованной двумя когерентными точечными источниками, находящимися в рассеивающей среде, от толщины среды и степени ее мутности. Значительное снижение видности интерференционной картины, обусловленное вкладом рассеянного излучения, затрудняет применение лазерных интерферометров при диагностике ретинальной остроты зрения в условиях сплошной мутности хрусталика или при измерении скорости движения биочастиц в рассеивающей среде.
Прямое отношение к оптическим моделям тканей глаза имеет работа [704], в которой исследуется угловая структура излучения, рассеянного дисперсным слоем
свысокой концентрацией оптически мягких частиц.
2.7.Особенности взаимодействия лазерного излучения
сбиотканями
2.7.1.Введение. В дополнение к уже отмеченным выше свойствам лазерного излучения, которые показали некоторые важные особенности взаимодействия излучения с биологическими тканями и клетками, например возможность получения коротких и сверхкоротких импульсов света или заданного состояния поляризации, обсудим те из них, которые связаны, в основном, с когерентностью лазерного излучения. Когерентность излучения важна для многих биомедицинских приложений, связанных с возможностью бесконтактных неинвазивных измерений и получения изображений, например скорости кровотока и лимфотока в сосудах и микроциркуляции крови в тканях. К ним относятся спекл-корреляционные методы анализа рассеянного когерентного света от движущихся клеток или компонентов ткани, интерферометрия лазерных спекл-полей, интерферометрия с использованием источников излучения
смалой степенью временной когерентности, цифровая голографическая и фазовая микроскопия, а также методы на основе нелинейных преобразований когерентного излучения в биотканях (например, генерация второй гармоники) или преобразований лазерного излучения на нелинейных кристаллах для получения терагерцового излучения, которое, в свою очередь, тоже используется для спектроскопии и томографии биотканей.
Кратко остановимся на идеях, используемых в когерентной и конфокальной томографии и микроскопии. В когерентной томографии биотканей на сегодняшний день наиболее широко обсуждаются два подхода. Первый по своей сути очень близок к импульсной томографии, так как также основан на регистрации прямопрошедших фотонов. Однако селекция этих фотонов осуществляется за счет сохранения ими когерентности по отношению к падающему пучку путем оптического гетеродинирования (интерференции), поэтому метод может регистрировать томограммы сравнительно протяженных (1–2 см) объектов и в непрерывном режиме [393–397]. Второй подход основан на селекции обратно рассеянных (отраженных) фотонов локальными неоднородностями биоткани за счет использования интерферометров
снизкокогерентными источниками света (суперлюминесцентные светодиоды, фемтосекундные лазерные системы), однако их пространственная когерентность является высокой, что позволяет использовать одномодовые волоконно-оптические интерферометры [12, 16, 19, 21, 27, 29, 33, 106, 111–113, 116, 117, 125, 183, 432–438]. Такие томографы имеют рекордное пространственное разрешение, порядка 5–15 мкм, при низком уровне шумов и широком динамическом диапазоне, порядка 90–100 дБ. Область их применения — это тонкие (1–2 мм) сравнительно прозрачные ткани: кожа, ткани глаза (роговица, хрусталик, ретина и пр.), слизистые оболочки и т. п.
Сканирующая конфокальная микроскопия, использующая конфокальный принцип для селекции пришедших от заданного объема рассеянных фотонов (две оптически
144 |
Гл. 2. Распространение света в биологических тканях |
сопряженные диафрагмы малых размеров в плоскости предметов и изображений), является основой развития одного из направлений в оптической томографии биотканей и клеток с субклеточным разрешением [1, 12, 13, 15, 19, 175, 439–446, 707]. Именно для конфокальной микроскопии в последнее время появились значительные результаты по 3D-визуализации живой ткани, в частности кожи, с разрешением, позволяющим распознавать различные типы клеток, а также одновременно наблюдать движущиеся клетки крови в микрососудах [442, 443]. Реализована также конфокальная томография твердых тканей зуба [444]. Однако конфокальные сканирующие микроскопы, используемые для получения томограмм биотканей, — это сравнительно дорогостоящие устройства, требующие принятия мер по защите от вибраций и высокого уровня компьютеризации. Отметим, что низкокогерентные томографы кроме принципа селекции «когерентных» фотонов используют одновременно конфокальный принцип, поэтому контраст изображения оказывается значительным даже при измерениях in vivo, кроме того они могут быть компактными, сравнительно недорогими устройствами. Сравнение двух методик визуализации — гетеродинной и конфокальной — дано в работе [446].
Для визуализации клеток и клеточных структур широко применяются голографическая интерферометрия [396–399, 708–713] и фазовая интерференционная микроскопия [714–718]. Эти методы используют высокостабильные лазеры и обеспечивают субклеточное разрешение вплоть до нанометров.
Приведенные в разделе 2.5 данные свидетельствуют о перспективности поляризационных методов для оптической томографии биотканей [12, 27, 652, 655–673, 675, 681, 683, 684, 700, 705, 706]. Получены, например, вполне обнадеживающие результаты по визуализации структуры зрительного нерва, что очень важно в ранней диагностике глаукомы [700].
Развитие нелинейной микроскопии и томографии, основанных на генерации гармоник и многофотонной флуоресценции в клеточных структурах при воздействии на них излучения фемтосекундного лазера ближнего инфракрасного диапазона, привело к революционным изменениям в технологии визуализации живых клеток, поскольку стал возможным, без применения каких бы то ни было специальных маркеров, продолжительный неразрушающий мониторинг живых клеток и тканей в их естественных физиологических условиях [15, 20, 260–269, 719–739]. В настоящее время оптическая биопсия с использованием нелинейной микроскопии дает зачастую гораздо лучшие изображения, чем гистологические срезы, сделанные при стандартной биопсии [738]. Важно, что повышая на три порядка интенсивность в импульсе фемтосекундного лазера в нелинейном микроскопе, его уже можно использовать как прецизионный наноразмерный оптический скальпель для проведения тонких операций на клетке без повреждений окружающих структур. Это так называемая тераностика (терапия/диагностика), когда в рамках одной технологии сначала проводится диагностика (нахождение патологии при использовании излучения лазера меньшей интенсивности), а затем путем простого повышения интенсивности импульса того же лазера производится воздействие, например разрезание митохондрии или хромосомы [737]. Такая процедура может быть использована для оптической чистки клеточных кластеров [739] и оптической трансфекции клеток (см. табл. 1.10 [424]).
2.7.2. Формирование спеклов и интерферометрия рассеивающих сред. Статические и динамические спекл-структуры (поля) формируются в результате интерференции большого числа элементарных волн со случайными фазами, возникающими при отражении когерентного света от неподвижной или движущейся шероховатой поверхности биоткани или при его прохождении через рассеивающую свет биоткань, в том числе и с движущимися рассеивателями, например клетками крови или
2.7. Особенности взаимодействия лазерного излучения с биотканями |
145 |
лимфы [12, 13, 19, 27, 31, 78, 104, 105, 114, 128, 176, 181, 182, 400, 403–408, 430, 431, 577, 672, 673, 739–756]. Спеклы (по-русски, пятна) представляет собой результат трехмерной интерференции в каждой точке пространства, где встречаются прошедшие или отраженные от оптических неоднородностей волны. В общем случае существует два типа спеклов: субъективные спеклы, которые получаются в пространстве изображений оптической системы (включая глаз), и объективные спеклы, которые формируются в свободном пространстве и обычно наблюдаются на экране (ПЗС-матрице), расположенном на некотором расстоянии от объекта. Поскольку практически все биоткани, включая даже такие прозрачные как роговица глаза, оптически неоднородны (см. раздел 2.6), то освещение их когерентным светом всегда вызывает появление спекл-структур (рис. 2.27, цветная вклейка), которые либо искажают результаты измерений и, следовательно, должны быть устранены, либо несут новую информацию о структуре и движении ткани и ее компонентов, и тогда могут быть использованы в биомедицинской диагностике.
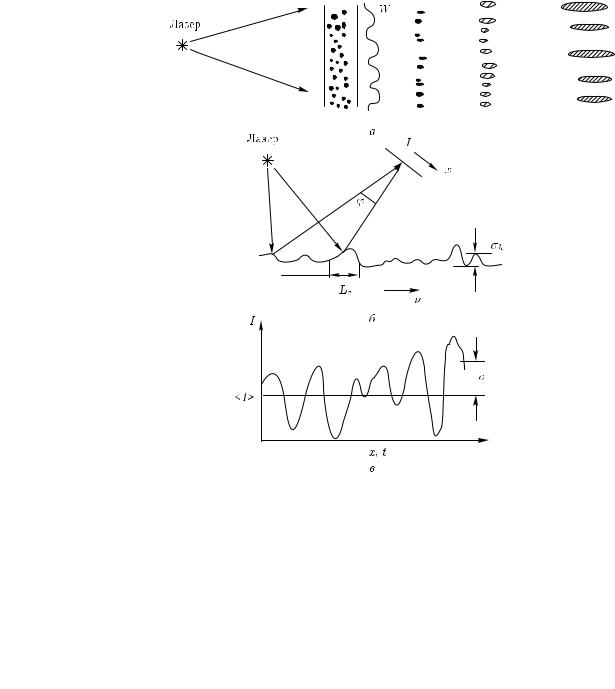
Рис. 2.28. Формирование и распространение спеклов (а), наблюдение спеклов (б) и модуляция интенсивности (в); W — рассеянная волна [12]
146 |
Гл. 2. Распространение света в биологических тканях |
Принципы формирования и распространения спекл-полей, формируемых при взаимодействии когерентного света с оптически неоднородной средой, схематически иллюстрирует рис. 2.28. Средний размер спеклов в дальней зоне поля оценивается как dav λ/ϕ, где λ — длина волны, а ϕ — угол наблюдения. Смещение точки наблюдения по экрану (x) или сканирование лазерного пучка по объекту с некоторой скоростью v (или эквивалентное движение самого объекта относительно лазерного пучка), при котором точка наблюдения остается неподвижной, приводит к возникновению пространственных или временных флуктуаций интенсивности рассеянного поля. Эти флуктуации характеризуются средним значением интенсивности hIi и стандартным отклонением σI (см. рис. 2.28, б). Сам объект характеризуется стандартным отклонением σh высоты неоднородностей и длиной корреляции Lc этих неоднородностей.
Поскольку многие биоткани и клетки являются фазовыми объектами [105, 176], то распространение когерентных пучков в них можно описывать в рамках модели случайного фазового экрана (СФЭ) [174]. Амплитудный коэффициент пропускания СФЭ дается выражением
ts(x, y) = t0 exp{−iΦ(x, y)}, |
(2.71) |
где t0 — не зависящее от координат амплитудное пропускание; Φ(x, y) — случайный фазовый сдвиг, вносимый СФЭ в точке (x, y) за счет вариаций показателя преломления n(x, y) или толщины СФЭ h(x, y). Для тонких пропускающих и отражающих СФЭ фазовые сдвиги определяются, соответственно, следующими соотношениями:
Φ(x, y) = |
2π |
[n(x, y) − 1]h(x, y), |
(2.72) |
||
λ |
|||||
Φ(x, y) = |
4π |
h(x, y). |
(2.73) |
||
|
|||||
|
|
|
λ |
|
|
Фазовые флуктуации рассеянного поля характеризуются стандартным отклонением σϕ и длиной корреляции Lϕ. Два предельных типа СФЭ — это слабо рассеиваю-
щие СФЭ (σϕ2 1) и глубокие СФЭ (σϕ2 1).
При описании статистических свойств спеклов в зависимости от решаемых задач можно использовать статистику первого или второго порядка. Статистика первого порядка описывает свойства спекл-полей в каждой точке. Такое описание обычно использует функцию распределения вероятности (ФРВ) интенсивности p(I) и контраст
VI = |
σI |
, |
(2.74) |
|
hIi |
||||
|
|
|
где σI2 = hI2i − hIi2, а hIi и σI2 — средняя интенсивность и дисперсия флуктуаций интенсивности соответственно.
Для идеальных условий, когда комплексная амплитуда рассеянного света имеет гауссову статистику, контраст VI = 1 (развитые спеклы), и ФРВ интенсивности есть экспонента с отрицательным показателем [758]:
p(I) = |
1 |
exp − |
I |
. |
(2.75) |
hIi |
hIi |
В соответствие с этим распределением наиболее вероятное значение интенсивности спеклов равно нулю, т. е. деструктивная интерференция происходит с большей вероятностью.
ФРВ интенсивности, описываемая выражением (2.75), соответствует интерференции поляризованного света, когда поляризация спеклов сохраняется неизменной и соответствует поляризации падающего света, т. е. объект не деполяризует рассеянный свет [13]. Материалы, в которые свет мало проникает и рассеяние происходит
2.7. Особенности взаимодействия лазерного излучения с биотканями |
147 |
восновном с поверхности или преобладает однократное рассеяние в объемной среде,
вобщем случае создают спекл-поля с распределением интенсивности, соответствующим (2.75). С другой стороны, в средах с многократным рассеянием, что характерно
для многих биологических тканей, интерферирующий свет деполяризуется [27]. В условиях многократного рассеяния спекл-поля могут иметь ФРВ интенсивности, существенно отличающуюся от формы (2.75) и обычно представляемую в терминах некогерентной комбинации двух спекл-полей [13]:
|
I |
2 |
|
|
|
p(I) = 4 |
|
exp − |
I |
. |
(2.76) |
hIi2 |
hIi |
||||
Действие спекл-интерферометров основано на интерференции двух спекл-по- лей [19]. Спеклы могут интерферировать как когерентно, так и некогерентно. В случае когерентной комбинации статистические свойства результирующего третьего спекл-поля остаются принципиально теми же, что и у двух исходных полей,
ив типичном случае описываются выражением (2.75). Однако при описании ФРВ интенсивности спекл-полей от большинства биологических тканей более подходящим оказывается соотношение (2.76). Причина состоит в следующем: когерентный свет, рассеянный тканью, создает случайным образом поляризованные спекл-структуры,
илюбые две ортогонально поляризованные компоненты рассеянного света некогерентны друг другу. Таким образом поляризованные случайным образом отдельные спекл-структуры можно рассматривать как некогерентную комбинацию двух или более спекл-структур.
Частично развитые спекл-поля характеризуются контрастом VI < 1. Контраст может быть ниже единицы по следующим причинам:
1) если к спекл-полю добавляется однородный когерентный фон, например, в случае слабой неоднородности сильная зеркальная (нерассеянная) компонента когерентного пучка интерферирует со спекл-полем, очевидно, что
в предельном случае однородной среды спеклы исчезают, VI = 0;
2)если появляется однородный некогерентный фон (например, из-за снижения когерентности источника света или многократного рассеяния в среде).
Для гауссовой статистики и гауссовой корреляционной функции фазовых флуктуаций распространение интенсивности спекл-поля в свободном пространстве вдоль оси z за СФЭ описывается выражением [174]
|
|
|
|
σ2 |
1 |
|
|
|
||
|
|
|
|
σI2(z) = |
ϕ |
1 + |
|
, |
(2.77) |
|
|
|
|
|
2 |
1 + D2 |
|||||
где D = zλ/πLϕ2 |
— волновой параметр. Для слабо рассеивающего СФЭ (σϕ2 |
|
1) |
|||||||
|
|
|
|
|
|
|
2 |
|
||
контраст спекл-поля (2.74) всегда меньше единицы. Для глубокого СФЭ (σϕ 1) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
контраст достигает своего максимума в зоне дифракции Френеля (D = 1), когда |
||||||||||
z |
= (2π/λ)(L2 |
/σ |
ϕ |
), V > 1. Тот факт, что контраст выше единицы означает, что |
||||||
max |
ϕ |
|
|
|
|
|
|
|
|
|
темные области доминируют в спекл-структуре. Появление максимума флуктуаций
интенсивности объясняется фокусировкой рассеянных волн за СФЭ [13, 19, 400]. В зоне дифракции Фраунгофера имеем VI → 1.
Статистика второго порядка показывает, насколько быстро меняется интенсивность от точки к точке пространства и времени, т. е. она характеризует размер и распределение размеров спеклов в структуре или временные´ флуктуации интенсивности для динамических спеклов от движущихся неоднородностей. Статистика второго порядка обычно описывается с помощью автокорреляционной функции флуктуаций интенсивности
g2(Δξ) = hI(ξ + ξ)I(ξ)i |
(2.78) |
148 |
Гл. 2. Распространение света в биологических тканях |
и ее фурье-образа, представляющего спектр мощности случайного процесса, ξ ≡ x или t — пространственная или временная переменная; ξ — ее изменение; угловые скобки hi означают усреднение по ансамблю или по времени.
В общем случае из-за значительного вклада объемного рассеяния при отражении или прохождении лазерного излучения через биоткань формируются частично развитые спекл-поля со сравнительно малым размером спеклов, контрастом, отличным от единицы, и случайной поляризацией света в отдельных спеклах. Все это делает описание сигнала двулучевого спекл-интерферометра, в котором в одном из плеч находится исследуемый объект, довольно сложным. Тем не менее, главные черты интерференции такого интерферометра можно выявить при анализе простейшего случая, когда спекл-поля сохраняют линейную поляризацию. Распределение интенсивности на выходе такого двухлучевого интерферометра спекл-интерферометра можно записать в виде [407, 759]
I(r, t) = Ir(r) + Is(r)+
+ 2[Ir(r)Is(r)]1/2|γ11(Δt)| cos{ΔΦI (r) + ΔΨI (r) + ΔΦI (t)}, (2.79)
где Ir(r) и Is(r) — распределения интенсивности опорного и сигнального поля, соответственно; r — поперечная пространственная координата; γ11(Δt) — степень временн´ой когерентности света; ΔΨI (r) — детерминированная разность фаз интерферирующих волн; ΔΦI (r) = ΦIr(r) − ΦIs(r) — случайная разность фаз; а ΔΦI (t) — зависящая от времени разность фаз, связанная с движением объекта. В частности, для продольных гармонических колебаний одного из зеркал (объекта) с амплитудой
l0 и частотой Ωv, ΔΦI (t) = (4π/λ)l0 sin(Ωvt).
При отсутствии спекл-модуляции детерминированная разность фаз ΔΨI (r) отвечает за формированием регулярных интерференционных полос. Выходной сигнал спекл-интерферометра максимален, когда интерферирующие поля согласованы по фазе (ΔΨI (r) = const в пределах апертуры приемника), при этом используются сфокусированные лазерные пучки (поскольку формируются спеклы максимального размера) и приемник интерференционного сигнала с максимально возможной площадью. Для фотоприемника большой апертуры, который в основном усредняет амплитудно-фазовые пространственные вариации интерференционного поля, глубина модуляции фотоэлектрического сигнала интерферометра с фокусированными пучками описывается следующими простыми соотношениями [759]:
|
|
sin(u) |
|
|
z |
|
|
β = |
|
u |
, |
u = π(NA)2 |
λ |
, |
(2.80) |
|
|
|
|
|
|
|
|
где (NA) — числовая апертура объектива в объектном плече спекл-интерферометра, z — продольное смещение объекта.
Пространственно-модулированные лазерные пучки, полученные путем регулярной интерференции, довольно широко используются в биомедицинских исследованиях, например в лазерной анемометрии биологических жидкостей, цитометрии, в исследованиях седиментации крови, ретинометрии [5, 12, 13, 19, 388, 760–763]. Одни методы используют малые расстояния между интерференционными полосами, ΛI = λ/2ϑI (ϑI — угол между волновыми векторами интерферирующих полей), которые сравнимы с размерами неоднородностей рассеивающего объекта. В этом случае удается, например, измерить скорость клетки, пролетающей пространственно-моду- лированный пучок, поскольку пространственная модуляция света дает возможность зафиксировать координату клетки при пересечении интерференционных полос.
С другой стороны, использование модулированных пучков с большими расстояниями между полосами интерференции, существенно превосходящими размеры неод-
2.7. Особенности взаимодействия лазерного излучения с биотканями |
149 |
нородностей, приводит к проявлению новых корреляционных эффектов в рассеянном поле [12, 13, 19, 760–763]. Интерференционные полосы средней интенсивности, возникающие в этом случае, имеют контраст VI (z), меняющийся вдоль оси распространения света z за счет эффекта пространственной фильтрации рассеянного излучения. Если диаметр пучка и расстояние между полосами достаточно велики, полосы модулируют спекл-поле и эволюция контраста полос средней интенсивности вдоль оси z определяется статистическими параметрами объекта и расстоянием между полосами.
Интерференционные полосы средней интенсивности регистрируются фотоприемником со щелью, ориентированной вдоль полос. Широкая апертура используется для усреднения спекл-модуляции рассеянного поля. Глубина модуляции фотоэлектрического сигнала равна относительному контрасту интерференционных полос [760–762]:
|
VI (z) |
= |µ(z)|, |
(2.81) |
|
VI0 |
||
где VI (z) — контраст полос средней интенсивности, VI0 — контраст в исходном ла- |
|||
зерном пучке, а |µ(z)| — модуль коэффициента поперечной корреляции комплексной амплитуды рассеянного поля.
В биомедицинских приложениях находит применение схема со сфокусированными пучками, когда пространственно-модулированный пучок света фокусируется с помощью дифракционно-ограниченной оптической системы с апертурой D > ΛI (рис. 2.29, цветная вклейка). В этом случае в области фокусировки формируется два пространственно разделенных световых пятна. Поскольку освещаются две различные области объекта, взаимодействие указанных световых пятен с рассеивающей средой порождает две совершенно разные (некоррелированные) спекл-составляющие дифракционного поля. Если расстояние между интерференционными полосами удовлетворяет неравенству ΛI < dav (средний размер спеклов в плоскости наблюдения), то диаметр перетяжки пучка удовлетворяет неравенству 2w0 > Lϕ. В такой ситуации в пределах каждого спекла наблюдаются регулярные интерференционные полосы, ориентированные случайным образом от спекла к спеклу. Контраст полос зависит в этом случае только от соотношения между интенсивностями интерферирующих
полей и не зависит от статистических свойств объекта. Если ΛI |
> dav и 2w0 > Lϕ, |
в рассеянном поле полосы не видны (или сильно искажены |
за счет рассеяния |
на неоднородностях) (рис. 2.29, в). Однако, когда объект (или пучок света) движется в поперечном направлении, появляется набор полос средней интенсивности (см. рис. 2.29, г). Контраст этой картины определяется статистическими свойствами объекта.
Метод спеклов для изучения случайных фазовых объектов с использованием пространственно модулированного пучка дает возможность определять такие статистические параметры объекта, как стандартное отклонение σϕ и длина корреляции Lϕ фазовых флуктуаций [12, 13, 19, 760–763]. Этот метод можно использовать для изучения тонких слоев эпидермиса человека, более толстых прозрачных биотканей переднего сегмента глаза человека (роговицы и хрусталика) и склеры в процессе оптического просветления (увеличенной прозрачности) в условиях механических и осмотических напряжений [12, 19, 22, 761–763].
Например, клинические испытания на 238 пациентах показали хорошие возможности метода при исследовании ретинальной остроты зрения при наличии у пациентов катаракты разной степени тяжести (мутности), что позволило надежно прогнозировать результат хирургического вмешательства при операциях на хрусталике [763]. Поскольку интерференционная картина усредняется при сканировании сфокусированного лазерного пучка, то даже пациенты с мутным (катаракта) хрусталиком

150 |
Гл. 2. Распространение света в биологических тканях |
могут видеть интерференционные полосы (см. рис. 2.29, б–г), что дает возможность определять остроту зрения отдельно ретины даже при наличии помутнений хрусталика.
2.7.3. Динамическое рассеяние света
2.7.3.1. Квазиупругое рассеяние света, принципы доплеровской спектроскопии.
Рассеяние света от подвижных объектов называется динамическим рассеянием, в отличие от рассеяния от неподвижных объектов, которое называется статическим или упругим, поскольку происходит без изменения энергии. Напротив, при рассеянии на подвижном объекте происходит, хотя и небольшое, но заметное изменение энергии, поэтому динамическое рассеяние часто называют квазиупругим рассеянием. В основе квазиупругого рассеяния лежит эффект Доплера, который и определяет сдвиг частоты рассеянного света в соответствии с известным соотношением [577]
νD = (νs − ν0) = ν0 |
υ |
(cos ϑi − cos ϑs), |
(2.82) |
c |
где νs — частота рассеянной волны, ν0 — частота падающей волны, υ — скорость движения рассеивателя, c — скорость света, ϑi — угол между вектором падающего на объект излучения и направлением движения объекта, ϑs — угол между направлением движения объекта и наблюдением рассеянного излучения.
Доплеровский сдвиг пропорционален скорости рассеивающей свет частицы. Измерение этого сдвига и соответствующих углов ϑi и ϑs позволяет определять скорость движения частицы или потока частиц. В этом заключается идея доплеровских измерителей скорости. Однако во многих случаях, в том числе и для живых объектов, имеет место набор скоростей движения частиц и их направлений. Поэтому при измерениях определяется не одна частота, а спектр доплеровских частот, по которому можно, в принципе, восстановить распределение частиц по скоростям и направлениям движения. Такие измерения уже называются доплеровской спектроскопией или спектроскопией квазиупругого рассеяния, или фотонно-корреляционной спектроскопией, что отражает фундаментальную связь между спектром флуктуаций интенсивности и автокорреляционной функцией случайного процесса, обусловленного доплеровскими сигналами от многих рассеивателей [5, 12, 13, 19, 577, 764].
На практике доплеровский сдвиг частоты для сравнительно малых скоростей микрoциркуляции крови не может быть измерен непосредственно, поскольку он очень мал по сравнению с частотой света. Например, для типичной скорости кровотока в 1 см/с сдвиг частоты не превышает 100 кГц. Традиционные спектральные методы не могут обеспечить такие измерения. Однако в случае использования лазеров и техники оптического смешения (гетеродинирования или самобиений) это возможно. Поскольку ток фотодетектора пропорционален интенсивности, то оптическое смешение на приемнике компонентов электрического поля рассеянного света может быть описано с помощью автокорреляционной функции интенсивности, которая в случае гауссовой статистики связана с автокорреляционной функцией первого порядка формулой Зигерта:
g2(τ ) = hI(t)I(t + τ )i = A{1 + βsb|g1(τ )|2}, |
(2.83) |
где τ — время задержки, A = hii2 — квадрат среднего значения фототока или базовая |
|
линия автокорреляционной функции, βsb — параметр эффективности самобиений, |
|||
βsb ≈ 1, а |
g (τ ) = |
hE(t)E (t + τ )i |
(2.84) |
|
|||
|
1 |
h|E(t)|2i |
|
— нормированная автокорреляционная функция оптического поля.

2.7. Особенности взаимодействия лазерного излучения с биотканями |
151 |
Для монодисперсной системы броуновских частиц имеем |
|
g1(τ ) = exp(− Tτ ), |
(2.85) |
где T = q2DT — параметр релаксации, DT = kBT /6πηrh — коэффициент трансляционной диффузии, kB — постоянная Больцмана, T — абсолютная температура, η — абсолютная вязкость среды, а rh — гидродинамический радиус частицы. Многие биологические системы характеризуются бимодальным распределением коэффициента диффузии, когда быструю диффузию (DTf) можно отделить от медленной диффузии (DTs), связанной, например, с агрегацией частиц [5, 764].
Целью спектроскопии квазиупругого рассеяния является реконструкция распределения рассеивающих частиц по размерам, что необходимо для диагностики и мониторинга заболеваний. Реализация режима однократного рассеяния и использование источников когерентного света в этом случае имеют принципиальное значение.
2.7.3.2. Динамические спеклы, спекл-корреляционный метод. Лазерный спеклкорреляционный метод основан на исследовании пространственно-временных свойств динамических спекл-полей [12, 13, 19, 577, 758, 765–768]. Если рассеиватели движутся случайно, т. е. имеет место броуновское движение рассеивающих частиц, то формируемые при этом оптические спеклы подчиняются гауссовой статистике. В этом случае пространственно-временная корреляционная функция комплексной амплитуды рассеянного света может быть факторизована и представлена в виде произведения пространственной и временной корреляционных функций. Однако в случае рассеивающей среды, удовлетворяющей модели движущегося глубокого случайного фазового экрана (СФЭ) (σϕ2 1), пространственные и временные флуктуации не
являются независимыми [765–768].
Следуя работам [577, 765], рассмотрим пространственно-временные свойства динамических спеклов, которые формируются при рассеяние гауссова (лазерного) пучка на движущемся СФЭ. Рассеивающий объект, содержащий большое число случайным образом распределенных рассеивающих центров, движется в плоскости со скоростью v (рис. 2.30). В предположении, что флуктуации фазы подчиняются гауссовой статистике и вариации фазы рассеянного света, выраженные в масштабе оптической длины пути, много больше длины волны излучения, выражения (2.83) и (2.84) могут быть обобщены для учета пространственной корреляции. Тогда нормированная пространственно-временная корреляционная функция стационарного процесса может быть записана как [765]:
g (r, τ ) = |
|
hI1I2i |
|
= 1 + g (r, τ ) 2 |
, |
(2.86) |
|||
2 |
h |
I1 |
ih |
I2 |
i |
| 1 |
| |
|
|
|
|
|
|
|
|
|
|||
где |
|
|
|
|
|
hE1E2 i |
|
|
|
g (r, τ ) = |
|
|
|
|
|
(2.87) |
|||
1 |
|
|
(hE1E1 ihE2E2 i)1/2 |
|
|
|
|||
— пространственно-временная корреляционная функция комплексной амплитуды рассеянного поля; r = X1 − X2 (см. рис. 2.30), τ = t1 − t2.
В случае нормального падения гауссова пучка на движущийся перпендикулярно пучку СФЭ с перетяжкой пучка, расположенной на расстоянии z от плоскости экрана (рис. 2.30), радиус лазерного пучка на экране w и кривизна волнового фронта на
