
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf
52 |
Гл. 1. Основы лазерной биомедицины |
рассчитать оптимальный режим теплового повреждения ткани-мишени, при котором окружающие ткани остаются интактными.
Теория СФТ базируется на трех общих принципах:
1. Длина волны излучения должна быть выбрана исходя из обеспечения максимального контраста поглощения излучения мишенью по сравнению с окружающей тканью или конкурирующими мишенями. Например, при воздействии на волосяные фолликулы (при удалении волос или лечении акне) хромофором-мишенью является меланин в волосяном стержне и матриксе или краситель, внедренный в сальную железу [281, 282]. Конкурирующими хромофорами являются гемоглобин крови, вода и липиды, а также меланин эпидермиса. В первом приближении оптимальная длина волны может быть выбрана в соответствии со спектрами основных хромофоров биотканей, представленных на рис. 1.6–1.8. Дополнительным фактором селекции длины волны является глубина проникновения света и глубина залегания биологической мишени. Например, такая мишень, как матрикс волосяной луковицы, расположен на глубине 2–5 мм в подкожной жировой клетчатке, а стволовые клетки — на глубине около 1 мм.
2. Длительность импульса излучения должна быть выбрана исходя из обеспечения максимального контраста нагрева мишени по сравнению с окружающей тканью. Для выполнения этого условия длительность импульса излучения t должна быть меньше времени тепловой релаксации (TRT) для всей мишени. TRT — это время остывания мишени до температуры в e (= 2,7) раз меньшей той, что достигается при ее быстром адиабатическом нагреве:
2 |
|
TRT ≈ Fda1T , |
(1.53) |
где d1 — размер мишени в мм или см, aT — коэффициент термодиффузии (температуропроводности) биоткани (aT ≈ 0,1 мм2с−1 = 0,001 см2/с−1 для дермы), а F — геометрический фактор (F = 8, 16, или 24, соответственно для планарной, цилиндрической или сферической форм мишени). Действительно, если выполнено условие, что t TRT, генерируемое за счет поглощения внутри мишени тепло не уходит за пределы этой структуры и можно обеспечить локализованное тепловое действие на мишень с коагуляцией или другим видом ее повреждения. Такой подход гарантирует как селективность воздействия, так и минимальный вклад оптической энергии.
3. Плотность энергии импульса должна быть достаточной для коагуляции или абляции мишени.
Для описания более сложных и практически важных случаев, когда биологическая мишень и поглотитель (тепловой источник) пространственно разделены, была предложена модифицированная теория СФТ [280], которая учитывает теплообмен между пространственно-разделенными источником и мишенью. При этом для исключения фазовых превращений ткани и таких деструктивных процессов, как ее обесцвечивание, плавление, кипение и образование пузырьков, затрудняющих управляемый нагрев, вводится ограничение на амплитуду и длительность импульсов излучения. Итак, для предотвращения нежелательных тепловых эффектов температура источника тепла (поглотителя) не должна превышать определенной величины, T1 max, называемой температурой потерь поглощения источником тепла. Такая температура для большинства эндогенных хромофоров (например, меланина, гемоглобина и воды) превышает 100 ◦C. Одновременно, для обеспечения необратимого повреждения всей ткани мишени, температура должна превышать некоторую температуру поврежде-
ния, T2 (см. соотношение (1.52), T2 = Tcrit), в пределах всей области мишени. Для коллагена кожи человека, T2 порядка 65–75 ◦C, а для клеток T2 — около 60 ◦C при
условии, что время экспозиции составляет несколько десятков миллисекунд.
1.7. Действие лазерного излучения на биоткань |
53 |
Для обеспечения такого температурного режима лазерные импульсы должны быть достаточно длинными, чтобы вложить необходимую для нагрева энергию. Необходимо также выбором длины волны обеспечить более или менее равномерную генерацию тепла в пигментированных областях в течение импульса излучения с одновременным максимально возможным поглощением, что достижимо при условии 1 < µad1 < 3, где d1 — размер пигментированной области. Необходимо ввести такой параметр, как время теплового поражения (TDT) мишени, которое соответствует промежутку времени, в течение которого происходит необратимое повреждение ткани мишени без повреждения соседних участков ткани. Очевидно, что оптимальная длительность импульса излучения, t0, должна быть короче или равна TDT.
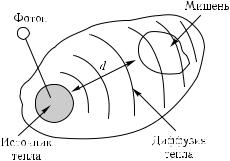
Рисунок 1.27 иллюстрирует обобщенную структуру мишени, которая повреждается за счет выделения и переноса тепла от поглотителя (источника тепла). В качестве конкретного примера моделирования передачи тепла от поглотителя к мишени на рис. 1.28 представлены расчеты для сильно пигментированного цилиндра диаметром d1 с окружающей его областью воздействия диаметром d2. Такая простая модель довольно хорошо воспроизводит модель теплового разрушения волосяного фолликула или кровеносного сосуда. Моделирование проведено для двух видов нагрева: путем использования прямоугольного импульса излучения (рис. 1.29, а) или импульса, который дает температурный импульс с плоской вершиной (рис. 1.29, г). В случае прямоугольного импульса излучения температура источника тепла нарастает в процессе импульса излучения и достигает значения T1 в конце импульса (рис. 1.29, б). В случае температурного импульса с плоской вершиной температура источника тепла постоянна в течение всего импульса излучения, что требует создания импульса лазерного излучения специальной формы (рис. 1.29, в). Для обоих видов нагрева, температура источника тепла ниже температуры T1 max, при которой меняется (уменьшается) коэффициент поглощения поглотителя.
Рис. 1.27. Общая структура биологической мишени, которая повреждается (денатурируется) за счет диффузии тепла от источника тепла; источником тепла может быть эндогенный или экзогенный хромофор (пигмент), имеющий высокий коэффициент поглощения для воздействующего лазерного излучения; сама мишень в данном случае имеет малый коэффициент поглощения; расстояние между источником тепла и мишенью равно d [148]
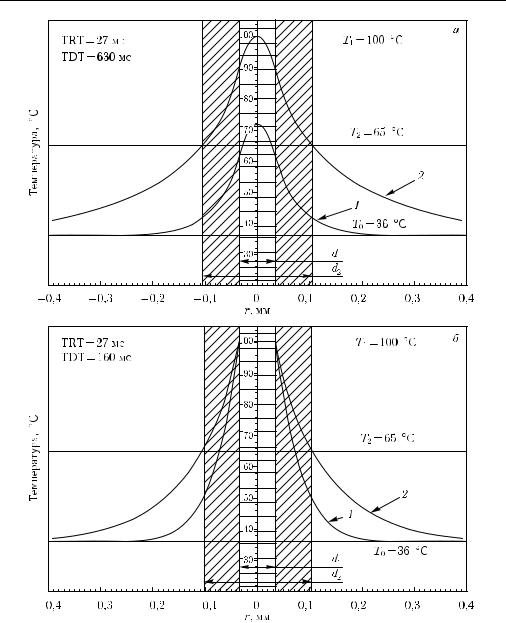
Последовательность тепловых профилей в течение процесса лазерного нагрева представлена на рис. 1.28. Входные параметры для моделирования: d1 = 70 мкм, d2 = 210 мкм, температура T1 = 100 ◦C (температура кипения воды). Температура повреждения T2 = 65 ◦C, что соответствует средней температуре денатурации белков в диапазоне длительностей импульсов порядка 10–1000 мс. Предполагалось, что излучение поглощается только источником тепла, а все компоненты ткани имеют одинаковые тепловые свойства. Диффузия тепла происходит одновременно с повыше-
54 |
Гл. 1. Основы лазерной биомедицины |
Рис. 1.28. Температурное распределение в ткани, содержащей цилиндрический поглотитель с диаметром 0,07 мм и окружающего его биологическую мишень диаметром 0,21 мм [280]: распределение температуры для прямоугольного импульса излучения для двух моментов времени, нижняя кривая для t = TRT = 27,5 мс, а верхняя — для t = TDT = 1,6 с (а); распределение температуры при возбуждении температурного импульса с плоской вершиной для двух моментов времени, нижняя кривая для t = TRT = 27,5 мс, а верхняя — для t = TDT = 0,36 с (б). Максимальная температура поглотителя T1 = 100 ◦C; температура, при которой наступают повреждения ткани T2 = 65 ◦C; начальная температура T0 = 37 ◦C. При
расчетах пренебрегали поглощением света в среде вокруг источника тепла (поглотителя)
|
|
|
|
1.7. Действие лазерного излучения на биоткань |
55 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
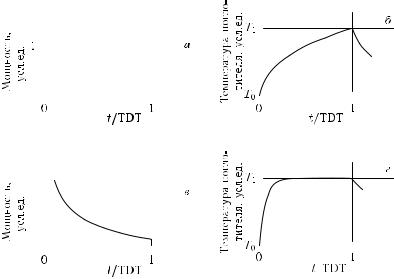
Рис. 1.29. Временные зависимости мощности лазерного излучения (EMR) и температуры источника тепла (поглотителя) [280]. Показаны два основных случая: прямоугольный лазерный импульс (а) и соответствующий температурный импульс источника тепла (б); а также импульс излучения, который возбуждает температурный импульс с плоской вершиной (в)
и сам температурный импульс с плоской вершиной (г)
нием температуры источника тепла за счет поглощения лазерного излучения. Этот процесс хорошо описывается в рамках уравнения теплопроводности.
Кривые 1 на обоих рис. 1.28, а и рис. 1.28, б представляют собой температурные профили в момент времени, равном времени тепловой релаксации для всей мишени целиком, TRT = 27 мс. Видно, что в этот момент времени температура на границе мишени еще существенно меньше повреждающей температуры. Соответственно, кривые 2 представляют момент времени, когда температура на границе мишени достигает значения повреждающей температуры T2. К этому моменту вся ткань мишени повреждена, однако окружающая ткань остается еще интактной. Это и есть время теплового повреждения TDT, которое для прямоугольного лазерного импульса равно 0,63 с, а для специального температурного импульса с плоской вершиной — 0,16 с.
На основе приведенного примера можно сделать два следующих важных вывода: 1) отношение TDT/TRT, соответственно, порядка 23 и 6 для прямоугольного лазерного импульса и для специальной формы импульса, индуцирующего температурный импульс с плоской вершиной, т. е. в обоих случаях длительность лазерного импульса t = TDT существенно больше, чем время тепловой релаксации мишени целиком, TRT; 2) в момент времени t = TDT нагреваемая область существенно больше, чем повреждаемая мишень.
В этом состоят существенные отличия данной теории от классического определения селективного фототермолиза, что является следствием пространственного разделения областей поглощения и воздействия, при котором именно контролируемая диффузия тепла обеспечивает повреждение ткани. Конечно, диффузионный фронт не является крутым, поэтому часть тепла распространяется вне очага поражения, однако повреждение все еще достаточно селективно.

56 |
Гл. 1. Основы лазерной биомедицины |
Отметим, что при определенных условиях взаимодействие лазерного пучка с биотканью может быть эффективным за счет мгновенного выпаривания жидкости в объеме, занятом сфокусированным лазерным пучком, в случае сильного поглощения света в жидкости, значительной энергии импульсов света (Eи) и высокой частоте их повторения (f ) [46]. Глубина (h) незаполняемой биожидкостью полости, образованной за счет выпаривания, определяется соотношением
E |
|
2/3 |
|
|
|
||
h ≈ A fи |
, |
(1.54) |
где A — константа.
Причина образования полости и постоянство во все время действия лазерного излучения (серия импульсов) ее объема заключается в таком подборе параметров излучения, когда каждый последующий импульс испаряет всю жидкость, попавшую в образованную полость за время между импульсами 1/f . Поскольку большинство биотканей на 70–80 % состоят из воды, то все высокоинтенсивные лазеры, излучающие на длинах волн вблизи сильных полос поглощения воды, например эрбиевый (λ = 2,94 мкм), гольмиевый (λ = 2,1 мкм), СО-лазер (λ = 5 мкм) и СО2-лазер (λ = 10,6 мкм), эффективно и локально испаряют ткань за счет поглощения воды. Например, излучение СО2-лазера (λ = 10,6 мкм) при энергии импульсов Eи = 30 мДж и f = 500 Гц проникает в ткань (за счет ее последовательного испарения) на глубину h = 2 мм, в то время как низкоинтенсивное излучение этого лазера проникает в глубь ткани всего в пределах нескольких клеточных слоев. Для гольмиевого лазера с λ = 2,1 мкм, используя эффект выпаривания, удается осуществить абляцию биоткани, закрытую слоем жидкости (кровь, физиологический раствор) толщиной до 3 мм. Аналогичные явления наблюдаются и для лазеров, работающих в УФ-области спектра, где биожидкости и ткани имеют значительное поглощение.
С другой стороны, селективный нагрев биоткани позволяет осуществлять мониторинг фотовоздействия с помощью тепловой визуализации, которая основана на восприятии ИК-излучения, испускаемого всеми объектами при любой температуре выше абсолютного нуля [278]. Такое излучение обусловлено молекулярными переходами из состояний с более высокой энергией в состояния с более низкой энергией, и для конденсированных сред распределение его энергии по длине волны описывается кривой Планка. При нормальной температуре человеческого тела пик кривой Планка попадает в средний ИК-диапазон длин волн между 9 и 10 мкм.
Функция Планка экспоненциально нелинейная по температуре, из нее следует, что низкотемпературные объекты излучают на порядки меньше энергии, чем высокотемпературные. Тело человека принадлежит к низкотемпературным объектам, поэтому точное измерение его ИК-излучения — непростая задача. Более того, обычно тело человека и его окружение излучают сравнимые количества энергии, что приводит к дополнительным трудностям при измерениях. Отношение сигнал–шум обычно невелико, и для детектирования сигнала требуется специальное оборудование для коррекции фона, методы синхронизации при обработке измерений и тщательный анализ полученных данных. За последние 10 лет технология матричных ИК-приемников, техника обработки изображений и снижения шумов были существенно усовершенствованы. Обзор инфракрасных камер, подходящих для получения тепловых изображений в медицине, приведен в работе [278]. В настоящее время точность экспериментального определения изменений температуры достигла 10−3 K, что с лихвой удовлетворяет задаче мониторинга лазерных тепловых воздействий на биоткань.
Инфракрасный термограф IRISYS 4010 на основе болометрического матричного приемника был использован для неинвазивного мониторинга температуры поверхности кожи лабораторных животных при исследовании оптимальных режимов лазер-

1.7. Действие лазерного излучения на биоткань |
57 |
ного разрушения опухолей [283–285]. Термограф позволял получать изображения тепловых полей на поверхности объектов в широком диапазоне температур от −10 до +250 ◦C, с разрешением порядка 0,15 ◦C. Система достаточно быстра (8 кадров в секунду), что позволяет проводить исследования in vivo. Поскольку диапазон длин волн термографа (8–14 мкм) лежит далеко от используемого лазерного излучения (808 нм), то рассеянное лазерное излучение не влияло на тепловизионные измерения.
Этот термограф был использован для исследований in vivo температурных полей, возникающих при взаимодействии лазерного излучения с биотканями при их сенсибилизации плазмонными наночастицами, эффективно поглощающими на длине волны лазерного излучения [283–285]. Суспензии частиц инжектировались в ткань,
тем самым искусственно создавалась мишень |
|
|
|
|
для воздействия лазерного пучка. На рис. 1.30 |
|
|
|
|
хорошо видно, что нагрев происходит быстрее |
|
|
|
|
и до более высоких температур при сенсиби- |
|
|
|
|
лизации ткани наночастицами. Скорость нагре- |
|
|
|
|
ва — один из ключевых моментов при лече- |
|
|
|
|
нии раковых опухолей, важно и само значение |
|
|
|
|
температуры, которое должно лежать в диапа- |
|
|
|
|
зоне 46–50 ◦C (для запуска механизмов само- |
|
|
|
|
разрушения опухоли) или несколько выше для |
|
|
|
|
прямой деструкции ткани. В описываемых экс- |
|
|
|
|
периментах при наличии нанооболочек в тка- |
|
|
|
|
ни нагрев происходил до температуры 46 ◦C |
Рис. 1.30. |
Измеренные in vivo вре- |
||
за 15–20 с, в то время как без наночастиц при |
менные зависимости температуры ко- |
|||
тех же параметрах лазерного излучения анало- |
жи |
крысы |
при |
лазерном нагреве |
гичный нагрев ткани был почти в десять раз |
с помощью излучения непрерывного |
|||
более медленным, 3–4 мин. |
(•, ◦) и квазинепрерывного импульс- |
|||
Интересно, что в присутствии наночастиц |
ного (N, ) диодных лазеров (808 |
|||
обе кинетические кривые нагрева ткани излуче- |
нм), |
1, 3 |
— без |
наночастиц, 2, 4 |
нием непрерывного (выходная мощность 2 Вт) |
— с внедренными золотыми нанообо- |
|
лочками (кварц/золото, 140/20 нм), |
||
и квазинепрерывного (длительность импульса |
||
подкожная инъекция суспензии нано- |
||
1 мс, скважность 0,25, пиковая мощность 8 Вт) |
||
частиц [283] |
||
лазеров имеют локальный максимум в момент |
||
|
времени 60 с (рис. 1.30). Это может быть связано с компенсаторной реакцией живого организма на температурное возмущение, которая имеет характеристическое время порядка 100 с. Важно отметить, что квазинепрерывный нагрев одномиллисекундными импульсами более управляем на больших временных масштабах, а на малом интервале времени кинетика при непрерывном и импульсном нагревах одинаковая. В этом смысле нагрев одномиллисекундными импульсами в квазинепрерывном режиме более предпочтителен, поскольку имеет сравнимую с непрерывным лазером быструю кинетику нагрева на коротких временах, и насыщение роста температуры на больших промежутках времени.
На рис. 1.31 (цветная вклейка) представлены термограммы поверхности кожи лабораторных крыс при действии лазерного излучения на ткани с внедренными частицами под кожу и в мышечную ткань, полученные in vivo. Приведены также соответствующие гистологии материала биопсий, взятых со здоровых и облученных участков ткани через 24 часа после лазерного воздействия. На контрольных образцах не видны какие-либо патологические изменения (рис. 1.31, а и 1.31, г). В то же время в областях воздействия лазерного излучения как для кожи (рис. 1.31, в), так и для мышечной ткани (рис. 1.31, е), видны существенные изменения: частичное разрушение эпидермиса, образование пузырьков, заполненных серозной жидкостью,

58 Гл. 1. Основы лазерной биомедицины
сильный отек дермы с дезориентацией коллагеновых волокон; отек мышечной ткани, гиперемия и инфильтрация лейкоцитов.
ИК-термограммы показывают, что через 30 с лазерного воздействия достигается максимальная температура в центре лазерного пучка на поверхности кожи на уровне 65,1 ◦C (рис. 1.31, б). Для внутримышечного введения наночастиц поверхностная температура была всего 51,3 ◦C (рис. 1.31, д); очевидно, что внутренняя температура в области скопления наночастиц превышала порог повреждения ткани, что хорошо видно на рис. 1.31, е.
Представленные на рис. 1.32 (цветная вклейка) фотографии наглядно иллюстрируют приложение обсуждаемой фототермической технологии для удаления раковых опухолей на примере плоскоклеточного рака кожи собаки. Для селективной и усиленной деструкции раковых клеток золотые наноболочки инжектировались непосредственно в опухоль, и далее опухоль облучалась излучением одномиллисекундного импульсного диодного лазера (808 нм), работающего в квазинепрерывном режиме. Обычно для удаления подобных опухолей необходимо обеспечить среднюю плотность мощности 1–3 Вт/см2 с полной энергетической дозой 100–200 Дж/см2 [285].
Следуя работе [286], кратко проанализируем на физиологическом уровне тепловые эффекты в нормальной и опухолевой тканях. При росте температуры вблизи 40 ◦C увеличивается скорость кровотока как в опухоли, так и здоровой ткани. Температура, равная 41,5 ◦C, является токсичной для опухолевых клеток, а температура выше 42,5 ◦C может привести к повреждению опухолевой ткани. Влияние температуры резко увеличивается при достижении 43 ◦C; скорость гибели клеток удваивается на каждый 1 ◦C роста температуры выше 43 ◦C. Было установлено, что опухолевая ткань более чувствительна к изменению температуры, чем здоровая. При этом существенным является более высокая кислотность (низкие значения pH) опухолевой ткани за счет ее пониженной оксигенации.
В последние годы уделяется большое внимание нагреву клеток как специфическому иммуномодулятору: температура тела в диапазоне 39–40 ◦C (температура лихорадочного состояния) может модулировать активность иммунокомпетентных клеток, включая клетки, содержащие антигены, T-клетки и клетки-киллеры. Несколько более высокая температура в диапазоне 41–43 ◦C (температура теплового шока), может увеличить иммуногенность опухолевых клеток. Цитотоксическая температура соответствует температурам выше 43 ◦C, когда может возникать антигенный источник, индуцирующий антиопухолевый иммунный отклик.
Как мы уже убедились, лазерная фототерапия с использованием естественных поглотителей-источников тепла (например, меланина в меланоме) или экзогенных сенсибилизаторов, таких как сильно поглощающие свет наночастицы золота, может обеспечить высокие уровни повышения температуры локально в опухоли без сильного нагрева окружающей здоровой ткани. Это приводит к непосредственному разрушению раковых клеток и выделению большого количества опухолевого антигена, который способствует формированию антиопухолевого иммунитета.
Впервые в работе [287] было предложено для селективного нагрева опухоли лазерными излучением использовать краситель индоцианин зеленый, который имеет уникально высокий коэффициент поглощения на длине волны, практически совпадающей с длиной волны мощных диодных лазеров (800–808 нм), излучение которых глубоко проникает в любые биологические ткани. Именно эта пара — индоцианин зеленый и диодный лазер (805 нм) успешно использовались для теплового разрушения привитых опухолей крыс как in vitro, так и in vivo [286, 287].
Антигены, индуцируемые теплом, включают антигены, ассоциированные с опухолью, белки теплового шока и большое количество собственных антигенов. Клетки, вырабатывающие антигены, такие как дендритные иммунно-компетентные клетки,
1.7. Действие лазерного излучения на биоткань |
59 |
могут захватить эти антигены и мигрировать в лимфатические узлы. Они передают антигены T-клеткам, которые уже индуцируют иммунный ответ, который может быть эффективным в борьбе с раковыми клетками.
Конечно, из-за сильного угнетения иммунной системы раковых больных, может оказаться, что биологически активных остатков от разрушенных при лазерном воздействии раковых клеток недостаточно для возбуждения требуемого антиопухолевого ответа. В этом случае возможно использование дополнительной местной иммунологически активной интервенции уже химических или биологических препаратов [286]. Таким образом, технология лазерной антираковой термотерапии может включать в себя не только селективный нагрев клеток опухоли, сенсибилизированных красителем или металлическими наночастицами, с ее последующим разрушением, но и добавление препаратов, вызывающих соответствующий иммунный ответ.
Важным компонентом такой технологии является и адресная доставка красителей или наночастиц к клеткам-мишеням (раковым клеткам, например). Красители могут помещаться в полимерные микроили наноконтейнеры [288], а к поверхности этих контейнеров или металлических наночастиц можно присоединять специфические биомолекулы, распознающие клетки-мишени [289]. Это так называемая функциализация наночастиц, которая для металлических частиц осуществляется путем физической адсорбции на поверхности частиц олигонуклеотидов, антител, карбогидратов и прочих [289]. Такие наноструктуры называются биоконъюгатами. Итак, моле- кула-зонд конъюгата используется для адресного связывания с клеткой-мишенью, а металлическая сердцевина — как оптический маркер клетки и/или поглотитель лазерного излучения.
Другие примеры применения лазерного излучения для фотодеструкции патологических тканей можно найти в ряде монографий [2, 7, 14, 17, 25, 30, 36, 39, 41, 75, 85, 205, 290–292].
1.7.3. Фотодинамическое и фотохимическое воздействие. Большинство фотохимических реакций происходит под действием света коротких длин волн (λ < 320 нм) (см. рис. 1.2). Многим биосистемам свойственны реакции фотодиссоциации (расщепление молекулы на радикалы и ионы) и фотоприсоединения (связывание двух мономерных молекул). Различают фотодимеризацию — присоединение такой же молекулы, находящейся в невозбужденном состоянии; фотогидратацию
— присоединение молекулы воды; фотооксидирование — присоединение молекулы кислорода [4]. Если под действием света возбужденная молекула отдает свой электрон невозбужденной молекуле, то это реакция фотоокисления, а если возбужденная молекула получает электрон — фотовосстановления. Указанные реакции приводят к структурным изменениям биообъекта, включающим и процессы фоторазрушения.
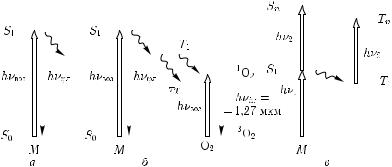
Управление биохимическими процессами с помощью света лежит в основе лазерной терапии. Использование лазерного света принципиально при многофотонном возбуждении, для осуществления которого необходима очень высокая плотность фотонов, практически недостижимая для обычных источников света [53]. Нужно, чтобы скорость возбуждения Wвоз, пропорциональная плотности фотонов, была выше скорости релаксации возбуждаемого уровня, 1/τS, T . Первые две схемы на рис. 1.33 являются основными для линейной однофотонной фотобиологии; возбужденная молекула либо принимает участие в химической реакции (рис. 1.33, а), либо передает свое возбуждение другой молекуле, участвующей в химических превращениях (рис. 1.33, б).
Третья схема (рис. 1.33, в) является основной для нелинейной многофотонной фотобиологии и реализуется при таких интенсивностях лазерного излучения, когда молекула может поглотить более чем один фотон [293, 294].
60 |
|
|
|
Гл. 1. Основы лазерной биомедицины |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1.33. Типы фотохимической модификации биомолекул: а — однофотонное возбуждение, сопровождающееся флуоресценцией и фотохимической реакцией; б — однофотонное возбуждение молекул сенсибилизатора, сопровождающееся флуоресценцией и передачей возбуждения на кислород с последующей модификацией биологической молекулы при ее взаимодействии с синглетным кислородом; в — двухфотонное возбуждение высоколежащих синглетных и триплетных уровней и последующая фотомодификация или перенос возбуждения другим
молекулам [53]
Однофотонные фотобиохимические процессы лежат в основе терапии желтухи новорожденных (избыточной концентрации билирубина), фототерапии или фотохимиотерапии различных заболеваний кожи [43–46, 83, 86, 205, 295–298] и фотодинамической терапии (ФДТ) опухолей и других заболеваний с использованием гематопорфирина, фталоцианина и других фотосенсибилизаторов [6, 43–46, 54–56, 68, 83, 205, 208, 295, 299–308]. Введенные в организм производные гематопорфирина (ПГП) или фталоцианина имеют тенденцию избирательно накапливаться
вопухолевых клетках, что связано с их высокой пролиферативной активностью. Молекулы ПГП хорошо возбуждаются видимым светом (рис. 1.34) и могут через свое триплетное состояние передавать энергию возбуждения присутствующим
втканях молекулам кислорода (рис. 1.33, б). В свою очередь, молекулы кислорода
возбуждаются в химически активное синглетное состояние (1О2) и разрушают клетки. В этом состоит один из механизмов фотодинамической терапии, реализуемый
восновном для гидрофобных фотосенсибилизаторов. Другой механизм, характерный для гидрофильных фотосенсибилизаторов, заключается в разрушении сосудистой системы биоткани. Избирательность накопления ПГП в опухолях через 2–3 суток после введения в организм составляет 5 : 1. Наиболее активный компонент из ПГП (фотофрин II) имеет еще большую избирательность — 10 : 1 [309].
ПГП хорошо поглощают свет с длиной волны около 620 нм, который довольно глубоко проникает внутрь биоткани. Активно ведется поиск новых фотосенсибилизаторов, поглощающих в длинноволновой видимой и ближней ИК-областях спектра (металлокомплексы порфиринов, фталоцианины и т. д.) и тем самым способствующих эффективному разрушению глубоколежащих опухолей (рис. 1.34), в том числе и черезкожно, а также таких фотосенсибилизаторов, которые эффективно инактивируют
вкрови лейкемические клетки (анионные красители), вирусы, бактерии и простей-
шие [6, 54, 296, 302, 303, 305, 306, 310].
Например, высокая степень чистоты Zn2+-фталоцианина и значительный коэффициент поглощения на длине волны 680 нм позволяют иметь значительную эффективность фототерапии при вводимых дозах препарата порядка 0,15–0,25 мг на килограмм веса пациента, что в 10 раз меньше аналогичных доз при использовании фотофрина II [6]. Важным является и время накопления красителя в патологических
|
|
|
|
|
1.7. Действие лазерного излучения на биоткань |
61 |
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
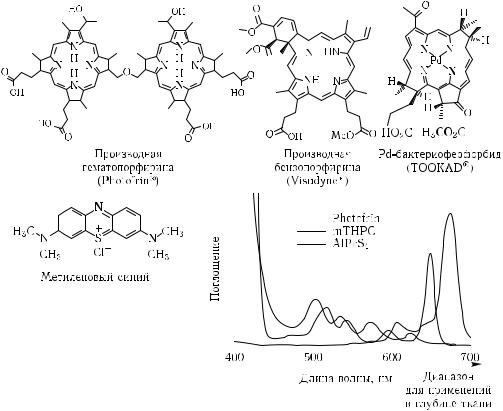
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1.34. Молекулярные структуры и спектры поглощения некоторых фотосенсибилизаторов для ФДТ [306]: производная гематопорфирина (Photofrin R ); производная бензопорфирина (Visudyne R ); Pd-бактериофеофорбид (TOOKAD R ); метиленовый синий; mTHPC (м-тетрагид- роксифенилхлорин); AlPcS4 — фталоцианин
клетках; например, для фталоцианина (AlS2Pc) уже через 2–4 ч после введения интенсивность флуоресценции (возбуждение на λ = 650–670 нм) патологической ткани (MS-2 фибросаркома) экспериментального животного оказывалась максимальной при дозе 0,5–1 мг · кг−1 [6].
В так называемой реакции типа II (рис. 1.33, б) синглетный кислород образуется из растворенных в клетках молекул кислорода, находящихся в основном состоянии (3O2), при их переводе в возбужденное состояние благодаря обмену энергии с триплетным состоянием (T1) молекул фотосенсибилизатора. Само триплетное состояние фотосенсибилизатора формируется при внутримолекулярном переходе из состояния (S1), которое возбуждается за счет поглощения фотонов света молекулами фотосенсибилизатора, находящимися в основном состоянии (S0). Типичные спектры поглощения молекул фотосенсибилизаторов и их структурные формулы показаны на рис. 1.34. В этом процессе состояние S0 молекул фотосенсибилизатора регенерирует, так что цикл может быть повторен. Для данной молекулы процесс может быть повторен много тысяч раз в течение одной процедуры облучения, поэтому, фактически, фотосенсибилизатор служит катализатором конверсии энергии света в энергию возбужденного химически активного состояния кислорода 1O2. Затем
