
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf12 |
Гл. 1. Основы лазерной биомедицины |
рассеивающих), по сравнению с фоном, неоднородностей, возникающих в ткани за счет различных патологий, например образования опухоли, локального увеличения объема крови за счет кровоизлияния или разрастания микрососудов. Поэтому в оптической томографии важна разработка методов селекции фотонов, несущих изображение в сильно рассеивающей среде. Такие методы могут быть построены только на основе фундаментальных исследований распространения света в рассеивающих средах с поглощением [1, 3, 13, 18, 19, 27, 30–34, 57, 64, 75, 161–163, 184].
Другое важное направление, в котором часто бывает необходимо глубинное зондирование биоткани, — это отражательная спектроскопия ткани, например пульсовая оксиметрия, служащая для определения изменения степени оксигенации гемоглобина крови в работающей мышечной ткани, в головном мозге новорожденных с патологией или взрослых, в процессе активной деятельности мозга [1–3, 13, 17, 18, 30–32, 45, 88, 91–97, 135, 161–163, 185].
Конечно же, все многообразие оптических медицинских технологий не сводится лишь к использованию ближнего ИК-излучения. Ультрафиолетовое (УФ), видимое, среднее и дальнее ИК-излучения находят свои конкретные применения как в медицинской диагностике, так и терапии (в данном случае нас интересует в основном дозиметрический аспект). Поэтому для ряда задач особенности взаимодействия света различных длин волн с биотканями рассматривают с точки зрения взаимодействия света с рассеивающими средами, игнорируя и фотохимическое, и тепловое действие света, а также переизлучение света в виде флуоресценции, считая, что уход энергии по этим каналам очень мал по сравнению с объемной плотностью энергии фотонов, циркулирующих в биоткани. В принципе, при решении конкретных задач указанные процессы могут быть учтены в виде изменения оптических параметров биотканей под действием распространяющегося в среде света [2, 3]. С другой стороны, те же процессы лежат в основе хорошо продвинутых в биомедицине методов лазерной диагностики, таких как флуоресцентная и калориметрическая спектроскопия, или
воснове методов лазерной фототерапии, которые также будут рассмотрены в этой и последующих главах.
Внастоящей главе представлено обсуждение характера взаимодействия лазерного излучения с живыми объектами, особенностей строения биологических тканей и клеток, определяющих рассеяние, поглощение и переизлучение распространяющегося
вних света. Описываются также виды фотовоздействий на биоткань, лежащие в основе лазерной терапии и хирургии. Многочисленные примеры применения лазеров
вбиомедицинской диагностике, терапии и хирургии сопровождаются обсуждением проблем и перспектив лазерных биомедицинских технологий.
1.2. Виды взаимодействия лазерного излучения с живыми объектами
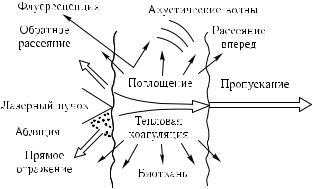
Лазерное излучение, так же как и обычный свет, может поглощаться, отражаться, рассеиваться, переизлучаться биологической средой; и каждый из указанных процессов несет информацию о микро- и макроструктуре этой среды, движении и форме отдельных ее составляющих (рис. 1.1). Видимый и ультрафиолетовый свет могут оказывать фотобиохимическое действие (примером является механизм зрения).
Световое излучение — от ультрафиолетового (УФ) до инфракрасного (ИК) — обладает большей специфичностью по отношению к биологическим системам, чем коротковолновое рентгеновское и γ-излучение или длинноволновое электромагнитное излучение радиодиапазона, что связано с большим разнообразием процессов взаимодействия света с молекулами (диссоциация, электронное возбуждение, колебательное
1.2. Виды взаимодействия лазерного излучения с живыми объектами |
13 |
||
|
|
|
|
|
|
|
|
Рис. 1.1. Виды взаимодействия лазерного излучения с биотканью [62, 89]
или вращательное возбуждение) (рис. 1.2). Фотоны малых энергий (дальнее ИК и терагерцовое излучение, излучение крайне высоких частот (КВЧ) и сверхвысоких частот (СВЧ) радиодиапазона) могут оказывать селективное действие на некоторые биомолекулы и их комплексы с окружением, например за счет возбуждения вращательных уровней, механических колебаний макромолекул или акустических колебаний в клеточных мембранах, но в основном их действие неспецифическое и сводится к тепловому. Фотоны рентгеновского и более коротковолнового излучения имеют настолько высокую энергию, что могут с одинаковой эффективностью ионизировать любую молекулу, входящую в состав сложноорганизованной биологической материи, поэтому их взаимодействие с молекулами не зависит от химической природы молекул.
Лазерное излучение умеренной интенсивности оказывает неспецифическое тепловое, а высокой интенсивности — разрушающее (деструктивное) действия на биообъекты, т. е. проявляет себя как электромагнитное излучение любой другой природы. В отличие от нелазерных источников света тепловое действие и фоторазрушение могут быть осуществлены в очень малых объемах (в пределах клетки или даже ее частей).
Таким образом, процессы, характеризующие взаимодействие лазерного излучения с биообъектами, можно разделить на три группы. К первой группе относятся все невозмущающие процессы (по крайней мере, не оказывающие заметного действия на биообъект), ко второй — процессы, в которых проявляется фотохимическое или тепловое действие, и к третьей — процессы, приводящие к фоторазрушению (абляция, фотокоагуляция) (см. рис. 1.1).
Поскольку мы имеем дело с живыми объектами, то помимо физико-химических проявлений светового излучения необходимо учитывать влияние света на функционирование живой материи, определяющееся степенью гомеостаза живого объекта. Степень гомеостаза является функцией эволюционного развития и оказывается наинизшей у биологических молекул и наивысшей у позвоночных животных. Излучение малой интенсивности не запускает адаптационные механизмы биосистемы, т. е. не затрагивается ее гомеостаз. При небольшом увеличении интенсивности происходят лишь возмущения локального гомеостаза, и не во всяких исследованиях они обнаруживаются. Рост интенсивности включает общие адаптационные и регуляционные механизмы живого объекта, полностью восстанавливающие систему, если интенсивность не слишком велика. При дальнейшем увеличении интенсивности они уже не справляются с полным восстановлением системы и происходят частично необратимые

14
биомедицины лазерной Основы .1 .Гл
Рис. 1.2. Шкала электромагнитных волн и типы взаимодействий излучения с веществом (УФ — ультрафиолетовое излучение, ВИ — видимое излучение, ИК — инфракрасное излучение, ТГц — терагерцовый диапазон частот, КВЧ — крайне высокие частоты радиодиапазона, СВЧ — сверхвысокие частоты радиодиапазона) [30, 62, 75, 89]
1.2. Виды взаимодействия лазерного излучения с живыми объектами |
15 |
процессы. Такие необратимые изменения нарастают, и происходят разрушения в системе, но объект можно еще считать «живым». В области очень больших интенсивностей разрушения оказываются настолько значительными, что объект уже не может считаться «живым».
Таким образом, при сравнительно малых интенсивностях оказывается возможным с помощью света изучать процессы, происходящие в живом объекте, не внося серьезных возмущений в его поведение. Представляет интерес область очень малых интенсивностей, в которой возможно применение ряда наиболее чувствительных методов исследования, не требующих сильных световых потоков и, следовательно, не вносящих искажений в результаты измерений за счет гомеостаза живой материи даже на локальном уровне. В области очень больших интенсивностей измерения также оказываются неискаженными за счет регуляторных механизмов биосистемы, поскольку она уже «неживая», однако исследователь в данном случае имеет дело лишь с органической материей, состав и свойства которой соответствуют моменту прекращения жизнедеятельности.
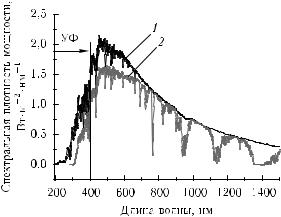
Важно ввести количественные критерии, которые могли хотя бы грубо определять уровень высокой и низкой (для функционирования живого организма) интенсивности. При этом важно сравнивать интенсивности света лазерного и нелазерного, используемого в том или ином исследовании. В зависимости от условий эксперимента такое сравнение следует вести либо по параметрам плотности мощности (интенсивности) (Вт/см2) или энергии (Дж/см2) светового излучения, падающего на объект, либо по параметрам спектральной плотности мощности (Вт/(см2 · нм)) или энергии (Дж/(см2 · нм)). Для ориентировки можно считать пороговыми параметрами для низкоинтенсивного излучения параметры излучения естественного светила — Солнца. Интегральная плотность мощности излучения Солнца в зените в диапазоне 250–2500 нм составляет 85 мВт/см2, а спектральная плотность в максимуме кривой излучения на λ = 500 нм — 0,15 мВт/(см2 · нм) (рис. 1.3).
Рис. 1.3. Спектр солнечного излучения выше атмосферы (1) и на уровне моря (2) [186]
Для взаимодействия света с биологическими объектами являются важными время облучения, режим облучения (непрерывный или импульсный), периодичность и длительность процессов. В этом также может проявить себя гомеостазная природа живой материи. В зависимости от длины волны и интенсивности света пороговая длительность облучения, при которой начинают происходить морфологические изменения, может быть весьма различной для одного и того же объекта, т. е. для живого объекта
16 |
Гл. 1. Основы лазерной биомедицины |
произведение интенсивности на время облучения не является константой. В зависимости от периодичности световых импульсов возможны резонансные явления в области частот, соответствующих периоду колебаний фотоотклика биологических систем, который изменяется в пределах от 10−3 до 103 с.
Следует отметить, что сложность исследования поведения биологических систем заключается в том, что из-за включения адаптационных и регуляторных механизмов их отклик является нелинейным даже при очень малых интенсивностях света.
1.3. Структура биологических тканей и клеток
Морфологическое разнообразие биотканей определяет различный характер прохождения света через них. Размеры клеток и структурных элементов клеток и соединительной биоткани лежат в диапазоне от нескольких десятков нанометров до сотен микрометров [13, 25, 31, 188]. Например, клетки крови (эритроциты, лейкоциты и тромбоциты) имеют следующие параметры: нормальный эритроцит в плазме имеет форму вогнуто-вогнутого диска диаметром от 7,1 до 9,2 мкм, толщиной 0,9–1,2 мкм в центре и 1,7–2,4 мкм на периферии и имеет объем порядка 90 мкм3; лейкоциты по форме близки к сфере и имеют широкий разброс по диаметрам, 8–22 мкм; тромбоциты в потоке крови представляют собой довяковыпуклые дискообразные частицы диаметром от 2 до 4 мкм. В норме кровь содержит (4–5) · 106 мм−3 эритроцитов, что примерно в 10–20 раз больше, чем тромбоцитов, которых порядка (2–3) · 105 мм−3, и (4–9) · 103 мм−3 лейкоцитов, что примерно в 30–50 раз меньше, чем тромбоцитов.
Большинство других клеток млекопитающих имеют диаметры 5–75 мкм. В эпидермальном слое клетки большие (со средней площадью сечения 80 мкм2) и весьма однородны по размеру. Жировые клетки, каждая из которых содержит одну капельку липидов, заполняющую почти всю клетку, что приводит к эксцентрическому расположению цитоплазмы и ядра, сильно различаются по диаметру, который может быть от нескольких микрометров до 50–75 мкм. При патологиях жировые клетки могут достигать в диаметре 100–200 мкм.
Внутри клеток имеются разнообразные структуры, определяющие рассеяние света тканью. Ядра клеток имеют диаметр порядка 5–10 мкм, митохондрии, лизосомы и пероксисомы — порядка 20 нм, а структуры внутри различных органелл могут иметь размер до нескольких сотен нанометров. Как правило, рассеивающие элементы внутри клеток не обладают сферической формой. Более типична здесь модель вытянутых эллипсоидов с отношением осей от 2 до 10.
Полые органы тела выстланы тонким слоем эпителиальной ткани с выраженной клеточной структурой, который поддерживается нижележащим слоем относительно бесклеточной соединительной ткани — стромы. В здоровых тканях эпителий часто состоит из одного хорошо организованного слоя клеток, у которых диаметр части, обращенной к поверхности, составляет 10–20 мкм, а высота 25 мкм. При дисплазии клетки эпителия пролиферируют, их ядра увеличиваются и выглядят темнее при окрашивании (гиперхроматичность) [189]. Увеличенные ядра являются главными индикаторами рака, дисплазии и регенерации клеток в большинстве тканей человека.
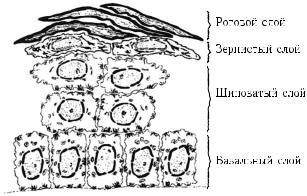
Верхний защитный слой кожи человека — эпидермис также относится к эпителиальным тканям с живыми клетками, начиная от границы дерма–эпидермис, где находятся базальные клетки (stratum basale), вплоть до рогового слоя (stratum corneum), где клетки уже мертвые (рис. 1.4) [190]. Клетки рогового слоя сильно уплощены, содержат много кератина и плотно примыкают друг к другу, представляя собой защитный экран от внешних механических и химических повреждений.
1.3. Структура биологических тканей и клеток |
17 |
Рис. 1.4. Структура эпидермиса (эпителиального слоя) кожи [190]
В волокнистых (соединительных) тканях, содержащих слои волокон (роговица, склера, твердая мозговая оболочка (dura mater), мышца, миокард, сухожилие, хрящ, стенка сосуда, слой нервных волокон сетчатки глаза и т. п.), которые состоят, в основном, из микрофибрилл и/или микротубул, типичный диаметр цилиндрических структурных элементов составляет 10–400 нм. Их длина может быть от 10–25 мкм до нескольких миллиметров.
Для артерии доминирующими в рассеянии могут быть волокна, клетки или субклеточные органеллы. Мышечные артерии имеют три основных слоя. Внутренний слой состоит из клеток эндотелия со средним диаметром менее 10 мкм. Средний слой состоит, главным образом, из плотно упакованных клеток гладкой мышцы со средним диаметром 15–20 мкм; в этом слое также содержится небольшое количество соединительной ткани, включающей эластин, коллагеновые и ретикулиновые волокна, а также немного фибробластов. Наружный адвентициальный слой состоит из плотной фиброзной соединительной ткани, которая образована, главным образом, коллагеновыми волокнами диаметром до 10–12 мкм и более тонкими эластиновыми волокнами диаметром 2–3 мкм.
Два других примера сложных рассеивающих структур — это миокард и слой нервных волокон сетчатки. Миокард состоит, в основном, из сердечной мышцы, образованной миофибриллами (мышечными волокнами диаметром около 1 мкм), которые, в свою очередь, состоят из цилиндрических миофиламентов (мышечных нитей диаметром 6–15 мкм) и асферических митохондрий диаметром 1–2 мкм. Слой нервных волокон сетчатки содержит пучки безмиэлиновых аксонов, которые проходят по поверхности сетчатки. Цилиндрические органеллы слоя нервных волокон сетчатки — это мембраны аксонов, микротубулы, нервные волокна и митохондрии. Мембраны аксонов, как и все клеточные мембраны, представляют собой тонкие (6–10 нм) фосфолипидные двойные слои, которые образуют цилиндрические оболочки, заключающие в себе аксонную цитоплазму. Аксонные микротубулы — длинные трубчатые полимеры белка тубулина с внешним диаметром ≈ 25 нм, внутренним диаметром ≈ 15 нм и длиной 10–25 мкм. Нейрофиламенты — стабильные белковые полимеры с диаметром ≈ 10 нм. Митохондрии — эллипсоидальные органеллы, которые содержат плотно связанные перепонки из липидов и белков. Они имеют толщину 0,1–0,2 мкм и длину 1–2 мкм.
Мягкая ткань состоит из плотно упакованных групп клеток и сети из волокон, через которую просачивается межтканевая (межклеточная) или интерстициальная жидкость. В микроскопическом масштабе компоненты биоткани не имеют четких

18 |
Гл. 1. Основы лазерной биомедицины |
границ. Они сливаются в непрерывную структуру с пространственно меняющимся показателем преломления.
Поскольку лазерное излучение довольно эффективно используется в стоматологии [59], рассмотрим особенности строения зубной ткани с точки зрения прохождения света через нее [145, 191–200]. В твердой части зуба различают эмаль и дентин. Эмаль покрывает коронку зуба. Она построена из эмалевых призм с поперечным размером 4–6 мкм. Призмы располагаются пучками, имеют извитой характер и залегают почти перпендикулярно к поверхности дентина. Между призмами находится менее обызвествленное склеивающее вещество (эмалевая жидкость, составляющая 0,2 % объема эмали). Эмаль является сравнительно прозрачной тканью, поэтому оптические свойства зуба (поглощение, рассеяние, цвет) определяются, в основном, дентином.
Дентин образует большую часть коронки, шейки и корня зуба и построен из основного вещества, пронизанного канальцами (тубулами). Канальцы берут начало в пульпе, около внутренней поверхности дентина, и, веерообразно расходясь, заканчиваются на его наружной поверхности. Некоторые канальцы проникают в эмаль. Внутренний слой стенки дентиновых канальцев содержит много минерализованных, по сравнению с остальным веществом дентина, волокон (рис. 1.5 [195, 196]). Внутренний диаметр дентиновых канальцев составляет 1–3 мкм, по некоторым данным 1,58 (±0,28) мкм [145], а плотность колеблется в широком диапазоне (0,5–9,0) · 106 см−2, однако наиболее вероятно более узкое распределение (0,8–5,7) · 106 см−2 [197], или по другим данным (1,5–6,5) · 106 см−2 со средним значением 3,5 · 106 см−2 [145]. Вариации размеров тубул и их плотности зависят от локализации в зубе и могут быть связаны с некоторыми патологиями.
Рис. 1.5. Схематическое представление зуба, включая дентинные канальцы — тубулы (а); изображение тубул, полученное с помощью лазерной сканирующей микроскопии (размеры изображения: 90 × 90 мкм) (б) [195]; сканирующая электронная микрограмма дентина человека; хорошо видны дентиновые тубулы (канальцы) (1), более плотный и однородный пертубулярный дентин (2) и менее плотный и менее однородный межтубулярный дентин (3) (в) [196]
Тубулы окружены пертубулярным дентином с диаметром 3,0 (±1,8) мкм и высоким содержанием минералов порядка 90 (±6) % по объему. Между тубулами с окружающим их пертубулярным дентином находится межтубулярный дентин с меньшим содержанием минерального компонента, порядка 40 (±6) % по объему. Межтубулярный дентин состоит на 90 % по объему из коллагеновых волокон (фибрилл) с встроенными кристаллами минералов и на 10 % по объему из межфибриллярного дентина. Тропоколлагеновые молекулы в фибриллах представляют собой образования сильно вытянутой формы с размерами 280 × 1,5 нм с молекулярным весом 360 000. Фибриллы с диаметром порядка 50–150 нм распределены в дентине с более или
1.3. Структура биологических тканей и клеток |
19 |
менее случайной ориентацией. Кроме тубул все составляющие содержат минеральные иглообразные кристаллы гидроксиапатита диаметром 2,0–3,5 нм и выше, до 5 нм, и длиной 20 нм и выше, вплоть до 100 нм. В видимой области показатель преломления гидроксиапатита ≈ 1,62 (см. табл. 1.1).
Т а б л и ц а 1.1. Измеренные in vitro средние значения фазового n или группового ng показателей преломления тканей зуба и их составляющих; в скобках даны значения среднеквадратичного отклонения
Ткань зуба |
λ, нм |
n, ng |
Источник |
Эмаль |
220 |
n = 1,73 |
[204] |
Эмаль |
400–700 |
n = 1,62 |
|
Гидроксиапатит |
400–700 |
n > 1,623 |
|
Матрикс дентина |
400–700 |
n = 1,553(0,001) |
[198] |
Эмаль |
856 |
ng = 1,62(0,02) |
[199] |
Дентин |
856 |
ng = 1,50(0,02) |
|
Эмаль |
850 |
ng = 1,65 |
[200] |
Дентин |
850 |
ng = 1,54 |
|
Итак, основными поглотителями в дентине являются белковоподобные молекулы, а рассеивателями — кристаллы гидроксиапатита.
Таким образом, строение зуба представляет собой пучки согласованных природных световодов. Извитая форма световодов определяет высокую эффективность освещения пульпы практически независимо от того, каким образом свет попадает на внешнюю поверхность зуба. Свет, падая на поверхность эмали, рассеивается на неоднородностях и частично захватывается оптическими волноводами, роль которых в эмали выполняют эмалевые призмы, а в дентине — область дентина между канальцами (см. гл. 7). Такие природные волноводы обеспечивают эффективный транспорт световой энергии от поверхности эмали к пульпе. Каждая точка поверхности эмали оказывается оптически связанной с вполне определенной точкой полости зуба. Волноводный эффект существенно более выражен в дентине, чем в эмали. Оптические характеристики зуба удовлетворительно описываются в рамках модели волноводно-рассеивающей среды [191, 192].
Рассеяние света на периодических структурах зубной ткани дает информацию о строении ткани. Обычно для этих целей используют шлифы зубной ткани. Однако, как показали исследования рассеяния лазерного излучения с λ = 633 нм, на периодических структурах дентина (свет направляется поперек дентинных канальцев) существующие теоретические модели дифракции света на оптических неоднородностях дентина не в полной мере описывают экспериментальные результаты. Оптические характеристики дентина и эмали зуба в видимой области существенно отличаются от характеристик мягких биотканей [145, 191–200] (см. табл. 1.2).
Т а б л и ц а 1.2. Оптические характеристики дентина и эмали зуба на длине волны He–Ne лазера (633 нм) [193]
Ткань зуба |
µs, см−1 |
µa, см−1 |
g |
Эмаль быка |
0,54 |
0,97 |
— |
Эмаль человека |
1,1 |
0,97 |
— |
Дентин быка |
2000 |
3,5 |
0,36 |
Дентин человека |
1200 |
6,0 |
0,44 |
|
|
|
|

20 Гл. 1. Основы лазерной биомедицины
1.4. Рассеяние и поглощение света
Биологические ткани являются оптически неоднородными поглощающими средами со средним показателем преломления большим, чем у воздуха, поэтому на границе раздела биообъект–воздух часть излучения отражается (френелевское отражение), а остальная часть проникает в биоткань. За счет многократного рассеяния и поглощения лазерный пучок уширяется и затухает при распространении в биоткани. Объемное рассеяние является причиной распространения значительной
доли излучения в обратном направлении (обратное
|
|
|
|
|
|
|
|
|
рассеяние) (см. рис. 1.1). Клеточные мембраны, ядра |
|||||||||||||
|
|
|
|
|
|
|
|
|
и органеллы, такие как митохондрии, а также грану- |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
лы меланина в клетках являются основными рассеи- |
|||||||||||||
|
|
|
|
|
|
|
|
|
вателями для многих биотканей [201–204]. Имеются |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
данные о том, что в зависимости от степени малиг- |
|||||||||||||
|
|
|
|
|
|
|
|
|
низации (злокачественности) новообразований тка- |
|||||||||||||
|
|
|
|
|
|
|
|
|
ни увеличивается хаотизация клеточных структур, |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
возрастает разброс размеров отдельных клеточных |
|||||||||||||
|
|
|
|
|
|
|
|
|
ядер относительно среднего значения, которое также |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
увеличивается от 10–12 мкм в норме до 20–50 мкм |
|||||||||||||
|
|
|
|
|
|
|
|
|
для патологических тканей, одновременно может из- |
|||||||||||||
|
|
|
|
|
|
|
|
|
меняться и относительный показатель преломления |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
ядро — цитоплазма [190]. Все это ведет к изменению |
|||||||||||||
|
|
|
|
|
|
|
|
|
характера рассеяния ткани. |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
Поглощенный свет преобразуется в тепло, пе- |
|||||||||||||
|
|
|
|
|
|
|
|
|
реизлучается в виде флуоресценции, а также тра- |
|||||||||||||
|
|
|
|
|
|
|
|
|
тится на фотобиохимические реакции. Спектр по- |
|||||||||||||
Рис. 1.6. Спектр поглощения |
|
глощения определяется типом доминирующих погло- |
||||||||||||||||||||
|
щающих центров и содержанием воды в биоткани |
|||||||||||||||||||||
|
воды [89] |
|
(рис. 1.6–1.8) [13, 30–32, 75, 89, 90, 203]. |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1.7. Молярные спектры ослабления растворов основных пигментов кожи человека: 1 — ДОФА-меланин (Н2О); 2 — оксигемоглобин (Н2О); 3 — гемоглобин (Н2О); 4 — билирубин (СНСl3) [90]
|
|
|
|
|
|
1.4. Рассеяние и поглощение света |
21 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
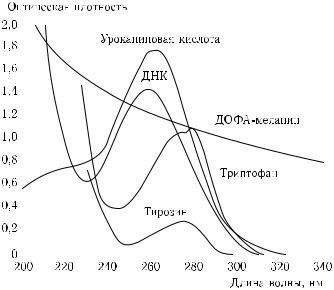
Рис. 1.8. УФ-спектры поглощения эпидермальных хромофоров (ДОФА-меланин, 1,5 мг % в Н2О; уроканиновая кислота, 104 М в Н2О; ДНК тимуса теленка, 10 мг % в Н2О (pH = 4,5); триптофан, 2 · 104 М (рН = 7)) [90]
Ослабление коллимированного (лазерного) пучка в биоткани происходит по экспоненциальному закону. Интенсивность прошедшего коллимированного света через тонкий образец ткани со значительным поглощением, по сравнению с рассеянием, может быть оценена на основе закона Бугера–Бера:
I(z) = (1 − R)I0 exp(−µtz), |
(1.1) |
где R — коэффициент френелевского отражения при нормальном падении пучка, R = [(n − 1)/(n + 1)]2, n — относительный показатель преломления биоткани; I0 — интенсивность падающего света; µt = µa + µs — коэффициент экстинкции (коэффициент взаимодействия или ослабления), µa — коэффициент поглощения, µs — коэффициент рассеяния; z — толщина образца.
Средняя длина свободного пробега однократно рассеянного фотона в биоткани определяется как lph = µ−t 1. Абсолютные значения коэффициентов поглощения ти-
пичных биотканей лежат в пределах 10−2–104 см−1 [1–3, 12, 13, 30–32, 43–45, 49, 69–75, 89, 161, 162, 204–208]. Коэффициенты поглощения для некоторых биотканей, измеренные на отдельных лазерных длинах волн, представлены в табл. 1.2 и 1.3. В УФ- и ИК- (λ > 2 мкм) областях спектра превалирует поглощение, поэтому вклад рассеяния сравнительно мал и свет неглубоко проникает в биоткань, всего на один или несколько клеточных слоев (рис. 1.9). Для коротковолновой видимой области глубина проникновения типичной биоткани составляет 0,5–2,5 мм (падение интенсивности в e раз). В данном случае имеет место как поглощение, так и рассеяние, поэтому около 15–40 % падающего излучения отражается на этих длинах волн. Рассеяние несколько уменьшается с увеличением длины волны, но при этом поглощение уменьшается более существенно, так что рассеяние превалирует над поглощением, а, следовательно, глубина проникновения света увеличивается до 8–10 мм в области длин волн 600–1600 нм. Также существенно увеличивается
