
Лазеры и волоконная оптика в биомедицинских исследованиях
.pdf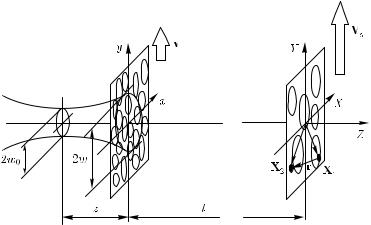
152 |
Гл. 2. Распространение света в биологических тканях |
Рис. 2.30. Рассеяние лазерного гауссова пучка диаметром 2w на движущемся со скоростью v случайном фазовом экране (СФЭ), расположенном в плоскости (xy) перпендикулярно лазерному пучку; (XY ) — плоскость наблюдения динамических спеклов, отнесенная на расстояние l от СФЭ [577]
объекте ρ определяются следующими соотношениями: |
|
||||||||
|
|
|
|
|
|
2 |
1/2 |
|
|
|
|
|
z |
|
|
2 |
|
||
w = w0 |
1 + |
|
a |
|
|
|
, |
(2.88) |
|
ρ = z 1 − |
a |
, |
(2.89) |
||||||
z |
|||||||||
где a = πw02/λ, w0 — размер лазерного пучка в перетяжке. |
|
||||||||
В этом случае нормированная пространственно-временная корреляционная функция интенсивности рассеянного света в плоскости наблюдения, расположенной на
расстоянии l от плоскости объекта, определяется соотношением [765] |
|
|
||||||||||||||||
I |
− |
1 = exp |
− w2 |
τ 2 |
|
−rs2 |
|
r |
− |
1 |
ρ |
|
|
2 |
|
, |
(2.90) |
|
g (r, τ ) |
|
|
|v|2 |
exp |
1 |
|
|
+ l |
vτ |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где rs = 2l/(k0w) — средний размер спекла в плоскости наблюдения, k0 = 2πn/λ — волновое число падающего излучения, v — скорость перемещения СФЭ. Как следует из уравнения (2.90), спеклы перемещаются в плоскости наблюдений со скоростью
Vs = |
r |
= 1 + |
l |
v. |
(2.91) |
τ |
ρ |
Хорошо известно, что движение динамических спеклов происходит в двух различных режимах, а именно если спеклы движутся без изменения своей структуры, то это так называемый режим «перемещения спеклов», если же спеклы меняют только свою структуру без перемещения в пространстве, то это так называемый режим «кипения спеклов». Последний режим характерен для случайного распределения скоростей рассеивающих центров.
Очевидно, что в нашем случае направленного движения рассеивающего экрана время, необходимое для смены реализации рассеивателей, освещаемых лазерным

2.7. Особенности взаимодействия лазерного излучения с биотканями |
153 |
пучком, равно: |
|
||||
τT = |
w |
. |
(2.92) |
||
|
|
||||
|
|v| |
|
|||
Учитывая соотношение (2.91), величина перемещения может быть оценена как |
|||||
rT = 1 + |
l |
w. |
(2.93) |
||
ρ |
|||||
Описанная динамика оптических спеклов является основой для спекл-корреля- ционного метода измерения скорости. Основная идея состоит в измерении скорости перемещения спеклов в плоскости наблюдения и определении скорости движения объекта из соотношения (2.91). Существует множество методов измерения перемещения спекл-полей, от фотографической регистрации до использования высокоскоростных ПЗС и СMOS 1) камер. Один из простейших методов заключается в регистрации флуктуаций интенсивности в двух пространственно разнесенных точках в плоскости наблюдения. Если расстояние между точками измерений короче, чем rT (2.93), то будут записаны два подобных сигнала со смещением во времени τd. Величина τd соответствует времени, которое необходимо для перемещения спеклов из одной точки
вдругую. Эта величина может быть легко измерена с использованием кросс-корре- ляционного метода, описанного в [577].
2.7.3.3.Доплеровские визуализаторы кровотока. Диагностика многих заболеваний, связанных с нарушением микроциркуляции крови, требует мониторинга микроциркуляции на довольно больших поверхностях ткани [12, 13, 19, 41, 391]. Поскольку доплеровские методы характеризуются высокой пространственной локальностью, то для визуализации поля скоростей кровотока требуется механическое сканирование лазерного пучка или последовательный анализ флуктуаций интенсивности в переделах одного пикселя ПЗС-камеры, либо и то, и другое одновременно. Сканирующие лазерные системы для визуализации кровотока были разработаны и внедрены в производство [769, 770]. Однако в целом такие системы не обеспечивают необходимой скорости получения и анализа изображений микроциркуляции.
Естественный путь для увеличения скорости получения изображений состоит
впараллельном измерении с использованием одномерных линеек или двумерных матриц фотоприемников. Новое поколение высокоскоростных устройств полнопольной (параллельной/многоканальной) лазерной доплеровской визуализации (ЛДВ) кровотока было недавно разработано на основе использования КМОП-камер [743–745]. Такая система ЛДВ выдает изображение кровотока с высоким разрешением каждые 0,7–11 с, в зависимости от числа используемых временных отсчетов в каждом пиксе-
ле (32–512 точек) и нужного пространственного разрешения изображения (256 × 256 или 512 × 512 пикселей). Типичный размер пикселя камеры 7 × 7 мкм2, скорость выборки 40 МГц при 8-битном АЦП. Такой сенсор имеет равномерный спектральный отклик в диапазоне от 500 до 750 нм. В качестве стабильного когерентного источника света использовался твердотельный лазер с диодной накачкой с выходной мощностью 250 мВт (λ = 671 нм). Для равномерности освещения объекта в пределах площади с диаметром 170 мм лазерное излучение направлялось на объект через пластиковый волоконный световод (ВС) диаметром 1,5 мм с градиентной линзой (GRIN-линза, волоконно-оптическая линза с градиентом показателя преломления) диаметром 1,8 мм на дистальном конце. Рассеянный назад свет собирался объективом (f = 6 мм) с малой эффективной фокальной длиной (f /D ≡ 1/(2NA) = 1,2, где D — диаметр входящего зрачка), обеспечивая высокую эффективность сбора фотонов, что критично
1) CMOS камера — оптическая матричная камера на основе комплементарных металло-ок- сидных полупроводников (или КМОП-камера).
154 |
Гл. 2. Распространение света в биологических тканях |
для малых времен интегрирования (в пределах нескольких десятков миллисекунд). Обычно камера располагалась на расстоянии 150–250 мм от поверхности исследуемой биоткани (см. рис. 2.31, а, цветная вклейка).
Обработка сигнала состоит в вычислении нулевого (M0) и первого (M1) моментов спектра плотности мощности S(ν) флуктуаций интенсивности I(t) для каждого пикселя. Нулевой момент связан со средней концентрацией hCi движущихся частиц в объеме выборки. Первый момент (плотность потока или перфузия) пропорционален среднеквадратичной скорости движущихся частиц Vrms, умноженной на среднюю концентрацию [741]. Соответствующие выражения имеют вид:
∞
Концентрация = hCi M0 = |
S(ν)dν, |
(2.94) |
||
|
|
0 |
|
|
|
|
∞ |
|
|
Перфузия = hCiVrms M1 = |
νS(ν)dν, |
(2.95) |
||
|
|
0 |
|
|
S(ν) = |
∞I(t) exp(−i2πνt)dt 2 . |
(2.96) |
||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Здесь переменная ν — частота флуктуаций интенсивности, индуцированных фотонами с доплеровским смещением. На основе зарегистрированных временных вариаций сигнала от каждого пикселя в пределах исследуемого участка вычислялся спектр флуктуаций плотности мощности с применением алгоритма быстрого преобразования Фурье (БПФ).
На рис. 2.31, б показаны изображения распределения кровотока, полученные на коже пальцев здорового человека при полном времени формирования изображения примерно 5 с. Изображения хорошо показывают разницу в распределениях скоростей и концентраций. В дополнение к этим изображениям на рис. 2.32 (цветная вклейка) представлены изображения распределения параметра перфузии для пальцев руки человека в реальном масштабе времени на участке размером 5,5 × 5,5 см2 (256 × 256), полученные в эксперименте с временной окклюзией артерии [745]. На этих изображениях и соответствующем графике зависимости усредненной перфузии от времени хорошо видны изменения в распределении перфузии и ее средней величины в процессе окклюзии, во время ее снятия и после, при восстановлении исходного уровня перфузии. Хорошо видна гиперемия после снятия окклюзии и кинетика подавления и восстановления перфузии.
Время формирования изображения у рассмотренной высокоскоростной системы ЛДВ приближается к аналогичному показателю существенно более простых систем лазерной спекл-визуализации (ЛСВ) [12, 13, 19, 114, 181, 182, 746–756, 771], которые в настоящее время считаются самыми быстродействующими [750]. В системах ЛСВ информация о кровотоке получается путем измерения контраста спеклов изображения. Практически значения контраста, измеряемые в ЛСВ, прямо пропорциональны нормированному значению M0 (см. (2.94)). В методе ЛДВ сигналы концентрации и скорости можно измерить независимо, об этом свидетельствуют изображения, показанные на рис. 2.31, б, которые демонстрируют различие между изображениями распределения перфузии (M1) (см. (2.95)) и концентрации (M0). Напротив, в методе ЛСВ эти два сигнала, как правило, смешаны, и поэтому не всегда возможно выяснить точную причину изменения контраста [742]. Тем не менее, была найдена высокая корреляция (R2 = 0,98) между ЛДВ- и ЛСВ-измерениями одной

2.7. Особенности взаимодействия лазерного излучения с биотканями |
155 |
и той же области местного церебрального кровотока у крыс [746]. Из детального сравнения этих методов, проведенного в работе [749], следует, что ЛСВ, как и ЛДВ, может давать изображение сосудистой структуры биоткани с относительным распределением скорости кровотока, но он не позволяет произвести измерение перфузии
влинейном режиме, что характерно для ЛДВ.
2.7.3.4.Методы лазерной спекл-визуализации полного поля. Как уже отмечалось выше, спекл-контрастный метод относится к методам лазерной спекл-визуа- лизации (ЛСВ). Его полное название — метод анализа контраста лазерных спеклов (АКЛАС) (laser speckle contrast analysis (LASCA)). Он является концептуально простым высокоэффективным полнопольным методом визуализации кровотока [12, 13, 19, 114, 181, 182, 746–756, 771]. В измерительной системе используется ПЗС-камера, плата захвата изображения и специальное программное обеспечение для вычисления локального контраста спекл-структуры и преобразования контраста
вцветное изображение, которое отображает распределение скоростей рассеивающих центров. Это результирующее изображение представляет собой усредненный по времени контраст спекл-поля. Усреднение производится достаточно быстро (время усреднения обычно равно 5–30 мс), поэтому измерения осуществляются в реальном времени.
Очевидно, что при времени усреднения, сравнимом с периодом флуктуаций интенсивности, вызванных динамическим рассеянием света, эффект состоит в размытии регистрируемой спекл-картины, т. е. снижении контраста спеклов. Контраст количественно описывается отношением стандартного отклонения флуктуаций интенсивно-
сти к средней интенсивности, sI /hIi (см. (2.74)). Для реализации метода важным является выбор числа пикселей, по которым вычисляется локальный контраст: если их слишком мало — недостоверна статистика, слишком много — происходит потеря пространственного разрешения. На практике удовлетворительным компромиссом является квадрат 7 × 7 или 5 × 5 пикселей.
Для случайного распределения скоростей каждый спекл флуктуирует по интенсивности («кипение спеклов»). С другой стороны, при регулярном поперечном движении СФЭ спеклы также движутся регулярно в поперечном направлении, при усреднении их изображение смазывается и происходит снижение контраста. Для потока жидкости ситуация может быть комбинацией этих двух типов «движения». В каждом случае проблемой для количественных измерений является определение соотношения между контрастом спеклов и скоростью (или распределением скоростей). Чем выше скорость, тем быстрее флуктуации и тем больше размытие картины за время интегрирования. Имеет место следующее соотношение между контрастом спеклов и временной статистикой их флуктуаций [771]:
|
T |
ge2(τ )dτ , |
|
σs2(T ) = T1 |
0 |
(2.97) |
где σs2 — дисперсия флуктуаций интенсивности спекл-картины в пространстве;
T — время интегрирования; ge2(τ ) = [hI(τ + τ ) − hIii] × [I(τ ) − hIi] — коэффициент автокорреляции флуктуаций интенсивности отдельного спекла во времени.
Формула (2.97) определяет связь между АКЛАС и теми методами, которые используют флуктуации интенсивности в лазерном свете, рассеянном движущимися объектами или частицами. АКЛАС измеряет величину в левой части уравнения (2.97); а спектроскопия корреляции фотонов, лазерный доплеровский метод и метод меняющихся во времени спеклов измеряют величину в правой части. Стоит также заметить, что АКЛАС использует спекл изображения, в то время как большинство
156 |
Гл. 2. Распространение света в биологических тканях |
временных методов используют спеклы дальнего поля. Однако это не нарушает фундаментальной эквивалентности двух подходов, выражаемой соотношением (2.97).
Все методы позволяют определить время корреляции τc. В случае корреляции фотонов этот параметр измеряется непосредственно. В случае АКЛАС требуются некоторые дополнительные допущения для установления связи измеряемого контраста спеклов с τc.
В зависимости от типа движения можно использовать различные модели для нахождения соотношения между контрастом спеклов и временем корреляции τc для заданного времени интегрирования T . Например, в случае лоренцева распределения скоростей это соотношение имеет вид [771]:
hIsi = h |
2T |
n1 − exp − τc |
oi . |
(2.98) |
|
σ |
τc |
|
2T |
1/2 |
|
Как и все временные методы, АКЛАС испытывает трудности, связанные с привязкой корреляционного времени τc к распределению скоростей рассеивателей. Она неочевидна и зависит от эффектов многократного рассеяния, размеров и формы рассеивающих частиц, неньютоновости потока и негауссовости статистики из-за малого числа рассеивателей в объеме, где проводится измерение, спина рассеивателей и т. д. Из-за неопределенностей, вызванных указанными факторами, во всех этих методах обычно полагаются главным образом на калибровку, а не на абсолютные измерения.
Формула (2.98) выражает контраст спеклов в усредненной по времени спеклструктуре как функцию времени экспозиции T и времени корреляции
τc = 1/(ak0v), |
(2.99) |
где v — средняя скорость рассеивающих частиц, k0 — волновое число падающего |
|
света, а a — фактор, зависящий от лоренцевой полуширины и рассеивающих свойств ткани [741]. Как и в ЛДВ, здесь теоретически возможно связать времена корреляции τc с абсолютными скоростями эритроцитов, однако на практике это сложно, поскольку число движущихся частиц, с которыми взаимодействует свет, и их ориентации неизвестны [741]. Тем не менее, можно получить пространственные и временные распределения для относительной скорости из измерения отношения 2T /τc, которое пропорционально скорости и определяется как измеряемая относительная скорость [772, 774–776].
Как было описано выше, ЛСВ основана на пространственной статистике первого порядка спеклов, проинтегрированных по времени. Основной недостаток метода АКЛАС — потеря разрешения, обусловленная необходимостью усреднять по блоку пикселей, чтобы получить пространственную статистику, используемую в анализе, хотя принципиально он имеет более высокое разрешение, чем некоторые другие методы. Недавно был предложен модифицированный метод ЛСВ, так называемый метод лазерного временного контраста (ЛВК), использующий временную статистику спеклов, проинтегрированных по времени [752, 772]. В этом методе каждый пиксель в спекл-изображении может рассматриваться как одна точка. Тогда обработка сигнала состоит в вычислении временной статистики интенсивности каждого пикселя
изображения: |
= hIi2, j, tit − hIi, j, tit2 , |
|
|||
N |
|
||||
i, j |
|
2 |
|
|
(2.100) |
|
|
hIi, j, tit |
|
|
|
i = 1–480, |
j = 1–640, |
t = 1–m, |
|
||
где Ii, j, t — мгновенная исходной спекл-картины, по последовательности m
интенсивность i-го и j-го пикселей в кадре с номером t а hIi, j, tit — средняя интенсивность i-го и j-го пикселей кадров. Величина Ni, j обратно пропорциональна скорости
2.7. Особенности взаимодействия лазерного излучения с биотканями |
157 |
рассеивающих частиц. Значение Ni, j каждого пикселя в m следующих друг за другом кадрах (Ii, j, t) необработанной спекл-картины вычисляется по формуле (2.100). Затем процесс повторяется для следующей группы m кадров. Результаты представляются в виде двумерного изображения в серой шкале (65536 уровней яркости) или условно-цветовой шкале (65536 цветов), которая описывает пространственные вариации распределения скоростей в исследуемой области.
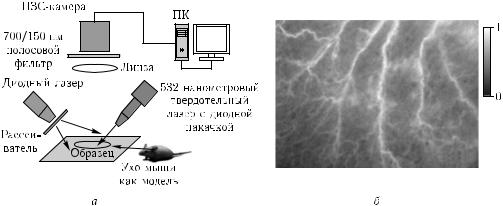
На рис. 2.33, а представлена оптическая схема системы визуализации кровеносных сосудов методом лазерного временного контраста (ЛВК) [773]. Измерительная система очень проста, освещающий диодный лазер на длину волны 670 нм, рассеиватель пучка, оптический фильтр и ПЗС-камера для регистрации спеклов. Твердотельный лазер с диодной накачкой с длиной волны 532 нм служит для создания окклюзии в выбранном сосуде путем его закупорки при коагуляции крови. Он необходим для проведения исследований по динамике сосудистой системы при окклюзии выборочных сосудов на модели уха мыши. Рис. 2.33, б представляет ЛВКизображение в виде пространственного распределения значений временного контраста лазерных спеклов; большие сосуды видны как белые линии, более мелкие и разветвленные образования соответствуют сигналам от эритроцитов, движущихся в капиллярах. Важно, что в отличие от многих других методов интравитальной микроскопии [777] этот метод не использует флуоресцентных или каких-либо других меток для визуализации микрососудов и поэтому потенциально более приспособлен для применения на пациентах при мониторинге in vivo лазерной коагуляции сосудов. Он позволяет надежно и с хорошим разрешением детектировать через кожу с глубины до 0,3 мм изменения движения эритроцитов при окклюзии сосудов васкулярной системы уха мыши. Дальнейшие совершенствования метода и измерительной системы должны позволить обеспечить еще лучшее разрешение и увеличить глубину, с которой получают изображения.
Рис. 2.33. Оптическая схема системы визуализации кровеносных сосудов методом лазерного временного контраста (ЛВК) (а); ЛВК изображение (б), шкала интенсивностей справа (0–1) представляет собой значение временного контраста лазерных спеклов; шкала размеров — бар = 1 мм; большие сосуды видны как белые линии, более мелкие и разветвленные образования соответствуют сигналам от эритроцитов, движущихся в капиллярах; 532 нанометровый твердотельный лазер с диодной накачкой служит для создания окклюзии в выбранном сосуде
путем его закупорки при коагуляции крови [773]
Например, снижения шумов можно добиться путем использования активной схемы усреднения спеклов, которая гарантирует хорошее усреднение по ансамблю

158 |
Гл. 2. Распространение света в биологических тканях |
[749, 755]. Можно применять различные методы генерирования спекл-изображений при сокращенном времени обработки, например путем использования вторичных низкокогерентных источников света — освещения рассеянным пучком лазера, пропущенным через вращающийся рассеиватель.
2.7.3.5. Диффузионно-волновая спектроскопия (ДВС). Диффузионно-волновая спектроскопия (ДВС) — новый класс исследований в области динамического рассеяния света, связанный с изучением динамики частиц в пределах очень коротких промежутков времени [12, 13, 19, 31, 105, 128, 172, 179, 180, 185, 409, 778–784]. Фундаментальное отличие ДВС от спектроскопии квазиупругого рассеяния света заключается в том, что ДВС применима только в случае сред с многократным рассеянием, что очень важно для биотканей.
Несмотря на внешнее сходство между экспериментами по ДВС и корреляционной спектроскопии оптического смешения (см. (2.83)–(2.85)) [177, 178], теория ДВС основана на качественно отличном описании распространения излучения именно в сильно рассеивающих средах. Благодаря многократному рассеянию каждый фотон, достигший точки наблюдения, испытывает большое число актов рассеяния N . Последовательные акты рассеяния, происходящие в момент времени t на рассеивающих
частицах, расположенных в точках r1(t), r2(t), ..., ri(t), ..., rN (t) среды, с волновыми |
|||||||||||||
векторами k1, k2, ..., ki, ..., kN , приводят к формированию поля E(t), у которого |
|||||||||||||
полный сдвиг фазы ϕ(t) определяется как [780] |
|
|
|
|
|
||||||||
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
ki(t)[ri+1(t) − ri(t)], |
(2.101) |
||||||
|
|
|
|
|
ϕ(t) = |
||||||||
|
|
|
|
|
i=0 |
|
|
|
|
|
|
|
|
|
|
ϕ(t) зависит от полной длины пути s каждого фотона, мигрирующего от источника |
|||||||||||
с координатой r0 до приемника с координатой rN +1: |
|
|
|||||||||||
|
|
|
|
N |
|
N |
|
ki |
|
|
|
|
|
|
|
|
s = |
|
|ri+1(t) − ri(t)| = i=0 |
|
|
|
[ri+1 |
(t) − ri(t)]. |
(2.102) |
||
|
|
|
i=0 |
| |
ki |
| |
|||||||
|
|
|
X |
|
X |
|
|
|
|
||||
Величина |
s связана |
с числом актов рассеяния |
N |
соотношением |
s = N ls, где |
||||||||
l |
s |
= (µ )−1 |
. В сильно |
рассеивающих |
средах, |
|
например коже человека, s можно |
||||||
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
рассматривать как статистически независимое случайное блуждание. Функция рас- |
|||||||||||||
пределения путей миграции фотонов p(s) в среде определяется как вероятность того, что свет пройдет оптический путь s, двигаясь от точки r0 до точки rN +1 [780]:
|
4πsD |
|
|
4sD |
2 |
|
|
p(s) = |
c |
3/2 |
exp |
c|r0 − rN +1| |
. |
(2.103) |
|
|
|
|
Здесь D — коэффициент диффузии фотонов (см. формулу (2.8)), а c — скорость света в среде.
Поле E(t) интерферирует с полем E(t + τ ), рассеянным немного позже на том же ряде рассеивающих частиц в момент времени t + τ . Время, необходимое фотону для прохождения всего оптического пути, короче характерного времени изменения положения рассеивающих частиц среды. Таким образом, в результате движения частиц разность фаз между полями E(t) и E(t + τ ) будет различной в разные моменты времени, т. е. флуктуирующей. Это определяет наличие временных флуктуаций интенсивности рассеянного излучения в дальней зоне (спеклы) (см. рис. 2.27).
Количественно указанные флуктуации описываются временной автокорреляционной функцией поля. Экспериментальная реализация ДВС весьма проста: нужно освещать рассеивающий объект светом лазера непрерывного действия и измерять флуктуации интенсивности рассеянного излучения в пределах одного спекла с по-
2.7. Особенности взаимодействия лазерного излучения с биотканями |
159 |
мощью ФЭУ (или лавинного фотодиода (ЛФД)) и электронного коррелятора. Типичная установка, используемая в модельных и экспериментальных исследованиях, показана на рис. 2.34 [12, 13, 19, 31, 179, 180, 185, 409, 782]. Свет, выходящий из некоторой области объекта, собирается одномодовым волоконным световодом (ВС) и передается на ФЭУ (или ЛФД). Выходной сигнал ФЭУ (ЛФД) с помощью цифрового автокоррелятора реконструируется во временную автокорреляционную функцию (АФ) флуктуаций интенсивности. Эта АФ связана с временной автокорреляционной функцией поля формулой Зигерта (см. соотношения (2.83) и (2.86)).
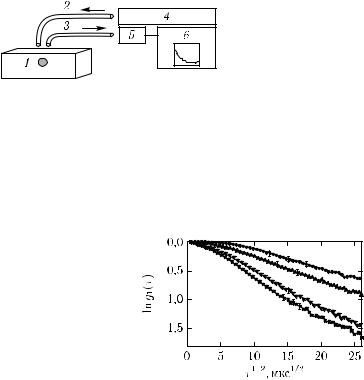
Рис. 2.34. Схема экспериментальной установки для ДВС: 1 — биоткань с локальной динами- |
||
ческой неоднородностью — опухоль с питающими ее кровеносными сосудами (темный шарик); |
||
2 и 3 — волоконно-оптический датчик — многомодовый облучающий волоконный световод (2) |
||
и одномодовый приемный волоконный световод; 4 — лазер с длиной когерентности не меньше, |
||
чем полная длина пути фотона s при многократном рассеянии; 5 — приемная система — фото- |
||
электронный умножитель (ФЭУ) или лавинный фотодиод (ЛФД), работающие в режиме счета |
||
фотонов и связанные с цифровым многоканальным электронным автокоррелятором (6) [12] |
||
На рис. 2.35 показаны экспериментальные результаты для нормированной времен- |
||
ной АФ поля. Характер АФ позволяет использовать их наклон (скорость затухания) |
||
как параметр для построения изображений |
|
|
динамических неоднородностей в среде. Это |
|
|
соответствует, в частности, ситуации, ко- |
|
|
гда скорость микроциркуляции крови ло- |
|
|
кально увеличена, например, вблизи расту- |
|
|
щей опухоли. Используя аналогичный под- |
|
|
ход, можно исследовать и направленные по- |
|
|
токи крови. |
|
|
Возможности метода ДВС для медицин- |
|
|
ских приложений были продемонстрирова- |
|
|
ны в [185, 409, 782]. В работах [409, 782] |
|
|
в качестве лазера использовался титан-сап- |
Рис. 2.35. Типичные автокорреляционные |
|
фировый лазер с мощностью около 100 мВт |
||
функции (АФ) флуктуаций поля g1(τ ), |
||
и длиной волны 800 нм. Лазерное излучение |
||
измеренные в условиях различной дина- |
||
подавалось на объект через многомодовый |
мики кровотока в эксперименте на доб- |
|
ВС с диаметром сердцевины 200 мкм. Рассе- |
ровольце при окклюзии артерии предпле- |
|
янное излучение регистрировалось в преде- |
чья и представленных в полулогарифми- |
|
лах одного спекла с использованием одномо- |
ческом масштабе в зависимости от τ 1/2; |
|
дового ВС с диаметром сердцевины 5 мкм. |
верхние кривые соответствуют медленно- |
|
Расстояние между оптическими волокнами |
му кровотоку, в то время как нижние — |
|
на поверхности объекта оставалось постоян- |
более быстрому [782] |
|
|
||
ным и равнялось 6 мм. Скорость потока кро- |
|
|
ви в объеме ткани предплечья человека устанавливалась при помощи наполняемой |
||
воздухом манжеты медицинского тонометра. Цифровой автокоррелятор на выходе |
||
ФЭУ, работающего в режиме счета фотонов, использовался для измерения временной |
||
АФ флуктуаций интенсивности и зависимости формы АФ от давления P , производи- |
||
мого тонометром. Такие зависимости для АФ поля, которая связана с АФ флуктуаций |
||

160 |
Гл. 2. Распространение света в биологических тканях |
интенсивности формулой Зигерта (см. (2.83)), представлены в полулогарифмическом масштабе на рис. 2.35. Эти зависимости указывают на высокую чувствительность наклона АФ к изменению давления, т. е. к изменению скорости объемного потока крови.
Из теоретического анализа следует [12, 13, 19, 31, 456, 778–780, 782], что как и в обычном методе динамического рассеяния света [177, 178], изменение g1(τ ) определяется через средний квадрат смещения частиц h r2(τ )i с той разницей, что наклон g1(τ ) растет пропорционально среднему числу рассеивающих частиц:
g1(τ ) = |
∞ |
p(s) exp |
−3k0h |
r |
(τ )iltr ds. |
(2.104) |
|
0 |
|||||||
|
|
|
1 2 |
2 |
|
s |
|
ltr — транспортная длина свободного пробега фотона (которая соответствует среднему расстоянию, на котором фотон полностью теряет первоначальное направление своего движения) (см. формулу (2.10)).
Учитывая уравнение (2.104), нормированная АФ флуктуаций поля может быть представлена в виде двух компонент, связанных с броуновским и упорядоченным движением рассеивающих частиц [409, 782]:
∞
|
|
|
|
|
|
|
|
|
|
|
τ |
|
|
|
|
|
τ |
2 |
s |
|
|
|
|
|
|
|
|
g1(τ ) = |
|
p(s) exp −2 |
|
|
+ |
|
|
ds, |
|
(2.105) |
|||||||||
|
|
|
|
0 |
τB |
|
τS |
ltr |
|
|
|||||||||||||
где τ −1 |
≡ |
|
T |
определяется формулой (2.85); τ −1 |
= |
0,18G |
q l |
|
характеризует на- |
||||||||||||||
B |
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
V | | tr |
|
||||||
правленный поток частиц, а GV — градиент скорости потока; |q| |
— модуль волнового |
||||||||||||||||||||||
вектора, |
|
|
|
|
|
4πn |
|
|
|
|
ϑ |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|q| = |
|
|
|
sin |
|
|
, |
|
|
|
|
|
|
|
(2.106) |
||
|
|
|
|
|
|
λ0 |
|
|
2 |
|
|
|
|
|
|
|
|||||||
где n — показатель преломления базового вещества рассеивающей среды (или средний показатель преломления базового вещества и вещества рассеивающих частиц, n = n), а ϑ — угол рассеяния. Пространственный масштаб тестирования коллоидной структуры (ансамбля биологических частиц) определяется величиной обратного модуля волнового вектора, |q|−1.
Cоотношение (2.105) позволяет выразить наклон АФ через коэффициент трансляционной диффузии (DT = kBT /6πηrh) (см. (2.85)) и градиент направленной скорости рассеивающих частиц GV . Когда упорядоченное течение существенно преобладает над броуновским движением, полулогарифмический график зависимости g1(τ ) от τ 1/2 имеет вид прямой линии, наклон которой пропорционален скорости потока рассеивающих частиц.
Рисунок 2.36 показывает измеренную скорость потока крови добровольца как функцию приложенного давления в области предплечья, создающего артериальную окклюзию. Если пренебречь броуновской компонентой, эта зависимость характеризуется изменением наклона АФ. Поскольку измерения производились на длине волны, близкой к изобестической точке (805 нм — длина волны, для которой имеет место равенство поглощательной способности оксигенированного и дезоксигенированного гемоглобина), изменение степени оксигенации крови из-за вариаций приложенного давления лишь слегка влияет на наклон АФ (скорость потока крови).
Заметим, что если параметры кровотока остаются постоянными, измеренные АФ дают информацию, относящуюся к статическим оптическим параметрам многократно рассеивающей среды, т. е. ltr или µ′s, µa и g (см. формулы (2.10) и (2.105)). Действительно, как показано в работе [784], полуширина спектра временных флуктуаций

2.7. Особенности взаимодействия лазерного излучения с биотканями |
161 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.36. Изменение относительного наклона временной АФ флуктуаций поля g1(τ ), представленной на рис. 2.35 и измеренной в реальном масштабе времени для добровольца при изменяющейся окклюзии артерии предплечья; степень окклюзии представлена в виде давления P в манжете на предплечье добровольца (мм. рт. ст.) [782]
интенсивности в условиях многократного рассеяния зависит не только от динамических и геометрических параметров рассеивающих частиц, но и от поглощающей способности эритроцитов в крови, что позволяет оценивать степень оксигенации крови из результатов измерений, производимых вдали от изобестической длины волны.
2.7.4. Конфокальная микроскопия. Конфокальная лазерная сканирующая микроскопия, использующая конфокальный принцип (две оптически сопряженные диафрагмы или щели малого размера в плоскости предметов и изображений) для селекции отраженных (баллистических) фотонов (рис. 2.37), является хорошо разработанным методом получения высококачественных изображений в биомедицинских исследованиях [1, 3, 12, 13, 15, 18, 19, 41, 439–446, 707, 785–789]. Разрешение этого метода дает возможность распознать различные типы клеток и одновременно наблюдать движущиеся клетки крови в микрососудах [788].
В обычном микроскопе поперечное и продольное разрешение не являются независимыми. Большим преимуществом конфокального микроскопа является то, что продольное разрешение усилено за счет селекции фотонов, в результате чего появляется возможность «оптического секционирования», т. е. получения послойного изображения [15, 440, 443, 707, 785, 786]. Поперечное разрешение конфокального микроскопа обратно пропорционально числовой апертуре (NA) линзы объектива микроскопа [788]:
x = |
0,46λ |
. |
(2.107) |
|
|||
|
NA |
|
|
Разрешение x составляет 0,4 мкм при NA = 1,2 линзы объектива с водной иммерсией на длине волны λ = 1064 нм. Продольное разрешение более чувствительно к числовой апертуре линзы объектива микроскопа. Поэтому для получения максимального продольного разрешения и, следовательно, более тонкого послойного анализа, нужно
6 Тучин
