
Борзенко,Зайцев
.pdf
алгоритмическом языке ФОРТРАН показан на рис. 4.2.
SUBROUTINE XYKKR(X1,X4,P,Y1,Y4,T,K1,K4)
REAL K1,K4
K4=1./(4.202-4.730*ALOG10(P))
T=(25.308-1./K4)/0.1824
Y4=K4*X4
Y1=1.-Y4
IF(X1.EQ.0.0)GO TO 18
K1=Y1/X1
18CONTINUE RETURN END
Рис. 4.2. Подпрограмма расчета параметров фазового равновесия смеси кислород–криптон
Константа фазового равновесия разбавленного раствора кислород–криптон имеет практически постоянное значение. Так, при
р = 125 кПа K4 = 0,118, а при р = 0,15 МПа K4 = 0,123, в то время как в рассматриваемом интервале изменения концентрации K3 = 1,0.
При расчете фазового равновесия обогащенной смеси криптон–ксенон (4–5) в целях получения чистых компонентов могут быть использованы аппроксимационные зависимости [21], позволяющие определить коэффициент разделения и другие параметры равновесия. Подпрограмма расчета равновесных параметров системы криптон–ксенон в интервале давлений от 0,2 до 0,45 МПа показана на рис. 4.3.
Коэффициент разделения смеси криптон–ксенон можно определить по уравнению
ln α |
45 |
= A + A x |
4 |
+ A x |
2 |
+ A x3 . |
(4.16) |
||
|
1 |
2 |
3 |
4 |
4 |
4 |
|
||
В уравнении (4.16) коэффициенты A1…A4 представлены в зависимости от давления:
62

A1 = 3,06486 + p[− 4,7260893 + p(7,8979574 − p 5,3903518)];
A2 = 4,30344 + p[− 8,8362595 + p(9,8571448 − p 4,0427681)];
A3 = −7,31344 + p[19,787712 + p(− 25,601349 + p12,128302)]; (4.17)
A4 = 3,35351+ p[− 10,109953 + p(13,257147 − p 6,0641518)],
где р – давление, МПа.
SUBROUTINE XYKXE(X4,X5,P,Y4,Y5,T,K2,K5) REAL K4,K5
С=9.36546-15.40755*Х4+56.9793*Х4**2.-86.1694*Х4**3.+
*60.5373*X4**4.-16.00*X4**5. D=-1543.561+4244.17*X4-13864.97*X4**2.+20942.37*X4**3.-
*14895.52*X4**4.+4000.0*X4**5.
AA=ALOG10(P/0.101325)*2.30259 T=D/(AA-C)
А1=3.06846+Р*(-4.7260893+Р*(7.8979574-Р*5.3903518))
A2=4.30344+P*(-8.8362595+P*(9.8571448-P*4.0427681)) A3=-7.31344+P*(19.787712+P*(-25.601349+P*12.128302)) A4=3.35351+P*(-10.109953+P*(13.257147-P*6.0641518)) ALP45=EXP(А1+А2*Х4+АЗ*Х4**2.+A4*Х4**3.)
Y4=ALP45*X4/(X5+ALP45*X4) Y5=1.-Y4
IF(X4.EQ.0.0)G0 TO 21 K4=Y4/X4
21 IF(X5.EQ.0.0)G0 TO 18 K5=Y5/X5
18CONTINUE RETURN END
Рис. 4.3. Подпрограмма расчета равновесных параметров системы криптон–ксенон
Значение равновесной концентрации паровой фазы при известном давлении и составе жидкой фазы определяем из уравнения
y4 |
= |
|
α45 x4 |
|
. |
(4.18) |
||||
α |
45 |
x |
4 |
+ x |
5 |
|||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||
Значение температуры кипения смеси при заданных ее параметрах определяем по уравнению
63
T = |
D |
|
|
, |
|
|
|
|
|
|
|
|
(4.19) |
||
C lg(p pст ) |
|
|
|
||||
|
− C |
|
|
||||
|
|
|
|
||||
где p – давление смеси, МПа; pст – стандартное давление, |
MПа, |
||||||
pст = 0,101325 MПа; |
|
|
|
|
|
|
|
C = 9,36546 −15,40755x |
4 |
+ 56,9793x |
2 − |
|
|||
|
|
|
|
4 |
|
|
|
− 86,1694x43 + 60,5373x44 −16,0x45 ; |
|
|
(4.20) |
||||
D = −1543,561+ 4244,17x |
−13864,97x2 |
+ |
|
||||
|
|
4 |
|
|
4 |
|
|
+ 20942,37x3 |
−14895,52x |
4 + 4000,0x5 . |
|
(4.21) |
|||
4 |
|
|
4 |
|
4 |
|
|
Результаты вычислительного эксперимента по фазовому равновесию смеси криптон–ксенон показаны на рис. 4.4 и 4.5.
K4
K5
6,0
K4 |
1,0 |
4,0 |
1 |
|
|
|
2 |
K5 |
0,5 |
2,0
2
1
0 |
0,2 |
0,4 |
0,6 |
0,8 |
x4, |
моль/моль
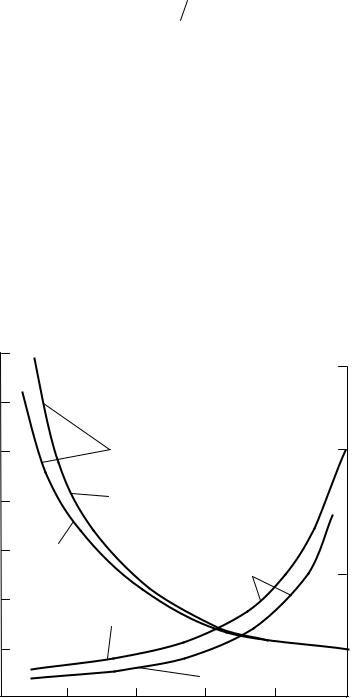
Рис. 4.4. Зависимость изменения констант фазового равновесия смеси криптон–ксенон от состава жидкой фазы и давления:
1 – 2000 гПа; 2 – 4000 гПа
64

Из анализа полученных данных следует, что, в отличие от ранее рассмотренных бинарных смесей, в системе криптон–ксенон имеет место более заметное изменение значений констант фазового равновесия и коэффициентов разделения. При этом константа фазового равновесия криптона K4 в широком диапазоне изменения концентраций (см. рис. 4.4) имеет значение намного больше минимального (K4 = 1,0),
а значение константы фазового равновесия ксенона K5 примерно на порядок ниже по сравнению K4.
α45 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
20 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x4, |
||
0 |
0,2 |
0,4 |
0,6 |
0,8 |
||||||||
|
|
|
|
|
|
|
|
|
|
моль/моль |
||
Рис. 4.5. Зависимость коэффициента разделения для смеси криптон–ксенон от состава жидкой фазы и давления:
1 – 2000 гПа; 2 – 3000 гПа; 3 – 4000 гПа
Такое соотношение между значениями констант фазового равновесия K4 и K5, которое отражает физико-химические свойства компонентов, позволяет получить большие величины коэффициентов разделения смеси криптон–ксенон (4–5) (см. рис. 4.5) с нелинейной зависимостью от молярного состава смеси.
65
4.2.3. Расчет параметров фазового равновесия бинарных и тройных смесей молекул водорода
Водород, поступающий на низкотемпературную ректификацию, представляет собой многокомпонентную смесь, состоящую из следующих форм молекул: параводорода р-Н2, ортоводорода o-Н2, водорододейтерия HD, ортодейтерия o-D2 и парадейтерия p-D2 (исходная концентрация в смеси молекул дейтерия 0,03 %).
Дейтерий из исходной смеси выделяют в два этапа: вначале разделяют смесь HD–H2 для получения водорододейтерия, а затем этот промежуточный продукт в специальном реакторе преобразуют
втройную систему D2–HD–D2, из которой получают дейтерий.
Всвязи с недостаточной информацией об экспериментальных данных по фазовому равновесию рассматриваемых систем и
отклонением смесей HD–H2 и D2–H2 по своим свойствам от законов идеальных растворов примерно на 1,5 % [34] при расчете фазового равновесия данных систем были применены законы Рауля и Дальтона. В этом случае коэффициенты разделения для бинарных смесей могут быть определены по соотношению (4.3) с использованием аппроксимационных полиномов [8] для расчета давления насыщенных паров чистых компонентов. Тогда уравнения для вычисления коэффициентов разделения имеют вид
|
|
|
|
|
|
|
|
|
1,4752 |
|
|
|
|
|
|
|||||
|
α12 = exp 2,30259 − 0,34874 |
− |
|
|
|
|
|
|
+ 0,00999T ; |
|
|
|
(4.22) |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
α13 |
|
|
|
|
|
12,4573 |
|
|
|
|
2 |
|
|
|
||||||
= exp 2,30259 |
0,065516− |
|
|
|
|
|
|
|
+ 0,003111T + 0,00021T |
|
|
; |
(4.23) |
|||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10,9821 |
|
|
|
|
|
|
2 |
|
|
|
||||||
α23 = exp 2,30259 |
0,41425− |
|
|
|
|
|
|
|
− 0,006879T |
+ 0,000021T |
|
|
, |
(4.24) |
||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где принято, что индекс 1 относится к D2, 2 – к HD и 3 – к Н2. Аналогичным образом составлены уравнения для расчета
коэффициентов разделения бинарных смесей нормального водорода. Температуру насыщения при фазовых переходах в рассматриваемых смесях находим методом итераций, в частности
66

методом половинного деления трансцендентного уравнения вида (4.5) по заданному давлению разделяемой смеси. При известных значениях αik и составе жидкой фазы бинарной смеси по уравнению типа (4.4) находим концентрацию компонентов в паровой фазе, а по соотношению (4.1) – константы фазового равновесия.
Для расчетов параметров фазового равновесия бинарных смесей разработаны соответствующие подпрограммы. На основе уравнений (4.22)–(4.24) с использованием зависимостей типа (4.8) составлены подпрограммы расчета фазового равновесия тройных смесей молекул параводорода, а также нормального водорода.
Подпрограмма расчета фазового равновесия молекул нормального водорода изображена на рис. 4.6.
SUBROUTINE XYHD3(X1,X2,X3,P,Y1,Y2,Y3,T.K1,K2,K3)
REAL K1,K2,K3
DIMENSION XF(3),YF(3)
XF(3)=20.
XF(1)=30.
10XF(2)=(XF(1)+XF(3))/2. DO 11 I=1,3
PS3=EXP((4.760284-44.2674/XF(I)+0.021669*XF(I)-0.000021*
*XF(I)**2)*2.30259) PS2=EXP((5.17454-55.2495/XF(I)+0.01479*XF(I))*2.30259) PS1=EXP((4.8258-56.7247/XF(I)+0.02478*XF(I))*2.30259) PS=PS1*X1+PS2*X2+PS3*X3
11 YF(I)=P-PS IF((YF(1)*YF(2)).LT.0.0)XF(3)=XF(2) IF((YF(1)*YF(2)).GT.0.0)XF(1)=XF(2) EPS=ABS(YF(1)-YF(3)) IF(EPS.GT.0.001)GO TO 10 T=XF(2)
ALP13=EXP((0.065516-12.4573/T+0.003111*T+0.000021*T**2)*2.30259) ALP23=EXP((0.414256-10.9821/T-0.006879*T+0.000021*T**2)*2.30259) Y1=ALP13*X1/(ALP13*X1+ALP23*X2+X3)
Y2=ALP23*X2/(ALP13*X1+ALP23*X2+X3) Y3=1.-Y1-Y2
IF(X2.EQ.0.0)G0 TO 19 K2=Y2/X2
19 IF(X3.EQ.0.0)G0 TO 20 K3=Y3/X3
20К1=Y1/X1
RETURN END
67
Рис. 4.6. Подпрограмма расчета фазового равновесия молекул нормального водорода
Среди бинарных смесей молекул водорода наибольшей разделительной способностью обладает система 1–3 (рис. 4.7), что объясняется, прежде всего, большей разностью парциальных давлений чистых компонентов смеси. Константы фазового равновесия бинарных
смесей молекул |
водорода в рассмотренном диапазоне давлений |
||||||
(р = 150...350 кПа) |
|
имеют близкие значения. Однако наиболее |
|||||
трудноразделимой |
|
системой |
является |
смесь |
дейтерия |
и |
|
водорододейтерия. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K1, K3 |
|
1 2 3 4 |
|
|
|
|
|
|
|
|
|
|
|
||
2,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K3 
1,0
K1
|
1 2 3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0,2 |
0,4 |
0,6 |
0,8 x1, |
||||
моль/моль
Рис. 4.7. Изменение констант фазового равновесия смеси D2–H2 в зависимости от состава и давления:
1 – 1000 гПа; 2 – 2000 гПа; 3 – 3000 гПа; 4 – 4000 гПа
Коэффициент разделения αik во всем диапазоне концентраций изменяется незначительно. Например, для бинарной смеси HD–H2 при давлении р = 150 кПа коэффициент α23
изменяется от 0,450 до 0,373, а при р = 350 кПа – от 0,538 до 0,466
и имеет прямолинейную зависимость.
68
4.2.4. Расчет параметров фазового равновесия многокомпонентной углеводородсодержащей смеси
Сжиженный природный газ (СПГ) представляет собой многокомпонентную смесь, состоящую из ряда компонентов с различными теплофизическими свойствами. При его транспортировании, хранении, ожижении и использовании происходят тепломассообменные процессы, для расчета которых может быть применен алгоритм на базе уравнения состояния Редлиха–Квонга в модификации Соаве [12]
z |
m |
= |
|
υm |
− |
OAbm Fm |
|
. |
(4.25) |
||||
υ |
m |
− b |
OB(υ |
m |
+ b |
) |
|||||||
|
|
|
|
|
|||||||||
|
|
|
|
m |
|
|
m |
|
|
||||
Наиболее часто встречается задача фазового равновесия, когда
N
по заданному давлению p и составу жидкой фазы ∑xi = 1 (N – число
i =1
компонентов смеси) требуется определить температуру смеси Т и
N
состав паровой фазы ∑ yi = 1.
i =1
Расчет фазового равновесия базируется на основе уравнения Соаве и выражения для расчета коэффициента летучести:
|
ln ψ |
i |
= |
|
bi |
(z |
m |
− 1) |
− ln z |
m |
+ ln |
υm |
|
− |
|
|||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
bm |
|
|
|
|
|
υm − bm |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
a′(T ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
− |
|
bi |
|
− 2∑(1 − k ij )[ai′(T )] |
y ln |
υm + bm , |
(4.26) |
|||||||||||||||
b RT |
|
|||||||||||||||||||||
|
b |
|
|
|
j |
|
|
|
|
a′(T ) |
|
|
υ |
m |
|
|||||||
|
m |
|
|
m |
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
bi |
|
= |
OBRTкрi |
; bm = ∑bi yi , |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
(4.27) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
pкрi |
|
|
i |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
здесь Tкр i, pкр i – критическая температура и критическое давление i-го компонента смеси; zm – коэффициент сжимаемости смеси; υm –
69

молярный объем смеси;
|
|
a′(T )= |
OA |
RTF b ; |
a′(T )= |
OA |
RTF b , |
|
|
|
|||
|
|
|
|
|
|
||||||||
|
|
|
|
|
OB |
m m |
i |
|
OB |
i i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
здесь OA, OB – коэффициенты (OA = 0,4274802327; OB = |
|||||||||||||
0,08664035); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∑∑yi y j (1 − ki j ){[TкрiTкр j (pкрi pкр j )]Fi Fj }0,5 |
|
||||||||||
Fm = |
|
i |
j |
|
|
|
|
|
|
|
|
; |
(4.28) |
|
|
|
|
|
∑y jTкр j |
pкр j |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
j |
|
|
|
|
|
|
|
Fi |
= |
1 |
[1 + (0,48 + 1,574ωi − 0,176ωi2 )(1 − T )0,5 ]2 |
, |
|
(4.29) |
|||||||
T0i |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
здесь T0i = T Tкрi |
– |
приведенная |
температура; ωi |
– |
фактор |
||||||||
ацентричности молекул i-го вещества; yi и yj – содержание i-го и j-го компонентов в смеси; kij – параметр бинарного взаимодействия компонентов смеси.
Межфазовое равновесие характеризуется равенством р, Т и парциальной летучести отдельных компонентов в любой точке систем:
– для каждой фазы;
– для каждой фазы;
– для каждой фазы (индекс 1 – пар; индекс 2 – жидкость; номера компонентов равны 1, 2, …, n;).
Для бинарной системы пар–жидкость можно выразить условия равновесия и преобразовать это равенство в выражение, содержащее коэффициенты летучести и активности:
y |
ψ |
i p |
= x |
γ |
i |
f |
OL |
(4.30) |
i |
|
i |
|
|
i |
|
||
или |
|
|
|
|
|
|
|
|
yi ψi p = xi γi ψs i ps i (T )(PF )i . |
(4.31) |
|||||||
На рис. 4.8 изображена блок-схема расчета коэффициентов уравнения Редлиха–Квонга в модификации Соаве, которые
70

используются для решения уравнения (4.26). Структурно она выполняет три цикла, зависящие от числа компонентов N и состава
N
смеси ( ∑xi =1).
i =1
Вблоке 1 осуществляется ввод исходной информации, характеризующей состав и свойства смеси.
Вблоке 2 рассчитываются индивидуальные коэффициенты
Fi (F(I)* по уравнению (4.29)), bi (B(I)) по (4.27), а также суммарный параметр bm (BM).
* Здесь и далее в аналогичном описании в скобках приведены идентификаторы величин, принятые в алгоритме.
71
