
- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
5. Скорость химической реакций
Химическая кинетика* – раздел химии, изучающий механизмы, скорости и условия протекания химических реакций.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объёма (для гомогенной реакции) или на единице площади поверхности раздела фаз** (для гетерогенной реакции).
Гомогенные реакции осуществляются во всём объёме жидкого или газового раствора.
Гетерогенные реакции осуществляются на поверхности твёрдого или жидкого вещества, взаимодействующего с жидкостью или газом.
Поскольку отношение количества вещества (моль) к единице объёма (л) – это молярная концентрация раствора, то скорость гомогенной реакции обычно характеризуют изменением концентрации исходного вещества (реагента) или конечного вещества (продукта реакции) в растворе за единицу времени [моль / (м3 ∙ с) или моль /(л ∙ с)].
Среднее значение скорости химической реакции υ определяется изменением концентрации Δс одного из реагентов или продуктов реакции за период времени ∆t
υ
=
![]() .
.
Поскольку по мере протекания химической реакции концентрация реагента убывает (∆с = с2 – с1 < 0), то отношение ∆с /∆t оказывается величиной отрицательной (∆t = t2 – t1 – величина положительная). Чтобы скорость реакции по реагенту имела положительное значение, это отношение берётся со знаком минус.
Истинное (мгновенное) значение скорости химической реакции в данный момент времени может быть определено как предел, к которому стремится средняя скорость при ∆t → 0, то есть как первая производная от концентрации по времени:
![]() =
lim
=
lim![]()
![]() .
.
Главными факторами, определяющими скорость химической реакции, являются: природа и концентрация реагирующих веществ, температура и наличие катализатора.
Природа реагирующих веществ является важнейшим фактором. Именно из-за химического разнообразия веществ одни реакции (молекулярные) протекают медленно, а другие (ионные, радикальные) – очень быстро. Например, в воздухе молекулярный кислород (∙O2∙ –бирадикал) весьма реакционноспособен, а азот – индифферентен.
В большинстве химических реакций превращение исходных веществ в конечные происходит не непосредственно, а через ряд промежуточных стадий, которые называются элементарными стадиями или простыми реакциями.
Механизм химической реакции – это полная последовательность её элементарных стадий.
Количественно элементарные стадии описываются основным законом химической кинетики, или законом действующих масс: скорость элементарной стадии химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции для этой стадии.
Для элементарной стадии, где реагентами являются вещества А и В и которая описывается уравнением со стехиометрическими коэффициентами а и в:
аА + вВ → продукты реакции,
закон действующих масс выражается следующим образом:
![]() =
kca(A)cв(B).
=
kca(A)cв(B).
Коэффициент пропорциональности k называется константой скорости химической реакции, которая численно равна скорости реакции, если концентрации реагирующих веществ равны 1 моль/л. Константа скорости зависит от природы реагирующих веществ, температуры системы и наличия катализатора и не зависит от концентрации реагирующих веществ.
Закон действующих масс можно использовать для расчёта скорости одностадийных химических реакций. Например, скорость реакции
2NO2 → N2O4
бурый газ бесцветный газ
можно рассчитать по уравнению
![]() =
kc2(NO2).
=
kc2(NO2).
Большинство химических реакций протекает в несколько элементарных стадий. Стадия, которая протекает медленнее других, является лимитирующей и определяет скорость реакции в целом. В таком случае скорость химической реакции описывается уравнением закона действующих масс для лимитирующей стадии.
При гетерогенных реакциях концентрации веществ, находящихся в твёрдой фазе, обычно не изменяются в процессе реакции и поэтому не включаются в выражении для определения её скорости.
Скорость химической реакции с ростом температуры увеличивается. При небольшом изменении температуры скорость реакции с некоторой степенью погрешности определяется по правилу Вант-Гоффа: повышение температуры на каждые 10 К увеличивает скорость большинства химических реакций в 2–4 раза:
![]() =
=
![]() =
=![]() ,
,
где
![]() –
скорость реакции при температуре Т;
–
скорость реакции при температуре Т;
![]() –скорость
реакции при температуре Т + ∆Т;
–скорость
реакции при температуре Т + ∆Т;
kТ – константа скорости реакции при температуре Т;
![]() –константа
скорости реакции при температуре Т +
∆Т;
–константа
скорости реакции при температуре Т +
∆Т;
γ – температурный коэффициент скорости химической реакции,
принимающий значения в интервале 2-4.
Для определения константы скорости газовых реакций в широком интервале температур применимо уравнение Аррениуса:
k
= А![]() ,
,
где k – константа скорости химической реакции;
А – постоянный множитель, характеризующий число геометрически
благоприятных для протекания химического взаимодействия
столкновений;
![]() –множитель,
характеризующий долю энергетически
–множитель,
характеризующий долю энергетически
эффективных столкновений при температуре Т;
е – основание натуральных логарифмов (e = 2,718…);
Еа – энергия активации – энергия веществ, достаточная для того,
чтобы они вступили в химическую реакцию, Дж / моль;
R – молярная газовая постоянная (8,314 Дж / (моль ∙ К);
Т – абсолютная (термодинамическая) температура, К.
Уравнение Аррениуса – критерий осуществления химического взаимодействия молекул, сталкивающихся в благоприятной ориентации и обладающих достаточной кинетической энергией. Из этого уравнения следует, что константа скорости химической реакции тем больше, чем меньше энергия её активации.
Пример 1. Как изменится скорость прямой реакции, если давление в гомогенной системе
2СО
+ О2 ![]() 2СО2
2СО2
увеличить в 2 раза ?
Решение.
Согласно закону действующих масс скорость данной реакции выражается уравнением
υ1 = k · с2(СО) · с (О2),
где с (СО) и с (О2) – молярные концентрации реагентов.
Вследствие увеличения давления в системе (то есть уменьшения объёма сосуда) в 2 раза концентрация каждого из реагентов увеличится в 2 раза. Следовательно,
υ2 = k · [2с (СО)]2 · 2с (О2) = k · 4с2(СО) · 2с (О2) = 8k · с2(СО) · с (О2)
Из отношения выражений для υ1 и υ2:
![]() =
=
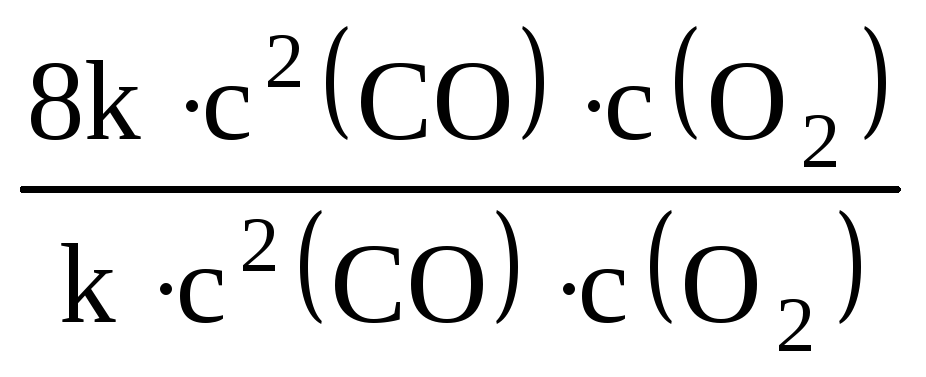
находим, что скорость прямой реакции увеличится в 8 раз.
Ответ: увеличится в 8 раз.
Пример 2. Температурный коэффициент скорости химической реакции равен 2,8. Во сколько раз увеличится скорость этой реакции при повышении температуры от 20 до 75 0С?
Решение.
Зависимость скорости химической реакции от температуры может быть выражена уравнением
![]() =
=![]()
где
![]() и
и![]() –
скорость реакции при температуре Т1
и Т2
соответственно;
–
скорость реакции при температуре Т1
и Т2
соответственно;
γ – температурный коэффициент скорости химической реакции.
![]() =
=
![]() =
2,85,5 =
288.
=
2,85,5 =
288.
Ответ: скорость химической реакции увеличится в 288 раз.
