
- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
1. Основные понятия химии
Химический элемент – вид (совокупность9) атомов с одинаковым положительным зарядом ядра.
Химический знак (символ) обозначает название химического элемента, 1 его атом, 1 моль атомов этого элемента.
Атом
– это микрочастица, наименьшая часть
химического элемента – носитель его
свойств. Атом состоит из положительно
заряженного ядра и окружающих его
электронов. Обозначение атомов элемента
![]() ,
гдеZ
– атомный
номер
– число протонов в ядре атомов элемента,
которое соответствует числу электронов
в электронейтральных атомах данного
элемента и его положению в Периодической
системе химических элементов
Д.И.Менделеева.
,
гдеZ
– атомный
номер
– число протонов в ядре атомов элемента,
которое соответствует числу электронов
в электронейтральных атомах данного
элемента и его положению в Периодической
системе химических элементов
Д.И.Менделеева.
Массовое число атома – это число нуклидов, или суммы протонов и нейтронов. Масса нуклидов измеряют при помощи масс-спектрометра.
|
Нуклид |
Относиткльная нуклидная масса |
Относительное обогащение природного хлора |
|
35Cl |
35 |
75% |
|
37Cl |
37 |
25% |
Относительная
атомная масса = ![]() =
35,5
(а.е.м.)
=
35,5
(а.е.м.)
Ядро, в свою очередь состоит из нуклонов – протонов (р) и нейтронов (n). Атомы являются как электронейтральными частицами (например, H•, He:, Li•, :Cl:), так и положительно- и отрицательно заряженными (простые катионы, например, Н+, Na+, Mg2+, Al3+, или простые анионы, например, F–, S2–, N3–).
Молекула – микрочастица, образованная из двух или большего числа атомов и способная к самостоятельному существованию. Обладает свойствами, отличающими её от других молекул. Эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества.
Массу атомов измеряют в относительных (безразмерных) единицах. За атомную единицу массы (а. е. м.) принимают углеродную единицу – 1/12 массы атома углерода с массовым числом 12 (атома нуклида угерода-12, или 12С):
Ar
=
![]() ,
,
где Ar – относительная атомная масса (r – от лат. relative – относительный);
m – масса атома, кг;
а. е. м. – атомная единица массы, равная 1,66 ∙ 10-27 кг.
Обычно молекулами называют электронейтральные частицы (например Н2, Н2О, Н2SO4); если молекула несёт электрический заряд (положительный или отрицательный), то говорят о молекулярных ионах – катионах или анионах соответственно (например Na+, NH4+, Ba2+, NO3–, CH3COO–, SO42–). В химическом соединении положительные ионы существуют вместе с свободно-отрицательными ионами. Молекулами также являются радикалы (например, •NO2, •ОН, •СН3).
Ионы – заряженные частицы, возникающие при потере или присоединении электронов электронейтральными атомами (простые ионы) или группами химически связанных атомов (сложные ионы).
Радикалы – это атомы или группы атомов, имеющие один или несколько неспаренных электронов.
Изотопы– разновидности атомов химического элемента с разными массовыми числами А.
Изотопы имеют практически одинаковые химические, но разные физические свойства (например, массы атомных ядер).
Относительная атомная масса химического элемента (Ar) или просто атомная масса (она приводится в таблице Периодической системы химических элементов Д.И. Менделеева) – величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода 12С; является одной из основных характеристик химического элемента.
Относительная молекулярная масса (Мr) или просто молекулярная масса – безразмерная величина, показывающая во сколько раз масса молекулы (формульной единицы) данного химического соединения больше атомной единицы массы.
Мr
=
![]()
Относительная молекулярная масса равна сумме относительных атомных масс формульного состава данного химического соединения:
Мr
=
![]() Ar(Хi),
Ar(Хi),
где Х – атомы химических элементов, входящих в состав данной молекулы (формульной единицы);
i – число атомов каждого химического элемента в данной молекуле (формульной единице).
Например, Мr (Н3РО4) = 3 ∙ 1 + 31 + 4 ∙ 16 = 98.
Если вещество немолекулярного, а, например, ионного строения, то для него также используют понятие относительной молекулярной массы, рассчитывая её по формульной единице этого вещества.
К таким единицам условно относят как реально существующие частицы: молекулы (H2, O2, H2O, CH4), атомы (H, O, C, Na), катионы (Na+, Al3+, NH4+), анионы (Cl-, SO42-, PO43-) и радикалы (HO•, H3C•), так и определённое сочетание атомов в веществах немолекулярного строения – «условные молекулы» солей [NaCl, CaCl2, Al2(SO4)3], гидроксидов, оксидов и пероксидов металлов [NaOH, Ca(OH)2, Al(OH)3, Na2O, CaO, Al2O3, Na2O2, CaO2], а также некоторых других соединений (диоксида кремния SiO2, карбида кремния SiC).
Стехиометрия – раздел химии, в котором изучаются количественный состав веществ и соотношения между количествами веществ, вступающих в химическую реакцию и образующихся в результате реакции.
В практике имеют дело не с отдельными атомами или молекулами, а с их молярными количествами.
Установление количественных соотношений в стехиометрии производится на основе понятия моль.
Моль (n) – количество вещества, содержащее столько же структурных единиц, сколько атомов содержится в 0,012 кг или в 12 г нуклида углерода с массовым числом 12 (нуклида 12С).
Структурными единицами могут быть электроны, протоны, атомы, молекулы, ионы, радикалы и другие частицы. Число атомов в 0,012 кг нуклида 12С определяется следующим образом:
N
=
![]() = 6,021 ∙ 1023,
= 6,021 ∙ 1023,
где 1,993 ∙ 10-26 кг – масса атома нуклида углерода-12.
В химии обычно оперируют не отдельными атомами или молекулами, а используют понятие «количество вещества».
Количество вещества показывает число структурных единиц (атомов, молекул, ионов). Единица количества вещества – моль.
Величина NA, равная 6,021∙1023 моль–1, является фундаментальной физической постоянной, или постоянной (числом) Авогадро. Один моль любого вещества с молекулярной структурой содержит 6,021 ∙ 1023 молекул.
Если известно число структурных единиц N какого-либо вещества, то количество этого вещества n определяется по формуле:
n
=
![]() .
.
Масса 1 моля называется молярной массой и обозначается М. Она определяется как отношение массы вещества к его количеству:
М
=
![]() .
.
В соответствии с Международной системой единиц (СИ) молярная масса измеряется в кг/моль, но для химических расчётов удобнее использовать молярные массы, выраженные в г/моль; иногда в мг/м, моль.
Например, М (Н2О) = 0,018 кг/моль, или 18 г/моль.
Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе, или относительной атомной массе:
М = Мr или М = Аr.
Чтобы рассчитать молярную массу вещества, необходимо вычислить его относительную молекулярную массу, сложив относительные атомные массы всех химических элементов, входящих в состав молекулы (формульной единицы) вещества, а затем выразить молярную массу в соответствующих единицах.
Например: Mr (CuSO4∙5H2O) = 64 + 32 + 4∙16 + 5(2∙1 + 16) = 250.
Следовательно, молярная масса кристаллогидрата сульфата меди(II) равна 250 г/моль и, чтобы взять 0,1 моль данного вещества, необходимо взвесить 25 г этого вещества.
Зная относительную атомную или молекулярную массу, можно выразить молярную массу атома или молекулы в граммах или килограммах.
Например, относительная атомная масса Ar фтора равна 19. а.е.м. Следовательно, молярная масса атомов фтора равна 19 г/моль. Зная, что 1 моль содержит 6,02∙1023 атомов, найдём массу одного атома фтора: m(F) = M(F) / NA=19 г/моль : 6,02∙1023 моль-1 = 3,16∙10-23 г = 3,16∙10-26 кг.
Стехиометрические коэффициенты – числа, стоящие перед химическими формулами и сиволами веществ в уравнении химической реакции. Они определяют соотношение количеств исходных веществ (реагентов) и конечных веществ (продуктов реакции).
Стехиометрические индексы – числа, стоящие в химических формулах веществ справа внизу при символах химических элементов. Они определяют соотношение количеств атомов элементов в молекулах (формульных единицах) веществ.
Пример 1. Выразите в граммах массу:
а) одной молекулы брома;
б) двух атомов кальция.
Решение.
Масса 1 моль вещества, выраженная в г/моль, численно равна относительной молекулярной (или атомной) массе (М = Mr или Ar). Следовательно, молярная масса Вr2 равна 160 г/моль, а Cа – 40 г/моль. Используя постоянную Авогадро, которая показывает число молекул, атомов или других структурных единиц в одном моле какого-либо вещества, найдём массу одной молекулы брома:
m(Br2)
=
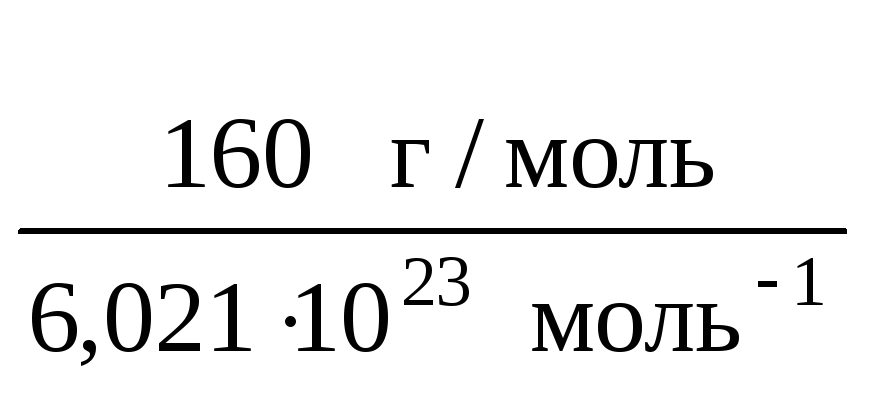 = 2,66 · 10–22
г;
= 2,66 · 10–22
г;
и массу двух атомов кальция:
m
(Ca)
=
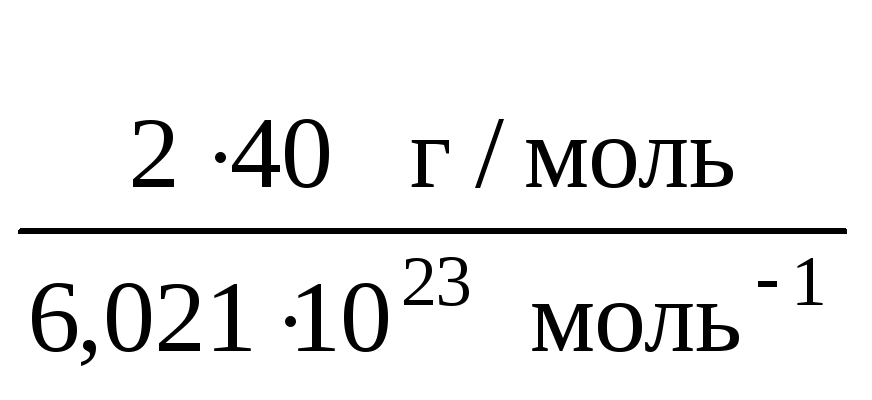 = 1,33 · 10–22
г.
= 1,33 · 10–22
г.
Ответ: а) 2,66 · 10–22 г; б) 1,33 · 10–22 г.
Пример 2. Вычислите (в г) массу 400 мл водорода, содержащегося в сосуде при давлении 102 кПа и температуре 293 К.
Решение.
Условия задачи выразим в единицах СИ:
-
р(H2) = 102 кПа = 1,02 105 Па;
V(H2) = 400 мл = 0,4 л;
M(H2) = 2 10-3 кг/моль.
Затем, воспользуюсь уравнением Менделеева-Клапейрона:
Р
V
=
![]()
где R = 8,314 Дж / (моль ∙ К), или [кПа ∙ л / (моль ∙ К)], получим:
![]() =
=
![]()
![]() =
=
![]() =
3,35 ∙ 10-2
(кг).
=
3,35 ∙ 10-2
(кг).
Ответ: 3,35 ∙ 10-2 кг.
Пример 3. Какова эмпирическая формула оксида, содержащего 68,4 % (по массе) хрома.
Решение.
Обозначим числа атомов хрома и кислорода в формульной единице данного оксида соответственно через х и y. Поскольку относительные атомные массы этих элементов равны 52 и 16, то массы хрома и кислорода в составе данного оксида будут относиться как 52х к 16y; из условия задачи – 68,4 : 31,6. Следовательно,
52х : 16y = 68,4 : 31,6,
или
х
: y
=
![]() :
:![]() =
1,32 : 1,98.
=
1,32 : 1,98.
Так как в химических формулах веществ отношение атомов элементов выражается целыми числами, то разделив значения полученного отношения на меньшее из них:
х
: y
=
![]() :
:![]() =
1 : 1,5
=
1 : 1,5
и умножив на 2, получим искомые значения стехиометрических индексов
х : y = 2 : 3.
Ответ: Cr2О3.
