- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
Периодичность изменения общих химических свойств элементов
(свойств, которые проявляют атомы химических элементов во многих соединениях и которые являются обычными, типичными для них)
Металлы и неметаллы. Понятие о металлической и неметаллической природе атомов химических элементов является одним из основных, так как оно связано со всеми общими химическими понятиями. Количественно металличность и неметалличность определяются электроотрицательностью атомов химических элементов. Чем меньше электроотрицательность атома, тем больше его электрополо-жительность, тем ярче выражены металлические свойства соответствующего простого вещества: металлический блеск, отсутствие окраски, пластичность в кристаллическом состоянии, электрическая проводимость и теплопроводность, существование в кристаллических солях, солеобразных соединениях и в водных растворах в виде катионов, образование оснований.
Атомы металлов характеризуются относительно большими размерами и слабым притяжением электронов их ядрами. Атомы неметаллов, наоборот, характеризуются относительно небольшими размерами с сильным притяжением электронов их ядрами.
Кислотно-оснóвные свойства. Наиболее электроположительные химические элементы – щелочные металлы – образуют сильные, растворимые в воде основания (щёлочи). Наиболее электроотрицательные атомы химических элементов образуют сильные кислородсодержащие кислоты.
По периодам уменьшается способность химических элементов к образованию оснований и растёт способность к образованию кислот. Изменение кислотно-основных свойств по периодам хорошо видно на примере химических соединений элементов третьего периода:
-
NaOH
– сильное основание;
Mg(OH)2
– слабое основание;
Al(OH)3
– амфотерный гидроксид;
HClO4
– очень слабая кислота;
H3PO4
– слабая кислота;
H2SO4
– сильная кислота;
H4SiO4
– очень сильная кислота.
В группах электроположительных атомов химических элементов сверху вниз увеличивается сила оснований. Например, в группе IIА: Ве(ОН)2 – амфотерный гидроксид, Ва(ОН)2 – сильное основание.
В группах электроотрицательных атомов химических элементов сверху вниз увеличивается сила бескислородных кислот. Например, в группе VIA: Н2О – амфолит, Н2S – слабая кислота, Н2Sе – довольно сильная кислота.
У d-элементов наблюдается зависимость изменения кислотно-основных свойств их гидроксидов от значения степени окисления их атомов.
Атомы d-элементов в низшей степени окисления образуют гидроксиды с наиболее выраженными основными свойствами, а в высшей степени окисления – кислотными свойствами. Например, среди гидроксидов марганца:
Mn(OН)2 – слабое основание;
Mn(OН)3 – амфотерный гидроксид;
Mn(OН)4 – амфотерный гидроксид;
Н2MnO4 – кислота средней силы;
НMnO4 – сильная кислота;
Окислительно-восстановительные свойства. Наиболее электроположительными элементами являются щелочные металлы. Их электронейтральные атомы являются самыми сильными восстановителями. Наиболее электроотрицательные элементы – галогены, их электронейтральные атомы проявляют свойства сильных окислителей.
По периодам ослабевают восстановительные и усиливаются окислительные свойства электронейтральных атомов химических элементов. Например, в третьем периоде восстановительная способность электронейтральных атомов уменьшается в последовательности Na, Mg, Al, Si, P, а окислительная способность увеличивается в последовательности Si, Р, S, Cl.
Окислительно-восстановительные свойства атомов химических элементов зависят от величин проявляемых ими степеней окисления, которые по периоду увеличивается: атом натрия проявляет две степени окисления (0 и +1), а атом хлора – семь (–1, 0, +1, +3, +4, +5, +7).
По группам увеличивается восстановительная способность электронейтральных атомов химических элементов и уменьшается окислительная способность. Например, во второй группе (Ве, Mg, Ca, Sr, Ba) наиболее сильным восстановителем является атом бария, а в седьмой группе (F, Cl, Br, I) наиболее слабым окислителем является иод.
Пример 1. Определите валентность электронейтрального атома кремния в основном и в возбуждённом состояниях при образовании ковалентных связей по обменному механизму.
Решение.
Поскольку валентность атома при образовании ковалентных связей по обменному механизму определяется числом неспаренных электронов, то запишем электронную формулу атома кремния в основном состоянии:
Si 1s22s22р63s23р2.
Затем графически изобразим электронную формулу его внешнего энергетического уровня (вакантный 3d-подуровень не показан):
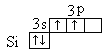
При переходе атома кремния в возбуждённое состояние может происходить распаривание 3s-электронов и переход одного из них на вакантную 3р-орбиталь:

В результате число неспаренных (валентных) электронов в атоме кремния увеличивается с двух до четырёх.
Ответ: валентность атома кремния в основном состоянии равна двум, а в возбуждённом – четырём.
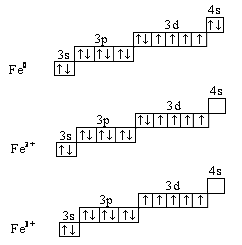
Пример 2. Составьте электронные формулы (для внешнего и предвнешнего энергетических уровней) положительно заряженных атомов (ионов) железа Fe2+ и Fe3+ и изобразите их графически.
Решение.
Атомный номер химического элемента соответствует числу электронов в его электронейтральном атоме; для атома железа – это 26 электронов. Заряд иона (катиона или аниона) показывает, какое число электронов было отдано или принято электронейтральным атомом. Следовательно, электронные оболочки ионов Fe2+ и Fe3+содержат 24 и 23 электронов соответственно.
В периодической системе химических элементов железо расположено в 4-м периоде, следовательно, электроны его атомов располагаются на четырёх энергетических уровнях, описываемых электронной формулой:
1s2 2s2 2p6 3s2 3p6 4s2 3d6, или [Ar] 4s2 3d6.
Поскольку атом железа способен отдавать электроны не только с внешнего, но как d-элемент ещё и с предвнешнего энергетического уровня, то электронные конфигурации его ионов будут выражаться следующими формулами:
26Fe2+ 1s2 2s2 2p6 3s2 3p6 4s0 3d6, или [Ar] 3d6;
26Fe2+ 1s2 2s2 2p6 3s2 3p6 4s0 3d5, или [Ar] 3d5.
Внешним у атома железа является 4-й, а предвнешним – 3-й энергетический уровень, которые в электронейтральном и заряженных атомах изображаются следующими электронно-графическими формулами (незаселяемые 4р-, 4d- и 4f- подуровни не показаны):