- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
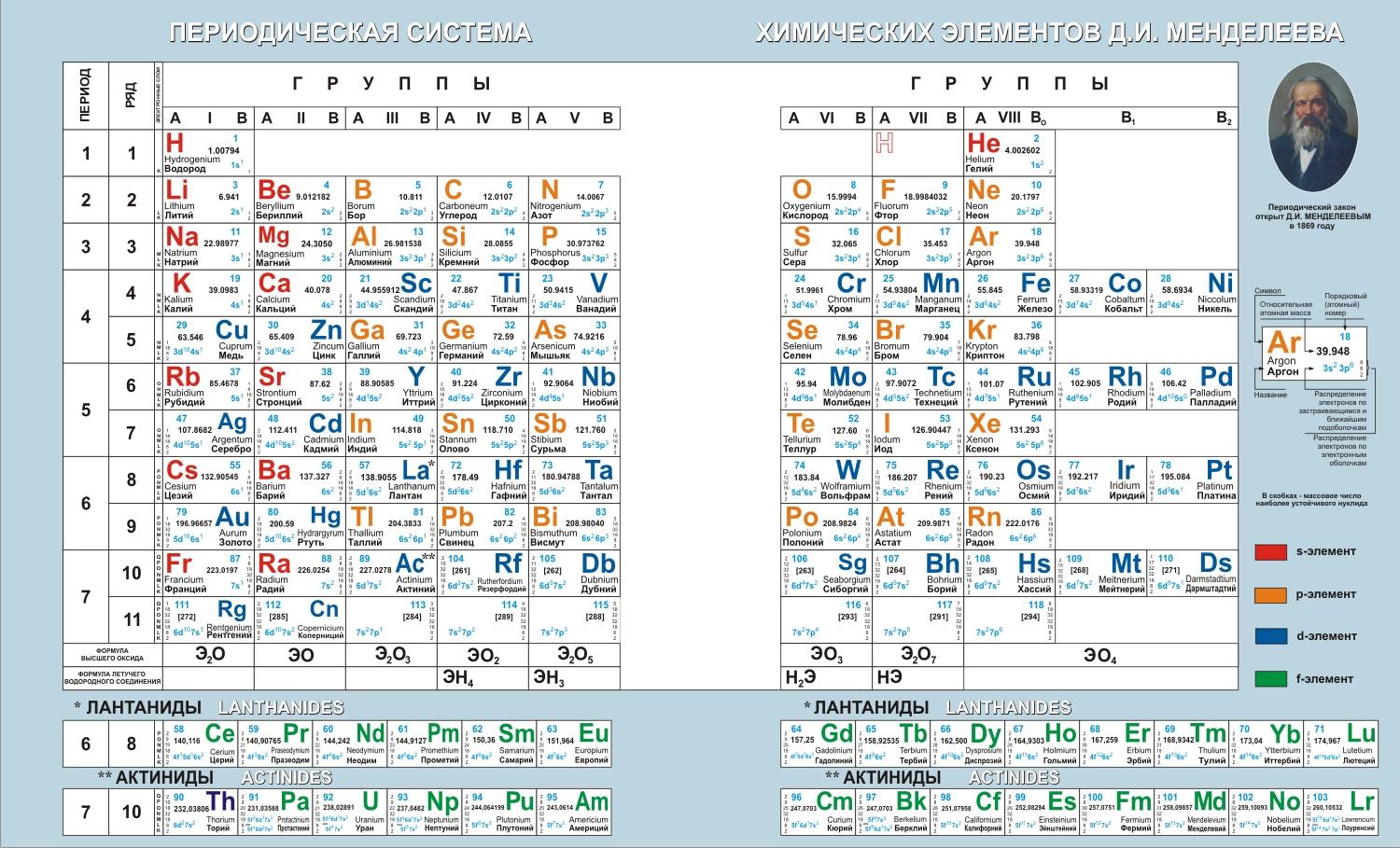
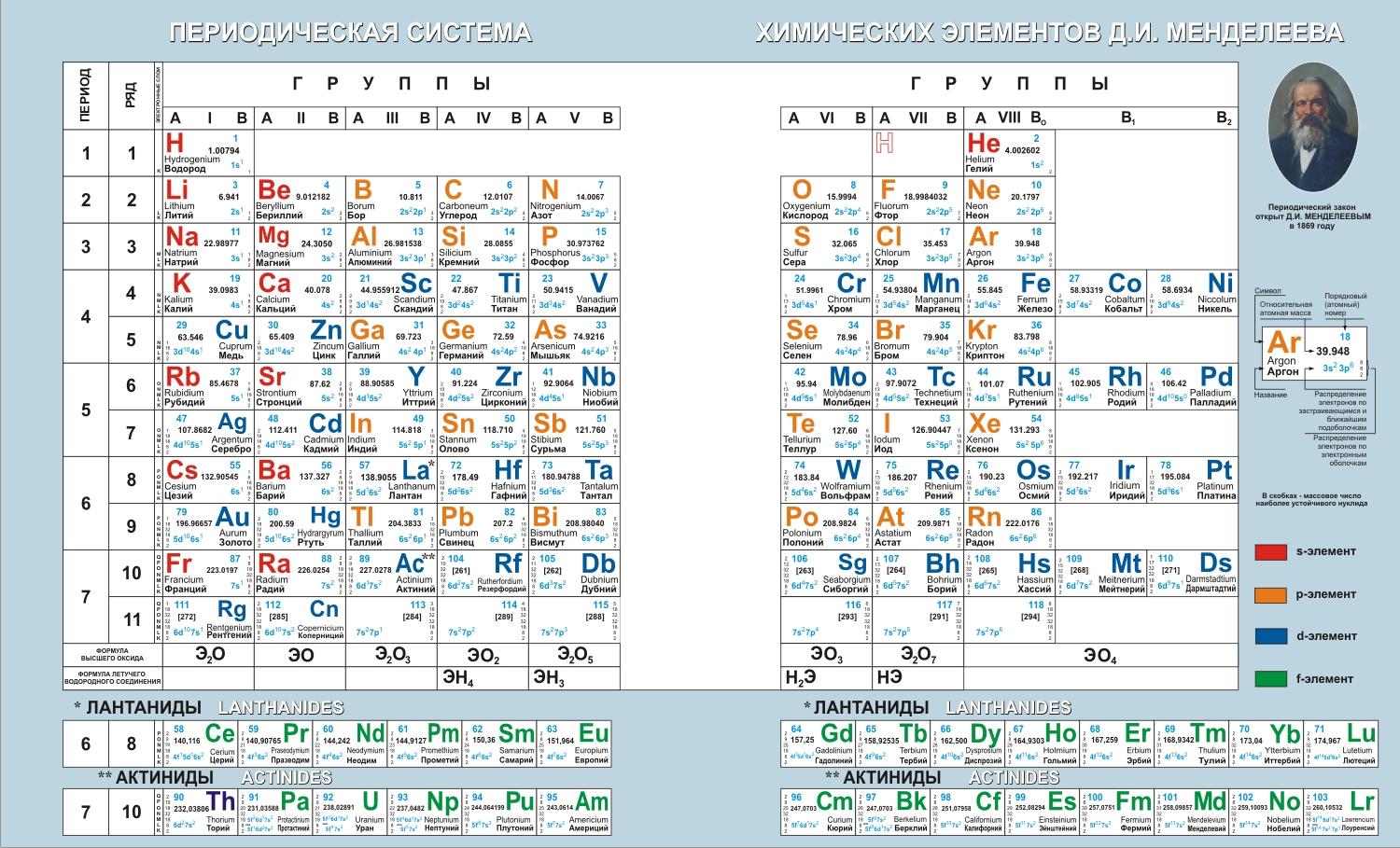
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
11. Электролиз
Электролизом называют совокупность электрохимических (окислительно-восстановительных) процессов, проходящих на электродах погруженных в расплав или раствор электролита при прохождении по нему электрического тока. В результате этих процессов вещества, входящие в состав электролита, выделяются в свободном виде.
За счёт источника постоянного тока на одном из электродов создаётся избыток электронов («−» электрод), на другом – недостаток («+» электрод).
При прохождении электрического тока через электролит происходит направленное движение ионов: к отрицательному электроду (катоду) перемещаются положительно заряженные частицы (катионы), а к положительному электроду (аноду) – отрицательно заряженные частицы (анионы).
На катоде ионы восстанавливаются до ионов с более низкой степенью окисления атомов или до электронейтральных атомов, например:
Fe3+ + ℮– = Fe2+;
Cu2+ + 2℮– = Cu.
Полярные молекулы также могут участвовать в процессе электролиза непосредственно на катоде или опосредованно, реагируя с продуктами катодного процесса, которые рассматриваются как промежуточные продукты электролиза.
На аноде происходит окисление ионов, поступающих из раствора или расплава электролита, или электронейтральных атомов, принадлежащих материалу анода; в последнем случае анод растворяется. Например:
2Cl– – 2e– = Cl2;
Cu – 2℮– = Cu2+;
2Al + 3H2O – 6℮– = Al2O3 + 6H+.
Электролиз включает два процесса: движение заряженных частиц под действием электрического поля к электродам и переход заряда либо с этих частиц на электрод, либо с электрода на эти частицы.
Важную роль в процессе электролиза играет материал, из которого изготовлены электроды, особенно анод. Угольные, графитовые, платиновые Pt, иридиевые Ir аноды являются инертными (или пассивными); они не изменяются при электролизе. Если анод изготовлен из сравнительно активных металлов, таких как цинк Zn, железо Fe, никель Ni, медь Cu, серебро Ag, то при электролизе атомы этих металлов окисляются и образующиеся ионы переходят в раствор (это активные аноды).
При электролизе расплавов электролитов с применением инертных электродов на катоде восстанавливаются катионы, а на аноде окисляются анионы.
При электролизе водных растворов электролитов с применением инертных электродов, наряду с катионами и анионами в электрохимических процессах, могут участвовать и молекулы воды. Чтобы определить, какие частицы участвуют в катодном процессе, надо знать значения электродных (окислительно-восстановительных) потенциалов, которым соответствуют ионы и молекулы, находящиеся в растворе. Для этого следует воспользоваться данными «Ряда стандартных электродных потенциалов» или приложения 6.
Возможны три случая:
– ионы металлов, у которых Ео < –1,18 В (например, ионы К+, Са2+ и Al3+), не восстанавливаются на катоде, а происходит восстановление молекул воды: 2Н2О + 2℮– = Н2 + 2ОН–, Ео = –0,83 В);
– ионы металлов, у которых Ео ≥ 0 (например, ионы Сu2+ и Ag+), практически полностью восстанавливаются на катоде (Сu2+ + 2℮– = Сu0);
– ионы металлов, у которых Ео находится в интервале от –1,18 до 0 (например, ионы Zn2+ и Fe2+), восстанавливаются на катоде одновременно с молекулами воды.
Таким образом, катионы, которым соответствует потенциал меньше 0 В в кислотной среде или – 0,41 В в нейтральной среде на катоде не восстанавливаются (в этих случаях восстанавливаются ионы Н+ или молекулы Н2О с образованием водорода).
Если водный раствор электролита содержит катионы нескольких металлов, то при электролизе выделение металлов на катоде протекает в порядке уменьшения алгебраической величины их стандартных электродных потенциалов.
Так, из смеси ионов Ag+, Cu2+ и Fe2+ сначала будут восстанавливаться катионы серебра (Ео = +0,80 В), затем – катионы меди (Ео = +0,34 В) и последними – катионы железа (Ео = –0,44 В).
На инертном аноде происходит окисление анионов электролита или молекул воды. При этом анионы бескислородных кислот (Cl–, Br–, I–, CN–, NSC–, S2–, за исключением F–), а также гидроксид-ионы легко окисляются, например:
2I– – 2℮– = I2
4ОН–− 4℮– = 2Н2О + О2.
Если же раствор содержит анионы кислородсодержащих кислот (ClO4–, SO42–, NO3–, РО43–, CO32–), а также фтороводородной (плавиковой) кислоты F–, то происходит окисление молекул воды (2Н2О − 4℮– = 4Н+ + О2, Е = +1,23 В).
При электролизе водных растворов электролитов с применением активного (растворимого) анода возможно протекание следующих процессов:
- окисление материала анода;
- окисление анионов электролита;
- окисление молекул воды.
Причём
в первую очередь будет идти процесс с
наименьшей величиной Ео.
Так,
при электролизе водного раствора CuSO4
с
применением медного анода
![]() =
0,34 В;
=
0,34 В;![]() =
1,23 В и
=
1,23 В и![]() =
2,01 В) пойдёт процесс окисления
электронейтральных атомов меди, так
как он требует наименьшей затраты
энергии.
=
2,01 В) пойдёт процесс окисления
электронейтральных атомов меди, так
как он требует наименьшей затраты
энергии.
Пример 1. Составьте уравнения реакций, протекающих на инертных электродах при электролизе расплавов:
а) гидроксида натрия; б) хлорида натрия и водных растворов;
в) сульфата калия; г) бромида цинка.
Решение.
а) Электролиз расплава гидроксида натрия.
В расплаве NaOH (сильный электролит) ионизируются11:
NаОН → Nа+ + ОН–.
Ионы натрия при пропускании электрического тока перемещаются к катоду (отрицательному электроду), а гидроксид-ионы – к аноду (положительному электроду).
На катоде происходит восстановление ионов натрия.
Катод (–): Nа+ + ℮– = Nа.
Гидроксид-ионы отдают электроны аноду, то есть окисляются. При этом образуются молекулярный кислород и вода.
Анод (+): 4ОН– – 4℮– = О2 + 2Н2О
Процесс электролиза удобно изображать с помощью схем, которые показывают: диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся при этом вещества.
Схема электролиза расплава гидроксида натрия выглядит так:
NаОН
↓
катод ← Nа ++ ОН - → анод
Nа+ + ℮– = Nа 4ОН– –4℮– = О2+ 2Н2О
Суммарное, или общее, уравнение реакции электролиза получают, складывая уравнения полуреакций окисления и восстановления. Для этого умножают каждое из уравнений на коэффициент, уравнивающий количество электронов, участвующих в катодном и анодном процессах.
В данном случае умножим уравнение полуреакции, происходящей на катоде, на 4 и получим суммарное уравнение реакции электролиза гидроксида натрия в ионной форме:
|
Na+ + ℮– = Na |
|
|
4 | |
|
4ОН– – 4℮– = О2 + 2Н2О |
1 |
|
|
|
4Nа+ + 4ОН– |
|
4Nа + О2 + 2Н2О.
|
Суммарное уравнение реакции в молекулярной форме имеет вид:
|
4NаОН |
|
4Nа + О2 + 2Н2О |
Таким образом, при электролизе расплава гидроксида натрия на катоде выделяется металлический натрий, а на аноде образуются газообразный кислород и вода.
б) Электролиз расплава хлорида натрия.
NаСl → Nа+ + Сl–
|
Катод (–) Na+ + ℮– = Na |
|
|
2 | |
|
Анод (+) 2Сl–− 2℮– = Cl2
|
1 |
|
|
|
2Na+ + 2Cl– |
|
2Na + Cl2 |
|
2NаCl |
|
2Nа + Cl2↑ |
в) Электролиз водного раствора сульфата калия.
В воде К2SO4 (сильный электролит) диссоциирует на ионы:
К2SO4 → 2К+ + SO42–.
Составим схему электролиза, учитывая, что катионы калия не восстанавливаются, а сульфат-анионы не окисляются в водном растворе:
|
Катод (–) 2Н2О + 2℮– = Н2+ 2ОН–
|
|
|
2 | |
|
Анод (+) 2Н2О − 4℮–= 4Н+ + О2
|
1 |
|
|
|
6Н2О |
|
2Н2 + 4Н+ + 4ОН–+ О2
|
|
2Н2О
|
|
2Н2↑ + О2↑ |
Таким образом, процесс электролиза раствора сульфата калия сводится к разложению воды с образованием газообразных водорода и кислорода. При этом образуются вторичные продукты электролиза: в прикатодном пространстве – КОН (лакмус синеет); в прианодном –Н2SO4 (лакмус краснеет).
г) Электролиз водного раствора бромида цинка.
ZnBr2 →Zn2+ + 2Br–
Ео(Zn2+/Zn) = −0,76 В (приложение 6), следовательно, на катоде будет происходить одновременно восстановление ионов цинка и молекул воды.
Катод (−): Zn2+ + 2℮– = Zn; 2Н2О + 2℮– = Н2 + 2ОН–.
Анод (+): 2Br– – 2℮– = Br2.
Суммарное уравнение реакции в этом случае записывать не следует, так как неизвестно, какая часть пропущенного электричества затрачивается на восстановление воды, а какая – на восстановление ионов цинка.
Пример 2. Какие реакции будут происходить на медных электродах при электролизе водного раствора сульфата меди(II)?
Решение.
Запишем уравнение электролитической диссоциации сульфата меди, который является сильным электролитом:
CuSO4 → Cu2+ + SO42–.
На катоде будет происходить восстановление ионов Cu2+, так как Ео(Cu2+/Cu) = 0,34 В.
Поскольку анод изготовлен из меди, то на нём возможно прохождение следующих процессов: окисление атомов меди, сульфат-анионов [Ео(S2O82– /2SO42–) = 2,01 В] или молекул воды [Ео (4Н++ О2 / 2Н2О) = 1,23 В].
В первую очередь будет происходить окисление атомов меди, так как величина Ео (Cu2+/Cu) наименьшая и этот процесс требует наименьшей затраты энергии.
|
Катод (–): Сu2+ + 2℮– = Cu. |
|
Анод (+): Cu – 2℮– = Сu2+. |
|
|
В процессе электролиза анод будет растворяться (ионы меди будут переходить в раствор), но такое же количество меди в виде нейтральных атомов (за исключением небольших потерь) будет выделяться на катоде.
В итоге, происходит перенос меди с анода на катод, при этом концентрация CuSO4 в растворе практически не меняется.
Суммарное уравнение реакции с активным анодом написать невозможно.
Пример 3. Вычислите массу меди, выделившейся на катоде, при пропускании тока через водный раствор сульфата меди(II) силой 2,5 А в течение 30 минут (электроды графитовые).
Решение.
Составим схему электролиза, учитывая, что сульфат-ионы на аноде не окисляются, а происходит электрохимическое окисление воды, приводящее к образованию кислорода:
CuSO4 → Cu2+ + SO42-
|
Катод (–) Сu2+ + 2℮– = Cu
|
2 | |
|
Анод (+) 2Н2О – 4℮– = О2 + 4Н+ |
1 | |
|
|
| |
|
2Сu2+ + 2Н2О |
|
2Cu + О2 + 4Н+ |
|
2CuSO4 + 2Н2О |
|
2Cu + О2↑ + 2Н2SO4 вторичный продукт электролиза (в анодном отделении)
|
Количественно электролиз описывается законами Фарадея, установленными в 1833-34 гг. и отражающими закон сохранения массы и энергии.
Согласно 1-ому закону, масса выделившегося на электроде вещества пропорциональна силе тока и времени электролиза, то есть количеству пропущенного электричества:
m = k∙I∙t = k∙Q,
где Q – количество электричества, Кл.
I – сила тока, А;
t – продолжительность электролиза, с;
k – коэффициент пропорциональности, называемый электрохимическим
эквивалентом данного вещества, г/Кл [k = M / (n∙F), где М – молярная
масса окислителя или восстановителя; n – число электронов,
участвующих в полуреакции на данном электроде; F – постоянная
Фарадея, равная 96 485 или приближённо 96 500 Кл/моль].
Согласно 2-ому закону, для разных электродных процессов (катодного и анодного) при одинаковом количестве пропущенного электричества массы выделившихся веществ относятся друг к другу так же, как молярные массы их химических эквивалентов.
Оба закона Фарадея объединяются одним уравнением:
m
=
![]() ,
,
В данном случае
m
=
![]() 1,49
г.
1,49
г.
Ответ: 1,49 г.
Пример 4. Вычислите объём газа, выделившегося при нормальных условиях при электролизе водного раствора бромида калия, если на инертном аноде выделилось 4 г брома.
Решение.
Составим схему электролиза, учитывая, что катионы калия не восстанавливаются в водном растворе.
КBr → К+ + Br–
|
Катод (–): 2Н2О + 2℮– = Н2 + 2ОН–
|
|
Анод (+): 2Br– – 2℮– = Br2
|
|
2Br– + 2Н2О
|
|
Br2 + Н2 + 2ОН– |
|
2КBr + 2Н2О |
|
Br2 + Н2↑ + 2КОН вторичный продукт электролиза (в катодном отделении)
|
Выделившийся на катоде газ – водород.
Из суммарного уравнения реакции электролиза следует, что водород и бром образуются в равном стехиометрическом отношении. И, следовательно, вычисляя количество вещества брома, находим количество вещества водорода:
n (Н2) = n (Br2);
n
(Br2)
=
![]() =
=![]() =
0,025 моль.
=
0,025 моль.
Вычислим объём водорода, приведённого к нормальным условиям:
V(Н2) = n(Н2) ∙ VМ; V(Н2) = 0,025 моль ∙ 22,4 л/моль = 0,56 л.
Ответ: 560 мл Н2.
Пример 5. При электролизе водного раствора нитрата серебра на инертном аноде выделился газ объёмом 84 л при нормальных условиях (н.у.)
Какая масса серебра образовалась при этом? Какое время для этого потребовалось, если сила тока составляла 5А?
Решение.
Составим уравнения электролитической диссоциации, электронных полуреакций восстановления и окисления и общее уравнение реакции электролиза.
AgNO3 → Ag+ + NO3ˉ.
|
Катод (–): Ag+ + ℮– = Ag |
|
|
4 | |
|
Анод (+): 2Н2О – 4℮–= О2 + 4Н+ |
1 |
|
|
|
4Ag+ + 2Н2О |
|
4Ag + О2 + 4Н+; |
|
4AgNO3 + 2Н2О |
|
4Ag + О2↑ + 4НNO3. |
Учитывая, что при нормальных условиях (температура 0 оС и давление 101 325 Па) молярный объём любого газа равен 22,4 л/моль, определим количество вещества выделившегося кислорода:
n(О2)
=
![]() =
=![]() = 3,75 моль.
= 3,75 моль.
Из суммарного уравнения реакции электролиза определим количество вещества и массу выделившегося серебра (по сравнению с кислородом его выделилось в 4 раза больше):
n(Ag) = 3,75 моль ∙ 4 = 15 моль;
M(Ag) = 108 г/моль;
m(Ag) = n(Ag) ∙ M(Ag) = 15 моль ∙ 108 г/моль = 1620 г.
Уравнение реакции, происходящей на катоде, показывает, что количество вещества выделившегося серебра равно количеству вещества затраченного на его восстановление электронов, то есть равно 15 моль.
Так как 1 моль электронов имеет заряд 96 500 Кл, то 15 моль электронов будут иметь заряд:
q = 15 моль ∙ 96 500 Кл/моль = 1 447 500 Кл.
Используя формулу для определения количества электричества (Q = I ∙ t), вычислим время электролиза:
t
=![]() = 289 500 с = 80,4 ч.
= 289 500 с = 80,4 ч.
Ответ: 1,62 кг; 80,4 ч.
Приложение 1