
- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
Вода является очень слабым электролитом. Её электролитическая диссоциация (правильно – ионизация) выражается равновесием
Н2О
+ Н2О
![]() Н3О+
+ ОН–
Н3О+
+ ОН–
или упрощённо
Н2О
![]() Н+
+ ОН–.
Н+
+ ОН–.
Количественно процесс электролитической диссоциации воды характеризуется константой равновесия. Константа равновесия электролитической диссоциации воды, определённая по электрической проводимости при 22 °С, равна:
Кд
=
![]() =
1,8 · 10–16.
=
1,8 · 10–16.
При
температуре 295 К (22 °С) диссоциирует лишь
одна из 5,56 · 108
молекул воды и, следовательно, степень
электролитической диссоциации воды
составляет α =
![]() = 1,8 · 10–9.
= 1,8 · 10–9.
Равновесную концентрацию нераспавшихся молекул воды можно считать равной её исходной молярной концентрации, то есть количеству молей воды в 1 л:
Так
как![]() =
18 г/моль, то [Н2О]
=
=
18 г/моль, то [Н2О]
=
![]() =
55,56 моль/л =const.
=
55,56 моль/л =const.
Объединив постоянные величины Кд и [Н2О], получим новую постоянную величину, которая называется ионным произведением воды:
![]() = Кд
[Н2О]
= [Н+][ОН–]
= соnst.
= Кд
[Н2О]
= [Н+][ОН–]
= соnst.
Константа ионизации воды может быть определена по закону разбавления Оствальда:
Кд = α2[H2О] = (l,8 · 10–9)2 · 55,6 = l,8 · 10–16.
Ионное
произведение воды –
![]() или КW,
–
величина
постоянная (при данной температуре)
для воды и водных растворов и равная
произведению равновесных концентраций
ионов водорода и гидроксид-ионов.
или КW,
–
величина
постоянная (при данной температуре)
для воды и водных растворов и равная
произведению равновесных концентраций
ионов водорода и гидроксид-ионов.
![]() =
[Н+][ОН–]
= Кд[Н2О]
= l,8
· 10–16
· 55,56 = 10–14.
=
[Н+][ОН–]
= Кд[Н2О]
= l,8
· 10–16
· 55,56 = 10–14.
Постоянство
ионного произведения воды означает,
что в любом водном растворе –
нейтральном, кислотном или щелочном –
имеются и ионы водорода, и гидроксид-ионы,
причём произведение равновесных
концентраций этих ионов равно величине
![]() при
данной температуре. Это позволяет
рассчитывать концентрацию ионов Н+
и ОН–
в любых водных растворах, используя
следующие соотношения:
при
данной температуре. Это позволяет
рассчитывать концентрацию ионов Н+
и ОН–
в любых водных растворах, используя
следующие соотношения:
[Н+]
=
![]() [ОН–]
=
[ОН–]
=
![]()
Значения
![]() возрастают
при увеличении температуры.
возрастают
при увеличении температуры.
-
Т, °С
0
22
37
50
100
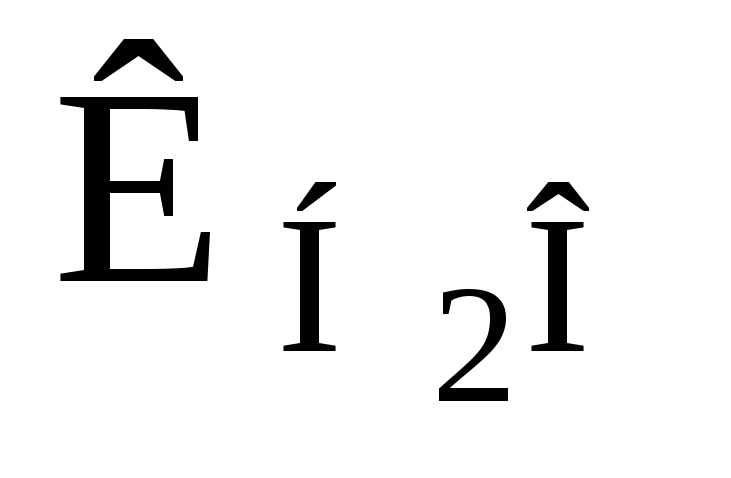 ·
1014
·
10140,13
1,0
3,1
5,6
7,4
В воде концентрации ионов водорода и гидроксид-ионов одинаковы, и при 22 °С их значения равны:
[Н+]
= [ОН–]
=
![]() =
=![]() = 10–7
моль/л.
= 10–7
моль/л.
Реакция среды* определяется тем ионом (Н+ или ОН–), концентрация которого в водном растворе преобладает. Для характеристики кислотности водных растворов принято использовать величину молярной концентрации в них ионов водорода [Н+].
Нейтральная среда характеризуется равенством концентраций ионов водорода и гидроксид-ионов:
[Н+] = [ОН–] = 1,0 ·10–7 моль/л (при 22 оС).
Кислотная среда характеризуется:
[Н+] > [ОН–], то есть [Н+] >10–7 моль/л.
Щелочная среда характеризуется:
[Н+ ] < [ОН–], то есть [Н+] < 10–7 моль/л.
На практике водную среду принято характеризовать не молярной концентрацией ионов водорода, а водородным показателем рН** (читается "пэ-аш"), который является безразмерной величиной.
Водородный показатель – это количественная характеристика кислотности водной среды, равная отрицательному десятичному логарифму молярной концентрации ионов водорода:
рН = –lg[H+].
Иногда для характеристики водной среды наряду с водородным показателем используют гидроксильный показатель рОН:
рОН = –lg[ОН–].
В любой водной среде [Н+][ОН–] = 1,0 · 10–14 (при 22 °С).
Логарифмируя это выражение, получаем:
lg[Н+] + lg[ОН–] = –14 или рН + рОН = 14.
В нейтральной среде водородный показатель равен:
рН =–lg[H+] = –lg10–7 = 7.
В кислотнй среде [Н+] >10–7, следовательно, рН < 7, и чем больше кислотность среды, тем меньше значение рН.
В щелочной среде [Н+] < 10–7, следовательно, рН > 7, и чем больше основность среды, тем больше значение рН.
В разбавленных водных растворах величина рН может быть < 0, например, 1 М раствор НСl имеет рН = –1.
Пример 5. Вычислите значения pH и pOH 0,0004 М раствора HNO3.
Решение.
Азотная кислота является сильным электролитом и диссоциирует в воде практически полностью согласно уравнению
HNO3 → H+ + NO3ˉ,
Следовательно,
[H+] = с (HNO3) = 0,0004 моль/л = 4 ∙ 10-4 моль/л.
Отсюда:
pH = lg[H+] = –lg (4 ∙ 10-4 ) = 3,4;
pOH = 14 – рН = 14 – 3,4 = 10,6.
Ответ: рН = 3,4; рН = 10,6.
Пример 6. Рассчитайте величину pH 0,01 М раствора NaOH.
Решение.
Гидроксид натрия – сильное основание, практически полностью диссоциирующее в воде согласно уравнению
NaOH → Na+ + OHˉ.
Следовательно,
[OH–] = [NaOH] = 0,01 моль/л.
Концентрацию ионов водорода найдём, воспользовавшись ионным произведением воды:
[H+]
=![]() =
=![]() =
10–12 (моль/л).
=
10–12 (моль/л).
рН = –lg[H+] = –lg 1012 = 12.
Ответ: рН= 12.
Пример 7. Рассчитайте величину рН и степень электролитической диссоциации 1,5 М водного раствора аммиака.
Решение.
В водном растворе аммиака устанавливается равновесие:
NH3
+ H2O
![]() NH3
· H2O
NH3
· H2O
![]() NH4+
+ OHˉ,
NH4+
+ OHˉ,
константа которого равна:
Кb
=
![]() =
1,8 ∙ 10–5.
=
1,8 ∙ 10–5.
Допустим, что равновесные концентрации ионов [OH–] и [NH4+] равны х моль/л, тогда [NH3] = (1,5 – х) моль/л. Подставляя эти значения в выражение для константы химического равновесия и решая квадратное уравнение, получим: х = 5 ∙ 10ˉ3. Равновесную концентрацию ионов водорода находим через ионное произведение воды:
[H+]
=![]() =
=![]() =
2 ∙ 10–12
(моль/л).
=
2 ∙ 10–12
(моль/л).
Отсюда
рН = –lg[H+] = –lg2 ∙ 10-12 = 11,7.
Степень
α ≈
![]() =
=![]() =
3,5 ∙ 10–3.
=
3,5 ∙ 10–3.
Ответ: рН=11,7; α=0,35%.
