
- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
Влияние различный факторов на овр
1. Влияние температуры: повышение температуры, как правило, повышает скорость реакции, иногда влияет на ход реакции:
Cl2 + 2KOH = KСlO + KCl + H2O
3Cl2
+
6KOH
![]() KClO3
+
5KCl
+
3H2O
KClO3
+
5KCl
+
3H2O
2. Влияние концентрации: увеличение концентрации окислителя или восстановителя ускоряет реакцию.
3. Влияние катализатора – ускоряет реакцию и изменяет её ход:
4NH3 + 3O2 = N2 + 6H2O
4NH3
+
5O2
![]() 4NO
+ 6H2O
4NO
+ 6H2O
4. Влияние кислотности среды – pH
Восстановление перманганат-иона:
Состав продуктов восстановления перманганат-иона MnO4– зависит от реакции среды. Перманганат калия в разных средах восстанавливается до разных продуктов:
в кислотной среде (pH < 7) – до солей Mn2+ – бесцветный раствор;
в нейтральной и слабощелочной среде (pH 7-8) – до MnO2 – осадок бурого цвета;
в щелочной среде (pH > 8) – до манганата MnO42– – раствор изумрудно-зелёного цвета.
Уравнения ОВР с участием пероксида водорода при разных значениях рН.
Пероксид в роли окислителя:
Н2О2 + 2Н+ + 2℮– = 2Н2О (рН < 7);
Н2О2 + 2℮– = 2OH– (рН > 7).
Пероксид в роли восстановителя:
Н2О2 – 2℮– = О2 + 2Н+ (рН < 7);
Н2О2 + 2OH– + 2℮– = О2 + 2Н2О (рН > 7).
Восстановление хромата и бихромата:
CrO42– → [Cr(OH)6]3– (рН > 7);
жёлтого тёмно-зелёного
цвета цвета
Cr2O72– → Cr3+ (рН < 7).
оранжевого грязно-зелёного
цвет цвета
Восстановление галогенов:
Г2 → НГ (рН < 7);
Г2 → МГ (рН > 7).
Пример. Укажите окислитель и восстановитель и составьте уравнение реакции, протекающей по схеме:
а) Н2О2 + КMnO4 + НNО3 (разб.) → Mn(NO3)2 + О2 + КNО3 + Н2О;
б) Сu + НNO3 → Сu(NO3)2 + NO + Н2О;
в) Р2S3 + НNO3 → Н3РО4 + SO2 + NO2 + Н2О;
г) BiCl3 + SnCl2 + NaOH → Bi + Na2SnO3 + NaCI + Н2О;
д) Вr2 + Сl2 + Н2О → НВrО3 + НСl.
Решение.
а) Укажем степени окисления атомов тех элементов, которые изменяют её в процессе реакции
![]() +
+
![]() +
НNО3
(разб.) →
+
НNО3
(разб.) →
![]() +
+![]() +
КNO3
+ Н2О.
+
КNO3
+ Н2О.
Степень окисления атомов кислорода, входящих в пероксид водорода повышается за счёт окисления, а атомов марганца, входящих в перманганат калия, понижается за счёт восстановления. Следовательно, это межмолекулярная окислительно-восстановительная реакция, и пероксид водорода является восстановителем, а перманганат калия – окислителем.
Составим электронные уравнения полуреакций окисления и восстановления:
|
|
Подбор стехиометрических коэффициентов при составлении уравнений окислительно-восстановительных реакций можно произвести по методу электронного баланса, который основан на сравнении степеней окисления атомов элементов в исходных и конечных веществах. Так как число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем, следует каждое из электронных уравнений умножить на соответствующий коэффициент. В рассматриваемом случае первое уравнение умножим на 5, а второе – на 2:
|
|
|
|
5 | |
|
|
2 |
Исходя из этого в схеме реакции перед формулами веществ, содержащих атомы марганца, проставим стехиометрической коэффициент 2, а перед формулами пероксида водорода и кислорода – 5 и получим:
5Н2О2 + 2КMnO4 + НNО3 → 2Mn(NO3)2 + 5О2 + КNО3 + Н2О.
Теперь уравняем количество атомов элементов, которые не изменили степень окисления – сначала атомов калия и азота, а затем водорода.
И, наконец, подсчитаем количество атомов кислорода в левой и правой частях полученного уравнения:
5Н2О2 + 2КMnO4 + 6НNО3 = 2Mn(NO3)2 + 5О2 + 2КNО3 + 8Н2О.
Во многих случаях равенство атомов кислорода в левой и в правой частях уравнения окислительно-восстановительной реакции свидетельствует о том, что оно составлено правильно.
б) Аналогичные действия проведём для реакции
![]() +
+
![]() →
→![]() +
+![]() +
Н2О
+
Н2О
-
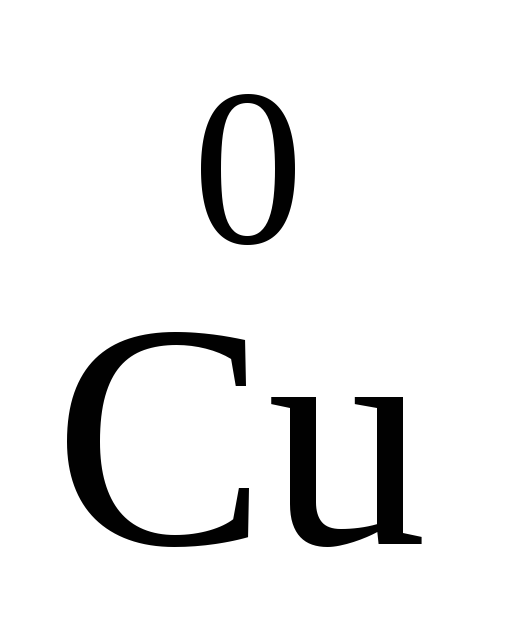 –2℮–
=
–2℮–
=
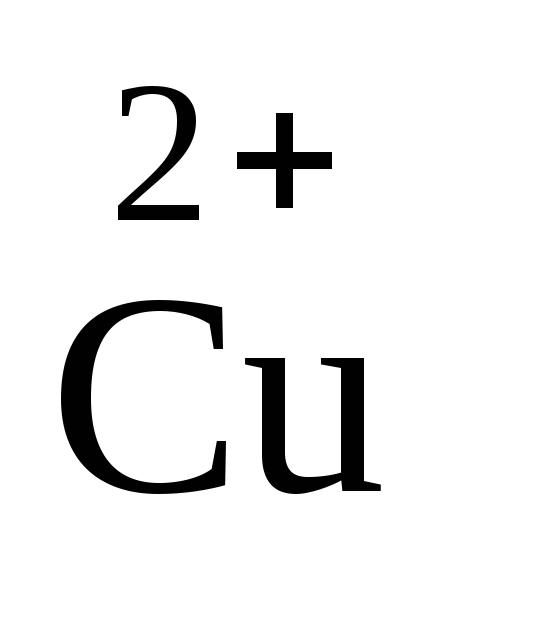
3 Сu – восстановитель
 +
3℮–
=
+
3℮–
=
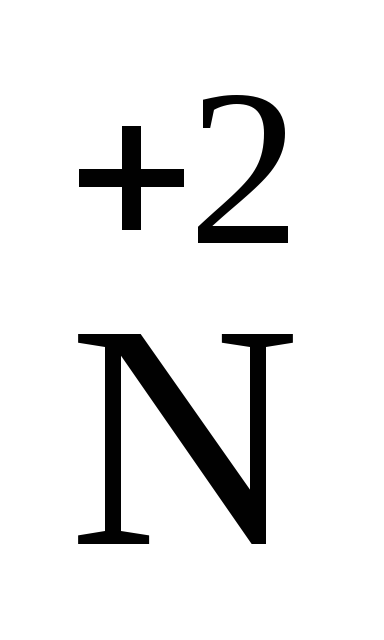
2 НNO3 – окислитель
Атомы азота азотной кислоты не все изменяют свою степень окисления: часть из них без изменения степени окисления переходит в нитрат меди(II). Поэтому найденные при помощи электронного баланса стехиометрические коэффициенты напишем перед формулами всех веществ, содержащих атомы меди и азота, кроме азотной кислоты:
3Сu + НNO3 → 3Сu(NO3)2 + 2NO + Н2О.
Коэффициент перед формулой азотной кислоты должен быть равен сумме атомов азота перед формулами нитрата меди и оксида азота(II), а именно 8, из чего следует, что 6 атомов азота не изменяют свою степень окисления в процессе реакции:
3Сu + 8НNO3 → 3Сu(NO3)2 + 2NO + Н2О
Уравняем количество атомов водорода в обеих частях схемы:
3Сu + 8НNO3 = 3Сu(NO3)2 + 2NO + 4Н2О
Для контроля подсчитаем количества атомов кислорода в полученном уравнении реакции.
в)
![]() +
+![]() →
→![]() +
+![]() +
+![]() +
Н2О
+
Н2О
В этой реакции изменяют степень окисления атомы трёх элементов. Атомы фосфора и серы в процессе реакции окисляются, а атомы азота – восстанавливаются.
-
 –4℮–
=
–4℮–
=

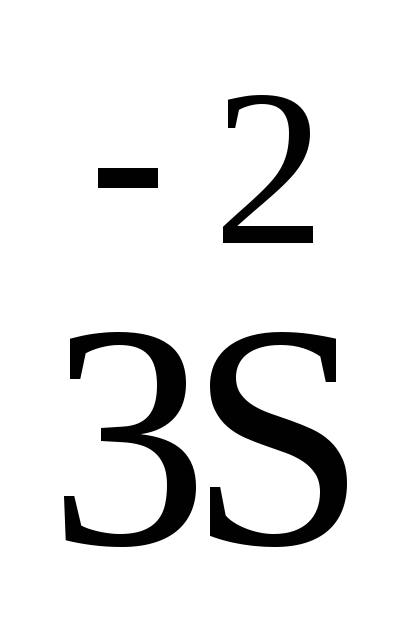 –18℮–
=
–18℮–
=

1
P2S3 – восстановитель
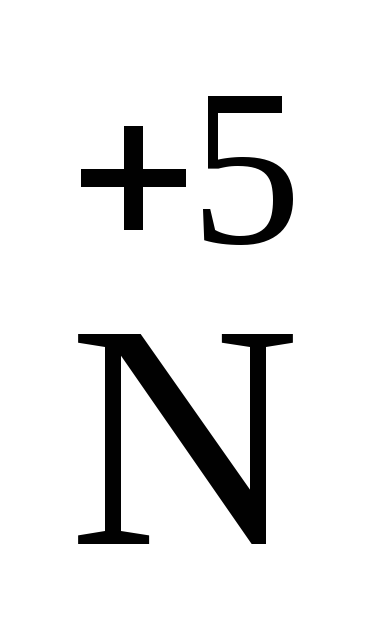 +
1℮–
=
+
1℮–
=
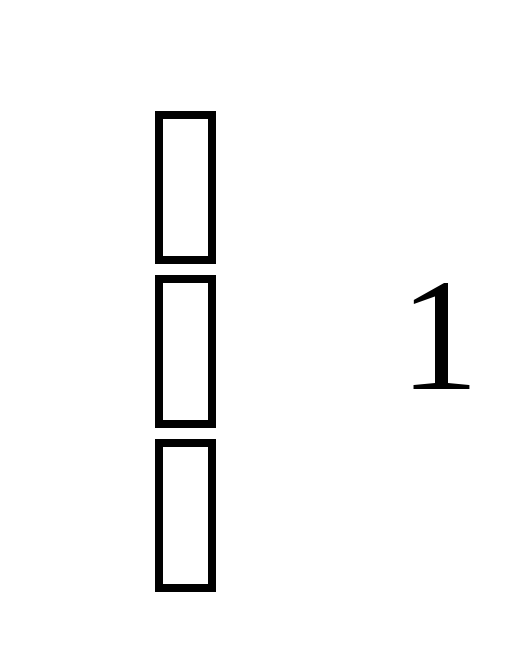
22
НNO3– окислитель
Р2S3 + 22НNO3 = 2Н3РО4 + 3SO2 + 22NO2 + 8Н2О
г)
![]() +
+![]() +NaOH
→
+NaOH
→
![]() +
+
![]() +NaCl
+ Н2О
+NaCl
+ Н2О
|
|
|
BiCl3 – окислитель |
|
2 | ||
|
|
3 |
SnCl2 – восстановитель |
2BiCl3 + 3SnCl2 + NaOH → 2Bi + 3Na2SnO3 + NaCl + Н2О
2BiCl3 + 3SnCl2 + 18NaOH = 2Bi + 3Na2SnO3 + 12NaCl + 9Н2О
д)
![]() +
+![]() + Н2О
→
+ Н2О
→
![]() +
+![]()
|
|
1 |
Br2 – восстановитель |
|
|
|
5 |
Сl2 – окислитель | |
Вr2 + 5Сl2 + Н2О → 2НВrО3 + 10НСl
Вr2 + 5Сl2 + 6Н2О = 2НВrО3 + 10НСl
Алгоритм составления уравнений окислительно-восстановительных реакций по методу электронного баланса.
1.Записать схему реакции:
Al + О2 → Al2О3
2.Найти окислитель и восстановитель:
Al – восстановитель; О2 – окислитель.
3.Написать схему окисления и восстановления:
![]() →
→![]() ;
;
![]() →
→
![]()
4.Сбалансировать заряды:
|
|
4 |
|
|
3 |
5.Суммировать уравнения реакций процессов окисления и восстановления:
![]()
![]()
![]() .
.
6.Найти стехиометрические коэффициенты:
4Al + 3О2 = 2Al2О3.
