
- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
3. Строение атомов. Периодический закон д.И. Менделеева
Периодический закон: свойства химических элементов в образуемых ими простых и сложных веществах находятся в периодической зависимости от величины заряда ядра их атомов и определяются повторяющимися электронными конфигурациями их атомов.
Периодический закон, не имея математического выражения, находит своё отражение в Периодической системе химических элементов Д. И. Менделеева.
Основной структурной единицей периодической системы является период.
Периодом с номером n называют совокупность химических элементов, расположенных в порядке возрастания заряда ядра их атомов, которая начинается ns- и заканчивается np-элементами (за исключением I периода, в котором нет р-элементов).
В этом определении n – номер периода, равный главному квантовому числу для внешнего энергетического уровня атомов всех элементов этого периода.
Структура периодической системы химических элементов определяется заполнением ("заселением") электронами энергетических уровней, подуровней и орбиталей атомов в соответствии с принципом минимума энергии, принципом Паули и правилами Хунда и Клечковского.
При заселении электронами энергетических уровней электронейтрального атома в основном (невозбуждённом) состоянии выполняется принцип минимума энергии, в соответствии с которым наиболее устойчивым состоянием любой системы, в том числе атома и молекулы, является состояние с минимальным запасом энергии. Поэтому заселение электронами энергетических уровней, подуровней и орбиталей происходит в порядке возрастания энергии. Энергия уровней возрастает с увеличением главного квантового числа n, однако каждый уровень расщепляется на подуровни. Чтобы определить порядок заполнения подуровней В.М.Клечковский на основе анализа Периодической системы химических элементов Д.И.Менделеева предложил следующее правило:
энергия подуровня возрастает с увеличением суммы главного и орбитального квантовых чисел (n + l).
если для нескольких подуровней сумма n + l одинакова, то энергия меньше для подуровня с меньшим значением n.
Порядок заполнения подуровней по правилу Клечковского иногда называют рядом Клечковского:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p.
Принцип Паули: в атоме не может быть электронов с одинаковым набором квантовых чисел.
Принцип Паули определяет максимальную электронную ёмкость атомной орбитали, на которой может находиться 1 или 2 электрона или она может быть вакантной (свободной).
Этот принцип определяет также электронную ёмкость энергетических подуровней:
Nl = 2(2l + 1)
и уровней:
Nn = 2n2.
Правило Хунда: электроны на энергетическом подуровне занимают максимально возможное число атомных орбиталей, таким образом, чтобы сумма их спинов была максимальной.
Состояние электрона в атоме описывается набором четырёх квантовых чисел.
Главное квантовое число (n) определяет характеризует энергетический уровень – общую энергию электрона и размер (средний радиус) атомной орбитали; принимает целочисленные значения от 1 до .
Орбитальное (побочное азимутальное) квантовое число (1) характеризует энергетический подуровень атома, а также определяет момент импульса электрона при движении вокруг ядра и характеризует пространственную форму и тип атомной орбитали; принимает целочисленные значения от 0 до n – 1.
Магнитное квантовое число (m) характеризует проекцию момента импульса на направление внешнего поля (электрического или магнитного), а так же ориентацию атомной орбиталей относительно этого поля; принимает целочисленные значения от –l до +l, через нуль, то есть энергетический подуровень атома состоит из 2l + 1 орбиталей.
Спиновое квантовое число (ms) характеризует спин (s) электрона – аналог его орбитального момента.
Внутреннее (орбитальное) движение электрона упрощённо представляется как «вращение вокруг собственной оси», которое может происходить в двух противоположных направлениях (условно по часовой и против часовой стрелки). Однако электрон обладает волновыми свойствами, поэтому его нельзя уподобить маленькому волчку. Он обладает собственным (внутренним) движением, которому соответствуют два возможных значения проекции момента импульса и два соответствующих значения спинового квантового числа: ms = +1/2 и
ms = -1/2
Строение внешней электронной оболочки атома определяет его химические свойства.
Общее количество электронов в атоме, которые образуют его электронную оболочку, равно атомному номеру химического элемента, его порядковому номеру в периодической системе Д. И. Менделеева.
Строение электронной оболочки (электронной конфигурации) атома выражается электронной формулой, которая показывает распределение электронов по энергетическим уровням и подуровням (уровни обозначаются цифрами: 1, 2, 3, 4,…; подуровни – буквами: s, p, d, f; число электронов на подуровнях – индексами вверху справа, сумма которых должна быть равна числу электронов в атоме). Например, электронная формула атома бора: 1s2 2s2 2p1.
Электронно-графическая формула показывает распределение электронов в атоме не только по энергетическим уровням и подуровням, но и по орбиталям. При этом используются следующие обозначения:
![]() –атомная
орбиталь; ↑ – электрон;
–атомная
орбиталь; ↑ – электрон;
![]() –пара
электронов (с противоположными значениями
спинового квантового
числа) на атомной орбитали.
–пара
электронов (с противоположными значениями
спинового квантового
числа) на атомной орбитали.
Например, электронно-графическая формула электронейтрального атома азота в основном состоянии имеет вид:
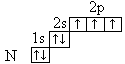
Химические свойства атомов определяются в основном строением внешних энергетических уровней (электронных слоёв), которые называются валентными.
Полностью заполненные энергетические подуровни, соответствующие электронным конфигурациям атомов благородных газов, называют электронным остовом.
Электронную
формулу атома благородного газа
сокращённо обозначают его символом в
квадратных скобках. Например, электронная
формула
неона 1s22s22p6
–
[Ne].
Это позволяет упростить запись
электронной формулы. Так, для атома
калия вместо 1s22s22p63s23p64s1
её можно
представить в виде
![]()
![]() .
Сокращённая запись выделяет валентные
электроны, определяющие химические
свойства атомов элементов.
.
Сокращённая запись выделяет валентные
электроны, определяющие химические
свойства атомов элементов.
При графическом изображении электронных формул орбитали, отвечающие электронному остову атомов, обычно не показывают, однако изображают не только заполненные, но и вакантные орбитали внешнего энергетического уровня. Это позволяет предсказать изменение валентности атома химического элемента при переходе его в возбуждённое состояние, когда происходит распаривание электронов валентного подуровня и переход одного из электронов каждой пары на более высокий энергетический подуровень.
Важнейшими характеристиками элемента, связанными с электронной структурой атома являются: атомные радиусы, энергия ионизации, сродство к электрону, электроотрицательность.
Атомные радиусы (по Ван-дер-Ваальсу) – это половина кратчайшего расстояния, на которое могут сблизиться ядра двух одинаковых атомов, если они принадлежат разным молекулам (рис. 1).
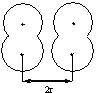
Рис. 1. Радиус атома водорода по Ван-дер-Ваальсу (rW)
в молекуле водорода Н2
Различают ковалентные, металлические, ван-дер-ваальсовы и ионные радиусы, их определяют как полусумму соответствующих расстояний между ядрами соседних атомов. Радиусы различных типов значительно отличаются друг от друга; для атомов Na и Cl это иллюстрирует следующая таблица.
Сопоставление разных типов радиусов атомов натрия и хлора
|
Атом |
Радиус, пм | |||
|
ковалентный |
металлический |
ван-дер-ваальсов |
ионный | |
|
Na |
156 |
190 |
– |
95 (Na+) |
|
Cl |
99 |
– |
185 |
181 (Cl–) |
Разработаны способы определения радиусов атомов, основанные на расчёте атомных волновых функций. Такие радиусы называют орбитальными.
Изменение радиусов носит периодический характер. Основная тенденция в периодах Периодической системы химических элементов Д.И.Менделеева – уменьшение радиуса (размера) атомов, а в главных подгруппах – его увеличение. Такое изменение радиусов обусловлено увеличением в периоде эффективного заряда атомных ядер, стремящегося "ужать" атомные орбитали за счёт экранирования валентных электронов внутренними электронными слоями (рис. 2). В меньшей степени уменьшаются радиусы атомов d- и f-элементов, что объясняется заполнением их внутренних электронных слоёв и называется это d- и f-сжатием.
|
|
|
|
|
|
|
|
|
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
|
|
|
|
|
|
|
|
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
Рис. 2. Изменение радиусов атомов элементов второго и
третьего периодов
Энергия ионизации – это энергия, необходимая для отрыва одного моля электронов от одного моля изолированных нейтральных атомов элемента, находящихся в основном (невозбуждённом) состоянии, с образованием положительно заряженных атомов (катионов).
Различают первую, вторую и последующие энергии ионизации, то есть энергии, отвечающие удалению первого, второго и каждого последующего электрона из многоэлектронного атома.
Удаление первого электрона описывается уравнением
Э + ЕИ, 1 = Э+ + ℮–,
где Э – элктронейтральный атом в газовой фазе;
Э+ – положительно заряженный атом элемента (катион);
ЕИ,1 – первая энергия ионизации, кДж/моль или эВ. (1эВ=1,602·10-19 Дж).
Первые энергии ионизации атомов с увеличением заряда ядра Z изменяются периодически. При перемещении по периоду системы химических элементов слева направо величина ЕИ в общем увеличивается, что обусловлено ростом эффективного заряда атомного ядра. При перемещении в группах сверху вниз для s- и p-элементов величина ЕИ уменьшается, причём сильнее всего это уменьшение выражено в группе атомов благородных газов и слабо – в группе атомов щелочных металлов.
Под средством к электрону понимается энергия, которая выделяется при присоединении одного моля электронов к одному молю электронейтральных атомов с образованием отрицательно заряженных атомов (анионов):
Э + ℮– = Э– + Еср.
Как и в случае энергии ионизации существует вторая (и т. д.) энергия сродства к электрону, т. е. энергия образования ионов Э2-.
Сродство к электрону с увеличением атомного (порядкового) номера химического элемента в периодах слева направо увеличивается, а в главных подгруппах сверху вниз – уменьшается.
Электроотрицательность – величина, характеризующая способность атома притягивать электроны, связывающие его с атомом другого элемента в молекуле, сложном ионе, кристалле.
χ
=
![]() (Еи
+ Еср )
.
(Еи
+ Еср )
.
С увеличением атомного номера химического элемента электроотрицательность атомов увеличивается по периодам слева направо и уменьшаются в главных подгруппах сверху вниз (Рис. 3).
Главные подгруппы (А-группы)
|
|
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
| |||||
|
1 |
1 H |
|
|
|
|
|
|
2 He | |||||||
|
2 |
3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||
|
3 |
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||
|
4 |
19 K |
20 Ca |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |||||||
|
5 |
37 Rb |
38 Sr |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |||||||
|
6 |
55 Cs |
56 Ba |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |||||||
|
7 |
87 Fr |
88 Ra |
|
|
|
|
|
|
| ||||||
|
|
|
|
| ||||||||||||
|
|
|
Неметалл |
|
Металл |
|
Амфотерный элемент |
| ||||||||
Рис. 3. Изменение окислительно-восстановительных свойств
электронейтральных атомов элементов главных подгрупп (А-групп)
Экспериментальными исследованиями была установлена зависимость химических и физических свойств элементов от их положения в Периодической системе химических элементов Д.И. Менделеева.
