
- •Итоговые контрольные задания по общей химии Учебно-методическое пособие
- •Репетитор и эталоны
- •Выполнения типовых заданий
- •По общей химии
- •Введение
- •1. Основные понятия химии
- •2. Химический эквивалент
- •3. Строение атомов. Периодический закон д.И. Менделеева
- •Периодичность изменения общих химических свойств элементов
- •4. Химическая термодинамика
- •Первое следствие.Энтальпия реакции равна разности алгебраических сумм энтальпий образования конечных и исходных веществ:
- •Второе следствие. Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком:
- •5. Скорость химической реакций
- •6. Химическое равновесие
- •7. Растворы
- •Способы выражения состава раствора (концентрации).
- •Электролитическая диссоциация и ионное произведение воды. Водородный и гидроксильный показатели (рН и рОн).
- •8. Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •Важнейшие окислители и восстановители
- •Влияние различный факторов на овр
- •4. Влияние кислотности среды – pH
- •10. Электродные потенциалы. Гальванические элементы.
- •11. Электролиз
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов
- •4. Константы ионизации некоторых слабых электролитов в водных растворах при 25 0с
- •5. Стандартные энтальпии , энтропии и энергии гиббса образования некоторых веществ при 298 к (25 оС)
- •6. Стандартные электродные (окислительно-восстановительные) потенциалы
- •Литература
- •Содержание
8. Гидролиз солей
Водные растворы средних (нормальных) солей показывает щелочную, кислотную или нейтральную реакцию, хотя они не содержат ни водородных, ни гидроксидных ионов. Объяснение этого факта – в химическом взаимодействии солей с водой.
Например, раствор ацетата натрия СН3СООNа показывает щелочную реакцию. Эта соль, как сильный электролит, при растворении в воде полностью диссоциирует на ионы СН3СОО– и Na+, которые взаимодействуют с ионами воды Н+ и ОН. При этом ионы натрия не могут связать ионы ОН– в молекулы, так как гидроксид натрия NaOH является сильным электролитом и существует в растворе в виде ионов. В то же время ацетат-ионы связывают ионы Н+ с образованием молекул слабого электролита – уксусной кислоты, в результате чего новые молекулы воды диссоциируют на ионы Н+ и ОН–. Эти процессы протекают до тех пор, пока не установятся равновесия:
СН3СОО–
+ Н+ ![]() СН3СООН;
СН3СООН;
Н2О
![]() Н+
+ ОН–.
Н+
+ ОН–.
Суммарное уравнение одновременно протекающих процессов (реакций) имеет вид:
СН3СОО–
+ Н2О
![]() СН3СООН
+ ОН–.
СН3СООН
+ ОН–.
Это уравнение показывает, что в результате образования слабого электролита (уксусной кислоты) смещается химическое равновесие диссоциации воды и создаётся избыток гидроксид-ионов, поэтому реакция раствора щелочная.
Гидролизомсолей называется обменное взаимодействие их ионов с молекулами воды, приводящее к образованию малодиссоциирующих электролитов.
Гидролиз солей происходит в тех случаях, когда образующиеся в результате электролитической диссоциации ионы, способны образовывать с водой слабые (малодиссоциирующие) электролиты.
Выделяют три типа гидролиза: гидролиз по аниону, гидролиз по катиону и гидролиз по катиону и аниону.
Уравнения реакций гидролиза можно составить в трёх формах:
- сокращённая ионно-молекулярная форма наиболее наглядна, она показывает, какой ион (катион или анион) взаимодействует с водой, какой слабый электролит образуется и какова реакция раствора;
- полная ионно-молекулярная форма отличается от сокращённой, наличием в левой и правой частях уравнения химических формул ионов, не претерпевающих в результате гидролиза изменений;
- молекулярную форму легко получить из полной ионно-молеку-лярной формы, соединяя ионы в молекулы с учётом знаков их заряда.
Пример 1. Для солей: а) NaHS; б) Na2S; в) AlCl3; г) СН3СООNН4; д) NaCl; е) Al2S3, которые подвергаются гидролизу, составьте уравнения соответствующих реакций в сокращённой, полной ионно-молекулярной и молекулярных формах. Укажите реакцию водных растворов этих солей.
Решение.
а) Гидросульфид NaHS – соль, состоящая из катиона сильного основания (гидроксида натрия NаОН) и аниона слабой (сероводородной Н2S) кислоты. В этом случае гидролиз идёт по аниону:
НS–
+ Н2О
![]() Н2S
+ ОН–.
Н2S
+ ОН–.
Это уравнение реакции в сокращённой ионно-молекулярной форме. Оно показывает, что в растворе увеличивается концентрация гидроксид-ионов, следовательно, реакция раствора данной соли щелочная (рН > 7).
Допишем к левой и правой частям этого уравнения реакции формулы ионов натрия, присутствующие в растворе, и получим уравнение в полной ионно-молекулярной форме:
Na+
+ HS–+
Н2О
![]() Н2S
+ Na+
+ OH–.
Н2S
+ Na+
+ OH–.
Уравнение реакции гидролиза соли в молекулярной форме имеет вид:
NaHS
+ Н2О
![]() Н2S
+NaOH.
Н2S
+NaOH.
б) Сульфид натрия Na2S – соль, состоящая из катиона сильного основания NaOH и аниона слабой двухосновной кислоты Н2S.
Гидролиз солей, состоящих из анионов слабых многоосновных кислот и катионов сильных оснований, происходит ступенчато (соответственно обратному процессу – ступенчатой электролитической диссоциации кислот) и при этом образуются кислотные соли (точнее, их анионы).
В данном случае гидролиз идёт в две ступени.
I ступень. С молекулами воды взаимодействуют анионы слабой кислоты – сульфид-ионы:
S2–
+ Н2О
![]() НS
+ OH;
НS
+ OH;
2Na+
+ S2–+
Н2О
![]() Na+
+ HS+
Na+
+ ОН;
Na+
+ HS+
Na+
+ ОН;
Na2S
+ Н2О
![]() NaHS
+ NaOH.
NaHS
+ NaOH.
II ступень. С водой взаимодействует анион НS–, являющийся более слабым электролитом, чем сероводородная кислота:
НS
+ Н2О
![]() Н2S
+ ОН;
Н2S
+ ОН;
Na+
+ HS+
Н2О
![]() Н2S
+ Na+
+ OH;
Н2S
+ Na+
+ OH;
NaHS
+ Н2О
![]() Н2S
+ NaOH.
Н2S
+ NaOH.
В обычных условиях (комнатная температура, атмосферное давление) гидролиз солей практически ограничивается первой ступенью. В данном случае сначала образуются ионы HS–, которые подвергаются электролитической диссоциации гораздо труднее, чем молекулы Н2S, так как гидросульфид-ион является более слабым электролитом (см. приложение 4). И поэтому лишь при сильном разбавлении (увеличении концентрации воды) и нагревании следует учитывать гидролиз кислотой соли по II ступени (по аниону HS–), который как эндотермический процесс происходит в соответствии с принципом Ле Шателье.
В результате гидролиза Na2S в растворе увеличивается концентрация гидроксид-ионов, следовательно, реакция раствора щелочная (рН > 7).
в) Хлорид алюминия АlCl3 – соль, состоящая из катиона слабого трёхкислотного основания (амфотерного гидроксида) Al (OH)3 и аниона сильной хлороводородной кислоты НСl. В этом случае гидролиз идёт по катиону. Процесс в принципе может идти в три ступени. При гидролизе солей, состоящих из катионов слабого многокислотного основания и аниона сильной кислоты, образуются оснόвные соли (точнее, их катионы).
I ступень. С молекулами воды взаимодействует катион слабого основания Al3+:
Al3++
Н2О
![]() AlOH2+
+ H+;
AlOH2+
+ H+;
Al3++
3Cl–
+ Н2О
![]() AlOH2++
2Cl–+
H+
+ Cl–;
AlOH2++
2Cl–+
H+
+ Cl–;
АlCl3
+ Н2О
![]() AlOHCl2
+ HCl.
AlOHCl2
+ HCl.
II ступень. С водой взаимодействует катион более слабого, чем гидроксид алюминия (см. приложение 4) основания AlOH2+:
AlOH2++
Н2О
![]() Al(OH)2+
+ Н+;
Al(OH)2+
+ Н+;
AlOH2
+ 2Cl–+
Н2О
![]() Al(OH)2++
Cl–+
Н+
+ Cl–;
Al(OH)2++
Cl–+
Н+
+ Cl–;
AlOHCl2
+ Н2О
![]() Al(OH)2Cl
+ НCl.
Al(OH)2Cl
+ НCl.
III ступень – реакция практически не идёт (ввиду накопления ионов водорода процесс согласно принципу Ле Шателье подавляется). Однако разбавление раствора и повышение температуры усиливают гидролиз. И поэтому можно записать уравнение реакции гидролиза данной соли по третьей ступени.
Al(OH)2+
+ Н2О
![]() Al(OH)3
+ Н+;
Al(OH)3
+ Н+;
Al(OH)2+
+ Cl–
+ Н2О
![]() Al(OH)3
+ Н+
+ Cl–;
Al(OH)3
+ Н+
+ Cl–;
Al(OH)2Cl
+ Н2О
![]() Al(OH)3
+ НCl.
Al(OH)3
+ НCl.
В результате гидролиза АlCl3 в растворе увеличивается концентрация ионов водорода, следовательно, реакция раствора кислотная (рН < 7).
г) Ацетат аммония СН3СООNН4 – соль, состоящая из аниона слабой кислоты и катиона соответствующего слабому основанию, которые связывают как ионы Н+, так и ОН–, одновременно образуя эти слабую кислоту и слабое основание:
СН3СОО–
+ NН4+
+ Н2О
![]() СН3СООН
+ NН3
· Н2О.
СН3СООН
+ NН3
· Н2О.
В аналогичных случаях реакция раствора зависит от относительной силы этих кислоты и основания. Если константы их электролитической диссоциации примерно равны, то гидролиз идёт в равной степени по катиону и по аниону и реакция раствора будет нейтральной. Если Ка > Кв, то соль гидролизуется по катиону в большей степени, чем по аниону, и концентрация ионов Н+ в растворе будет больше концентрации ионов ОН, следовательно, реакция раствора будет слабокислотной. Наконец, если Ка < Кв, то гидролиз соли будет идти в большей степени по аниону и реакция раствора будет слабощелочной.
Поскольку константы электролитической диссоциации СН3СООН и NН3 · Н2О, образующихся в результате гидролиза СН3СООNН4 равны, то раствор будет нейтральным (рН = 7).
д) Хлорид натрия NaCl – соль, состоящая из катиона сильного основания и аниона сильной кислоты, гидролизу не подвергается*. Ионы таких солей не способны образовывать с молекулами воды слабых электролитов. В этом случае гидролиз практически не происходит. Следовательно, концентрация ионов Н+ и ОН– будет такой же, как у воды, и реакция раствора будет нейтральной (рН = 7).
е) Сульфид алюминия Al2S3 – соль, состоящая из катиона слабого основания и аниона слабой кислоты.
Реакции гидролиза, как правило, обратимы (обратные гидролизу солей реакции – это реакции нейтрализации слабых кислот и слабых оснований).
Необратимо происходит гидролиз тех солей, продукты, реакции которых являются нерастворимыми или газообразными веществами. В уравнении реакции необратимого гидролиза, который идёт практически до конца, ставится знак равенства.
Необратимо гидролизующиеся соли невозможно получить реакциями обмена ионов в водных растворах.
В результате гидролиза сульфида алюминия образуются гидроксид алюминия и сероводород, которые уходят из сферы реакции:
Al2S3 + 6Н2О = 2Al(OH)3↓ + 3Н2S↑.
Поскольку константа электролитической диссоциации сероводородной кислоты больше константы диссоциации гидроксида алюминия, реакция раствора будет кислотной (рН < 7).
Обычно равновесие устанавливается после протекания реакции гидролиза по первой ступени. Для осуществления следующей стадии необходимо кипячение или нейтрализация раствора; этому способствует также разбавление раствора. Поэтому для предохранения солей от гидролитического разложения (подавления гидролиза) следует готовить по возможности наиболее концентрированные растворы солей и хранить их после добавления сильной кислоты или щёлочи, желательно содержащей общий ион в холодильнике.
Ответ: а, б рН > 7; в, е рН < 7; г, д рН = 7.
Пример 2. Вычислите значение рН 0,01 М водного раствора сульфата аммония.
Решение.
Сульфат аммония (NH4)2SO4, как хорошо растворимая в воде соль и сильный электролит, практически полностью диссоциирует в воде:
(NH4)2SO4 → 2NH4+ + SO42–,
при этом концентрация ионов аммония должна быть в 2 раза больше, чем исходная концентрация соли:
с (NH4+) = 0,01 моль/л ∙ 2 = 0,02 моль/л.
Поскольку данная соль, состоит из катиона, соответсвующего слабому основанию NH3·Н2О и аниона сильной кислоты H2SO4, то она подвергается гидролизу по катиону с образованием слабого основания:
NH4++
Н2О
![]() NH3·Н2О
+ Н+.
NH3·Н2О
+ Н+.
Рассчитаем константу гидролиза (Кh) данной соли (для этого с целью упрощения соответствующего выражения введём в числитель и знаменатель равновесную концентрацию гидроксид-ионов):
Кh
=
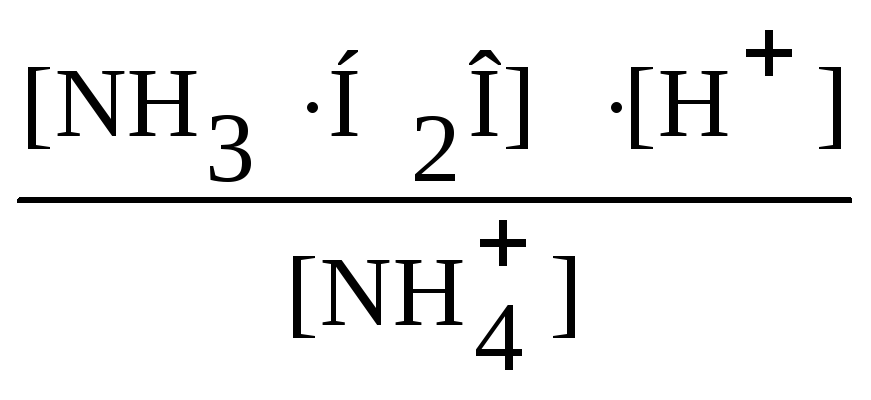 =
=
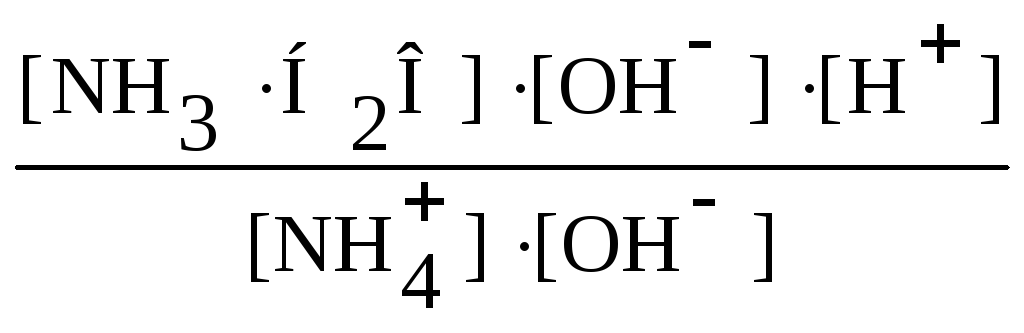 =
=
=
![]() =
=
![]() = 5,59 ∙ 10-10.
= 5,59 ∙ 10-10.
Доля подвергшихся гидролизу веществ, в частности солей, называется степенью гидролиза (h): 0 < h < 1. Гидролитическое равновесие подчиняется закону действующих масс. Константа гидролиза Кh представляет собой константу равновесия реакции гидролиза, умноженную на постоянную 55,56 моль/л (молярная концентрация воды, см. с. 44).
Для гидролиза солей катиона слабого основания, аниона слабой кислоты или/и катиона слабого основания аниона слабой кислоты выражения для соответствующих констант гидролиза будут иметь вид:
Кh
=
![]() ;
Кh
=
;
Кh
=
![]() ;
Кh
=
;
Кh
=
![]()
Для оценки степени гидролиза солей справедливо выражение, аналогичное закону разбавления Оствальда для электролитической диссоциации:
h=
![]() .
.
Для расчёта степени гидролиза солей разного типа применяются следующие формулы:
h
=
![]() ,
h
=
,
h
=
![]() или h
=
или h
=
![]() .
.
Пусть [H+] = x моль/л, тогда, исходя из уравнения реакции гидролиза,
![]() =
[H+]
= x
моль/л.
=
[H+]
= x
моль/л.
и подверглось гидролизу x моль/л ионов NН4+. Тогда равновесная концентрация иона [NH4+] равна (0,02 – х) моль/л. Подставим эти значения в выражение константы гидролиза:
Кh
=
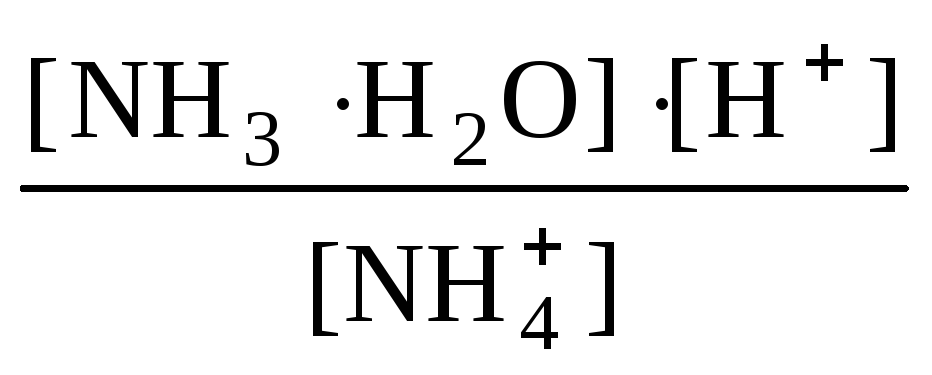 =
=![]() =
=![]() =
5,59 ∙ 10 –
10.
=
5,59 ∙ 10 –
10.
Упростим
выражение (![]() ).
).
Так как значение дроби очень мало (числитель во много раз меньше знаменателя), следовательно, х << 0,02 и 0,02 – х ≈ 0,02. Упрощённое таким образом уравнение имеет вид:
![]() =
5,59 ∙ 10–10.
=
5,59 ∙ 10–10.
Отсюда
х
=
![]() =
3,34 ∙ 10–6.
=
3,34 ∙ 10–6.
Следовательно,
[H+] = 3,34 ∙ 10–6; pH = –lg [H+] = –lg(3,34 ∙ 10–6) = 5,48.
Ответ: 5,48.
