
- •Глава 1 предмет, методы и значение генетики
- •Глава 2
- •(По с. Г. Куликовой)
- •1. Диплоидные наборы хромосом у сельскохозяйственных и некоторых видов домашних, прирученных и лабораторных животных
- •Гаметогенез и мейоз
- •Глава 3
- •Закон расщепления
- •Аллели. Множественный аллелизм
- •Отклонения от ожидаемого расщепления, связанные с характером доминирования признака и летальными генами
- •2. Вывод формулы расщепления по генотипу при дигибридном скрещивании
- •Полигибридное скрещивание
- •3. Количество фенотипов и генотипов в f2 при скрещивании родителей,
- •(Новообразование)
- •Глава 4 хромосомная теория наследственности
- •Полное сцепление
- •Сцеплении:
- •Неполное сцепление
- •Карты хромосом
- •4. Фенотипические классы кроликов, полученные при анализе на сцепление трех генов
- •Глава 5 генетика пола
- •Нарушения в развитии пола
- •5. Зависимость пола дрозофилы от отношения числа х-хромосом к числу наборов аутосом (Бриджес, 1932)
- •6. Нарушения в системе половых хромосом и их фенотипическое проявление
- •Проблема регуляции пола
- •Молекулярные основы наследственности
- •Строение и типы рнк
- •Генетический код
- •Синтез белка в клетке
- •Глава 7 генетика микроорганизмов
- •700А хвост
- •Конъюгация
- •Трансдукция
- •Трансформация
- •Глава 8 биотехнология
- •Генная инженерия
- •(По с. М. Гершензону)
- •I Химический синтез днк
- •Xj обработанные рестриктазой
- •1 Действие днк-лигазы
- •Трансформированные дочерние клетки
- •Клеточная инженерия
- •Химерные животные
- •Трансгенные животные
- •Виды изменчивости
- •9. Распределение сухостойных коров черно-пестрой породы
- •3,0 44 5,0 6Д 7.0 8,0 9,0 10,0 11,0 12.0 классы по количеству лейкоцитов (тыс.)
- •10. Определение основных статистических величин способом произведений для содержания количества лейкоцитов
- •В крови сухостойных коров (тыс. В 1 им)
- •11. Значение нормального интеграла вероятностей
- •Оценка достоверности разности между средними арифметическими двух выборочных совокупностей
- •Типы распределения
- •14. Распределение семейств по количеству больных туберкулезом коров
- •15. Значение вероятности появления редких событий при распределении Пуассона
- •3,4 3,6 4,0 4,6 5,0 5,4 5,8 Жирность молока, %
- •Критерий хи-квадрат (у2)
- •16. Соответствие фактического распределения семейств теоретически ожидаемому (биномиальному)
- •II квадрант
- •IV квадрант
- •I квадрант
- •III квадрант
- •20. Определение г для малых выборок
- •21. Корреляция частоты заболеваемости лейкозом матерей и дочерей
- •Дисперсионный анализ
- •23. Сводная таблица однофакториого дисперсионного анализа
- •Классификация мутаций
- •Хромосомные мутации
- •(По Харе, 1978)
- •Кариотипа
- •Генные мутации
- •Индуцированный мутагенез
- •Антимутагены
- •Глава 11 генетические основы онтогенеза
- •Тироксин
- •27. Продуктивность коров — дочерей и внучек разных быков-производителей в зависимости от условий кормления и выращивания (по о. А. Ивановой) Быки-производители— отцы и деды коров
- •Глава 12 генетика популяций'
- •Популяция и «чистая линия»
- •29. Снижение частоты рецессивного аллеля а при полной элиминации гомозигот aa (no Визнеру и Виллеру, 1979)
- •30. Уровень возрастания roi
- •31. Формы уродств в потомстве быка Бурхана 6083
- •Глава 13
- •32. Системы генетических групп крови
- •Наследование групп крови
- •33. Уточнение отцовства по группам крови
- •T t t гены
- •34. Некоторые биохимические полиморфные системы
- •V " j с j Гены легкой н- цепи
- •Генетика иммуноглобулинов
- •35. Аллотипы иммуноглобулинов кролика (по Кульбергу, 1985)
- •I клеткой тяжелых и легких I - -n/bJk I фенотип клетки — I а , d , d ,b,b — аллотипы иммуноглобулина кролика
- •36. Средние титры антител (1дг) поросят разных пород после вакцинации против псевдобешенства (по Rothschild и др.)
- •Ig2 титра антител
- •Клон клеток, возникший в результате мутации (2)
- •37. Мнс у домашних животных, в том числе птицы
- •38. Взаимосвязь аллелей комплекса в с заболеваемостью кур md, % (по Hansen и др.)
- •Генетические аномалии
- •Экзогенные аномалии
- •39. Частота пупочных грыж в потомстве разных быков (по а. И. Жигачеву)
- •40. Аутосомный доминантный тип наследования
- •41. Сводка доминантных признаков с летальным эффектом в гомозиготном состоянии (по Мейеру и Вегнеру, 1973)
- •42. Сцепленный с х-хромосомой тип наследования
- •43. Список генетически обусловленных аномалий у крупного рогатого скота
- •44. Частота отдельных форм врожденных аномалий у телят костромской породы (по данным племенного хозяйства за 1969—1982 гг.)
- •45. Список генетически обусловленных аномалий у свиней
- •46. Список генетически обусловленных аномалий у овец
- •IТип наследования
- •I дефекты, встречающиеся
- •Крупный рогатый скот
- •Крупный рогатый скот
- •48. Типы центрических слияний (транслокаций) различными парами аутосом у крупного рогатого скота (по Густавссону, с нашими дополнениями)
- •49. Число осеменений на зачатие (по Ценеру и др.)
- •50. Продолжительность сервис-периода
- •52. Сравнение снижения воспроизводительной способности хряков-носителей реципрокных транслокаций и эмбриональной смертности у их потомства
- •53. Классификация гоносомальных аберраций у лошади
- •64, Xy овари-
- •54. Хромосомные аберрации в разных линиях кур (по Блому, 1974)
- •Глава 16
- •Особей из Fi
- •55. Частота заболеваемости бруцеллезом потомства некоторых быков и семейств (по в. Л. Петухову)
- •56. Заболеваемость туберкулезом животных разных пород (по Bate, Sidhu)
- •57. Частота заболеваемости туберкулезом потомства некоторых быков и семейств (по в. Л. Петухову)
- •58. Сравнение устойчивости некоторых инбредных семейств кроликов
- •По длительности жизни после стандартного введения возбудителей
- •Бычьего туберкулеза и после ингаляции человеческого туберкулеза
- •(По Lurie и Dannenberg)
- •59. Результаты скрещивания резистентных и восприимчивых к лептоспирозу животных, % (по Przytulskl и др., 1980)
- •60. Среднее число нематод в 1 г фекалий чистопородных и гибридных овец (по Jazwinski и др.)
- •61. Генетическая устойчивость к нематодам овец с разными типами гемоглобина (по Aftaif и др.)
- •Выживаемость после инфекции.Дней
- •62. Смертность от сердечной водянки телят до 30-месячного возраста, родившихся на станции Мара в Трансваале (по Bonsma)
- •К клещам
- •63. Число клещей после двух заражений (по j. Frish)
- •64. Устойчивость к клещам разных пород (по j. Frish)
- •65. Заболеваемость лейкозом дочерей резистентных и восприимчивых к лейкозу быков (по в. Л. Петухову)
- •66. Частота заболеваемости потомства лейкозом в зависимости от состояния здоровья родителей (по в. Л. Петухову)
- •67. Частота инфицированности влкрс дочерей, полученных от инфицированных и здоровых матерей (по а. Г. Незавитину)
- •68. Рак глаз и пигментация радужной оболочки (по Nishimura и др.)
- •69. Резистентность к болезни Марека инбредных линий кур и их кроссов после экспериментального заражения (по Gavora, Spenser)
- •70. Зависимость резистентное™ кур к болезни Марека от антигена в21 (по Hutt)
- •Болезни обмена веществ
- •73. Влияние породы на заболеваемость овец энзоотической атаксией и содержание меди (по Wiener)
- •I печени, мг/кг
- •Воспалительно-инфекционные осложнения
- •74. Частота болезней и деформация копыт у коров различного происхождения, % (по Косолапикову)
- •76. Частота мертворожденных и трудных отелов у некоторых пород Скандинавских стран и фрг (цит. По Дехтяреву и др.)
- •К стрессу
- •Генетических аномалий и повышения наследственной устойчивости животных к болезням
- •77. Количество нормального потомства при разных типах спаривания, необходимое для проверки гетерозиготного носительства у животных
- •Оценка генофонда пород
- •78. Устойчивость скота разных пород к трипаносомозу, тейлериозу, анаплазмозу и нематодам (по Anosa)
- •79. Устойчивость кур разных линий к лейкозу и моноцитозу (по Hatt)
- •80. Коэффициент наследуемости устойчивости (%) к некоторым болезням
- •Крупный рогатый скот
- •81. Комплексная оценка генофонда некоторых семейств (по в. Л. Петухову)
- •Селекция животных на устойчивость к болезням
- •82. Селекция морских свинок на устойчивость и чувствительность к т. Columbrtformis (no Rothwell)
- •83. Результаты селекции цыплят на резистентность к эймериозу (no Klimes, Orel)
- •84. Наследуемость некоторых механизмов защиты у молодых быков
- •Глава 8. Биотехнология. Г. А. Назарова, в. Л. Лопухов 103
- •Глава 11. Гемтлеспе основы онтогенеза. Г. А. Назарова 178
- •Глава 16. Болезни с наследственной предрасположенностью.
- •Глава 17. Методы профилактики распространенна генетических аномалий н повыпкиня наследственной устойчивости животных к болезням.
Клеточная инженерия
Под клеточной инженерией понимают метод конструирования клеток нового типа на основе их культивирования, гибридизации и реконструкции.
К у*л ь т у р а клеток — метод сохранения жизнеспособности клеток вне организма в искусственно созданных условиях жидкой или плотной питательных сред. Использование культуры клеток начато в 50-е годы нашего столетия, когда была показана возможность выращивания вирусов в культивируемых клетках. Затем развитие вирусологии и методов культивирования клеток животных и человека позволило ученым приступить к созданию вирусных вакцин.
Для культивирования могут быть использованы клетки опухолевых тканей, клетки различных органов, лимфоциты, фибро-бласты, эмбрионы, клетки почек животных и человека, раковые клетки человека и т. д. Культуры, приготовленные непосредственно из тканей организма, называются первичными. В большинстве случаев клетки первичной культуры можно перенести из культуральной чашки и использовать для получения вторичных культур, которые можно последовательно перевивать в течение недель и месяцев. Многие клетки при этом сохраняют признаки дифференцировки тех тканей, из которых они были получены. Например, фибробласты продолжают секретировать коллаген, клетки скелетных мышц эмбриона сливаются и образуют гигантские мышечные волокна, которые спонтанно сокращаются в чашке для культуры тканей, и т. д. Так как все это происходит в культуре, то является доступным для изучения с помощью приемов, которые неприемлемы при работе с интактными тканями.
Клетки животных и человека выращивают на специальных средах в виде суспензии или монослоя на стекле. Технология культивирования некоторых клеток животных настолько хорошо отработана, что может быть использована в производственных целях для получения различных продуктов. В настоящее время клонировано много генов, кодирующих синтез белков разной
110
биологической ценности. Некоторые из таких генов удалось перенести в клетки животных, и они стали продуцентами биологически активных белков. В промышленных масштабах в биореакторах с использованием клеток животных налажено производство таких белков. Они используются как медицинские препараты. Например, эритропоэтин (гормон, стимулирующий образование красных кровяных тел), активатор плазминогена (используется для предотвращения образования тромбов), фактор свертывания крови III (используется при гемофилии), инсулин (для лечения диабета), поверхностный белок вируса гепатита В, интерлейкины и др.
Соматическая гибридизация. Одним из важных направлений клеточной инженерии является гибридизация соматических клеток. Сущность ее заключается в соединении клеток с хромосомными наборами систематически далеких форм.
Впервые гибриды соматических клеток обнаружил в I960 г. французский биолог Ж. Барский. В культуре ткани клеток двух линий мышей он выявил третий тип клеток. Клетки эти оказались гибридными. Они содержали хромосомы клеток обеих исходных линий. Морфологические и биохимические признаки гибридных клеток были промежуточными между признаками исходных. Однако спонтанное слияние клеток наблюдается редко. В связи с этим разработана техника гибридизации соматических клеток с использованием вируса Сендай. Вирус инактивируют ультрафиолетовыми лучами или алкилирующим мутагеном. Инактивированный вирус вносят в смешанную культуру двух типов клеток. Некоторые клетки при этом сливаются с образованием одной с двумя ядрами. После митотического деления из двухъядерной клетки формируются две одноядерные гибридные соматические клетки. В каждой гибридной клетке содержится по одному набору хромосом каждого типа родительских клеток.
При помощи вируса Сендай к настоящему времени получены гибриды клеток многих далеких видов (мыши и курицы, мула и мыши, кролика и обезьяны, человека и курицы, коровы и норки и др.). Гибридные клетки могут размножаться в течение длительного времени, но межвидовая несовместимость имеет место и при соматической гибридизации. Так, в культуре клеток с течением времени образуются клоны, которые почти совсем или совсем утрачивают хромосомы второго вида. Это явление открывает возможности для изучения локализации и характера действия тех или иных генов.
Можно изучить клеточный клон, в котором сохранилась только одна хромосома другого вида, и по наличию или отсутствию в клетке определенных соединений решить вопрос, имеется ли в той или иной хромосоме определенный ген. Можно установить, какой, например, фермент прекращает вырабатывать клетка при утрате той или иной хромосомы. На этом основании можно
111
Антиген
7. 3
Антигенная
детерминанта
(зпнтоп)
Лимфоциты
клешни
мивламы
ГГФГ
Слияние
д полиэтилен
-гликоле
-У
Среда ГАТ ОтВор
гибридных клеток
*€>
Антиген
АнтисыЬаротка
Клон!
Анти-


 определить,
что ген, кодирующий данный фермент,
сцеплен с ушедшей
хромосомой. Таким путем была определена
локализация многих генов в определенных
хромосомах человека.
определить,
что ген, кодирующий данный фермент,
сцеплен с ушедшей
хромосомой. Таким путем была определена
локализация многих генов в определенных
хромосомах человека.
Соматическая гибридизация может быть использована для картирования хромосом, а также для изучения регуляции действия генов, дифференцировки клеток в онтогенезе и механизма взаимодействия ядра и цитоплазмы.
ГИБРИДОМНАЯ ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Введение антигена (бактерий, вирусов и т. д.) вызывает образование разнообразных антител против многих детерминант антигена. В 1975 г. Г. Кёлер и К. Мильштейн (лауреаты Нобелевской премии) получили моноклональные антитела с помощью гибридомной технологии.
Моноклональные антитела — это иммуноглобулины, синтезируемый одним клоном клеток. Моноклональное антитело связывается только с одной антигенной детерминантой на молекуле антигена.
Гибридомная технология — слияние с помощью полиэтиленгли-коля лимфоцитов селезенки предварительно иммунизированных организмов определенным антигеном с миеломными (раковыми) клетками, способными к бесконечной пролиферации (делению). Гибридные клетки селекционируют в среде ГАТ (среда, содержащая гипоксантин, аминоптерин и тимидин). Неслившиеся лимфоциты погибают в любой тканевой культуре. Миеломные клетки на этой среде также погибают, так как они были дефектны по ГГФТ (гипоксантин-гуанозин-фосфорибозилтрансферазе). Отбирают клоны клеток, синтезирующие необходимые антитела (рис. 28). Нужные клоны можно хранить в замороженном состоянии.
Таким образом, гибридомы представляют собой бессмертные клоны клеток, синтезирующие моноклональные антитела.
Получение и использование моноклональных антител — одно из существенных достижений современной иммунологии. С их помощью можно определить любое иммуногенное вещество. В медицине меченные изотопами или иным способом моноклональные антитела можно использовать для диагностики рака и определения локализации опухоли, для диагностики инфаркта миокарда. Получены моноклональные антитела к различным возбудителям: малярии, трипаносомозу, лейшманиозу, токсо-плазмозу и др. Ученые считают, что в самом ближайшем будущем моноклональные антитела займут доминирующее положение в диагностике болезней. Для использования в терапии моноклональные антитела можно соединять с лекарством (например, с токсическими веществами) благодаря специфичности антител они доносят это вещество непосредственно к раковым клеткам
112
Отбор Вариантов и размножение желательных* клинад(1,4)
![]()
![]()
| Выращивание \ в массовой
культуре
Смешанные антитела
Манокланалыные антитела
Рис. 28. Получение моноклональных антител (по Милыптейну, 1982)
или патогенным микроорганизмам, что позволяет значительно повысить эффективность лечения. Можно использовать моноклональные антитела (против Н — Y-антигена) для определения пола у крупного рогатого скота на предимплантационной стадии развития, а также для стандартизации методов типирования тка-
113
ней при трансплантации органов, при изучении клеточных мембран (так были изучены антигены Т-лимфощггов), для построения антигенных карт вирусов, возбудителей болезней.
ЭМБРИОГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
Эмбриогенетическая инженерия — это активная перестройка генома животных путем вмешательства в их развитие на самых ранних стадиях онтогенеза. Перестройка генома — это реконструкция эмбрионов путем клонирования, слияния или непосредственной инъекции в их ядра чужеродной ДНК. Однако получение эмбриональных клонов, химер или трансгенных животных возможно лишь в результате успешной трансплантации реконструированного эмбриона.
Трансплантация — метод ускоренного воспроизводства высокопродуктивных животных путем получения и переноса одного или нескольких эмбрионов от высокоценных животных (доноров) менее ценным животным (реципиентам). Использование трансплантации позволяет получать от одной генетически ценной самки в десятки раз больше потомства.
Технология трансплантации опирается на крупные достижения в области биологии размножения животных и включает следующие приемы: 1) гормональное вызывание суперовуляции; 2) осеменение доноров семенем производителей, оцененных по качеству потомства; 3) извлечение и оценку качества эмбрионов, сохранение и пересадку или криоконсервирование эмбрионов в жидком азоте, оттаивание и пересадку.
Трансплантацию эмбрионов применяют для следующих целей:
размножения генетически ценных особей; с помощью этого метода может быть решен вопрос быстрого создания высокопро дуктивных линий и семейств, резистентных к болезням;
получения идентичных животных путем разделения ранних эмбрионов. Это дает возможность изучить взаимодействие гено тип — среда, выяснить влияние наследственности на хозяйствен но полезные признаки. Технология разделения эмбрионов позво ляет одну половину полученной бластоцисты подвергнуть глубо кому охлаждению, а из другой вырастить животное. Если производитель (из одной половины бластоцисты) окажется гене тически ценным, то имеется возможность воспроизвести его копию через определенный промежуток времени;
сохранения мутантных генов, малых популяций и генофон да пород;
получения потомков от бесплодных, но генетически цен ных по генотипу животных;
5) выявления вредных рецессивных генов и хромосомных аномалий;
114
повышения устойчивости животных к болезням;
борьбы с болезнями путем замены импорта и экспорта животных на импорт и экспорт криоконсервированных эмбрио нов;
акклиматизации импортных животных иностранных пород;
определения пола эмбриона и получения животных опреде ленного пола;
межвидовых пересадок;
получения химерных животных, которые развиваются из ранних эмбрионов, сконструированных из бластомеров разных животных.
КЛОНИРОВАНИЕ ЭМБРИОНОВ МЛЕКОПИТАЮЩИХ
Истинные клоны позвоночных животных — амфибий были получены путем пересадки ядер соматических клеток в энуклеи-рованные яйцеклетки. Получение эмбриональных клонов основано на свойстве тотипотентности эмбриональных клеток.
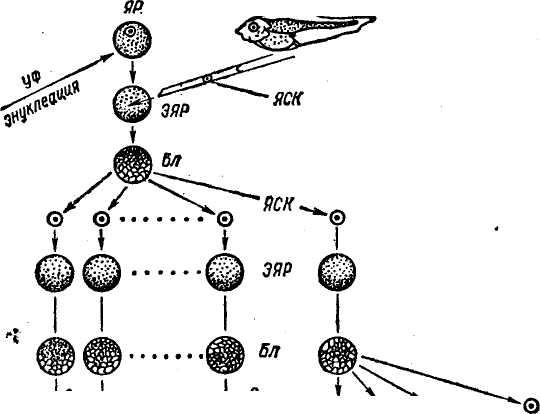
В 1952 г. Р. Бриггс и Т. Кинг разработали метод пересадки ядер соматических клеток зародышей в энуклеированные яйцеклетки лягушек. Дж. Гёрдон в 1962 г. усовершенствовал технику пересадки. Он разрушал ядра яйцеклеток лягушки ультрафиолетовыми лучами, затем в каждое из яиц вводил ядро из дифференцированной клетки кишечного эпителия плавающего головастика (рис. 29). В ряде случаев такие ядра вызывали развитие генетически идентичных эмбрионов и взрослых лягушек. Впервые были получены истинные клоны позвоночных животных. Затем был использован метод культивирования in vitro клеток кожи взрослых лягушек. Пересадка ядер из таких клеток привела к получению генетических клонов головастиков, но вероятность успеха при трансплантации ядер из клеток кожи взрослых лягушек очень мала. При использовании ядер соматических клеток взрослых животных развитие клонов ограничивалось стадией головастиков. Ядра взрослых организмов и даже поздних эмбрионов по каким-то причинам утрачивают свои потенции. В последние годы установлено, что в ядрах эритроцитов взрослых амфибий имеются гены, контролирующие развитие эмбриона до .стадии головастика, включение таких ядер в цитоплазму ооцитов ведет к реактивации репрессированных участков генома.
В последние 10 лет разработан метод пересадки ядер, сочетающий приемы микрохирургии и технику слияния клеточных фрагментов, начато проведение опытов по трансплантации ядер у овец и крупного рогатого скота.
Несмотря на сложность проведения работ по трансплантации ядер соматических клеток в энуклеированную зиготу, проблема эта является актуальной, так как открывает возможности копи-
115
Гй
ЯСК
©
© © яск
\
\ \


 {КС
9
{КС
9
Рис. 29. Серийные ядерные пересадки (по Дж. Гёрдову):
© ©
иксз
ЯСК для ШКСЭ
ЯР — яйцо-реципиент; ГД ЯСК — головастик—донор ядер соматических клеток; ЭЯР — энуклеированное яйцо-реципиент; ЯСК — ядра соматических клеток; Бл — бластула; КСЭ — клон серийных эмбрионов
рования выдающихся по продуктивности животных и создания стад с высоким генетическим потенциалом.
Клоны можно получить путем разделения эмбрионов на ранней стадии развития. Установлено, что, если количество клеток эмбриона (бластомеров) не превышает 16, они еще не дифференцированы. Это позволяет разъединять эмбрионы (бластулы) на 2 и большее число и получать однояйцевых близнецов. К настоящему времени получены монозиготные близнецы телят, жеребят, ягнят и поросят. В перспективе предполагается, что обеспечение оптимальных условий для культиви-
116
рования ранних эмбрионов in vitro создаст возможность выращивать половинки эмбрионов с последующим неоднократным их разделением, что позволит в значительной степени увеличить число годных для трансплантации зародышей, происходящих от одного эмбриона, и получить более многочисленные клоны эмбрионов у сельскохозяйственных животных, что будет способствовать более успешной их селекции.
