
posobie_hirurg_sepsis
.pdf
&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
гемокоагуляции, некрозу эндотелия и развитию полиорганной недостаточно- сти (рис. 1).
Грамотрицательная |
микрофлора |
Эндотоксин
липополисахарид
Липид А |
Ядерный антиген |
О-специфический антиген |
Липополисахарид- |
Клетки-мишени: моноци- |
|
связывающий белок в |
||
ты/макрофаги, эпителиоциты, |
||
организме больного |
||
лимфоциты, фибробласты |
||
|
хемотаксис
метаболическая активность
пролиферация
апоптоз
дифференцировка

Рис. 1. Роль грамотрицательной микрофлоры в патогенезе сепсиса. ме-
За последнее время среди этиологических факторов хирургического сепсиса существенно вырос удельный вес грамотрицательной микрофлоры, среди которой особое место занимает синегнойная палочка (Pseudomonas
16

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
aeruginosa). Последняя чаще обитает на ожоговых ранах, перитонельном экс- судате, достаточно часто встречается при возникновении госпитальной ин- фекции. Патогенность синегнойной палочки обусловлена способностью её вырабатывать эндотоксин, обладающий кроме всего прочего и протеолити- ческими свойствами. Хирургический сепсис, вызванный данным возбудите- лем, обычно протекает по типу молниеносного, нередко - с явлениями септи- ческого шока.
Среди грамотрицательной флоры в развитии сепсиса важную роль иг- рает кишечная палочка (E. сoli). Последняя является представителем семей- ства энтеробактерий, относится к условно-патогенным микробам, однако при попадании в инфицированные ткани является источником развития гнойно- септического процесса. Классическим примером такого её патологического влияния служит участие этой микрофлоры в развитии перитонита и абдоми- нального сепсиса. Патогенные формы E. coli выделяют как экзо- так и эндо- токсин.
Среди анаэробных возбудителей сепсиса чаще других выявляются представители так называемой «неклостридиальной анаэробной инфекции» (факультативные анаэробы) - бактероиды, фузобактерии, пептококки, пепто- стрептококки, эубактерии, фузобактерии, вейлонеллы и другие. Сепсис, вы- зываемый этими представителями, протекает тяжело, зачастую со скудной
клинической симптоматикой и требует интенсивных и адекватных методов лечения.
Одним из представителей неклостридиальной анаэробной микрофлоры является семейство бактероидов (Bacteroides). Как правило, они продуци- руют многочисленные протеолитические ферменты, в т.ч. гепариназу. Этот
фермент способствует образованию микротромбов и клеточных агрегатов в системе микроциркуляторного русла, существенно ухудшая тканевой крово- ток, стимулирует процессы диссеминированного внутрисосудистого сверты- вания (ДВС) крови, может вести к разнообразным эмболическим осложне- ниям. Отмечен синергизм действия бактероидов и слабовирулентных форм аэробов. Последние за счет поглощения кислорода из тканей, выделяют про- дуценты с резко выраженными восстановительными свойствами. Это спо- собствует размножению бактероидов. Сепсис с участием бактероидов проте- кает с формированием вторичных пиемических очагов в головном мозге, легких, органах брюшной и грудной полостей.
Представителями облигатных анаэробов, которые могут участвовать в возникновении сепсиса, ведущая роль принадлежит клостридиям - Cl. septicum, Cl. рerfringens, Cl. hystoliticum, Cl. oedematiens, Cl. sprogenes, экзотоксин которых обладает сильнейшим протеолитическим, липолитическим и гемо- литическим действием. Данные свойства экзотоксина приводят к быстрому расплавлению тканей, свободному распространению в организме и тяжелому повреждению практически всех органов и систем больного. Основными па- тогенетическими проявлениями сепсиса, вызванного этими микроор-
17

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
ганизмами, являются: преобладание общеклинических проявлений над мест- ными; тенденция к развитию тяжёлого септического шока; гнилостный ха- рактер повреждения тканей вследствие анаэробного окисления белков с об- разованием летучих жирных кислот, водорода, азота, метана и других ве- ществ; клеточный гемолиз и быстро нарастающая анемия; редкое метастази- рование; высокая устойчивость к действию антибиотиков; формирование ус- тойчивых ассоциаций с протеем, кишечной палочкой и стафилококком. Ши- рокое, не всегда обоснованное, применение антибиотиков в клинической
практике способствовало появлению различных форм кандидозного сепсиса
(Candida albicans, Candida tropikal и др.). Эта форма генерализованной ин-
фекции, вследствие выделения кандидами высокотоксичных субстанций и их способности к внутриклеточной гиперактивации клеток макрофагально-мо- ноцитарного ряда, имеет тяжёлое течение с явлениями септического шока.
3.1. РОЛЬ ПРОТИВОИНФЕКЦИОННЫХ МЕХАНИЗМОВ МАКРООРГАНИЗМА В РАЗВИТИИ ХИРУРГИЧЕСКОГО СЕПСИСА
Противоинфекционные механизмы макроорганизма складываются из последовательного включения в борьбу с проникающими микробными воз- будителями трех различных составляющих, обеспечивающих единый функ- циональный комплекс (рис. 2).
На пути проникновения микрофлоры из первичного гнойно-септиче- ского очага находится ряд барьеров, входящих в систему естественной ре-
зистентности организма (рис. 3):
а) I уровень – конкурентные взаимодействия с бактериями нормаль- ной микрофлоры, так называемая «колонизационная резистентность»;
б) II уровень – барьеры по пути микробной инвазии: кожа, слизистые оболочки, лизоцим, интерферон и др.; данный уровень оказывает на микро- организмы бактерицидное и бактериостатическое действие; стимулирует рост одних микробов, препятствуя размножению других видов; в большин- стве случаев клиническим проявлением сепсиса предшествуют механиче- ские, физические или трофические нарушения целостности кожных покровов или слизистых оболочек; в некоторых случаях по характеру кожных высыпа- ний можно судить об этиологическом факторе заболевания: так, для стафи- лококкового сепсиса характерна геморрагическая ссыпь на ладонной поверх- ности пальцев, для пневмококкового – мелкоточечная ссыпь на поверхности грудной клетки, для менингококцемии - полиморфные геморрагические вы- сыпания на лице, грудной клетке, передней брюшной стенке и конечностях;
в) III уровень включает клеточные (фагоцитарная система циркули- рующих в крови моноцитов, тканевых макрофагов, нейтрофилов, естествен-
18

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
ных клеток-киллеров) и гуморальные механизмы; последние представлены индукцией альтернативного пути активации компонента, естественными ан- тителами, лизоцимом и интерфероном.
Первичный гнойно-септический очаг
I |
Начало болезни - Механизмы естественной резистентности |
|
1 сутки |
(клеточные, гуморальные) |
|
II |
2-3 сутки |
Ранний иммунный (индуцибельный) |
|
ответ |
|
|
|
3-4 сутки |
Адаптивный иммунный ответ |
III |
(специфические иммунные реакции) |
Протективный |
Иммунологическая память |
|
Клеточный |
Гуморальный |
Поствакцинальный иммунитет |
Рис. 2. Механизмы противомикробной защиты при сепсисе.
Механизмы естественной резистентности организма эффективны в отношении внеклеточных (условно-патогенных) возбудителей со слабой ви- рулентностью.
Далее, как правило, вступает в действие второй, наиболее мощный механизм защиты организма от инфекции – так называемый ранний индуцибельный ответ. Действие данного механизма защиты продолжается в те- чение 96 часов до наступления специфического (адекватного) иммунного от-
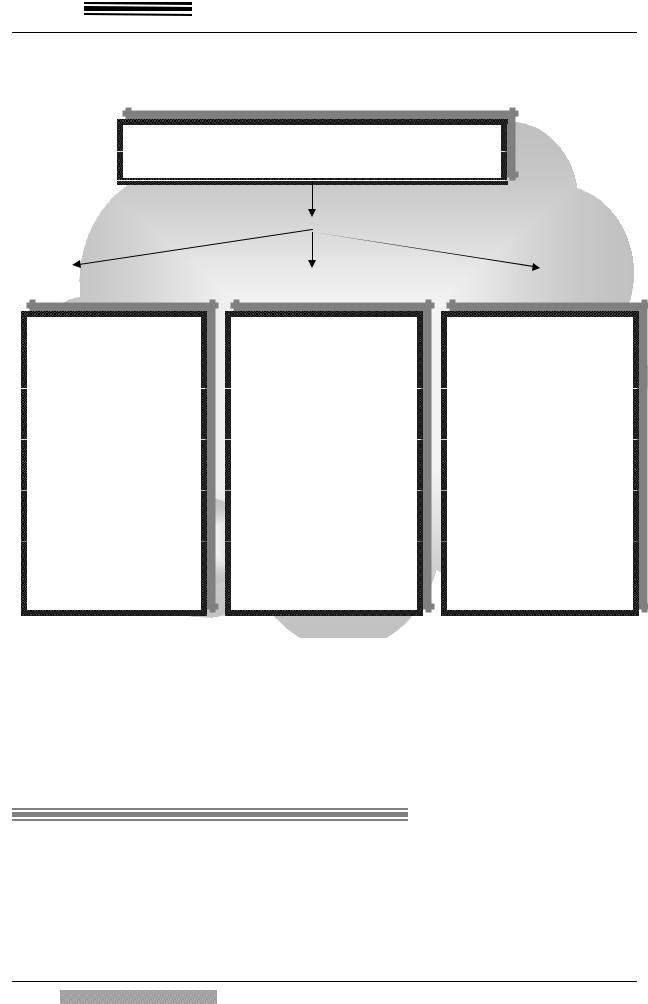
19
& |
Хирургический сепсис. Учебное пособие |
||
вета. Для раннего индуцибельного иммунитета также можно выделить кле- |
|||
точные и гуморальные факторы (рис. 4). |
|
||
Первичный гнойно-септический очаг |
|||
Механизмы естественной резистентности |
|||
Барьерные |
Клеточные |
Гуморальные |
|
Механизмы ре- |
Тканевые макрофа- |
Лизоцим; |
|
акции кожных и |
ги; |
|
|
слизистых оболо- |
|
|
|
чек; |
Нейтрофилы; |
Комплемент; |
|
|
|
||
Колонизационная |
Естественные кил- |
|
|
резистентность; |
Интерферон; |
||
леры (ЕК); |
|||
|
|
||
Целостность ко- |
Клетки моноци- |
|
|
жи и слизистых |
Специфические |
||
тарно-макрофа- |
|||
оболочек. |
антитела. |
||
гальной системы. |
|||
|
|
||
Рис. 3. Механизмы естественной резистентности организма при хи- |
|||
|
рургическом сепсисе. |
|
|
3.2. ЗНАЧЕНИЕ ВОСПАЛИТЕЛЬНЫХ МЕДИАТОРОВ
В ПАТОГЕНЕЗЕ ХИРУРГИЧЕСКОГО СЕПСИСА
Тканевые макрофаги, активированные микробными липополисаха- ридными комплексами в результате фагоцитоза возбудителя, начинают про- дуцировать ряд цитокинов. Последние представляют собой сравнительно крупные белковые молекулы с молекулярной массой 10000-45000 Д. Цито- кины являются медиаторами межклеточных реакций, участвующими в им-
20

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
мунном ответе, гемопоэзе, развитии воспаления и т.д.; они также обеспечи- вают взаимодействие иммунной с другими системами организма.
96 часов
Первичный гнойно-септический очаг
Ранний индуцибельный ответ
96 часов |
Клеточные механизмы |
Гуморальные механизмы |
||
Макрофаги Нейтрофилы |
Естественные |
Цитокины |
Белки |
клетки-киллеры |
|
острой фазы |
|
|
|
|
воспаления |
Цитокины: |
v фактор некроза опухолей-α, |
v интерлейкины – 1, 6, 8, 12, |
v α-интерфероны, |
v колониестимулирующие |
факторы. |
Рис. 4. Механизмы раннего (индуцибельного) иммунного ответа при сепсисе.
Цитокиновая сеть включает основные группы веществ, объединен- ных по их доминирующему характеру действия на другие клетки:
1. Интерлейкины (ИЛ) – факторы взаимодействия между лейкоци-
тами;
2.Интерфероны (ИФ) – цитоксины с противовирусной активностью;
3.Факторы некроза опухолей (ФНО) – цитоксины с цитотоксиче- ской активностью;
4.Колониестимулирующие факторы (КСФ) – или гемопоэтические цитоксины.
21

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
Выделяют 3 группы клеток, вырабатывающих цитокины. Каждая груп-
па характеризуется собственным типом ответа на активацию и собственным набором вырабатываемых при этом цитокинов:
v А. Стромальные соединительнотканные клетки – продуцируют
КСФ;
vБ. Макрофаги/моноциты – продуцируют цитокины воспаления (монокины));
vВ. Лимфоциты – продуцируют лимфокины (последние обеспечи- вают развитие специфических реакций иммунного ответа).
Внастоящее время известно о 18 интерлейкинах, которые условно под-
разделяют на две основные группы:
1.Провоспалительные – интерлейкины 1, 6, 8, 12 и др.
2.Противовоспалительные – интерлейкины RA-ИЛ-1; 4; 10; 11; 13.
Данные цитокины при развитии сепсиса вызывают ряд опосредован-
ных процессов:
vИЛ-1. Активирует Т- и В-лимфоциты, стимулирует образование белков острой фазы воспаления (БОФ) и продукцию провоспалительных ме- диаторов (ИЛ-6; ИЛ-8; ФНО), фактора агрегации тромбоцитов (ФАТ). Сти- мулирует гемопоэз; температуру тела.
vИЛ-2. Стимулирует продукцию ФНОL и интерферона (ИФ); уве- личивает пролиферацию и цитотоксические свойства Т-лимфоцитов.
vИЛ-4. Активирует В- и Т-клетки, макрофаги усиливает выработ- ку иммуноглобулина (Jg) Е, способствует развитию аллергических реакций.
vИЛ-6. Активирует Т-клетки. Стимулирует дифференциацию ак- тивированных В-клеток и пролиферацию активированных Т- и В-клеток. По- вышает температуру тела, стимулирует синтез БОФ. Способствует обост-
рению хронических воспалительных инфекционных процессов и хронизации острых.
vИЛ-8. Стимулирует активность гранулоцитов, хемотаксис, уси- ливает нейтрофильный лейкоцитоз и ангиогенез. Индуктор движения фаго- цитов.
vИЛ-10. Тормозит синтез цитокинов с помощью Т-хелперов 1-го типа; активирует макрофаги и ЕКК. Стимулирует теноциты, В-клетки и туч- ные клетки.
vИЛ-12. Регулирует соотношение клеточного и гуморального им- мунного ответа в направлении Т-хелперов 1-го типа. Стимулирует актив- ность ЕКК, обуславливает дифференцировку цитотоксических Т-лимфоци- тов. Активирует В-лимфоциты; обуславливает выход стволовых кроветвор- ных клеток в циркуляцию.
Группа факторов некроза опухолей (ФНО) включает α-ФНО и β-
ФНО (или лимфотоксин-альфа и лимфотоксин-бета);
22

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
v ФНО – гликопротеины с молекулярной массой 17000-25000 Д. Наибольшее значение при сепсисе имеет ФНО-α. Он способствует
развитию классических признаков воспаления (опухоль, покраснение, боль, жар), активирует макрофаги, гранулоциты, эозинофилы и эндотелиальные клетки, обладает хемотоксической и ангиогенной активностью.
В группе интерферонов (ИФ) выделяют α- (макрофагальный), β- (фиб- робластный) и γ- (лимфоцитарный или иммунный) интерфероны.
v γ-ИФ проявляет антивирусную и противоопухолевую актив- ность; способствует повышению температуры, активирует макрофаги и эндо- телиальные клетки; стимулирует дифференцировку и активацию В- и ЕК- клеток.
К колониестимулирующим факторам (КСФ) относят гранулоци-
торно-макрофагальный, гранулоцитарный и макрофагальный факторы, а также фактор стволовых клеток (ФСК). КСФ стимулируют рост нейтрофилов и их активность, гранулоцитов и эозанофилов, активируют макрофаги и ге- мопоэз.
Наряду с активированными макрофагами, являющимися основными продуцентами цитокинов, немаловажную роль в защите организма от микро-
бов из первичного септического очага играют нейтрофилы и естественные клетки-киллеры (ЕКК).
Нейтрофилы характеризуются наличием двух важных функций:
1)поглощения внеклеточных бактерий и их фагоцитирование;
2)они являются продуцентами цитокинов (ИЛ-1, 8; 12; ФНО-α, α- ИФ, КСФ); с помощью них активируются и вовлекаются в борьбу с микроб- ными возбудителями новые эшелоны клеток, поступающих в первичный очаг инфекции.
Естественные клетки-киллеры защищают организм от внутрикле- точных микроорганизмов за счет наличия у них ряда функций - цитотоксиче- ской и индуктивной (выработка γ-интерферона). Именно γ-интерферон обла- дает выраженной способностью активировать нейтрофилы, моно- циты/макрофаги и новые ЕКК. Кроме того, ЕКК участвуют в общей реакции синтеза цитокинов (ИФ-γ, КСФ, ИЛ-3, 8 и др.). Эти клетки наряду с макрофа- гами выполняют в организме человека надзорную и санитарную функцию.
Без микробной (антигенной) стимуляции цитокиновая сеть функцио- нирует на минимальном уровне, при этом клетки иммунной системы практи- чески не выделяют цитокины и не реагируют на них. Кроме того, нормально функционирующие механизмы иммунной системы препятствуют бескон- трольному выделению цитокинов и других воспалительных медиаторов, обеспечивая адекватную реакцию организма на воспаление. В начале воспа- лительной реакции (ответ на первичное поступление микробов и их токсинов из гнойно-септического очага) в крови начинают одновременно появляться как про-, так и противовоспалительные цитокины. Без дальнейшего поступ- ления микрофлоры из первичного очага, цитокины данных групп уравнове-
23

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
шивают (нейтрализуют) активность друг друга. Это определяет благоприят-
ное течение воспалительного процесса и способствует отграничению очага воспаления.
При непрерывном поступлении микробов из первичного гнойно-сеп- тического очага (а также при их повышенной вирулентности, обширности и массивности бактериального очага, микробной обсеменённости >105/г, нали- чии некроза тканей, а также тканевой гипоксии, ишемии и др.) происходит дальнейшая активация иммунных клеток. При этом макрофаги, нейтрофилы
иЕК-клетки начинают бесконтрольно выделять цитокины, что превращает их из факторов иммунной защиты организма в факторы агрессии. Кроме «цитокинового шквала», проходящего непрерывно и бесконтрольно, в фор-
мировании системного воспалительного ответа принимают также активное участие другие медиаторы воспаления.
Кним относятся медиаторы как про-, так и противовоспалительного характера: эйкозаноиды и кислородные метаболиты.
Кэйкозаноидам (продуктам метаболизма арахидоновой кислоты, вырабатываемых макрофагами и нейтрофилами) относятся простагландины
(PG); лейкотриены (LT) - В4; С4; D4; Е4, а также тромбоксан А2 и 5-НЕТЕ
(5- гидроксиэйкозатетраеноат).
v Простагландин Е2 в нормальных условиях подавляет иммунный ответ и аллергические реакции; снижает активность макрофагов, лимфоцитов
инейтрофилов; уменьшает продукцию цитокинов; расслабляет мускулатуру бронхов;
v Тромбоксан А2 является нестойкой субстанцией, превращаю- щейся в тромбоксан В2; вызывает сужение сосудов и бронхов, агрегацию тромбоцитов; стимулирует выброс ферментов и других активных факторов;
v Простагландин I2 (простациклин) расширяет сосуды, повышает их проницаемость, ингибирует агрегацию тромбоцитов, обуславливает ощу- щение боли при воспалении;
v Лейкотриены (D4, С4, Е4) расширяют сосуды и повышают их проницаемость, вызывают сильный бронхоспазм, активируют гемотаксис;
v 5-НЕТЕ служит хемоаттрактантом и активатором нейтрофилов и тучных клеток.
Кислородные метаболиты являются продуцентами активированных полиморфноядерных лейкоцитов. Среди набольшее значение имеют О2-, ОН-, ОСl-, NO, ONOO, H2O2 и др. Существенная роль в патогенезе сепсиса при- надлежит оксиду азота (NO). Последний синтезируется как лейкоцитами, так и эндотелием сосудов. За счет отсутствия электрического заряда, мини- мальных размеров и липофифильности NO легко диффундирует через кле- точные мембраны и активно участвует во многих клеточных реакциях, при-
24

&  Хирургический сепсис. Учебное пособие
Хирургический сепсис. Учебное пособие
ваодя к серьёзным изменениям (вплоть до трансформации белковых моле- кул). При отсутствии микробной агрессии оксид азота принимает участие в поддержании нормального тонуса венозной стенки и сосудистой проницае- мости, способствует адекватной перфузии тканей и защите клеток от повре- ждения. NO защищает эндотелий сосудов от агрессивного действия эндоток- синов и ФНО, сдерживает повышенную активацию макрофагов, расслабляет мышечные клетки в стенках сосудов, участвует в регуляции сосудистого то- нуса и проницаемости сосудистой стенки, релаксации сфинктеров и уничто- жении бактерий.
Под влиянием цитокинов и эндотоксинов при сепсисе происходит ги- перпродукция NO, что оказывает повреждающее действие на ткани: снижает периферическое сопротивление и венозный тонус; депонирует кровь и вызы- вает развитие отеков; способствует развитию септического шока и полиор- ганной недостаточности. И наоборот, угнетение активности NO-синтетазы снижает продукцию и концентрацию NO в крови, уменьшает её повреждаю- щее действие, увеличивает артериальное давление, периферическое сопро- тивление, повышает венозный тонус.
Кроме оксида азота, клетки эндотелия продуцируют эндотелин и и фактор активации тромбоцитов (ФАТ). Эти вещества являются связую-
щим звеном между клетками паренхиматозных органов и циркулирующими в кровеносном русле тромбоцитами, нейтрофилами, макрофагами, цитоки- нами, NO и другими воспалительными медиатерами – белками «каскада» комплемента, биогенными кининами (гистамином, серотонином, брадикини- ном), прекалликреином (взаимодействует с фактором Хагемана [XII] с обра- зованной калликреина), стрессорными гормонами и эндорфинами.
Эндотелиальные клетки находятся в центре всех реакций, равиваю- щихся при воспалении и являются центральным звеном в развитии, прогрес- сировании и исходе воспаления, а также определячют тип ответной реакции на него. В условиях массивной бактериемии циркулирующие в крови цито- кины непрерывно активируют макрофаги, лейкоциты и другие цитокинопро- дуцирующие клетки, что способствует их неконтролируемой активации. За
счёт этого поверхность эндотелия приобретает повышенную тромбогенность и адгезивность. Следствием этого становятся микротромбозы, нарушение микроциркуляции, выраженная вазодилятация, повышение проницаемости сосудистой стенки и гипоксия тканей. В результате развиваются отеки и ги- поволемия, нарушается кровоснабжение жизненноважных органов с возник- новением их дисфункции («шоковый орган») и образованием в последующем необратимой полиорганной недостаточности (рис. 5).
25
