
- •Оглавление
- •СПИСОК СОКРАЩЕНИЙ
- •ПОДРОБНОЕ СОДЕРЖАНИЕ
- •ГЛАВА 02. ДЕМОГРАФИЧЕСКАЯ СИТУАЦИЯ В РОССИЙСКОЙ ФЕДЕРАЦИИ. ОБЩИЕ И ЧАСТНЫЕ АСПЕКТЫ
- •ГЛАВА 03.МАТЕРИНСКАЯ И ПЕРИНАТАЛЬНАЯ ЗАБОЛЕВАЕМОСТЬ И СМЕРТНОСТЬ. СТРАТЕГИЯ РИСКА В АКУШЕРСТВЕ И ПЕРИНАТОЛОГИИ
- •ГЛАВА 04.ПОСЛЕДИПЛОМНАЯ ПОДГОТОВКА ВРАЧЕЙ АКУШЕРОВГИНЕКОЛОГОВ В КОНТЕКСТЕ БОЛОНСКОЙ ДЕКЛАРАЦИИ
- •ГЛАВА 05.ДЕОНТОЛОГИЯ В АКУШЕРСТВЕ
- •ГЛАВА 07. ИЗМЕНЕНИЯ В ОРГАНИЗМЕ ЖЕНЩИНЫ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ГЛАВА 08. РАЦИОНАЛЬНОЕ ПОВЕДЕНИЕ ЗДОРОВОЙ ЖЕНЩИНЫ В ПЕРИОД БЕРЕМЕННОСТИ
- •ГЛАВА 09. КЛИНИЧЕСКИЕ МЕТОДЫ ОБСЛЕДОВАНИЯ БЕРЕМЕННЫХ
- •ГЛАВА 10. ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ.
- •ГЛАВА 11. ИНСТРУМЕНТАЛЬНЫЕ НЕИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ.
- •ГЛАВА 12.ИНСТРУМЕНТАЛЬНЫЕ ИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ
- •ГЛАВА 13. ПРИНЦИПЫ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ В АКУШЕРСТВЕ
- •ГЛАВА 14. ХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
- •ГЛАВА 15. ФАРМАКОТЕРАПИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
- •ГЛАВА 16.ВЕДЕНИЕ ФИЗИОЛОГИЧЕСКОЙ БЕРЕМЕННОСТИ
- •ГЛАВА 17. ФИЗИОЛОГИЧЕСКИЕ РОДЫ
- •ГЛАВА 18.ФИЗИОЛОГИЧЕСКОЕ ТЕЧЕНИЕ ПОСЛЕРОДОВОГО ПЕРИОДА И ПЕРИОДА НОВОРОЖДЁННОСТИ
- •ГЛАВА 19.БЕРЕМЕННОСТЬ У НЕСОВЕРШЕННОЛЕТНИХ
- •ГЛАВА 20.ТАКТИКА ВЕДЕНИЯ БЕРЕМЕННОСТИ ПОСЛЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ
- •ГЛАВА 21. МНОГОПЛОДНАЯ БЕРЕМЕННОСТЬ
- •ГЛАВА 22. САМОПРОИЗВОЛЬНЫЙ АБОРТ (ВЫКИДЫШ)
- •ГЛАВА 23. ПРИВЫЧНОЕ НЕВЫНАШИВАНИЕ БЕРЕМЕННОСТИ
- •ГЛАВА 24. НЕРАЗВИВАЮЩАЯСЯ БЕРЕМЕННОСТЬ
- •ГЛАВА 25. ПРЕЖДЕВРЕМЕННЫЕ РОДЫ
- •ГЛАВА 26. ПЕРЕНАШИВАНИЕ БЕРЕМЕННОСТИ
- •ГЛАВА 27. ПЛАЦЕНТАРНАЯ НЕДОСТАТОЧНОСТЬ
- •ГЛАВА 28. ЗАДЕРЖКА РОСТА ПЛОДА
- •ГЛАВА 29. ПАТОЛОГИЯ ОКОЛОПЛОДНЫХ ВОД
- •ГЛАВА 30. АНОМАЛИИ ПУПОВИНЫ, ОСЛОЖНЯЮЩИЕ ТЕЧЕНИЕ РОДОВ И УХУДШАЮЩИЕ ПЕРИНАТАЛЬНЫЙ ИСХОД
- •ГЛАВА 31. ТОКСИКОЗЫ БЕРЕМЕННЫХ И ГЕСТОЗ
- •ГЛАВА 32. НАСЛЕДСТВЕННЫЕ ДЕФЕКТЫ СИСТЕМЫ ГЕМОСТАЗА
- •ГЛАВА 33. АНТИФОСФОЛИПИДНЫЙ СИНДРОМ
- •ГЛАВА 34. HELLP-СИНДРОМ
- •ГЛАВА 35. СИНДРОМ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЁРТЫВАНИЯ КРОВИ
- •ГЛАВА 36. ЭМБОЛИЯ ОКОЛОПЛОДНЫМИ ВОДАМИ
- •ГЛАВА 37. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ВЕН
- •ГЛАВА 38. ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЁННОГО
- •ГЛАВА 40. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ КРОВИ
- •ГЛАВА 41. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ОРГАНОВ ДЫХАНИЯ
- •ГЛАВА 42. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ОРГАНОВ ПИЩЕВАРЕНИЯ
- •ГЛАВА 43. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ПОЧЕК И МОЧЕВЫВОДЯЩИХ ПУТЕЙ
- •ГЛАВА 44. БЕРЕМЕННОСТЬ И ОФТАЛЬМОЛОГИЧЕСКИЕ ОСЛОЖНЕНИЯ
- •ГЛАВА 45. БЕРЕМЕННОСТЬ И ЭНДОКРИННАЯ ПАТОЛОГИЯ. БЕРЕМЕННОСТЬ И БОЛЕЗНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- •ГЛАВА 46. БЕРЕМЕННОСТЬ И ДЕПРЕССИВНЫЕ СОСТОЯНИЯ
- •ГЛАВА 47. БЕРЕМЕННОСТЬ И ПСИХОАКТИВНЫЕ ВЕЩЕСТВА
- •ГЛАВА 48. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ГЛАВА 49 БЕРЕМЕННОСТЬ И ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ МАЛОГО ТАЗА
- •ГЛАВА 50. БЕРЕМЕННОСТЬ И ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
- •ГЛАВА 51. БЕРЕМЕННОСТЬ И ХИРУРГИЧЕСКАЯ ПАТОЛОГИЯ
- •ГЛАВА 52. ПАТОЛОГИЧЕСКИЕ РОДЫ
- •ГЛАВА 53. КРОВОТЕЧЕНИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
- •ГЛАВА 54 .ПАТОЛОГИЯ ПОСЛЕРОДОВОГО ПЕРИОДА
- •ГЛАВА 55. РОДОВОЙ ТРАВМАТИЗМ
- •ГЛАВА 56. ВНУТРИУТРОБНАЯ ИНФЕКЦИЯ
- •ГЛАВА 57. ВРОЖДЁННЫЕ ПОРОКИ РАЗВИТИЯ
- •ГЛАВА 58 .АСФИКСИЯ НОВОРОЖДЁННОГО
- •ГЛАВА 59. РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ НОВОРОЖДЁННЫХ
- •ГЛАВА 60. ИНФЕКЦИИ НОВОРОЖДЁННЫХ
- •ГЛАВА 61. РОДОВЫЕ ТРАВМЫ ПЛОДА И НОВОРОЖДЁННОГО
- •ПРИЛОЖЕНИЕ. БЕЗОПАСНОСТЬ ИСПОЛЬЗОВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ПРАВА БЕРЕМЕННЫХ ЖЕНЩИН И КОРМЯЩИХ МАТЕРЕЙ
ГЛАВА 50. БЕРЕМЕННОСТЬ И ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
50.1. БЕРЕМЕННОСТЬ И РАК ШЕЙКИ МАТКИ
Рак шейки матки (РШМ) — заболевание, очень опасное для здоровья и жизни женщин. Характеризуется атипией клеток эндоцервикса или экзоцервикса (нарушением дифференцировки, наличием полиморфизма, метастатическим ростом). Опухоль встречается во многих странах мира с различной частотой.
КОД ПО МКБ10
·M80.5-M80.8 Плоскоклеточные новообразования.
·N86 Эрозия и эктропион шейки матки.
·N87 Дисплазия шейки матки.
·N88 Другие невоспалительные болезни шейки матки.
ЭПИДЕМИОЛОГИЯ
В последние годы заболеваемость РШМ (10,8 на 100 000 женщин) и летальность больных РШМ (5 на 100 000 женщин) сохраняются в РФ на постоянном уровне.
· Частота РШМ в разных странах варьирует, составляя в среднем 10–12 новых случаев на 100 000 женского населения в год. Благодаря организованной сети смотровых кабинетов, женских консультаций и цитологических лабораторий стало возможным выявлять рак на 0–Iа стадиях, при которых излечение составляет 100%. Тем не менее из-за несвоевременной диагностики ежегодно умирает от 4 до 5 на 100 000 женщин.
У беременных среди злокачественных опухолей на первом месте стоит РШМ, составляя от 0,17 до 4,1%. Сочетание беременности и РШМ встречается редко: беременность отмечается только у 1,3–4,2% больных РШМ.
КЛАССИФИКАЦИЯ
Существует две классификации РШМ: TNM и FIGO (табл. 50-1). |
|
|
Таблица 50-1. Сравнительная характеристика классификаций TNM и FIGO |
|
|
TNM |
Шейка матки |
FIGO |
|
|
|
Tis |
In situ |
0 |
T1 |
Ограничена маткой |
I |
T1a |
Диагностируется только микроскопически |
IA |
T1a1 |
Глубина <3 мм, ширина <7 мм |
IAI |
T1a2 |
Глубина >3–5 мм, ширина <7 мм |
IAII |
T1b |
Клиническая и гистологическая картина в большей степени выражена, чем при T1a2 |
IB |
T1b1 |
<4 см |
IBI |
T1b2 |
>4 см |
IBII |
T2 |
Ограничена маткой без перехода на стенки таза или нижнюю треть влагалища |
II |
T2a |
Нет параметриев |
IIA |
T2b |
Параметрии |
IIB |
T3 |
Переход на нижнюю треть влагалища/стенки таза/гидронефроз |
III |
T3a |
Нижняя треть влагалища |
IIIA |
T3b |
Стенки таза/гидронефроз |
IIIB |
T4 |
Переход на слизистую мочевого пузыря/слизистую прямой кишки/за пределы таза |
IVA |
M1 |
Отдалённые метастазы |
IVB |
ЭТИОЛОГИЯ
Риск заболеваемости РШМ имеет непосредственную связь с сексуальной и генеративной функциями женщины: ·данное заболевание очень редко встречается у девственниц; ·частота РШМ выше у замужних женщин, чем у одиноких;
·заболеваемость выше у женщин, которые рано вышли замуж или рано начали половую жизнь; ·риск заболеваемости возрастает у женщин, имеющих много половых партнеров или повторно выходящих замуж за мужчин, имевших много сексуальных партнеров;
·заболеваемость связана с социальноэкономическими условиями (заболеваемость высока в группах женщин с низким социальным статусом); ·риск развития заболевания повышается при курении и длительном приеме оральных контрацептивов;
·на частоту заболевания также может влиять число беременностей, циркумцизия, а также наличие ВПГ-2 или ВПЧ (все эти данные требуют дополнительной проверки). Ассоциация ВПЧ с развитием данного рака в последнее время находит всё большее подтверждение, так как ВПЧ 16 и 18 типов обнаруживается в опухолевом компоненте при инвазивных формах РШМ.
ПАТОГЕНЕЗ
Основным проявлением прогрессии опухоли является снижение степени дифференцировки.
·Низкодифференцированный рак выявляется в 2 раза чаще у беременных, чем у небеременных. Этот факт свидетельствует о высокой злокачественности РШМ у беременных.
Неблагоприятным фактором является также глубокая инвазия опухоли.
·В 73% случаев у больных РШМ I стадии, оперированных во время или непосредственно после беременности, глубина прорастания опухоли в строму превышала 1 см. У небеременных этот показатель не превышал 30%. Снижение дифференцировки и склонность к метастазированию способствуют быстрому распространению рака за пределы шейки матки, при этом метастазы в регионарных лимфатических узлах обнаруживаются в 2 раза чаще у
беременных, чем у небеременных пациенток.
· Способность опухоли к метастазированию реализуется уже в первом триместре беременности, тогда как на более поздних сроках нарастает степень поражения регионарного лимфатического аппарата. Однако в I триместре беременности симптом маточного кровотечения нередко расценивается как начинающийся выкидыш, а во II и III триместрах — как акушерская патология: предлежание или ПОНРП.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина обусловлена:
·формой роста опухоли (эндофитная, экзофитная, смешанная или язвенно-инфильтративная); ·стадией заболевания;
·вариантом распространения заболевания (влагалищный, маточный, параметральный или метастатический).
ДИАГНОСТИКА
АНАМНЕЗ
Выявляются следующие патологические признаки:
·бели (водянистые или сукровичные цвета «мясных помоев» с гнилостным запахом); ·кровотечения (контактные, при физическом напряжении или ациклические); ·боли; ·нарушение функций соседних органов;
·ухудшение общего состояния больной.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Необходимо проводить осмотр шейки матки в зеркалах (ректовагинальную и бимануальную пальпации) с одновременным взятием мазков с поверхности влагалищной части шейки матки и из цервикального канала, так как цитологическое исследование мазков играет ведущую роль в распознавании РШМ.
·Применение данных методов диагностики показано на любом сроке беременности.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При подозрении на РШМ необходимы следующие лабораторные исследования:
·взятие мазков на онкоцитологию, что позволяет обнаружить преклинические формы рака на 0–Iа стадии, когда шейка не имеет видимых изменений; ·проведение пробы Шиллера, что позволяет разграничить нормальную (гликогенсодержащую) слизистую от
патологически измененной (не содержащих гликоген) тканей с целью последующего проведения биопсии йоднегативных пятен;
·проведение молекулярногенетической диагностики ВПЧ с использованием Digene–теста, благодаря которому возможно определить количество единиц вируса; такие данные терапевтически более значимы: если мы знаем концентрацию вируса в организме, то можем прогнозировать развитие болезни и принимать необходимые терапевтические меры.
Применение данных методов диагностики показано на любом сроке беременности.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
При необходимости следует провести специальное обследование беременной:
·инцизионную биопсию очага поражения шейки матки (инфильтрации, изъязвления или опухоли с явными клиническими проявлениями) на границе измененной и нормальной ткани, при этом необходимо избегать получения некротических и воспалительных изменений, которые обычно сопровождают рост опухоли и протекают под этой маской; биопсию следует проводить в стационарных условиях из-за опасности возникновения кровотечения;
·полное обследование эндоцервикального канала (при отсутствии явного роста) путем выскабливания или аспирации в зависимости от патанатомического состояния шейки матки; ·кольпоскопическое обследование с применением операционного микроскопа для точного установления границ патологического процесса, прицельной биопсии и удаления;
·цистоскопию, проведение которой позволяет определить вовлечение в процесс мочевого пузыря; ·конусовидную биопсию у пациенток с позитивной цитологией, но без явных проявлений (эта диагностическая
процедура является терапевтической, и одновременно позволяет выявлять очаги возможного развития рака на месте).
Применение данных методов диагностики показано на любом сроке беременности.
СКРИНИНГ
Проведение цитологического скрининга, а именно взятие мазков на онкоцитологию с эктоцервикса и эндоцервикса, позволило получить сведения о частоте выявления РШМ у беременных (диагностируется у 0,34%), при этом частота преинвазивного рака составила 0,31%, инвазивного — 0,04%.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
РШМ следует дифференцировать с доброкакчественными заболеваниями шейки матки (эктопия, эктропион, цервицит) на основании данных цитологического исследования мазка и кольпоскопии.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Во всех случаях показана консультация онколога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 5–6 недель. Cancer coli uteri in situ.
ЛЕЧЕНИЕ
При РШМ in situ в I триместре беременности лечение заключается в прерывании беременности и конусовидной эксцизии шейки матки. Во II и III триместрах осуществляется диагностическое кольпоскопическое и цитологическое наблюдение. Через 2–3 месяца после родоразрешения проводится конусовидная эксцизия шейки матки.
У женщин, страдающих преинвазивным и микроинвазивным РШМ, но желающих иметь детей, возможно осуществление функциональнощадящих методов лечения:
·электроконизации; ·криодеструкции;
·ножевой и лазерной ампутации шейки матки.
Также сегодня получила широкое распространение радиоволновая хирургия (аппараты «Сургитрон», «Визалиус»).
· Радиоволновая хирургия — нетравматический метод разреза и коагуляции мягких тканей без их разрушения. Эффект разреза при радиоволновой хирургии достигается за счёт тепла, которое образуется при контакте электрода, передающего высокочастотные радиоволны, с мягкими тканями. Точечное нагревание фактически испаряет клетку. Для обезболивания применяют внутривенный наркоз кетамином.
GПослеоперационные осложнения немногочисленны и возникают редко. Косметические результаты намного превышают результаты после применения других хирургических методов:
–традиционной хирургии;
–электрохирургии (электрокоагуляции и диатермокоагуляции);
–лазерной деструкции и криодеструкции (воздействия низкими температурами).
GВ этом случае беременность и роды не оказывают неблагоприятного влияния на течение основного заболевания. GДиспансерное наблюдение после функциональнощадящего лечения начальных форм РШМ в 1-й год включает в себя обследование пациентки не менее 6 раз, во 2-й год — 4 раза, и в последующем — 2 раза в год.
Лечение зависит от стадии заболевания и срока беременности:
·в случае Ia стадии заболевания в I или II триместре беременности или после родов проводится экстирпация матки с верхней третью влагалища;
·в случае Ib стадии в I или II триместре беременности или после родов осуществляется расширенная экстирпация матки; в послеоперационном периоде при глубокой инвазии и регионарных метастазах проводится дистанционное облучение;
Gесли Ib стадия заболевания диагностирована в III триместре беременности, проводится КС с последующей расширенной экстирпацией матки, при этом в послеоперационном периоде проводится дистанционная лучевая терапия;
·в случае IIа стадии в I, II или III триместре беременности проводится расширенная экстирпация матки с последующим дистанционным облучением;
Gесли IIа стадия заболевания диагностирована в послеродовом периоде, лечение заключается в предоперационном облучении, выполнении расширенной экстирпации матки и проведении дистанционного облучения в послеоперационном периоде при глубокой инвазии и регионарных метастазах;
·в случае IIв стадии заболевания в I триместре беременности или после родов проводится сочетанное лучевое лечение (внутриполостное и дистанционное), при этом лечение в I триместре начинают с искусственного прерывания беременности в I триместре при II и III стадиях заболевания;
Gесли IIв стадия заболевания диагностирована во II или III триместре беременности, проводится КС и сочетанное лучевое лечение в послеоперационном периоде по вышеизложенной схеме;
·в случае III стадии заболевания в I триместре беременности и после родов лечение начинают с сочетаннолучевой терапии;
Gесли III стадия заболевания диагностирована во II или III триместре беременности, лечение начинают с операции КС с последующей сочетанной лучевой терапией.
· При проведении лапаротомий для обезболивания используют эндотрахеальный наркоз.
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
Планировать наступление беременности целесообразно не ранее чем через 2 года после функциональнощадящего лечения патологии шейки матки. Ведение родов через естественные родовые пути не противопоказано (родоразрешение путем КС осуществляется только по акушерским показаниям).
·Отмечается повышение частоты невынашивания беременности и преждевременных родов по сравнению со здоровыми женщинами.
·Наблюдается более высокий уровень ПС (11%).
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Частота рецидивов после органосохраняющего лечения начальных форм РШМ составила 3,9%, при этом частота рецидивов в популяции — 1,6–5,0%. Частота наступления беременности после органосохраняющего лечения начальных форм РШМ составляет от 20,0 до 48,4%.
·После органосохраняющего лечения возможно развитие следующих осложнений: Gбесплодия;
Gневынашивания беременности (ИЦН); Gранений мочевого пузыря, мочеточника и кишки.
ПРОФИЛАКТИКА
Первичная профилактика РШМ заключается в предупреждении половой передачи причинно-значимых вирусов. Перспективна вакцинация. Кроме того, отказ от курения тоже позволит снизить частоту заболевания РШМ.
Вторичная профилактика РШМ достигается посредством цитологического скрининга и лечения предраковых заболеваний.
·Благодаря эффективности метода, который является неотъемлемой частью государственных программ во многих развитых странах, наметилась чёткая тенденция к снижению инвазивных форм РШМ и заболеваемости в целом.
·Для эффективной вторичной профилактики необходимо следующее:
Gперсонал должен быть достаточно подготовлен, чтобы правильно провести забор мазков на цитологическое исследование и интерпретировать результаты;
Gсистема здравоохранения должна координировать чёткое выполнение разработанных методов и следить за этапностью лечебнодиагностических мероприятий.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Поскольку вовремя выполненные диагностические мероприятия позволяют провести пациентке органосохраняющее лечение, наибольшее значение приобретает оценка факторов риска, а также ранняя диагностика предраковых процессов, внутриэпителиального и микроинвазивного РШМ в I триместре беременности и особенно до беременности. Несмотря на снижение заболеваемости и смертности от РШМ, в последние годы отмечается тенденция к увеличению числа случаев РШМ среди молодых, что может усугубляться сочетанием с беременностью.
·Частота данного заболевания в сочетании с беременностью в популяции остается невысокой. Тем не менее полностью исключить такого рода ситуации в практической медицине нельзя, особенно если учесть, что современные женщины нередко откладывают рождение детей на более поздний возраст, когда вероятность возникновения онкологического заболевания выше.
Прогноз заболевания при ранних формах РШМ (CIN3, IA, mi) во время беременности не отличается от такового у небеременных, однако предсказать биологическое поведение опухоли шейки матки при большом распространении процесса во время беременности крайне затруднительно.
·Выбор лечебной тактики зависит не только от стадии заболевания и срока беременности, но и от решения самой больной в отношении беременности и метода лечения. Клиницист, в свою очередь, стоит перед двумя трудными задачами: информировать пациентку о прогнозе заболевания и о сопутствующих осложнениях при беременности, и провести лечение, беря на себя ответственность нередко за две жизни.
Все женщины должны быть просвещены и заинтересованы следить за состоянием своего здоровья, а именно проходить регулярное обследование: после двух нормальных цитологических результатов их необходимо подтверждать обследованиями через каждые три года.
ПРОГНОЗ
При выполнении полного комплекса диагностических мероприятий возможно поставить диагноз предракового состояния и начальных форм РШМ на 0–Iа стадиях в 90–95% случаев. Прогноз в этом случае благоприятный. ·Беременность является неблагоприятным фактором прогноза РШМ. Начиная со II триместра беременности промедление с лечением ухудшает прогноз заболевания на 5% каждый месяц.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Урманчеева А.Ф., Берштейн Л.М., Бурмина М.М. и др. Гормональная реабилитация больных раком шейки матки после радикального хирургического лечения // Акуш. и гин. — 2001. — №1. — С. 18–22.
Bristow R.E., Montz E.J. Cervical cancer and pregnancy // Cancer obstetrics and gynecology / Ed. by E.L. Trimble, C.L. Trimble. — 1998. — C. 157–175.
Cliby W.A., Dodson M.J.С, Podratz К.С. Cervical cancer complicated by pregnancy: episiotomy site recurrences following vaginal delivery // Obstet. Gynecol. — 1994. — Vol. 84. — P. 179–182.
Creasman W.T. Cancer and Pregnancy // Ann. New York Acad. Sciences. — 2001. — Vol. 943. — P. 281–286.
Cronje H.S., Van Rensburg E., Niemand I. et al. Screening for cervical neoplasia during pregnancy // Int. J. Gynecol. Obstet. —2000. — Vol. 68. — P. 19–23.
50.2. БЕРЕМЕННОСТЬ И РАК ТЕЛА МАТКИ
Рак тела матки (РТМ) — злокачественная опухоль слизистой оболочки тела матки.
СИНОНИМЫ Рак эндометрия, аденокарцинома эндометрия. КОД МКБ-10
D07.0 Злокачественные новообразования эндометрия.
ЭПИДЕМИОЛОГИЯ
В последние десятилетия заболеваемость раком тела матки увеличилась на 55%, и эта опухоль в настоящее время занимает первое место среди злокачественных новообразований женской половой сферы.
Сочетание рака тела матки и беременности встречается редко по двум основным причинам: из-за значительного снижения генеративной функции у этих больных, а также из-за сильного влияния прогестерона, препятствующего развитию атипической гиперплазии и рака эндометрия, при беременности.
Основные причины, влияющие на увеличение заболеваемости РТМ:
●возрастание продолжительности жизни женщин;
●увеличение количества женщин с нейрообменно-эндокринными нарушениями (при ожирении до 15 кг риск возникновения рака эндометрия увеличивается в 3 раза, до 25 кг — в 10 раз; при СД — в 3 раза);
●неадекватное использование гормональных препаратов с высоким содержанием эстрогенов (при длительном приёме эстрогенов риск возникновения РТМ увеличивается в 10–15 раз, при приёме тамоксифена — в 8 раз).
КЛАССИФИКАЦИЯ
Морфологическая классификация стадий рака тела матки (FIGO, 1988).
Стадия IA — опухоль в пределах эндометрия.
Стадия IB — инвазия миометрия менее чем на половину его толщины.
Стадия IC — инвазия миометрия более чем на половину его толщины. Стадия IIA — распространение на железы шейки матки.
Стадия IIB — распространение на строму шейки матки.
Стадия IIIA — прорастание серозной оболочки матки, метастазы в маточные трубы или яичники или наличие опухолевых клеток в смывах из брюшной полости.
Стадия IIIB — распространение на влагалище.
Стадия IIIC — метастазы в тазовые или поясничные лимфатические узлы.
Стадия IVА — прорастание слизистой мочевого пузыря или прямой кишки.
Стадия IVB — отдалённые метастазы, в том числе метастазы в пределах брюшной полости, а также метастазы в паховые лимфатические узлы.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
РТМ относят к гормонально-зависимым опухолям.
Выделяют два патогенетических варианта возникновения РТМ.
Первый патогенетический вариант диагностируют у 60–70% больных. При нём чётко выражены нарушения овуляции (ановуляторные маточные кровотечения, бесплодие, позднее наступление менопаузы), сочетающиеся с нарушением метаболизма жиров и углеводов (ожирение различной степени, сахарный диабет, гипертоническая болезнь). Опухоль возникает на фоне гиперпластического процесса эндометрия и стромы яичников, часто сочетается с другими гормонально-зависимыми опухолями (раком молочной железы, феминизирующими опухолями яичников), синдромом Штейна–Левенталя (у 62% больных РЭ — склерокистозные яичники). У таких больных опухоль матки характеризуется
медленным ростом, высокой степенью дифференцировки, чувствительностью к прогестагенам. Заболевание протекает менее злокачественно и сравнительно редко сопровождается лимфогенным метастазированием. Следует отметить, что если на первом этапе канцерогенеза при данном патогенетическом варианте обменно-эндокринные нарушения приводят к возникновению РЭ, то на втором этапе они играют противоположную роль — обуславливают низкую потенцию к метастазированию и благоприятный прогноз.
При втором патогенетическом варианте нарушение овуляции и стероидного гомеостаза выражены нечётко или совсем отсутствуют. Опухоль возникает чаще в постменопаузе на фоне атрофии эндометрия, фиброза стромы яичников. Отсутствие гормональной зависимости ведёт к прогрессии опухоли, нарастанию её автономности. В этих случаях опухоль низкодифференцированная, склонна к инвазивному росту и лимфогенному метастазированию, мало чувствительна к прогестагенам. Течение заболевания менее благоприятно.
Факторы риска возникновения РЭ:
●ановуляция и ановуляторные маточные кровотечения;
●миома матки и генитальный эндометриоз;
●синдром Штейна–Левенталя;
●гиперпластический процесс в эндометрии;
●гормонально-зависимые опухоли в анамнезе;
●отягощённая наследственность (рак органов репродуктивной системы);
●ожирение, гиперлипидемия, сахарный диабет, гипертоническая болезнь;
●бесплодие, отсутствие родов, поздние роды и роды крупным плодом (более 4 кг).
Значение имеет не столько число факторов риска, сколько сочетание нарушений в двух системах: репродуктивной и эндокринной. При сочетании трёх и более факторов в различных системах гомеостаза риск развития РЭ увеличивается в 9 раз.
КЛИНИЧЕСКАЯ КАРТИНА
Наиболее частый симптом РТМ — маточное кровотечение (у 70–90% больных). В репродуктивном возрасте кровотечение происходит по типу менометроррагии.
При РТМ боли появляются раньше, чем при РШМ, имеют схваткообразный характер и сопровождаются усилением выделений. Боли тупого характера указывают на распространение опухоли за пределы матки и обусловлены сдавлением опухолевыми инфильтратами нервных стволов малого таза или симпатического ствола метастатически поражёнными парааортальными лимфатическими узлами.
Общее состояние больной обычно ухудшается только в запущенных случаях. Факторы прогноза при РТМ:
●гистологическая структура и степень дифференцировки опухоли;
●глубина инвазии в миометрий;
●распространение опухоли на цервикальный канал;
●наличие опухолевых клеток в сосудах;
●метастазы в яичниках;
●метастазы в лимфатических узлах;
●содержание рецепторов прогестерона и эстрадиола в ткани опухоли;
●наличие опухолевых клеток в перитонеальной жидкости (цитологическое исследование).
Метастазирование
Для РЭ характерна ортодоксальность метастазирования: последовательность и этапность поражения регионарных и отдалённых лимфатических коллекторов и затем присоединение гематогенного распространения.
Лимфогенное метастазирование тесно связано не только с биологическими свойствами опухоли, но и с некоторыми особенностями организма. Лимфогенные метастазы чаще определяют у больных пожилого возраста при втором патогенетическом варианте РТМ. У больных до 30 лет лимфогенные метастазы отсутствуют, их частота в возрасте 40–49 лет составляет 5,7%, старше 70 лет — 15,4%; при первом патогенетическом варианте — 8,9%, при втором —
13,6%.
Большое значение имеет степень дифференцировки опухоли. Для высокодифференцированной аденокарциномы характерно поверхностное прорастание в миометрий, тогда как низкодифференцированные опухоли отличаются глубокой инвазией и высокой потенцией к лимфогенному метастазированию. Частота метастазирования в лимфатические узлы при высокодифференцированной аденокарциноме — 4,2%, при умеренно дифференцированной — 10–12%, при низкодифференцированной — 18–26%.
При локализации опухоли в пределах слизистой оболочки метастазы в лимфатические узлы практически не выявляют, при поверхностной инвазии определяют в 5% случаев, а при глубокой — в 35–40%.
ДИАГНОСТИКА ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При обследовании больных РЭ следует уточнить состояние менструальной функции (длительность репродуктивного периода, наличие ациклических маточных кровотечений, особенности генеративной функции и течения пременопаузального периода, время наступления менопаузы) и обратить внимание на наличие в анамнезе гиперпластического процесса в эндометрии. Большое значение имеют обменные нарушения (ожирение, сахарный диабет).
При двуручном гинекологическом исследовании можно обнаружить увеличение размеров матки и яичников. Увеличение яичников может быть обусловлено наличием первично-множественной опухоли или их метастатическим поражением.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Клинический анализ крови: лейкоцитоз (до 10x109/л), увеличение СОЭ до 20 мм/час; анемия лёгкой степени. Коагулограмма: признаки гиперкоагуляции.
Биохимический анализ крови: гипопротеинемия.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ

Ультразвуковое исследование органов малого таза. Расширение срединной маточной структуры до 20 мм, с неоднородным, гиперэхогеннным внутренним содержимым, нечёткими, неровными контурами, местами «изъеденными».
ЦДК. Признаки неоваскуляризации, множество сосудов с низким индексом резистентности (ИР <0,3).
Ультразвуковое исследование органов брюшной полости и забрюшинного пространства. Метастатическое поражение (образования неправильной формы, с гипоэхогенной неоднородной структурой) печени, почек, лимфатических узлов. При ЦДК определяется васкуляризация метастатических узлов.
СКРИНИНГ
Трансвагинальное ультразвуковое исследование органов малого таза.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Гиперпластический процесс эндометрия можно отличить только при проведении ЦДК (отсутствии выраженного неоангиогенеза, нормальных показателях ИР).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Пациентка проходит лечение под наблюдением акушера и онкогинеколога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 12 нед. Состояние после гормонального лечения рака тела матки, IА стадия.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Для больных репродуктивного возраста разработана и рекомендована результативная двухэтапная схема лечения, где первый этап преследует цель достичь излечения онкологического заболевания. Под воздействием больших доз прогестинов происходит постепенное повышение степени дифференцировки опухоли, а затем активизация секреции желёз эпителия и через фазу секреторного истощения наступает атрофия желёз. Этот этап заканчивается констатацией онкологического излечения. Второй этап предусматривает коррекцию нарушенного гормонального гомеостаза для восстановления нормального овуляторного менструального цикла.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Клинически первый этап характеризуется прекращением кровотечения и довольно быстрым установлением стойкой аменореи на время всего периода лечения (при АГЭ 6 мес). Больным с АГЭ вводят 12,5% раствор 17-α-ОПК по 500 мг в/м 3 раза в неделю в течение 2 мес, суммарно 15 г препарата, до получения «дозы достижения эффекта (ДДЭ). Затем во время гистероскопии производят забор материала эндометрия для оценки чувствительности опухоли по степени выраженности гормонального патоморфоза. Если патоморфоз хорошо выражен, считают, что опухоль гормончувствительна, и лечение прогностически эффективно. Следующие 2 мес больная получает по 500 мг ОПК в/м 2 раза в неделю. Данный этап лечения завершается последующим двухмесячным введением ОПК по 500 мг в/м 1 раз в неделю. Всего на курс лечения больная получает 23–28 г ОПК. Можно использовать не только отечественный препарат 12,5% раствор 17-ОПК, но и синтетические гестагены импортного производства (провера , депопровера ) — таблетированные формы. Одна таблетка проверы содержит 500 мг медроксипрогестерон-ацетата, таким образом, дозы в схемах лечения остаются теми же.
Назначение и проведение самостоятельной гормонотерапии больным с АГЭ требует сугубо индивидуального подхода и зависит от гормональной чувствительности опухоли, исчезновения клинических проявлений, наступления атрофии эндометрия, подтверждённой как эндоскопически, так и морфологически. Последнее — окончательный критерий завершения первого онкологического этапа лечения.
Следующий, второй этап — гормональная реабилитация — направлен на восстановление монофазных менструальных циклов. Независимо от тяжести исходной патологии (атипическая гиперплазия или начальная форма рака эндометрия) в течение 6 мес искусственно создаётся менструальный цикл при помощи комбинированных эстроген-гестагенных препаратов первого и второго поколений (нон-овлон , овидон , ригевидон и т.д.). Среди них предпочтение имеют препараты второго поколения с преобладанием прогестагенной активности. Лечение проводят по контрацептивной схеме, т.е. с 1-го по 21-й день по 1 таблетке с перерывом на 7 дней. Приём этих препаратов позволяет восстановить функциональную активность эндометрия.
Учитывая гормонозависимость АГЭ и РЭ, реальная возможность профилактики рецидива болезни — восстановление овуляции и устранение хронической гиперэстрогении. Таким образом, следующая ступень гормональной реабилитации — восстановление овуляции.
Реабилитацию функции яичников осуществляют по индивидуальной программе, что позволяет добиться выздоровления больной.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Показания к операции:
●рак эндометрия;
●комплексная гиперплазия эндометрия с атипией;
●кровотечение.
Противопоказания:
●тяжёлые сопутствующие заболевания при ранних стадиях РТМ. По этой причине не подвергаются операции только 13% больных;
●запущенные стадии рака тела матки (III–IV). У небольшой части больных РТМ при обследовании выявляется
диссеминация опухоли (массивный переход опухоли на шейку матки, инфильтраты в параметрии, врастание в мочевой пузырь или прямую кишку, отдалённые метастазы), препятствующая операции.
Каждый случай отказа от операции при РТМ необходимо тщательно аргументировать. Даже в ведущих мировых клиниках частота рецидивов после лучевой терапии (как самостоятельного метода лечения РТМ) составляет 10–15%. В связи с этим отказ от операции у больной РТМ оправдан только в тех случаях, когда риск летального исхода во время и после операции превышает риск смерти от прогрессирования РТМ.
Условия для проведения операции.
Операцию проводят в онкогинекологическом стационаре, располагающем возможностью срочной гистологической диагностики.
Методы обезболивания.
Эндотрахеальный наркоз позволяет провести оперативное лечение в полном объёме.
Техника операции.
Редкость РТМ у женщин детородного возраста не позволяет дать общих рекомендаций по внедрению в клиническую практику аблации эндометрия и гормонотерапии как самостоятельных методов лечения РТМ ранних стадий. Выполняют нижнюю срединную лапаротомию с обходом пупка слева, но возможны и поперечные доступы с пересечением прямых мышц живота (доступ по Мэйлэрду) или с их отсечением от лобковых костей (доступ по Черни). После вскрытия брюшной полости выполняют смывы с брюшины поддиафрагмальной области, боковых каналов и малого таза. Для смыва с каждой области берут 50 мл изотонического раствора натрия хлорида. Затем проводят ревизию брюшной полости и малого таза, осматривают серозную оболочку матки, тщательно осматривают и пальпируют диафрагму, печень, большой сальник, тазовые и поясничные лимфатические узлы. Основной принцип ревизии органов брюшной полости — последовательность. Начинают со слепой кишки, затем по часовой стрелке исследуют правый латеральный канал и восходящую ободочную кишку, правую почку, печень, желчный пузырь, правое поддиафрагмальное пространство, малый сальник, вход в сальниковую сумку, желудок, поперечную ободочную кишку, левое поддиафрагмальное пространство, левый латеральный канал, левую почку, нисходящую ободочную, сигмовидную и прямую кишку. Проводят ревизию тонкой кишки и её брыжейки от связки Трейтца до слепой кишки. При пальпации почек определяют их положение и наличие грубых анатомических изменений.
После ревизии производят экстрафасциальную экстирпацию матки с придатками. Поскольку опухоль у многих больных ограничена телом матки, то верхнюю треть влагалища обычно не удаляют. Выполняют биопсию или удаление всех подозрительных объёмных образований. Проводят лимфаденэктомию увеличенных тазовых и поясничных лимфатических узлов.
Определять морфологическую стадию, т.е. выполнять дополнительные манипуляции во время операции по поводу РТМ ранних стадий, следует только тем больным, у которых лимфаденэктомия технически возможна, и у которых высок риск выявления микрометастазов.
Осложнения:
●бесплодие;
●прерывание беременности;
●тромбоэмболические осложнения;
●повреждение мочеточника и мочевого пузыря;
●ранение кишки.
Особенности ведения больных в послеоперационном периоде.
Положение о нежелательности беременности в ближайшие 3–5 лет после лечения злокачественной опухоли может быть изменено в отношении преинвазивного рака тела матки. Беременность характеризуется сильным прогестероновым влиянием на эндометрий, что препятствует возникновению рецидивов рака эндометрия.
Частота рецидивов после гормонального лечения РЭ IА стадии составляет 10,5%. Для сравнения частота рецидивов в популяции — 10,0–26,6%.
Частота наступления беременности после функционально-щадящего лечения РЭ IА стадии составляет 52,6%.
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
При наступлении беременности после лечения АГЭ или РЭ родоразрешение проводят в зависимости от акушерской ситуации.
ПРИМЕРНЫЕ СРОКИ НЕТРУДОСПОСОБНОСТИ
Гормональную терапию пациентка проходит амбулаторно. Госпитализация для проведения гистероскопического и морфологического контроля осуществляется по направлению МЭС (7–10 суток).
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Раздельное диагностическое выскабливание эндометрия показано после введения ДДЭ для определения степени чувствительности опухоли к гормонам и решения вопроса о продолжении их назначения, а также по завершению первого онкологического этапа лечения для оценки степени атрофии эндометрия (излеченности процесса). Гистероскопию с прицельной биопсией используют для текущей оценки эффективности лечения, её проводят при достижении половинных курсовых доз гестагенов.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
В целях профилактики РЭ необходимо учитывать факторы риска развития этого заболевания, проходить регулярные осмотры у гинеколога, включая УЗИ с ЦДК. Также необходимо нормализовать менструальный цикл.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Бениршке К. Эндометрий // Репродуктивная эндокринология. / под ред. Йене С.С. и Джаффе.Б.Б. — М.: Медицина, 1998. — С. 531–560.
Бохман Я.В. Руководство по онкогинекологии. — Л.: Медицина, 1989.
Саркисов С.Э. Хирургическая эндоскопия в гинекологии: Автореф. дис. ... д-ра мед. наук. — М., 1999. Стрижаков А.Н., Давыдов А.И. Гистерорезектоскопия. — М., 1997.
Чернуха Г.Е. Аденоматозная и железистая гиперплазия эндометрия в репродуктивном возрасте (патогенез, клиника, лечение): Автореф. дис. .. д-ра мед. наук. — М., 1999. — 42 с.
Baker T.R. Premalignant Conditions of the Endometrium (Endometrial Hyperplasia and Adenocarcinoma in situ) // Handbook of Gynecologic Oncology / еd. by Piver M.S. — 1995. — P. 133–140.
Burke T.W., Eifel P.J., Muggia F.M. Cancers of the Uterine Body // Cancer: Principles and Practice of Oncology— 6th ed. — Lippincott Williams & Wilkins, 2001.
Danton C.J., Baak J.P.A., Palazzo J.P. et al. Use of computerized morphometric analysis of endometrial hyperplasias in the prediction of coexistent cancer // Amer. J. Obst. Gynecol. — 1996. — Vol. 174, № 5. — P. 1518–1521.
Fox H., Buckley C.H. The endometrial hyperplasia and their relationship to endometrial neoplasia // Histopathology. — 1982. — Vol. 6. — P. 493–510.
Jobo T., Imai M. et al. Successful conservative treatment of endometrial carcinoma permitting subsequent pregnancy : report of tow cases // Europ J. Gynaecol. Oncol. — 2000. — Vol. 21(2). — P. 119–122.

Kaku T., Tsukamoto N. et al. Endometrial carcinoma associated with hyperplasia // Gynecol. Oncol. — 1996. — Vol. 60(1). — P. 22–25.
Kaku T., Yoshikawa H. et al. Conservative therapy for adenocarcinoma and atypical endometrial hyperplasia of the endometrium in young women: central pathologic review and treatment outcome // Cancer Letters. — 2001. — Vol. 167. — P. 39–48.
Schneider J., Centeno M.M., Ausin J. Use of the Cornier pipelle as the only means of presurgical histologic diagnosis in endometrial carcinoma: agreement between initial and final histology // Europ. J. Gynaecol. Oncol. — 2000. — Vol. 21 (1). — P. 74–75.
Silverberg S.G. Problems in the differential diagnosis of endometrial hyperplasia and carcinoma // Mod. Pathol. — 2000. — Vol. 13 (3). — P. 309–327.
50.3. БЕРЕМЕННОСТЬ И ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЯИЧНИКОВ
КОД ПО МКБ-10
M844–M849 Кистозные, муцинозные и серозные новообразования. M859–M867 Специфические новообразования половых желёз. M900–M903 Фиброэпителиальные новообразования.
M906–M909 Герминогенные [зародышевоклеточные] новообразования.
ЭПИДЕМИОЛОГИЯ
Рак яичников — вторая по частоте злокачественная опухоль гинекологической локализации, сочетающаяся с беременностью. Частота сочетания рака яичников и беременности не превышает 1:25 000, а рак этой локализации составляет 3% от всех опухолей яичников, оперированных во время беременности.
КЛАССИФИКАЦИЯ
Используют две классификации рака яичников: TNM и FIGO (табл. 50-2).
КЛИНИЧЕСКАЯ КАРТИНА
Болевой синдром отмечают 48% больных.
Перекрут ножки опухоли яичника у беременных диагностируют с частотой 29%.
Больные эстрогенпродуцирующими гранулёзотекаклеточными опухолями часто страдают бесплодием, а в случае наступления беременности у них возможны выкидыши.
Метастатические опухоли яичников (рак Крукенберга) при беременности диагностируют крайне редко. Во время беременности может произойти спонтанный разрыв капсулы метастатической опухоли яичников, развиться клиническая картина «острого живота», которая может быть принята за прервавшуюся внематочную беременность (в I триместре). Особенность этих больных — наличие гигант-ских новообразований яичников при отсутствии чётких данных о локализации первичной опухоли. Вероятно, первичные опухоли имеют малые размеры, и их быстрому метастазированию способствует беременность.
ДИАГНОСТИКА
АНАМНЕЗ
При отсутствии специфических симптомов заболевания большая часть больных опухолями яичников в сочетании с беременностью попадают в гинекологические стационары в связи с осложнениями, возникшими в связи с невынашиванием беременности или перекрутом ножки опухоли яичника.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
С одной или с двух сторон от матки определяют опухоль различного размера, плотной консистенции, неправильной формы, иногда с бугристыми контурами. Подвижность новообразования может быть ограничена.
При метастатическом поражении брюшины малого таза при ректовагинальном исследовании возможно обнаружение «шипа» позади шейки матки.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Клинический анализ крови: лейкоцитоз (до 10´109/л), при разрыве капсулы, перекруте ножки опухоли — до 15– 20´109/л; увеличение СОЭ до 27–40 мм/ч; анемия лёгкой степени.
Таблица 50-2. Классификация рака яичников
TNM, FIGO, Пояснения категории стадии
TX |
- |
|
Недостаточно данных для оценки первичной опухоли |
|
|
|
|
|
|
TO |
|
- |
|
Первичная опухоль не определяется |
|
|
|
|
|
T1 |
|
I |
|
Опухоль ограничена яичниками |
|
|
|
|
|
T1a |
|
IA |
|
Опухоль ограничена одним яичником; капсула интактна, нет опухоли на поверхности яичника; |
|
|
|
|
нет злокачественных клеток в асцитической жидкости или в смывах из брюшной полости |
|
|
|
|
|
T1b |
|
IB |
|
Опухоль ограничена двумя яичниками; капсула интактна, нет опухоли на поверхности яичника; |
|
|
|
|
нет злокачественных клеток в асцитической жидкости или в смывах из брюшной полости |
|
|
|
|
|
T1c |
|
IC |
|
Опухоль ограничена одним или обоими яичниками со следующими изменениями: капсула |
|
|
|
|
поражена, опухоль на поверхности яичника, злокачественные клетки в асцитической жидкости |
|
|
|
|
или в смывах из брюшной полости |
|
|
|
|
|
T2 |
|
II |
|
Опухоль поражает один или оба яичника, распространяется на малый таз |
T2a |
IIA |
Опухоль с переходом и/или метастазированием на матку и/или маточную(ые) трубу(ы); нет |
|
|
злокачественных клеток в асцитической жидкости или в смывах из брюшной полости |
|
|
|
T2b |
IIB |
Опухоль переходит на другие органы малого таза; нет злокачественных клеток в асцитической |
|
|
жидкости или в смывах из брюшной полости |
|
|
|
T2c |
IIC |
Опухоль переходит на органы малого таза (IIA или IIB), в асцитической жидкости или в смывах |
|
|
из брюшной полости находят злокачественные клетки |
|
|
|
T3 и/или N1 |
III |
Опухоль поражает один или оба яичника с микроскопически подтверждёнными |
|
|
внутрибрюшинными метастазами за пределами малого таза и/или в региональных |
|
|
лимфатических узлах |
|
|
|
T3a |
IIIA |
Микроскопические внутрибрюшинные метастазы за пределами малого таза |
|
|
|
T3b |
IIIB |
Макроскопические внутрибрюшинные метастазы за пределами малого таза максимальными |
|
|
размерами до 2 см |
|
|
|
T3c и/или |
IIIC |
Внутрибрюшинные метастазы за пределами малого таза больше 2 см в максимальном размере |
N1 |
|
и/или метастазы в региональные лимфатические узлы |
|
|
|
M1 |
IV |
Отдалённые метастазы (включая внутрибрюшинные метастазы) |
|
|
|
Примечание: метастазы на капсуле печени — T3/стадия III, метастазы в паренхиме печени — M1/стадия IV, цитологическое обнаружение злокачественных клеток в жидкости из плевральной полости — M1/стадия IV. Коагулограмма: гиперкоагуляция (фибриноген >4 мкмоль/л, протромбин 0,8–1,05 мкмоль/л, активированное парциальное тромбопластиновое время 24–39 с).
Биохимический анализ крови: гипопротеинемия (общий белок <60 г/л).
CA-125, CA-19-9 (£35 МЕ/мл), CA-72-4 (£18 МЕ/мл) превышает нормальные показатели в 3–10 раз.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
УЗИ органов малого таза. Одностороннее или двухстороннее объёмное образование сбоку или позади матки, неправильной формы, с бугристой поверхностью, солиднокистозной структурой, многокамерное, с разрастанием тканевого компонента по внутренней капсуле.
ЦДК. Выраженная васкуляризация наружной и внутренней капсулы опухоли яичников, а также тканевого компонента; «мозаичный» хаотичный низкорезистентный кровоток (ИР=0,2–0,4).
УЗИ органов брюшной полости и забрюшинного пространства. Метастазы в печени, почках, лимфатических узлах — образования неправильной формы, с гипоэхогенной неоднородной структурой.
ЦДК. Васкуляризация метастатических узлов.
ЭГДС, колоноскопию (ректороманоскопию), УЗИ молочных желёз, маммографию необходимо проводить для исключения метастатических поражений яичников из органов ЖКТ (метастазы Крукенберга) и молочных желёз.
СКРИНИНГ
Скрининговый метод определения злокачественных опухолей яичников — УЗИ. Ультразвуковые признаки опухоли яичника:
·увеличение яичника в размерах;
·неровные нечёткие контуры;
·утолщение перегородок на отдельных участках;
·наличие солидных включений в структуре кистозного образования;
·чем сложнее ультразвуковое строение опухоли яичника, тем больше вероятность злокачественности;
·границы между опухолью и мочевым пузырём неодинаковой ширины. При инфильтративном росте стенки опухоли определяют с трудом. Отмечают фиксированную взаимосвязь с другими органами малого таза.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Доброкачественные опухоли яичников:
·образования округлой или овальной формы, с чёткими наружными и внутренними контурами, гипоили анэхогенным содержимым;
·однокамерные образования, возможно наличие единичных перегородок;
·внутренняя капсула гладкая;
·при ЦДК: в наружной капсуле опухоли — кровоток в единичных сосудах.
Миома матки
Простая миома:
·гиперэхогенное новообразование с эффектом дистального поглощения звука, периферическое уплотнение в виде капсулы (73%);
·сниженный внутриопухолевый кровоток миоматозного узла с единичными цветовыми сигналами по периферии;
·ИР: в миометрии — 0,63+0,05; в миоматозных узлах — 0,59+0,06;
·максимальная систолическая скорость — 18,7 см/с.
Пролиферирующая миома:
·неоднородная, «пятнистая» структура миоматозных узлов;
·неоваскуляризация;
·кровоток с низким сосудистым сопротивлением, синусоидальные сосуды с высокой скоростью и разнообразным направлением кровотока;
·кровоток с выраженной яркостью цветового сигнала и «мозаичной» формой картирования, высокой плотностью цветовых сигналов;
·ИР в миометрии — 0,53+0,09, в миоматозных узлах — 0,34+0,06;
·максимальная систолическая скорость — 28,9 см/с;
·много вен в различных отделах миоматозного узла с максимальной систолической скоростью — 12,8 см/с.
Опухолевидные изменения яичников:
·округлая или овальная форма;
·тонкие стенки;
·чёткие ровные внутренние и наружные контуры;
·однокамерные образования;
·однородное гипоэхогенное или анэхогенное внутреннее содержимое;
·гладкая внутренняя капсула.
Опухоль толстой кишки:
·неправильная форма;
·солиднокистозное строение;
·при ЦДК — выраженный низкорезистентный кровоток;
·яичники не определяются.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При подозрении на злокачественную опухоль яичников во время беременности дифференциальную диагностику и лечение совместно проводят акушер-гинеколог и онколог. При распространённых злокачественных опухолях яичников показана консультация терапевта, кардиолога, химиотерапевта, радиолога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Рак яичников IА стадии. Беременность 13 нед. Угроза прерывания беременности.
ЛЕЧЕНИЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
При обнаружении злокачественной опухоли яичника на фоне беременности показана операция. Оптимальным для выполнения хирургического вмешательства принято считать срок после 12 нед беременности (14–16 нед), хотя при достоверных признаках злокачественности операцию проводят во всех триместрах беременности.
Условия для проведения операции
Оперировать больных целесообразно в онкогинекологическом стационаре, так как необходимы органосохраняющее хирургическое вмешательство и срочное гистологическое исследование удалённых тканей. После операции больную переводят в акушерский стационар для проведения терапии, направленной на пролонгирование беременности.
Методы обезболивания
Оперативное вмешательство необходимо проводить под эндотрахеальным наркозом.
Техника операции
При IА стадии рака яичников по классификации FIGO у молодых женщин с дисгерминомой или муцинозной цистаденокарциномой и при отсутствии отягощающих прогноз факторов (прорастание капсулы или её разрыв, спайки и сращения с окружающими органами) выполняют органосберегающие операции (одностороннее удаление придатков, резекция второго яичника, резекция большого сальника). При серозной цистаденокарциноме органосберегающие операции не показаны.
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
В I триметре при I стадии дисгерминомы возможно выполнение органосохраняющих операций. При остальных гистологических типах и стадиях необходимо выполнение стандартного комбинированного лечения (экстрипация или надвлагалищная ампутация матки с придатками, резекция большого сальника с последующей химиотерпией). Во II триместре необходим индивидуальный подход к объёму операции в зависимости от конкретной клинической ситуации и желания женщины. В III триместре при достижении срока жизнеспособности плода выполняют КС, а затем — операцию в стандартном для данной стадии объёме.
В случаях «чистых» дисгермином IА стадии может быть выполнена органосохраняющая операция в объёме односторонней сальпингоофорэктомии и оментэктомии. Вопрос адъювантной химиотерапии при IА стадии, по данным литературы, до конца не решён.
При наиболее частой злокачественной опухоли яичников, сочетающейся с беременностью, — дисгерминоме IА стадии, частота рецидивов после хирургического лечения не превышает 20%. В связи с этим такие больные могут быть успешно лечены только хирургическим методом. При развитии рецидива эффективна химиотерапия на базе платины в комбинации с блеомицином и этопозидом.
За исключением «чистых» дисгермином и «чистых» незрелых тератом IА стадии, все другие случаи герминогенных карцином, диагностированных в период беременности, необходимо подвергать адъювантной химиотерапии на базе препаратов платины в связи с агрессивностью этих опухолей.
Осложнения:
·прерывание беременности;
·ранение кишечника, мочевого пузыря, мочеточника;
·перекрут ножки опухоли;
·разрыв капсулы опухоли;
·тромбоэмболия.
Особенности ведения больных в послеоперационном периоде
Терапия, направленная на пролонгирование беременности:
·антиагрегантная терапия (пентоксифиллин, дипиридамол) по показаниям;
·сосудорасширяющие препараты (дротаверин, теофиллин);
·препараты для снижения гипертонуса матки, улучшения венозного оттока: токолитики (b-адреномиметики), препараты магния (магния сульфат).
·метаболическая терапия (актовегин©);
·антиоксиданты по показаниям;
·антибактериальная терапия препаратами широкого спектра действия (цефалоспорины II поколения).
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
При планировании беременности необходимо проведение полного клиниколабораторного обследования, включая УЗИ, ЦДК органов малого таза, онкомаркёры CA-125, CA-19-9 при наличии яичникового образования.
Вопрос о допустимости и сроках беременности и родов у молодых женщин на фоне ремиссии после окончания лечения по поводу злокачественной опухоли яичников I стадии нельзя считать окончательно решённым. Принципиально такая возможность не исключается у отдельных больных, первично леченных по поводу муцинозной цистаденокарциномы и дисгерминомы яичника.
Исходя из наибольшей вероятности возникновения рецидива в первые 2–3 года после удаления опухоли, наступление беременности в этот период нежелательно.
При локализации злокачественной опухоли в одном яичнике у молодых женщин, желающих иметь в будущем детей, рекомендуют выполнять одностороннее удаление придатков матки, резекцию второго яичника и большого сальника, а в дальнейшем — химиотерапию. Частота рецидивов при таком лечении начальных форм рака яичников составляет 9,1%; в популяции — 23,4–27,0%.
ПРОГНОЗ
Частота наступления беременности после органосохраняющего лечения в указанном объёме достигает 72,7%.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Бохман Я.В. Руководство по онкогинекологии. — Л.: Медицина, 1989. — 463 с.
Дамиров М.М., Бакулева Л.П., Слюсарь Н.Н. и др. Дифференциальная диагностика доброкачественных и злокачественных опухолей яичников // Акуш. и гинек. — 1996. — № 3. — С. 49–50.
Избранные лекции по клинической онкологии / Под ред. В.И. Чиссова, С.Л. Дарьяловой. — М., 2000. — 736 с. Митьков В.В., Медведев М.В. Клиническое руководство по ультразвуковой диагностике. — М.: Видар. — Т. 3. — 1997. — 320 с.
Новикова Е.Г., Чиссов В.И., Чулкова О.В. и др. Органосохраняющее лечение в онкогинекологии. — М.: Видар, 2000. — 112 с.
Стручкова Н.Ю., Медведев М.В., Зыкин Б.И. Возможности допплерографии в дифференциальной диагностике злокачественных и доброкачественных опухолей яичников: обзор современной литературы // Ультразвук. диагн. — 1998. — № 3. — С. 5–16.
50.4. БЕРЕМЕННОСТЬ И РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
В современной литературе рак молочной жележы (РМЖ), возникший на фоне беременности, лактации либо в течение первого года после завершения беременности, обозначают термином «РМЖ, ассоциированный с беременностью».
СИНОНИМЫ
Carcinoma mamma.
КОД ПО МКБ-10
C50 Злокачественное новообразование молочной железы.
В зависимости от анатомической локализации опухоли заболеванию присваивают статистический шифр.
·C50.0 Соска и ареолы.
·C50.1 Центральной части молочной железы.
·C50.2 Верхневнутреннего квадранта молочной железы.
·C50.3 Нижневнутреннего квадранта молочной железы.
·C50.4 Верхненаружного квадранта молочной железы.
·C50.5 Нижненаружного квадранта молочной железы.
·C50.6 Подмышечной задней части молочной железы.
ЭПИДЕМИОЛОГИЯ
Ежегодно в мире выявляют более 1 млн новых случаев РМЖ, прогнозируя рост числа заболевших к 2010 г. до 1,5 млн. В России РМЖ занимает первое место по частоте среди всех злокачественных новообразований у женщин. Ежегодно регистрируют более 46 тыс. новых случаев РМЖ. Примерно 1 из 10 женщин на протяжении жизни заболевает РМЖ. Смертность равна половине заболеваемости РМЖ. В 2002 г. в России от РМЖ умерли 22,1 тыс. женщин, что составило 16,7% среди злокачественных новообразований. Среди всех злокачественных новообразований, выявляемых при беременности, РМЖ занимает второе место по частоте после РШМ. На 3000 беременностей приходится 1 случай РМЖ. Около 3% всех наблюдений РМЖ диагностируют во время беременности. До 7,3% женщин моложе 45 лет, страдающих этим заболеванием, — беременные или кормящие.
КЛАССИФИКАЦИЯ
Классификация РМЖ, ассоциированного с беременностью, не отличается от таковой у небеременных и основана на клинических проявлениях заболевания. В её основу положены восемь признаков: анатомическая локализация и размер опухоли, объём метастатического поражения лимфатических узлов, наличие отдалённых метастазов, стадия развития опухоли (как вариант комбинации её размера и объёма метастатического поражения), а также клеточный тип, гистопатологический уровень дифференцировки и тип экспрессируемых рецепторов клеток опухоли.
Клиническая классификация первичной опухоли и регионарных лимфатических узлов (Международный противораковый союз, 6-е издание. Перевод и редакция проф. Н.Н. Блинова).
Оценка размеров первичной опухоли (T): ·T0 — нет признаков первичной опухоли;
·TX — оценка первичной опухоли невозможна;
·Tis — карцинома in situ; внутрипротоковая карцинома, дольковая карцинома in situ или поражение соска (болезнь Педжета);
·T1 — опухоль 2 cм или менее в наибольшем измерении;
·T1mic — микроинвазия; опухоль 0,1 см или менее 1 см в наибольшем измерении; ·T1а — опухоль более 0,1 см, но менее 0,5 см в наибольшем измерении;
·T1b — опухоль более 0,5 см, но менее 1 см в наибольшем измерении;
·T1c — опухоль более 1 см, но менее 2 см в наибольшем измерении; ·T2 — опухоль более 2 см, но менее 5 см в наибольшем измерении; ·T3 — опухоль более 5 см в наибольшем измерении;
·T4 — опухоль любого размера, прорастающая грудную стенку и кожу; ·T4а — прорастание грудной стенки;
·T4b — отёк (включая симптом «лимонной» корки) или изъязвление кожи молочной железы; ·T4с — сочетание T4а и T4b;
·T4d — воспалительный РМЖ.
Поражение регионарных лимфатических узлов (N): NX (если лимфатические узлы нельзя исследовать по какойлибо причине), N0 (регионарные лимфатические узлы не пальпируются), N1 (метастазы в ипсилатеральные подмышечные лимфатические узлы, при этом последние подвижны), N2 (метастазы в ипсилатеральные подмышечные лимфатические узлы, которые неподвижно фиксированы друг с другом или с окружающими тканями), N3 (метастазы в надключичные и подключичные лимфатические узлы на стороне поражения, метастазы в окологрудинные лимфатические узлы на стороне поражения).
Отдалённые метастазы (М): MX (наличие отдалённых метастазов оценить невозможно), M0 (отсутствие метастазов), М1 (есть отдалённые метастазы; уточнение их локализации в конкретном органе — лёгком, костях, печени, мозге и т.д.).
Стадии РМЖ:
·0 (ТisN0M0);
·I (Т1N0M0);
·IIA (T1N1M0,T2N0M0);
·IIB (T2N1M0,T3N0M0);
·IIIA (T1N2M0,T2N2M0,T3N1M0,T3N2M0);
·IIIB (T4N0M0,T4N1M0,T4N2M0);
·IIIC (любая Т N3M0);
·IV (любая Т любая N M1).
ЭТИОЛОГИЯ
На заболеваемость РМЖ оказывает влияние ряд факторов.
· Факторы риска развития РМЖ, связанные с репродуктивной функцией. GРаннее менархе, поздняя менопауза.
GНерегулярный менструальный цикл.
GОтсутствие беременностей и родов (риск рака снижается на 7% с каждыми родами).
GПоздняя первая беременность и поздние первые роды. У женщин, имевших поздние первые роды (в возрасте старше 30 лет) или не имевших родов вообще, риск заболеть РМЖ в 2–3 раза выше, чем у родивших до 20 лет. Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска развития РМЖ. Риск возникновения РМЖ в возрасте до 40 лет в 5,3 раза выше у женщин, родивших в возрасте старше 30 лет по сравнению с родившими до 20 лет.
GПродолжительность лактации менее 1 мес. Отсутствие лактации сопровождается увеличением риска возникновения РМЖ в 1,5 раза. Прослеживается обратная зависимость между общей длительностью лактаций и риском развития РМЖ.
· Наследственные факторы. В 5–10% наблюдений РМЖ связан с мутацией генов BRCA1 и BRCA2, что объясняет семейные случаи заболевания. Риск развития РМЖ у женщин-носителей мутантных генов чрезвычайно высок и составляет 80–95% на протяжении всей жизни. Рожавшие женщиныносители данных мутаций существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем нерожавшие. Ранний возраст первых родов в этой группе не снижает риск развития рака.
·Факторы риска, связанные с заболеваниями молочных желёз и других органов.
GНаличие пролиферативной формы фиброзно-кистозной болезни и различных доброкачественных опухолей молочных желёз (риск возникновения рака увеличивается в 2,3 раза).
GТравмы молочной железы, неоперированные лактационные маститы. · Генитальные факторы риска.
GРак эндометрия, рак яичников повышают риск развития РМЖ в 2 раза.
GНекомпенсированное влияние эстрогенов также повышает риск РМЖ. Для женщин, у которых естественная менопауза наступила в возрасте до 45 лет, риск развития РМЖ снижается вдвое по сравнению с теми, у кого менструации продолжаются после 54 лет. Показано достоверное снижение риска возникновения рака у женщин с хирургической кастрацией до 40 лет на 47% по сравнению с группой женщин с естественной менопаузой в 45–54 года, причём наименьшее число опухолей обнаружено при искусственной менопаузе до 35 лет.
GПриём синтетических прогестинов повышают риск развития РМЖ. · Факторы внешней среды.
GФакторы риска внешней среды и питания (курение, алкоголь, избыточный вес).
GИонизирующая радиация. В качестве фактора риска имеет наибольшую опасность в возрасте до 30 лет (в период от пременархе до 18 лет). Это одна из причин предпочтительного использования УЗИ, а не рентгенологического метода исследования молочных желёз у молодых женщин.
Этиологические факторы, влияющие на возникновение РМЖ на фоне сущест-вующей беременности, предположительно, не отличаются от таковых в группе небеременных пациенток.
ПАТОГЕНЕЗ
Регуляция нормального функционирования молочной железы происходит под влиянием комплексного взаимодействия между различными гормонами.
Гормональное влияние на развитие РМЖ хорошо известно. Эстрогены и прогестерон могут выполнять роль стимуляторов роста опухоли во время беременности, если злокачественная трансформация уже произошла. Это осуществляется в результате индукции синтеза факторов роста, которые стимулируют пролиферацию эпителиальных
клеток молочной железы и тормозят апоптоз (транскрипция фактора роста эндотелия сосудов индуцируется эстрогенами, что может привести к патологической неоваскуляризации); стимуляции клеточного роста за счёт отрицательной обратной связи, согласно которой эстрогены нивелируют эффекты ингибирующих факторов роста. Известен эффект эстрогенов, вызывающих ускорение роста числа микрометастазов, — стимуляция так называемых спящих метастазов. Прогестерон также поддерживает циклическую пролиферацию молочных желёз в течение беременности, стимулируя рост эпителия. В зависимости от продолжительности воздействия прогестерон может потенциально видоизменять ответ как нормальных, так и раковых клеток молочной железы на различных уровнях.
КЛИНИЧЕСКАЯ КАРТИНА
Гипертрофия, набухание молочных желёз, изменение консистенции, усиленная васкуляризация, а также ряд возможных осложнений (мастит, галактоцеле) затрудняют осмотр и маскируют развивающуюся опухоль во время беременности и лактации.
Наиболее характерной жалобой у 95% больных бывает определение болезненных неоформленных опухолевидных масс в ткани молочной железы, часто сопровождающихся дискомфортом в области соска (болезненность, покалывание, отёчность); изменение состояния всей молочной железы в виде асимметричного набухания и уплотнения; одностороннее увеличение лимфатических узлов. Втяжение соска, наличие кожных симптомов (например, «симптом площадки»), как правило, не отмечают.
ДИАГНОСТИКА
АНАМНЕЗ
Нередко в анамнезе у заболевших раком на фоне беременности есть пролиферативная форма фиброзно-кистозной болезни, а также различные доброкачественные опухоли молочных желёз. В 45–50% случаев пациентки, ранее имевшие беременность, перенесли лечение по поводу лактационного мастита. Нередко пациентки отмечают случаи РМЖ в своей семье. При сборе анамнеза женщины указывают на длительный период наблюдения опухоли. В 82% случаев пациентки самостоятельно выявляют опухоль в I триместре. Треть заболевших на фоне беременности при первом выявлении опухоли не обращаются за врачебной помощью, а при подозрении на злокачественный процесс в 25% случаев отказываются от диагностических мероприятий. С момента появления первых симптомов до установления диагноза врачом у беременной женщины проходит гораздо больше времени, чем в обычной ситуации (15 и 4 мес соответственно). Поздняя диагностика РМЖ в период беременности приводит к отсрочке начала лечения в среднем на 2–3,5 мес. Установлено, что 1 мес задержки в лечении увеличивает риск метастазирования в подмышечные лимфатические узлы на 0,9%, а задержка в лечении на 6 мес — на 5,1%. По этой причине к моменту установления правильного диагноза заболевание нередко находится в неоперабельной стадии.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Физиологическая гипертрофия (средний вес молочных желёз, равный приблизительно 200 г, удваивается во время беременности до 400 г), изменение консистенции, отёк, усиленная васкуляризация затрудняют осмотр. Стандартное пальпаторное исследование малоэффективно и в большинстве случаев, особенно на поздних сроках гестации, не позволяет дифференцировать опухоль.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Клинический и биохимический анализы крови больных с РМЖ, ассоциированном с беременностью, не отличаются от таковых у здоровых беременных. Изменение биохимических показателей крови, косвенно указывающих на возможное метастазирование РМЖ в кости или в печень, при беременности не характерно. Так, активность ЩФ при беременности физиологически может увеличиваться от 2 до 4 раз; АЛТ, АСТ, лактатдегидрогеназа обычно находятся на уровне, соответствующем сроку беременности. Уровень половых гормонов и пролактина у больных с РМЖ также соответствует срокам беременности.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Рентгенологическое исследование (маммография) ассоциируется с негативным влиянием на плод. Тем не менее, при адекватном экранировании и защите плода в ряде случаев этот метод диагностики можно проводить. Так, рентгенография в передней и боковой проекции воздействует на плод в дозе только 0,4–0,5 мрад (0,004–0,005 Гр) при доказанной повреждающей дозе, равной 0,05–0,1 Гр. Однако маммография при беременности существенного диагностического значения не имеет и в 25% случаев даёт ложноотрицательную картину — тень опухоли сливается с гипертрофированной железистой тканью (рис. 50-1, см. цв. вклейку). Если удалось визуализировать участок уплотнения (симптом затемнения) в двух проекциях, можно говорить об объёмном процессе. Высокоинтенсивное затемнение неправильной формы, нечёткость контура, наличие микрокальцинатов не позволяют исключить злокачественный процесс. Однако в большинстве случаев чётко определить размеры и структуру опухоли весьма затруднительно.
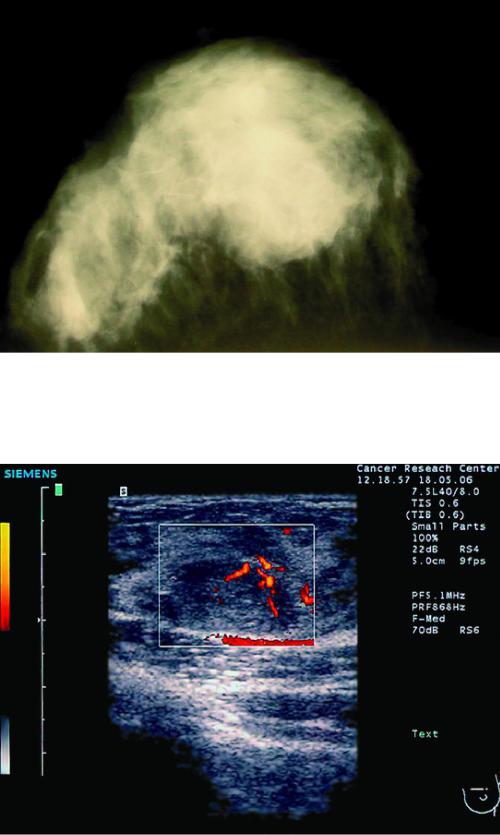
Рис. 50-1. Рентгенограмма молочной железы в прямой проекции. Рак молочной железы. Беременность 24 нед. Опухоль чётко не определяется.
УЗИ (ультрасонография) — метод, наиболее рекомендуемый для диагностики рака у беременных и кормящих женщин. С помощью стандартного УЗИ возможно выполнить цветовую и энергетическую допплерографию, количественную оценку скорости кровотока в визуализируемых сосудах. В 97% случаев метод УЗИ позволяет провести дифференциальную диагностику кистозных образований с солидными (рис. 50-2, см. цв. вклейку). При сонографии РМЖ представляет собой гипоэхогенное образование (тёмносерые оттенки на экране), неправильной формы без чётких контуров, неоднородной структуры, с гиперваскуляризацией.
Рис. 50-2. Сонограмма молочной железы. Пациентка, 23 года. Беременность 11 нед. Фиброаденома.
МРТ можно применять во время беременности, так как данный метод не несёт радиоактивного компонента. Тем не менее, контрастный препарат гадобутрол не рекомендуется использовать при беременности за исключением случаев крайней необходимости. В настоящее время в России МРТ молочных желёз исследуют и используют в диагностике случаев, неоднозначно интерпретируемых при маммографии и УЗИ. Оценка количественной характеристики динамического накопления контрастного вещества (интенсивное), а также качественные характеристики выявленного патологического процесса (нечёткие, тяжистые контуры) позволяют дифференцировать злокачественный процесс.
Цитологическое и гистологическое исследования пунктатов и биоптатов молочной железы — наиболее достоверные методы диагностики. Результат цитологического исследования у беременных во многом зависит от опыта работы цитолога с аналогичными случаями.
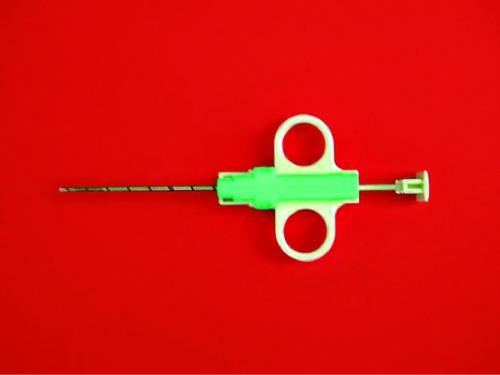
Эксцизионную биопсию, выполняемую под местной анестезией, считают «золотым стандартом» при любой неясной патологии в молочной железе. При завершённой беременности для снижения риска развития лактационного свища рекомендуют прекратить лактацию приблизительно за неделю до проведения манипуляции (каберголин). После выполнения биопсии назначают холодовое воздействие на молочные железы и их тугое бинтование. Техника «Corбиопсии» образований в молочной железе высокоспецифична и высокочувствительна (рис. 50-3, см. цв. вклейку) Морфологу, выполняющему исследование удалённого препарата, необходимо сообщить о наличии беременности у пациентки. «Сor-биопсия» позволяет не только получить достаточное количество материала для верификации диагноза, но и выполнить целый набор иммуногистохимических исследований для определения прогноза и тактики лечения пациентки (рецепторный статус опухоли, экспрессия гена Her2-neu, Ki-67 и т.д.). РМЖ у беременных имеет то же гистологическое строение, что и в группе небеременных. От 70 до 90% опухолей соответствует инфильтративному протоковому РМЖ. У беременных чаще наблюдают опухоль больших размеров с выраженным внутрипротоковым компонентом, метастатически изменённые регионарные лимфатические узлы, распространение раковых эмболов по лимфатическим щелям. Как правило у беременных, больных РМЖ, определяют эстроген и прогестеронотрицательные опухоли.
Рис. 50-3. Аппарат-игла для проведения «Cor-биопсии».
Выявление отдаленных метастазов в печени без риска для плода может быть произведено с помощью УЗИ и МРТ. Радиоизотопное исследование костей скелета для выявления метастазов выполняют чрезвычайно редко, поскольку данный метод исследования несёт 0,00194 Гр лучевой нагрузки на плод.
СКРИНИНГ
Программа скрининга подразумевает маммографическое и физикальное исследования, а также самообследование женщиной молочных желёз. У беременных наиболее рациональными, доступными и информативными методами скрининга считают самообследование молочных желёз и УЗИ. Схема ультразвукового скрининга при беременности, регламентированная приказом №457 МЗ РФ «О совершенствовании пренатальной диагностики в профилактике наследственных и врождённых заболеваний у детей» включает три обязательных исследования в 10–14, 20–24 и 32– 34 нед беременности, позволяющие своевременно диагностировать ВПР. Считают рациональным одномоментно выполнять и контрольные УЗИ молочных желёз.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику РМЖ у беременных и кормящих женщин следует проводить с маститом, фиброаденомой, листовидной опухолью молочной железы, галактоцеле, липомой, лимфомой, гамартомой, саркомой, туберкулёзом. Постановка диагноза «лактационный мастит» при наличии злокачественной опухоли в молочной железе — типичная ошибка в клинической практике. Кроме совпадения сроков проявления истинного лактационного мастита и РМЖ не редкостью бывает и совпадение клинической картины (рис. 50-4, 50-5, см. цв. вклейку).
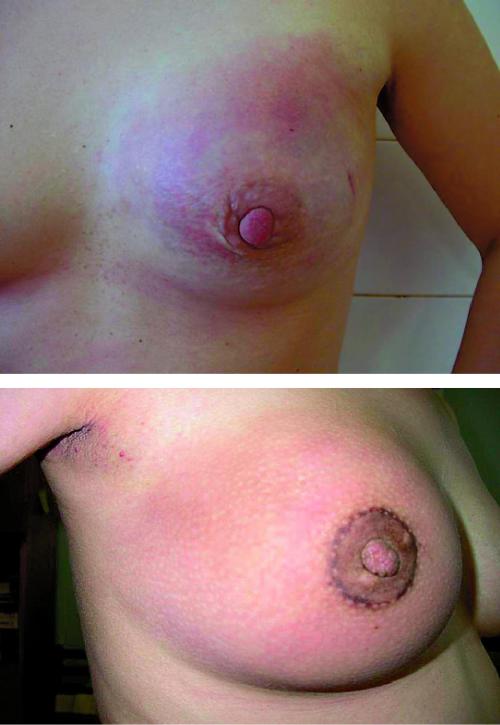
Рис. 50-4. Пациентка, 21 год. Беременность 16 нед. Рак молочной железы (отёчно-инфильтративная форма).
Рис. 50-5. Пациентка, 25 лет. Беременность 24 нед. Мастит.
В последние годы всё чаще наблюдают стёртые формы воспалительных поражений молочной железы, характеризующиеся, если не полным отсутствием, то, по крайней мере, слабой выраженностью типичных клинических проявлений. Так, гнойный мастит может протекать с нормальной или субфебрильной температурой, без озноба, без выраженных изменений картины крови, при вялой воспалительной реакции. В клинике возрастает число случаев необоснованного и неадекватного применения лечебных физиотерапевтических процедур, которые стимулируют диссеминацию злокачественного процесса и приводят к быстрой инвазии в окружающие ткани, образуя так называемые острые, или диффузно-инфильтративные, формы рака.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При обнаружении опухоли и при её цитологической верификации необходимо коллегиальное обсуждение полученных диагностических данных с участием онколога и акушера. В крупных медицинских центрах на этапе постановки диагноза возможно привлечение медицинского генетика.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
В диагнозе указывают локализацию опухоли (правая/левая молочная железа) и соответствие стадии по классификации ТNM. Необходимо указать наличие беременности и срок гестации в неделях.
Рак правой молочной железы T2N0M0 (IIА стадия). Беременность 23–24 нед.
ЛЕЧЕНИЕ
ЦЕЛИ ЛЕЧЕНИЯ
Целью лечения больного с онкологическим заболеванием считают не только достижение максимально выраженного клинического эффекта, но и увеличение продолжительности и улучшение качества жизни. Определение лечебной тактики зависит прежде всего от стадии заболевания, а не от срока беременности. В том случае, когда больная отказывается от медицинской помощи и приоритетом для неё и её семьи представляется защита плода, лечение откладывают до момента родов. Как правило, прогноз у больных, выбравших этот вариант, крайне неблагоприятен.
Второй вариант подразумевает немедленное завершение беременности и проведение лечения в объёме, адекватном стадии опухолевого процесса. Дальнейшее лечение не отличается от такового у небеременных.
Третий вариант, который всё чаще применяют в мировой практике последние 20 лет — проведение лечения без прерывания беременности. При этом можно проводить как оперативные вмешательства, так и лекарственную терапию.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Лечение РМЖ подразумевает комплексный подход, включающий оперативное вмешательство, лекарственное лечение и лучевую терапию. Несмотря на то что лучевую терапию достаточно часто применяют в обычной онкологической практике, для беременных она противопоказана. Тератогенные свойства лучевой терапии, а также угроза развития онкологической патологии у ребёнка, в том числе лейкоза, заставляют воздерживаться от её применения на протяжении всей беременности. При проведении стандартного курса в суммарной дозе, равной 5000 рад (50 Гр), плод получает лучевую нагрузку в пределах от 3,9–15 рад (0,039–0,15 Гр) в I триместре и 200 рад (2 Гр) — к концу беременности. Пороговой повреждающей дозой для плода в I и II триместрах беременности считают 10 рад (0,1 Гр). Доза от 10–15 рад приводит к дефектам развития, нарушениям ЦНС, доза 50–200 рад — к задержке развития, а доза от 100–250 рад — к уродствам.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Спорными вопросами бывают безопасность и возможные побочные эффекты противоопухолевых препаратов в период беременности. Наибольший риск развития уродств у плода возникает при проведении химиотерапии в I триместре беременности — частота ВПР составляет 10–20%, возрастает частота спонтанных абортов. Химиотерапия, проводимая во II и III триместрах беременности, также может приводить к преждевременным родам и таким осложнениям, как миелосупрессия у матери и плода, кровотечение и инфекционные заболевания, задержка роста, малая масса тела плода, рождение его мёртвым. Отдалённые результаты проведения химиотерапии во время беременности неизвестны. Решение о проведении химиотерапии возможно лишь после разъяснительной беседы с беременной и её семьёй.
В случае полной информированности больной о всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах беременности возможно назначение неоадъювантной полихимиотерапии (доксорубицин, циклофосфамид).
На современном этапе нет отдалённых данных о судьбе и здоровье детей, родившихся у женщин, подвергшихся специфическому лекарственному лечению.
Одним из наиболее действенных методов терапии РМЖ считают гормональное лечение. Однако антиэстрогенное средство тамоксифен оказывает тератогенное действие и противопоказан при беременности.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Оперативное лечение считают основным методом при РМЖ. На начальных стадиях заболевания возможно выполнение оперативного вмешательства в качестве первого этапа лечения. Радикальная мастэктомия или органосохраняющая операция, а также сопровождающее анестезиологическое пособие, не опасны для плода и, как правило, не приводят к самопроизвольному аборту. Радикальная маст-эктомия с сохранением обеих грудных мышц — наиболее рациональный хирургический объём при начальных (I, II) стадиях РМЖ в I триместре, когда больная хочет сохранить беременность. Больные, перенёсшие мастэктомию, не нуждаются в лучевой терапии. Органосохраняющие операции при сохранении беременности нежелательны, так как требуют дополнительной лучевой терапии, а её можно проводить только после завершения беременности. Необходимость выполнения аксиллярной диссекции во всех случаях определяется высокой частотой метастазов в регионарные лимфатические узлы.
При отказе больной от полного удаления молочной железы, при начальных сроках беременности органосохраняющая операция может быть дополнена полихимиотерапией, начиная со II триместра, и лучевой терапией после раннего родоразрешения.
Если диагноз поставлен в конце II триместра или позже, вариантом выбора считают радикальную резекцию с последующей дистанционной лучевой терапией после завершения беременности.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Метод лечения у больных РМЖ, ассоциированным с беременностью, определяют индивидуально с учётом срока беременности и данных о распространённости опухоли предпочтительно консилиумом с привлечением хирурга, акушера, химиотерапевта, радиолога, психолога.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация в онкологический стационар показана в случае согласия больной на тот или иной вид лечения. При госпитализации необходимо заключение акушера о сроке беременности, объективная инструментальная оценка жизнеспособности плода, наличия или отсутствия его патологии. Акушер предоставляет заключение о противопоказании к тому или иному виду планируемого лечения.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценка эффективности лечения.
Лечебный эффект от неоадъювантной химиотерапии определяется на основании сравнения размеров опухоли до лечения и после, наличия отека, гиперемии. Если контроль осуществляется на фоне существующей беременности, необходимо подобрать безопасные для плода методы. После окончания лечения контрольное исследование, включающее, осмотр, маммографию, рентген легких, УЗИ органов брюшной полости, радиоизотопное исследование костей, проводится через 6 месяцев. Последующее обследование — через 1 год.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
При местнораспространённом РМЖ (стадии IIIA, IIIB, IIIC), при отёчноинфильтративных формах рака и при IV стадии рака, если необходимо проведение химиотерапии и больная согласна на прерывание беременности, в качестве первого этапа лечения рекомендуют прерывание беременности, причём на любом сроке (с 22–27 недель — «очень ранние» преждевременные роды). При постановке диагноза в III триместре и при решении пролонгировать беременность возможны ранние преждевременные роды в сроке 34 недель.
ПРОФИЛАКТИКА
Профилактика основана на программах формирования здорового образа жизни и устранении факторов риска развития рака. Помимо повышения информированности женщин репродуктивного возраста о возможной злокачественной патологии молочных желёз на фоне беременности необходимо внедрять методы самообследования, а главное — инструментальное исследование молочных желёз в рамках прегравидарной подготовки. Основные профилактические меры должны быть направлены на выявление болезни на максимально ранних сроках. Необходимо включить УЗИ молочных желёз в план наблюдения беременной либо на этапе планирования, либо в I триместре беременности.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Необходимо информировать женщин о том, что опухолевые клетки не метастазируют в ткани плода; женщина, болеющая раком, должна прекратить лактацию, что связано с необходимостью немедленно начать лечение и принимать различные лекарственные препараты. Ошибочно предположение, что будущий ребёнок женского пола непременно заболеет РМЖ, если у болеющей матери обнаружены мутации генов BRCA1 и BRCA2.
Следует объяснить, что последующая беременность не ухудшает прогноз у больных с ранней стадией РМЖ. Вопрос о беременности после проведённого лечения при сохранённой репродуктивной функции следует решать с осторожностью. Необходимо учитывать стадию заболевания, наличие или отсутствие неблагоприятных факторов прогноза. Минимальным интервалом от момента завершения лечения до планирования последующей беременности считают интервал 2–3 года.
После окончания лечения женщина должна находиться под длительным наблюдением онколога. Срок первого контрольного осмотра — через 6 мес от момента проведения лечения. Затем рекомендована явка через год.
ПРОГНОЗ
При сравнении в рамках одинаковых стадий и возрастных групп выживаемость беременных, больных РМЖ, ассоциированным с беременностью, не отличается от таковой в группе небеременных. Тем не менее, РМЖ, ассоциированный с беременностью, имеет худший прогноз, чем в целом РМЖ, что обусловлено большей распространённостью болезни на момент постановки диагноза.
Примерные сроки нетрудоспособности
Ориентировочные сроки временной нетрудоспособности при злокачественных новообразованиях молочной железы (класс II по МКБ-10) I стадии составляют 50–75 дней, II–III стадии — 80–115 дней. Вопрос об установлении инвалидности решают после завершения оплачиваемого отпуска по беременности и родам.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Давыдов М.И. Злокачественные новообразования в России и странах СНГ в 2002 г. / М.И. Давыдов, Е.М. Аксель — М.:
МИА, 2004 — С. 105.
Кампова-Полевая Е.Б. Рак молочной железы и беременность / Е.Б. Кампова-Полевая, С.М. Портной // Материалы V Ежегодной Российской Онкологической Конференции — М., 2001.
Корженкова Г.П. Комплексное маммографическое и ультразвуковое исследование в диагностике заболеваний молочной железы: Клиническая маммология. Современное состояние проблемы / Г.П. Корженкова; под ред. Е.Б. КамповойПолевой, С.С. Чистякова — М.: ГЭОТАР-Медиа, 2006 — С. 49–84.
Albrektsen G. Family history of breast cancer and short-term effects of childbirths on breast cancer risk / G. Albrektsen, I. Heuch, S. Thoresen, G. Kvale // Int. J. Cancer. — 2006. — Vol. 119, N6. — P, 1468–1474.
Cnattingius S. Pregnancy characteristics and maternal risk of breast cancer / S. Cnattingius, A. Torrang, A. Ekbom, F. Granath, G. Petersson, M. Lambe // JAMA. — 2006. — Vol. 295, N10. — Р. 1124–1125.
Coultas L. Endothelial cells and VEGF in vascular development / L. Coultas, K. Chawengsakso-phak, J. Rossant // Nature. — 2005. — N 7070. — P. 937–945.
Espinosa. The Lactating Breast: Contrast-enhanced MR Imaging of Normal Tissue and Cancer Radiology / Espinosa et al. — 2005. — Vol. 237. — Р. 429–436.
Greskovich J.J. Radiation therapy in pregnancy: risk calculation and risk minimization / J.J. Greskovich, R. Macklis // Semin. Oncol. — 2000. — Vol. 27. — Р. 633-645.
Gwyn K. Breast cancer during pregnancy / K. Gwyn, R. Theriault // Oncology. — Huntington, NY, 2001. — Vol. 15, N1. — Р. 39–46.
Jonson P.H. The treatment of pregnant women with breast cancer and the outcomes of the children exposed to chemotherapy in utero / P.H. Jonson, K. Gwyn, N. Gordon et al. // Poster N 540, ASCO. — May-June 2005.
Junda C. Breast Cancer in Pregnancy / C. Junda, M.D. Woo, Taechin Yu et. al. // Arch. Surg. — 2003. — Vol. 138. — Р. 91– 98.
Kato S. Progesterone increases tissue factor gene expression, procoagulant activity, and invasion in the breast cancer cell line ZR-75-1 / S. Kato, M. Pinto, A. Carvajal et al. // Clin. Endocrinol Metab. — 2005. — Vol. 90. — Р. 1181–1188.
Mondi M.M. Sentinel Lymph Node Biopsy During Pregnancy: Initial Clinical Experience / Matthew M. Mondi, Rosa E. Cuenca, David W. Ollila et al. // Ann. of Surg. Oncol. — 2007. — Vol. 14. — Р. 218–221.
Mirkin S. Effects of 17beta-estradiol, progesterone, synthetic progestins, tibolone, and raloxifene on vascular endothelial growth factor and Thrombospondin-1 messenger RNA in breast cancer cells / S. Mirkin, BC. Wong, DF. Archer // Int. J. Gynecol. Cancer. — 2006. — Vol. 16, suppl. 2. —Р. 560–563.
Patricia J. Numann. Breast Cancer in Pregnancy — Invited Critique / Patricia J. Numann // Arch. Surg. — 2003. — Vol. 138. — Р. 99.
Westenend P.J. A comparison of aspiration cytology and core needle biopsy in the evaluation of breast lesions / P.J. Westenend, A.R. Sever, H.J. Beekman-De Volder, S.J. Liem // Cancer. — 2001. — Vol. 93. — Р. 146–150.
50.5. БЕРЕМЕННОСТЬ И ТРОФОБЛАСТИЧЕСКАЯ БОЛЕЗНЬ

Трофобластическая болезнь — связанные между собой формы патологического состояния трофобласта: простой пузырный занос, инвазивный пузырный занос, хорионкарцинома, опухоль плацентарного ложа и эпителиоидноклеточная трофобластическая опухоль. При последнем пересмотре классификации в 2000 году FIGO рекомендует термин трофобластические опухоли заменить на трофобластические неоплазии (ТН).
КОД ПО МКБ-10
M910 Трофобластические новообразования.
O01 Пузырный занос.
O01.0 Пузырный занос классический.
O01.1 Пузырный занос неполный и частичный.
O01.9 Пузырный занос неуточнённый.
O02 Другие анормальные продукты зачатия.
ЭПИДЕМИОЛОГИЯ
В странах Европы ТН встречаются с частотой 0,6–1,1 на 1000 беременностей, в США — 1 на 1200, в странах Азии и Латинской Америки — 1 на 200, в Японии — 2 на 1000 беременностей.
Частота возникновения различных форм трофобластической болезни по данным одного из самых крупных трофобластических центров, (межрегиональный Центр в Шеффилде, Великобритания): полный пузырный занос — 72,2%, частичный пузырный занос — 5%, хорионкарцинома — 17,5%, другие формы — 5,3%.
КЛАССИФИКАЦИЯ
Выделяют два вида пузырных заносов: полный и частичный. Наиболее частая форма пузырного заноса — полный пузырный занос.
Полный пузырный занос выявляют в сроки 11–25 нед беременности, он чаще оказывается диплоидным — содержит 46ХХ хромосомный набор, обе хромосомы отцовские. В 3–13% случаев встречается 46ХY комбинация. Полный пузырный занос характеризуется отсутствием признаков зародышевого и эмбрионального развития. Злокачественная трансформация возникает в 20% наблюдений, при наборе хромосом 46XY чаще развивается метастатическая опухоль. Первый клинический признак — несоответствие размеров матки сроку беременности (размеры матки превышают сроки беременности). Макроскопически выявляют отёчные хориальные ворсинки, пузырьки.
Частичный пузырный занос выявляют в 25–74% случаев всех пузырных заносов, обычно в сроки от 9 до 34 нед беременности. Клетки частичного пузырного заноса всегда триплоидны, при этом диплоидный набор — от отца, гаплоидный — от матери (чаще 69ХXY, 69ХХХ, реже 69XYY). Возможно развитие фрагментов нормальной плаценты и плода. Ранее считалось, что частичный пузырный занос не малигнизируется. В настоящее время доказана возможность злокачественной трансформации (до 5%). Клинически размеры матки меньше или соответствуют сроку беременности, макроскопически определяют фрагменты плода, плаценты и отёчные хориальные ворсины.
Гистологическая классификация ТН (FIGO, 2000)
·Пузырный занос (код МКБ-10 М9100/0): Gполный пузырный занос;
Gчастичный пузырный занос (код МКБ-10 М9103/0).
·Инвазивный пузырный занос (код МКБ-10 М9100/1).
·Хорионкарцинома (код МКБ-10 М9100/3).
·Трофобластическая опухоль плацентарного ложа (код МКБ-10 М9104/1).
·Эпителиоидноклеточная трофобластическая опухоль (код МКБ-10 М9105/3).
Гистологическая форма трофобластической опухоли имеет важное прогностическое значение. Инвазивный пузырный занос, хорионкарцинома, опухоль плацентарного ложа и эпителиоидноклеточная опухоль относятся к злокачественным трофобластным опухолям (ЗТО).
Современная клиническая классификация ТН (табл. 50-3) объединяет стадии опухолевого роста и группы риска по возникновению резистентности опухоли — главному прогностическому критерию.
Таблица 50-3. Классификация трофобластических новообразований FIGO и ВОЗ, 2000
Стадия |
|
Локализация новообразования |
|
|
|
I |
|
Болезнь ограничена маткой |
IIРаспространение новообразования за пределы матки, но ограничено половыми органами (придатки, широкая связка матки, влагалище)
|
III |
|
Метастазы в лёгких с поражением половых органов или без него |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
IV |
|
Все другие метастазы |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество баллов |
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
0 |
|
1 |
2 |
|
4 |
||
|
|
|
|
|
|
|
|
|
|
|
|
Возраст, годы |
|
|
|
|
£40 лет |
|
>40 лет |
|
– |
|
– |
|
|
|
|
|
|
|
|
|
|||
Исход |
предшествующей |
|
Пузырный занос |
|
Аборт |
|
Роды |
|
– |
||
беременности |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Интервал*, мес |
|
|
|
<4 |
|
4–6 |
|
7–12 |
|
>12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Уровень ХГЧ, МЕ/л |
<103** |
103–104 |
104–105 |
>105 |
||
Наибольшая опухоль, включая |
|
<3 |
3–5 |
>5 |
|
– |
опухоль матки, см |
|
|
|
|
|
|
|
|
|
|
|
|
|
Локализация метастазов |
|
Лёгкие |
Селезёнка, почка |
ЖКТ |
|
Печень головной мозг |
|
|
|
|
|
|
|
Количество метастазов |
|
– |
1–4 |
5–8 |
|
>8 |
|
|
|
|
|
|
|
Предыдущая химиотерапия |
|
– |
– |
1 препарат |
|
Два цитостатика или более |
|
|
|
|
|
|
|
Примечание: *интервал между окончанием предыдущей беременности и началом химиотерапии; **низкий уровень ХГЧ может быть при трофобластической опухоли плацентарного ложа.
Сумма баллов £6 соответствует низкому риску развития резистентности опухоли, ³7 баллов — высокому.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ Пузырный занос наиболее часто встречается среди опухолей трофобласта (1:1000 беременностей), причиной его
развития служат генетические нарушения беременности. Пузырный занос локализуется в матке (реже в маточной трубе), чаще возникает у юных и пожилых беременных, в плохой социальноэкономической среде. Пузырный занос не обладает инвазивным ростом, не метастазирует. Частота излечения — 100%.
ТН — результат генетических нарушений беременности, при которых отсутствующее или инактивированное ядро яйцеклетки подвергается оплодотворению либо двумя сперматозоидами (с образованием набора хромосом 46ХХ или 46XY), либо происходит дупликация отцовского генетического материала. В результате из мезодермы зародыша развивается пузырный занос (по последним представлениям о генезе заболевания).
ТН характеризуются двумя различными биологическими процессами: персистенцией в организме матери трофобластических клеток после завершения беременности (феномен наиболее часто встречается после частичного или полного пузырного заноса) и трофобластической малигнизацией (инвазивный пузырный занос, хорионкарцинома, опухоль плацентарного ложа, эпителиоидноклеточная опухоль). Злокачественная трансформация элементов трофобласта (цито-, синцитиотрофобласта, промежуточных клеток) может встречаться как во время беременности (нормальной и эктопированной) так и после её завершения (роды, аборт), но наиболее часто это происходит после полного пузырного заноса.
ТН составляют 1% от онкогинекологических опухолей и поражают женщин преимущественно репродуктивного возраста. ТН — уникальные в биологическом поведении и клинических проявлениях опухоли, характеризующиеся высокой степенью озлокачествления, быстрым отдалённым метастазированием и, при этом, высокой частотой излечения только с помощью химиотерапии даже при отдалённых метастазах. После излечения сохраняется репродуктивная функция у абсолютного большинства молодых женщин.
ЗТО в 50% случаев развиваются после пузырного заноса, в 25% — после нормальной беременности и родов, в 25% — после аборта и эктопированной беременности. С увеличением числа беременностей риск развития ЗТО возрастает. Инвазивный пузырный занос может развиться одновременно с простым (полостным) пузырным заносом. Морфологическое подтверждение инвазивного пузырного заноса возможно лишь в удалённой матке или метастатическом очаге (признаки инвазии ворсинок в миометрий и другие ткани). Инвазивный пузырный занос характеризуется наличием отёчных ворсинок хориона, отсутствием эмбриональных сосудов и вторжением пролиферирующих элементов цито- и синцитиотрофобласта в миометрий. Опухоль обладает способностью к быстрой и глубокой инвазии в миометрий и может вызывать тяжёлое интраперитонеальное кровотечение. Трофобластическая хорионкарцинома обладает смешанной структурой из эпителия трофобласта, с элементами цито-, синцитиотрофобласта и клеток промежуточного звена, ворсинки отсутствуют. Опухоль обладает способностью к быстрой и глубокой инвазии в окружающие ткани и стенки сосудов. Быстрый рост опухоли сопровождается обширными центральными некрозами с сохранением по периферии жизнеспособных клеток.
Трофобластическая опухоль плацентарного ложа — редкая неворсинчатая опухоль, возникающая на плацентарной части трофобласта преимущественно из клеток синцитиотрофобласта. Опухоль способна к инфильтрирующему росту, внедрению в стенку сосудов и замещению их гладкомышечных элементов гиалиновым материалом. Часто протекает с разрушением серозной оболочки матки и массивным кровотечением. Для трофобластической опухоли плацентарного ложа характерно незначительное повышение концентрации ХГЧ, более информативно определение ПЛ в сыворотке крови и иммуногистохимическое исследование удалённых тканей с ПЛ.
Эпителиоидно-клеточная трофобластическая опухоль — впервые описана морфологами в 1995 г, самая редкая ТО, развивается из клеток промежуточного звена трофобласта, характеризуется отсутствием ворсин, скоплением атипичных мононуклеарных трофобластических клеток и элементов синцитиотрофобласта, внешним видом схожих с эпителиальными клетками. При микроскопии обнаруживают «острова» трофобластических клеток, которые окружены обширными некрозами и связаны между собой структурами, подобными гиалину, создавая рисунок «географической карты». При иммуногистохимическом исследовании эпителиоидноклеточная трофобластическая опухоль позитивна по наличию a-ингибина, цитокератина, эпидермальному фактору роста и лишь центральная часть опухоли позитивна к ПЛ и ХГЧ. Для опухоли характерна узловая форма роста с инвазией в миометрий, без фокусов некроза и кровоизлияний.
КЛИНИЧЕСКАЯ КАРТИНА
Основные клинические симптомы пузырного заноса обычно возникают перед 18 нед беременности:
·влагалищное кровотечение (более 90% случаев);
·размеры матки превышают должные для данного срока беременности (в 50% случаев);
·двухсторонние текалютеиновые кисты 8 см и более (20–40%).
При пузырном заносе могут развиться различные осложнения: · неукротимая рвота беременных (20–30% случаев);
·АГ, преэклампсия (10–30%);
·симптомы гипертиреоза [тёплая кожа, тахикардия, тремор, увеличение щитовидной железы (2–7%)];
·разрыв овариальных кист, кровотечение, инфекционные осложнения;
·трофобластическая эмболизация встречается у 2–3% пациенток с острыми дыхательными расстройствами (кашель, тахипноэ, цианоз) при размерах матки, соответствующих сроку 20 и более недель (чаще развивается спустя 4 ч от
эвакуации ПЗ); · ДВС.
Клинические особенности ИПЗ:
·опухоль обычно локальная, с инвазивным ростом и редко метастазирует (20–40%) — преимущественно во влагалище, вульву, лёгкие;
·значительно чаще, чем при простом пузырном заносе, трансформируется в хорионкарциному;
·возможна спонтанная регрессия опухоли;
·основной клинический маркёр — повышение концентрации ХГЧ в сыворотке крови;
·основной метод визуализации опухоли — ультразвуковая КТ;
·высокая чувствительность к химиотерапии;
·излечение в 100% случаев.
Клинические особенности трофобластической хорионкарциномы:
· встречается с частотой 1:20 000 беременностей (1:160 000 нормальных родов, 1:15 380 абортов, 1:5 330 эктопированных беременностей, 1:40 пузырных заносов);
·первичная опухоль быстро растёт, способна к глубокой инвазии в стенку матки и её разрушению с развитием кровотечения;
·высокая частота метастазирования в отдалённые органы (лёгкие — 80%, влагалище — 30%, органы малого таза — 20%, печень, головной мозг — 10%, селезёнка, желудок, почки — 5%);
·первые клинические симптомы — кровотечение или симптомы роста отдалённых метастазов;
·высокая чувствительность к химиотерапии;
·излечение в 90% наблюдений.
Клинические особенности трофобластической опухоли плацентарного ложа:
·в 95% наблюдений возникает после родов;
·чаще — солидная опухоль, растущая в просвет полости матки, проникающая в миометрий и серозную оболочку
матки, а так же смежные органы;
·непредсказуемое клиническое течение (в 90% случаев либо регрессирует, либо поддаётся лечению, в 10% наблюдений метастазирует и слабо чувствительна к стандартной химиотерапии);
·оптимальное лечение первичной опухоли — гистерэктомия, при метастатическом поражении — химиотерапия для
высокого риска резистентности опухоли.
Клинические особенности эпителиоидноклеточной трофобластической опухоли:
·опухоль чаще локализуется в дне матки, перешейке или слизистой цервикального канала (последняя локализация может симулировать картину рака цервикального канала);
·клинические проявления чаще развиваются в репродуктивном возрасте, но возможны и в более позднем возрастном периоде, спустя годы после последней беременности;
·возможно проявление болезни в виде отдалённых метастазов (без признаков первичного поражения матки);
·для дифференцированного диагноза необходимо определить концентрацию ХГЧ в сыворотке крови, провести
гистологическое и иммуногистохимическое исследование удалённых тканей с маркёрами;
·оптимальное лечение — хирургическое удаление первичной опухоли и метастазов с химиотерапией для высокого риска резистентности опухоли;
·прогноз трудно предсказать.
ДИАГНОСТИКА ПУЗЫРНОГО ЗАНОСА
Для постановки диагноза пузырного заноса необходимо:
·оценить клинические симптомы во время беременности;
·провести УЗИ, КТ органов малого таза;
·определить концентрацию ХГЧ в сыворотке крови (при нормальной беременности пик ХГЧ отмечают в 9–10 нед, он не выше 150 000 мМЕ/мл, в дальнейшем концентрация снижается).
ДИАГНОСТИКА ЗЛОКАЧЕСТВЕННЫХ ТРОФОБЛАСТИЧЕСКИХ ОПУХОЛЕЙ АНАМНЕЗ
Наиболее часто болезнь возникает у женщин репродуктивного возраста, хотя может проявляться у пациенток в перименопаузе. Беременность в анамнезе, завершившаяся родами, абортом (искусственным или самопроизвольным), в том числе и эктопическая — необходимый критерий для постановке диагноза. Опухоль может возникнуть и в период развивающейся беременности. Но чаще ЗТО развивается после перенесённого пузырного заноса.
Жалобы Абсолютное большинство женщин репродуктивного возраста с ЗТО жалуются на нарушение менструального цикла
(аменорея, ациклические кровяные выделения, олигоменорея, маточные кровотечения различной интенсивности и продолжительности). Данные менограммы пациентки после окончания беременности могут дать полезную для своевременной диагностики информацию.
Реже пациентки жалуются на боли внизу живота, в грудной клетке, кашель, кровохарканье, головную боль, различные проявления токсикоза беременных, возможно появление симптомов тиреотоксикоза. В отдельных случаях пациентки самостоятельно обнаруживают метастазы во влагалище или опухоль в малом тазу, пальпируемую через переднюю брюшную стенку.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При гинекологическом осмотре часто можно обнаружить увеличение размеров матки, несоответствие их должным при данном сроке беременности или длительности послеродового периода. Кроме того, можно пальпировать опухолевые образования в стенке матки, в малом тазу, во влагалище (чаще выявляют при осмотре в зеркалах).
Патогномоничный признак ТН — текалютеиновые кисты яичников, часто очень больших размеров. В связи с этим возможен перекрут ножки кисты и развитие клиники «острого живота».
Внешние проявления болезни возникают только при значительном распространении опухоли и длительном течении. Как правило, общее состояние больной не нарушено, за исключением редких наблюдений у пациенток со значительным распространением опухоли (массивное поражение лёгких, головного мозга, печени и других органов).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ Определение концентрации ХГЧ в сыворотке крови
В норме ХГЧ образуется в синцитиотрофобластических клетках плаценты, что обусловливает высокую концентрацию гормона у беременных. Известно, что любое повышение уровня ХГЧ, не связанное с развивающейся беременностью, свидетельствует о возникновении ТН. Диагностическая чувствительность ХГЧ при ТН близка к 100%.
Определённые трудности имеет диагностика ТН во время беременности. Одним из критериев диагноза может быть отсутствие снижения уровня ХГЧ в сыворотке крови после 12 нед беременности. Целесообразно оценить динамику роста другого гормона беременности — АФП, концентрация которого в норме с 11 нед начинает прогрессивно увеличиваться. Если содержание ХГЧ повышается после 11 нед беременности, а при этом отмечается снижение концентрации АФП, можно думать о возникновении ТН. При этом концентрация ХГЧ в сыворотке крови в несколько раз выше соответствующей данному сроку нормы.
Наличие у больной репродуктивного возраста нарушений менструального цикла, ациклических кровотечений и беременности в анамнезе всегда требует определения концентрации ХГЧ для исключения у неё ТН.
Плато или увеличение содержания ХГЧ в трёх последующих исследованиях в течение 14 дней свидетельствует о развитии ЗТО.
Определение концентрации ПЛ
Такое исследование можно проводить при подозрении на трофобластическую опухоль плацентарного ложа или эпителиоидноклеточную трофобластическую опухоль — редкие ТН, характеризующиеся невысокой концентрацией ХГЧ даже при распространённом процессе и значительной экспрессией ПЛ. Эти соотношения лежат в основе дифференциальной диагностики. Но наиболее информативно в данном случае иммуногистохимическое исследование на наличие ПЛ в ткани опухоли.
Критерии диагноза «трофобластическая неоплазия» (рекомендации ВОЗ и FIGO, 2000):
·плато или увеличение концентрации ХГЧ в сыворотке крови после удаления пузырного заноса в трёх последовательных исследованиях в течение 2 нед (1-й, 7-й, 14-й день исследования);
·повышенное содержание ХГЧ через 6 и более месяцев после удаления пузырного заноса;
·гистологическая верификация опухоли (хорионкарцинома, трофобластическая опухоль плацентарного ложа, эпителиоидноклеточная трофобластическая опухоль).
Самый ранний признак развития трофобластической опухоли — увеличение концентрации ХГЧ в сыворотке крови при
динамическом контроле у пациенток с беременностью в анамнезе.
Всем женщинам с различными нарушениями менструального цикла и беременностью в анамнезе, а так же с выявленными метастазами неясной этиологии следует определять концентрацию ХГЧ в сыворотке крови.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ Данные морфологического исследования
ТН — единственные опухоли, для которых морфологическая верификация не обязательна. Несмотря на это необходимо тщательное морфологическое исследование удалённых тканей (при выскабливании полости матки, иссечении образований в стенке влагалища и др.) женщин репродуктивного возраста с целью раннего выявления ТН. Следует сохранять морфологический материал в виде парафиновых блоков, позволяющих проводить дополнительные (иммуногистохимические) исследования при необходимости в уточнении диагноза.
У большей части больных диагноз ТН ставят на основании данных морфологического исследования. Диагностика пузырного заноса не вызывает трудностей у морфолога.
Верификация хорионкарциномы нередко затруднена, так как при выскабливании полости матки опухолевая ткань (чаще расположенная интерстициально в стенке матки) зачастую не попадает в соскоб. Повторные выскабливания сопряжены с высоким риском разрушения опухоли и последующего профузного маточного кровотечения либо перфорации стенки матки, инфильтрированной опухолью, и развитием внутреннего кровотечения.
Морфологический диагноз ИПЗ возможен только в удалённой матке, либо метастазе опухоли.
Морфологическая диагностика эпителиоидноклеточной трофобластической опухоли сложна из-за отсутствия опыта у морфологов, часто не располагающих данными о редких наблюдениях, описанных в литературе только в последние годы.
Роль морфологического исследования возрастает при изучении удалённых метастазов опухоли. Часто это ключ к постановке диагноза у пациенток со стёртой картиной болезни, а также у пациенток в менопаузе. Иммуногистохимическое исследование удалённых тканей с опухолевыми маркёрами вносит значительный вклад в диагностику ЗТО при нетипичном клиническом течении.
Ультразвуковая компьютерная томография
В диагностике первичной опухоли матки наряду с определением концентрации ХГЧ обязательно применяют ультразвуковую КТ — высоко информативный и абсолютно доступный метод.
Применение высокочастотных трансвагинальных датчиков даёт возможность выявить опухоль трофобласта (минимальным диаметром 4 мм) уже на первом этапе обследования пациентки, полностью исключив необходимость инвазивных методов исследования (повторные выскабливания, лапароскопия, гистероскопия, тазовая ангиография). Ультразвуковая КТ позволяет быстро и эффективно диаг-ностировать метастазы в органы малого таза, брюшной полости и забрюшинного пространства.
Выявление метастазов
Для обнаружения метастазов ТО используют следующие методы (FIGO).
· Для диагностики лёгочных метастазов и определения стадии заболевания — рентгенографию органов грудной полости. Можно использовать и КТ лёгких.
·Метастазы в печени (и других органах брюшной полости и забрюшинного пространства) выявляют с помощью рентгеновской или ультразвуковой КТ.
·Церебральные метастазы обнаруживают с помощью МРТ или рентгеновской КТ.
Рентгенологическое исследование лёгких обязательно проводят при первичном обследовании пациенток при развитии у них ТН.
Метастазирование опухолей трофобласта в лёгкие встречается наиболее часто и составляет до 80% от всех случаев метастазирования. В зависимости от степени распространения метастазы в лёгких могут определяться в виде солитарных очагов, очаговых теней, либо множественных метастазов до тотального поражения лёгочной ткани. При этом у части больных первичная опухоль матки может не выявляться.
Рентгеновская КТ — высокоинформативный метод диагностики лёгочных метастазов, метастазов ЗТО в паренхиматозных органах, средостении и забрюшинном пространстве, а также в головном мозге.
В соответствии с соглашением, принятым клиницистами трофобластических центров, всем больным с высоким риском резистентности ТО (по шкале FIGO), имеющим метастазы в лёгких и других органах, обязательно выполняют рентгеновскую КТ головного мозга.
МРТ применяют для диагностики метастазов ЗТО в головном мозге. Диагностическая ценность МРТ значительно превосходит рентгеновскую КТ, особенно при выполнении с контрастированием.
Позитронная эмиссионная томография — новый метод исследования больных трофобластическими опухолями, позволяющий в отдельных наблюдениях выявлять опухолевые очаги, не обнаруженные стандартными методами исследования.
СКРИНИНГ
Поводят после удаления пузырного заноса — ежемесячно исследуют концентрацию ХГЧ в сыворотке крови в течение года.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
ТН следует дифференцировать от нормальной беременности. Ультразвуковая КТ и динамическое исследование ХГЧ в сыворотке крови позволяют своевременно заподозрить развитие ТН (первый признак — несоответствие концентрации ХГЧ гестационному сроку).
У женщин репродуктивного возраста при обнаружении очаговых теней в лёгких, опухоли в головном мозге, печени, почке и других органах всегда необходимо исключать опухоли трофобласта с помощью определения концентрации ХГЧ в сыворотке крови.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Показаниями служат симптомы, характерные для экстрагенитальной локализации опухоли (метастазы в ЦНС, почку, стенку желудка, печень и др.). Необходима консультация нейрохирурга, абдоминального хирурга, уролога и др.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Трофобластическая опухоль матки, I стадия.
Трофобластическая опухоль матки, множественные метастазы в лёгких и головном мозге, IV стадия.
ЛЕЧЕНИЕ ПУЗЫРНОГО ЗАНОСА
Тактика врача при пузырном заносе:
·вакуум-экстракция пузырного заноса с контрольным острым кюретажем;
·гистологическое исследование материала;
·пациентки с резусотрицательной кровью и частичным пузырным заносом должны получать Rh0-(анти-D)-Ig;
·в последующем — тщательный мониторинг в течение года.
Мониторинг после удаления пузырного заноса:
·еженедельное определение концентрации ХГЧ в сыворотке крови до получения трёх последовательных отрицательных результатов, затем — ежемесячно до 6 мес, далее — 1 раз в 2 мес в течение следующих 6 мес;
·Ультразвуковая КТ органов малого таза через 2 нед после экстракции пузырного заноса, далее — ежемесячно до
нормализации содержания ХГЧ;
·рентгенография лёгких после эвакуации пузырного заноса, далее — через 4 и 8 нед при динамическом снижении ХГЧ;
·обязательное ведение пациенткой менограммы в течение не менее чем трёх лет после пузырного заноса.
В норме концентрация ХГЧ в плазме крови нормализуется через 4–8 нед после экстракции пузырного заноса. Повышенная концентрация ХГЧ после 8 нед может свидетельствовать о развитии ЗТО, что требует обязательного повторного обследования больной (гинекологический осмотр, ультразвуковая КТ органов малого таза и рентгенография лёгких). Химиотерапию после удаления пузырного заноса при динамическом снижении концентрации ХГЧ до нормальной величины не проводят. Исключение составляют пациентки, у которых невозможен мониторинг после удаления ПЗ. В этом случае рекомендуют проведение трёх курсов химиотерапии в стандартном режиме (метотрексат, кальция фолинат с профилактической целью).
Контрацепция обязательна в течение года после нормализации концентрации ХГЧ, предпочтительнее — пероральными контрацептивами.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Достичь излечения больных с сохранением молодым пациенткам репродуктивной функции.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
·состояния, угрожающие жизни больной (кровотечения, симптомы метастазов в головном мозге, массивное поражение опухолью внутренних органов и др.);
·отсутствие возможности для амбулаторного обследования и лечения (из-за отдалённого места жительства либо
общего состояния больной);
·лечение, требующее стационарного пребывания (комбинированная химиотерапия, хирургическое лечение, лучевая терапия метастазов в ЦНС);
·угроза осложнений, опасных для жизни (чаще — в первый месяц лечения при больших размерах опухоли).
Консультацию и лечение больных ЗТО следует проводить только в специализированной клинике, располагающей всеми современными возможностями диагностики, а главное — опытом успешного лечения таких больных.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Лечение всегда начинают со стандартной химиотерапии I линии (табл. 50-4), режим которой определяется группой риска возникновения резистентности опухоли по шкале FIGO, 2000 г. (см. выше).
Пациенткам, получавшим ранее нестандартные режимы химиотерапии, после оценки группы риска следует обязательно начать стандартную химиотерапию.
Кровотечение из опухоли не служит противопоказанием к началу химиотерапии, которую необходимо проводить параллельно с интенсивной гемостатической терапией.
Таблица 50-4. Стандарты химиотерапии I линии |
|
|
|
|
|
||||
|
Низкий риск |
|
|
|
Высокий риск |
|
|
||
|
|
|
|
|
|
|
|
|
|
Метотрексат |
по 50 мг |
в/м |
в 1,3,5,7- |
Этопозид |
по 100 мг/м2 |
в/в капельно в 1-й |
и 2-й |
день |
|
й дниКальция фолинат по 6 мг в/м в 2,4,6,8- |
химиотерапииДактиномицин по 500 мкг в/в в 1-й и 2-й деньМетотрексат |
||||||||
й дни, через |
30 ч |
после |
введения |
по 100 мг/м2 в/в струйно, с последующей 12-часовой инфузией в дозе |
|||||
метотрексатаПовторение курсов с 15-го дня |
200 мг/м2, |
в 1-й деньКальция фолинат по 15 мг в/м через 24 ч после |
|||||||
химиотерапии |
|
|
|
введения |
метотрексата, |
затем |
каждые |
12 ч — |
всего |
|
|
|
|
4 дозыЦиклофосфамид по 600 мг/м2 в/в на 8-й деньВинкристин 1мг/м2 в/в |
|||||
|
|
|
|
струйно на 8-й деньПовторение курсов с 15-го дня химиотерапии |
|
||||
|
|
|
|
|
|
|
|
|
|
В процессе лечения осуществляют еженедельный динамический контроль концентрации ХГЧ в плазме крови для оценки эффективности лечения и раннего выявления резистентности опухоли.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Показания к хирургическому лечению:
· кровотечение из первичной опухоли или метастаза, угрожающее жизни больной;
·перфорация опухолью стенки матки;
·резистентность первичной опухоли;
·резистентность солитарных метастазов.
Оптимальный объём операции:
·органосохраняющая гистеротомия с иссечением опухоли в пределах здоровых тканей у больных репродуктивного возраста;
·резекция поражённого органа с резистентным метастазом в пределах здоровых тканей (возможно эндоскопическим
путём).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Наличие симптомов развития метастазов ЗТО в головном мозге, брюшной полости, забрюшинном пространстве.
ПРИМЕРНЫЕ СРОКИ НЕТРУДОСПОСОБНОСТИ
У больных с низким риском резистентности ТН при эффективном лечении без осложнений нетрудоспособный период длится 3 мес, для больных с высоким риском без поражения ЦНС и без осложнений при эффективном лечении — 4– 5 мес.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ БОЛЬНЫХ
Обязательно проводят мониторинг:
·концентрации ХГЧ в плазме крови 1 раз в 2 нед в течение первых трёх месяцев, затем ежемесячно до шестого месяца, затем 1 раз в 2 мес до года, в течение второго года — один раз в 2–3 мес, в течение третьего — 1 раз в 6 мес;
·менструальной функции — пациентка должна вести менограмму (при нарушении менструального цикла проводят определение ХГЧ);
·состояния органов малого таза — контрольную ультразвуковую КТ выполняют 1 раз в 2 мес до нормализации ультразвуковой картины, далее — по показаниям;
·состояния лёгких — рентгенологическое исследование лёгких проводят 1 раз в год;
·изменений со стороны ЦНС (для больных с церебральными метастазами) — МРТ головного мозга проводят 1 раз в
6 мес — в течение двух лет.
Беременность разрешается спустя 1 год после окончания лечения — больным с I –III стадиями болезни; спустя 2 года — больным с IV стадией.
ПРОФИЛАКТИКА В настоящее время не разработана.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Необходимо знать, что при правильном и своевременном лечении в специализированном учреждении трофобластическая болезнь излечима в абсолютном большинстве наблюдений независимо от стадии. При этом удаётся сохранить детородную функцию у молодых пациенток. Главное условие для достижения успеха — строго соблюдать все рекомендации врача как во время лечения, так и после его завершения. Обязательно ведение менограммы, обследование в рекомендуемые сроки и последующая контрацепция. При нарушении менструального цикла после окончания лечения следует незамедлительно обратиться к онкогинекологу.
ПРОГНОЗ
Излечение больных пузырным заносом после его удаления происходит в 80% случаев, в 20% возможно развитие ЗТО. Для больных с низким риском резистентности ТН вероятность излечения составляет 100%, для больных с высоким риском резистентности без метастазов в ЦНС и печени — 90%, при поражении печени и головного мозга излечение возможно в 50–80% случаев. Частота излечения больных с рецидивом ЗТО — 75%.
Прогноз при ТН у абсолютного большинства больных определяется выбором начальной химиотерапии, которая в настоящее время стандартная и принята всеми трофобластическими центрами мира.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Мещерякова Л.А. Злокачественные трофобластические опухоли: современная диагностика, лечение и прогноз: Дис… дра мед. наук. — М., 2005.
Чекалова М.А. Ультразвуковая диагностика злокачественных опухолей тела матки: Автореферат дис... д-ра мед.
наук. — М., 1998. — С.18–31.
Berkowitz R.S., Goldstein D.P. Gestational trophoblastic neoplasia // Cancer medicine. — 1997. — N 4(II). — P. 2327–2336. Berkowitz R.S. et al. Management of gestational trophoblastic disease: Subsequent pregnancy experience // Semin. Oncol. — 2000. — N 27. — P. 678.
Cohn D.E., Herzog T.J. Gestational trophoblastic diseases: New standards for therapy // Curr. Opin. Oncol. 2000. — N 12. — P. 492.
Kim S.J. Placental site trophoblastic tumour. Best Pract. Res // Clin. Obstet. Gynaecol. — 2003. — Vol. 17, N 6. — P. 969– 984.
Lai C.H., Yen T.C., Chang T.C. Positron emission tomography imaging for gynecologic malignancy // Curr. Opin. Obstet. Gynecol. — 2007. — Vol. 19, N 1. — P. 37–41.
Ngan H.Y. The practicability of FIGO 2000 staging for gestational trophoblastic neoplasia // Int. J. Gynecol. Cancer. — 2004. — Vol. 14, N 2. — P. 202–205.
Soper J.T. Gestational trophoblastic disease // Obstet. Gynecol. — 2006. — Vol. 108, N 1. — P. 176–187.
