
- •Оглавление
- •СПИСОК СОКРАЩЕНИЙ
- •ПОДРОБНОЕ СОДЕРЖАНИЕ
- •ГЛАВА 02. ДЕМОГРАФИЧЕСКАЯ СИТУАЦИЯ В РОССИЙСКОЙ ФЕДЕРАЦИИ. ОБЩИЕ И ЧАСТНЫЕ АСПЕКТЫ
- •ГЛАВА 03.МАТЕРИНСКАЯ И ПЕРИНАТАЛЬНАЯ ЗАБОЛЕВАЕМОСТЬ И СМЕРТНОСТЬ. СТРАТЕГИЯ РИСКА В АКУШЕРСТВЕ И ПЕРИНАТОЛОГИИ
- •ГЛАВА 04.ПОСЛЕДИПЛОМНАЯ ПОДГОТОВКА ВРАЧЕЙ АКУШЕРОВГИНЕКОЛОГОВ В КОНТЕКСТЕ БОЛОНСКОЙ ДЕКЛАРАЦИИ
- •ГЛАВА 05.ДЕОНТОЛОГИЯ В АКУШЕРСТВЕ
- •ГЛАВА 07. ИЗМЕНЕНИЯ В ОРГАНИЗМЕ ЖЕНЩИНЫ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ГЛАВА 08. РАЦИОНАЛЬНОЕ ПОВЕДЕНИЕ ЗДОРОВОЙ ЖЕНЩИНЫ В ПЕРИОД БЕРЕМЕННОСТИ
- •ГЛАВА 09. КЛИНИЧЕСКИЕ МЕТОДЫ ОБСЛЕДОВАНИЯ БЕРЕМЕННЫХ
- •ГЛАВА 10. ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ.
- •ГЛАВА 11. ИНСТРУМЕНТАЛЬНЫЕ НЕИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ.
- •ГЛАВА 12.ИНСТРУМЕНТАЛЬНЫЕ ИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ
- •ГЛАВА 13. ПРИНЦИПЫ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ В АКУШЕРСТВЕ
- •ГЛАВА 14. ХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
- •ГЛАВА 15. ФАРМАКОТЕРАПИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
- •ГЛАВА 16.ВЕДЕНИЕ ФИЗИОЛОГИЧЕСКОЙ БЕРЕМЕННОСТИ
- •ГЛАВА 17. ФИЗИОЛОГИЧЕСКИЕ РОДЫ
- •ГЛАВА 18.ФИЗИОЛОГИЧЕСКОЕ ТЕЧЕНИЕ ПОСЛЕРОДОВОГО ПЕРИОДА И ПЕРИОДА НОВОРОЖДЁННОСТИ
- •ГЛАВА 19.БЕРЕМЕННОСТЬ У НЕСОВЕРШЕННОЛЕТНИХ
- •ГЛАВА 20.ТАКТИКА ВЕДЕНИЯ БЕРЕМЕННОСТИ ПОСЛЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ
- •ГЛАВА 21. МНОГОПЛОДНАЯ БЕРЕМЕННОСТЬ
- •ГЛАВА 22. САМОПРОИЗВОЛЬНЫЙ АБОРТ (ВЫКИДЫШ)
- •ГЛАВА 23. ПРИВЫЧНОЕ НЕВЫНАШИВАНИЕ БЕРЕМЕННОСТИ
- •ГЛАВА 24. НЕРАЗВИВАЮЩАЯСЯ БЕРЕМЕННОСТЬ
- •ГЛАВА 25. ПРЕЖДЕВРЕМЕННЫЕ РОДЫ
- •ГЛАВА 26. ПЕРЕНАШИВАНИЕ БЕРЕМЕННОСТИ
- •ГЛАВА 27. ПЛАЦЕНТАРНАЯ НЕДОСТАТОЧНОСТЬ
- •ГЛАВА 28. ЗАДЕРЖКА РОСТА ПЛОДА
- •ГЛАВА 29. ПАТОЛОГИЯ ОКОЛОПЛОДНЫХ ВОД
- •ГЛАВА 30. АНОМАЛИИ ПУПОВИНЫ, ОСЛОЖНЯЮЩИЕ ТЕЧЕНИЕ РОДОВ И УХУДШАЮЩИЕ ПЕРИНАТАЛЬНЫЙ ИСХОД
- •ГЛАВА 31. ТОКСИКОЗЫ БЕРЕМЕННЫХ И ГЕСТОЗ
- •ГЛАВА 32. НАСЛЕДСТВЕННЫЕ ДЕФЕКТЫ СИСТЕМЫ ГЕМОСТАЗА
- •ГЛАВА 33. АНТИФОСФОЛИПИДНЫЙ СИНДРОМ
- •ГЛАВА 34. HELLP-СИНДРОМ
- •ГЛАВА 35. СИНДРОМ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЁРТЫВАНИЯ КРОВИ
- •ГЛАВА 36. ЭМБОЛИЯ ОКОЛОПЛОДНЫМИ ВОДАМИ
- •ГЛАВА 37. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ВЕН
- •ГЛАВА 38. ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЁННОГО
- •ГЛАВА 40. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ КРОВИ
- •ГЛАВА 41. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ОРГАНОВ ДЫХАНИЯ
- •ГЛАВА 42. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ОРГАНОВ ПИЩЕВАРЕНИЯ
- •ГЛАВА 43. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ПОЧЕК И МОЧЕВЫВОДЯЩИХ ПУТЕЙ
- •ГЛАВА 44. БЕРЕМЕННОСТЬ И ОФТАЛЬМОЛОГИЧЕСКИЕ ОСЛОЖНЕНИЯ
- •ГЛАВА 45. БЕРЕМЕННОСТЬ И ЭНДОКРИННАЯ ПАТОЛОГИЯ. БЕРЕМЕННОСТЬ И БОЛЕЗНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- •ГЛАВА 46. БЕРЕМЕННОСТЬ И ДЕПРЕССИВНЫЕ СОСТОЯНИЯ
- •ГЛАВА 47. БЕРЕМЕННОСТЬ И ПСИХОАКТИВНЫЕ ВЕЩЕСТВА
- •ГЛАВА 48. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ГЛАВА 49 БЕРЕМЕННОСТЬ И ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ МАЛОГО ТАЗА
- •ГЛАВА 50. БЕРЕМЕННОСТЬ И ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
- •ГЛАВА 51. БЕРЕМЕННОСТЬ И ХИРУРГИЧЕСКАЯ ПАТОЛОГИЯ
- •ГЛАВА 52. ПАТОЛОГИЧЕСКИЕ РОДЫ
- •ГЛАВА 53. КРОВОТЕЧЕНИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
- •ГЛАВА 54 .ПАТОЛОГИЯ ПОСЛЕРОДОВОГО ПЕРИОДА
- •ГЛАВА 55. РОДОВОЙ ТРАВМАТИЗМ
- •ГЛАВА 56. ВНУТРИУТРОБНАЯ ИНФЕКЦИЯ
- •ГЛАВА 57. ВРОЖДЁННЫЕ ПОРОКИ РАЗВИТИЯ
- •ГЛАВА 58 .АСФИКСИЯ НОВОРОЖДЁННОГО
- •ГЛАВА 59. РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ НОВОРОЖДЁННЫХ
- •ГЛАВА 60. ИНФЕКЦИИ НОВОРОЖДЁННЫХ
- •ГЛАВА 61. РОДОВЫЕ ТРАВМЫ ПЛОДА И НОВОРОЖДЁННОГО
- •ПРИЛОЖЕНИЕ. БЕЗОПАСНОСТЬ ИСПОЛЬЗОВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ПРАВА БЕРЕМЕННЫХ ЖЕНЩИН И КОРМЯЩИХ МАТЕРЕЙ
ГЛАВА 48. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ВО ВРЕМЯ БЕРЕМЕННОСТИ
48.1. БЕРЕМЕННОСТЬ И БАКТЕРИАЛЬНЫЙ ВАГИНОЗ
Под термином «бактериальный вагиноз» понимают общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа, характеризующийся чрезмерно высокой концентрацией облигатно и факультативно анаэробных условнопатогенных микроорганизмов и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища.
Современный термин «бактериальный вагиноз» был предложен в 1984 г. на первом Международном симпозиуме по вагинитам в Швеции. Бактериальным синдром называют из-за повышения количества аэробных и анаэробных бактерий (с преобладанием последних) во влагалище, а термин «вагиноз» обусловлен отсутствием лейкоцитов (клеток, ответственных за воспаление).
СИНОНИМЫ
Гарднереллёз (устаревшее).
КОД ПО МКБ-10
Отсутствует.
ЭПИДЕМИОЛОГИЯ
Бактериальный вагиноз регистрируют у 5–17% практически здоровых женщин и у 30–38% пациенток, предъявляющих жалобы на выделения из половых путей, посещающих женские консультации и специализированные клиники для лечения ИППП. Бактериальный вагиноз достоверно чаще развивается у женщин моложе 25 лет. Он связан с факторами риска ИППП (множество половых партнеров, недавняя смена полового партнера). Среди беременных женщин от 10 до 46% больных БВ. Исследования последних лет свидетельствуют о возрастании числа сочетанных форм БВ и кандидоза.
ЭТИОЛОГИЯ
Этиология бактериального вагиноза не всегда ясна. В возникновении БВ существенная роль наряду с G. vaginalis принадлежит ассоциации различных анаэробных микроорганизмов, таких, как Mobiluncus, Bacteroides и др., концентрация которых возрастает в несколько раз и достигает 1010 КОЕ/мл. Многообразие микроорганизмов, участвующих в развитии данного заболевания, характеризует термин «бактериальный», а в связи с отсутствием в отделяемом влагалища лейкоцитов (клеток, ответственных за развитие воспалительной реакции) произошло изменение термина «вагинит» на термин «вагиноз».
ПАТОГЕНЕЗ
Дисбиоз влагалища обусловлен нарушением физиологического взаимодействия микроорганизмов. Патогенез осложнений гестации
В результате восходящей инфекции возможно развитие воспалительных процессов в верхних отделах мочеполовой системы, в оболочках плода и АЖ при беременности, что приводит к поздним выкидышам, преждевременным родам, ЗРП, хориоамниониту.
При бактериальном вагинозе возможны инфекционные осложнения после акушерских и гинекологических операций, в частности послеоперационный тазовый целлюлит, эндометрит и другие ВЗОМТ.
КЛИНИЧЕСКАЯ КАРТИНА
Пациенток беспокоят обильные жидкие гомогенные серовато-белые влагалищные выделения, имеющие неприятный «рыбный запах». Примерно у 35–50% больных заболевание протекает бессимптомно: они либо не отмечают выделений или какихлибо других субъективных симптомов, либо рассматривают их как норму или связывают с нарушением правил личной гигиены.
Осложнения гестации У беременных вследствие восходящей инфекции возможно инфицирование плодных оболочек и ОВ, что бывает
причиной самопроизвольных выкидышей и преждевременных родов. Плод может инфицироваться как антенатально, так и интранатально. При наличии осложнений беременности в анамнезе (ПРПО, рождение плода с низкой массой тела, мертворождение, эндометриты, преждевременные роды, недоношенность) целесообразно проводить исследования с целью диагностики бактериального вагиноза в сроки 12–16 нед.
ДИАГНОСТИКА
Диагноз должен устанавливать врач на приёме.
Выделяют следующие критерии диагностики бактериального вагиноза.
·Жалобы на обильные выделения с неприятным запахом.
·Наличие «ключевых» клеток при микроскопии влагалищного мазка.
·pH влагалищного содержимого менее 4,5.
·Положительный аминный тест (при добавлении капли 10% раствора гидроксида калия к влагалищным выделениям
появляется специфический неприятный запах, обусловленный выделением летучих аминов — продуктов метаболизма анаэробных микроорганизмов).
Наличие трёх из четырёх признаков позволяет поставить диагноз. Обследование на бактериальный вагиноз проводят у следующих групп лиц.
·Женщины с фоновыми процессами шейки матки (эрозия, эктопия, лейкоплакия, эндоцервицит и эндометриоз шейки матки с частым рецидивированием патологического процесса после проведённой терапии).
·Женщины, имеющие в анамнезе указания на поздние выкидыши, преждевременные роды, инфекционные осложнения во время беременности.
·Пациентки, направляемые на прерывание беременности.
·Беременных обследуют 3 раза (при постановке на учёт, при сроке 27–30 нед и 36–40 нед беременности). Вне указанных сроков обследование беременных проводят по показаниям (появление выделений из половых путей, субъективные жалобы и др.).
· В родильных домах обследуют всех рожениц без обменных карт, родильниц с осложнённым течением послеродового периода, лучше через 5–6 сут после родов.
АНАМНЕЗ
При сборе анамнеза обращают внимание на наличие в прошлом бактериального вагиноза, СД, других эндокринопатий, длительного лечения антибактериальными лекарственными средствами, применения гормональных методов контрацепции.
У пациенток отмечают следующие жалобы.
·Жидкие, беловато-серые влагалищные выделения, количество которых обычно незначительно. При длительно текущем процессе выделения приобретают желтоватозелёноватую окраску, становятся более густыми, пенистыми.
·Неприятный запах выделений (запах «тухлой рыбы»), который усиливается или появляется после полового контакта, а также во время менструации.
Эти симптомы могут сохраняться годами. Дискомфорт, зуд, жжение, дизурия, диспареуния обычно не беспокоят.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
·Наличие гомогенных выделений, тягучих и липких, равномерно распределяющихся по стенкам влагалища. Их количество варьирует от скудного до весьма обильного.
·Неприятный запах выделений усиливается при добавлении к влагалищному отделяемому раствора конгидроксида калия («аминный» тест).
·Повышение pH влагалищного отделяемого более 4,5.
Гиперемии слизистой оболочки и других признаков воспаления не отмечают.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
В случае, когда врач акушер-гинеколог не владеет методами прямой «Bed Side» микроскопии, материал, взятый из влагалища, направляют в лабораторию. Выделяют ряд правил взятия клинического материала для исследования: материал берут с боковых стенок влагалища при осмотре в зеркалах, помещают на 2 предметных стекла, высушивают на воздухе и направляют в лабораторию для исследования.
· Основной метод лабораторной диагностики — микроскопический. Изучают влажные (нативные) препараты выделений, а также делают мазок для окрашивания метиленовым синим. При бактериальном вагинозе отмечают следующие показатели влагалищного мазка.
G Отсутствие в мазке лейкоцитов и лактобацилл (или скудное их количество).
G Обильное количество бактерий, покрывающих всё поле зрения: мелкие коккобактерии, кокки, вибрионы.
G Наличие «ключевых» клеток — клеток плоского влагалищного эпителия, покрытых множеством бактерий вследствие прямой адгезии на поверхность клетки, а также «суперадгезии» на адгезированные микробные клетки.
Втабл. 48-1 представлены особенности микрофлоры влагалища в норме и при бактериальном вагинозе.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Всвязи с тем, что пациентки в основном жалуются на выделения из влагалища, необходима дифференциальная диагностика с вульвовагинитом (кандидозным, трихомонадным, неспецифическим), с цервицитом (гонококковым, хламидийным, бактериальным).
Таблица 48-1. Некоторые особенности микрофлоры влагалища в норме и при бактериальном вагинозе
|
Показатели |
|
Нормальная |
Бактериальный вагиноз |
|
|
|
|
микрофлора влагалища |
|
|
|
|
|
|
||
Преобладающая |
|
Род Lactobacillus (90–95%) |
Полимикробная, в основном анаэробная микрофлора (роды |
||
микрофлора |
|
|
|
Bacteroides, Peptostreptococcus, Fusobacterium) |
|
|
|
|
|
||
Степень колонизации |
107 КОЕ/мл |
|
109–1011 КОЕ/мл |
||
|
|
|
|
|
|
pH влагалища |
|
3,8–4,2 |
|
Более 4,5 |
|
|
|
|
|
||
Соотношение анаэробов к |
Анаэробов |
больше |
Анаэробов больше аэробов в 100–1000 раз |
||
аэробам |
|
аэробов в 2–5 раз |
|
|
|
|
|
|
|
||
Доля Gardnerella vaginalis |
5–60% |
|
Более 90% |
||
|
|
|
|
|
|
Доля |
видов |
рода |
До 5% |
|
50–70% |
Mobiluncus |
|
|
|
|
|
|
|
|
|
||
Доля Mycoplasma hominis |
15–30% |
|
65–75% |
||
|
|
|
|
|
|
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Бактериальный вагиноз.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Лечение должно быть направлено на купирование симптомов заболевания и нормализацию микробиоценоза влагалища.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Диета, направленная на восполнение молочнокислых бактерий кишечника.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В связи с тем, что при бактериальном вагинозе в микрофлоре влагалища преобладают анаэробные микроорганизмы (пептококки, пептострептококки, вибрионы рода Mobiluncus, гарднереллы, бактероиды и другие), в первую очередь назначают антибактериальные лекарственные средства, действующие на анаэробы.
В первой половине беременности проводят исключительно местную терапию, поскольку системная терапия противопоказана. В ранние сроки беременности назначают 2% крем клиндамицина интравагинально (5 г разовая доза). Препарат вводят во влагалище с помощью прилагаемого аппликатора 1 раз в сутки перед сном в течение 3 сут. Со второй половины беременности возможно применение системных препаратов, таких, как орнидазол по 500 мг 2 раза в сутки в течение 5 сут. В качестве альтернативных лекарственных средств используют комплексный препарат тернидазол + неомицин +нистатин преднизолон (тержинан©) интравагинально по 1 таблетке перед сном в течение 10 сут.
После завершения терапии одним из вышеперечисленных препаратов показано лечение, направленное на нормализацию микробиоценоза влагалища и повышение местного иммунитета с помощью эубиотиков (лактобактерии ацидофильные и др.).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Не проводят.
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ
Профилактика и прогнозирование осложнений гестации заключается в своевременном лечении бактериального вагиноза во время беременности.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
При бактериальном вагинозе госпитализация не показана.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Эффективность элиминации анаэробов оценивают через 7–10 сут после окончания терапии — повторяют стандартное обследование. В целом же эффективность терапии можно оценить через 4–6 нед. Критерием излеченности считают восстановление нормобиоценоза влагалища.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
·Бактериальный вагиноз — дисбактериоз влагалища, а не венерическое заболевание, поэтому лечение полового партнера не проводят.
·Необходимо обсудить с пациенткой возможность и необходимость обследования её на другие ИППП. Рекомендуют
провести вакцинацию против гепатита B.
· Показано выявление предрасполагающих факторов и их устранение.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Гинекология от пубертата до постменопаузы / Под ред. Э.К. Айламазяна. — М.: Медпрессинформ, 2004. — 448 с. Основы микроскопии мазков мочеполового тракта / Вагорас А. и др. — Каунас: КАТА, 2001. — 42 с.
Дмитриев Г.А. Лабораторная диагностика бактериальных урогенитальных инфекций / Г.А. Дмитриев. — М.: Медицинская книга, 2003. — 336 с.
Савичева А.М. Бактериальный вагиноз: принципы диагностики и терапии / А.М. Савичева // Медлайн экспресс. — 2003. — №10. — С. 9–11.
Савичева А.М., Соколовский Е.В., Домейка М. Краткое руководство по микроскопической диагностике инфекций, передаваемых половым путем / А.М. Савичева, Е.В. Соколовский, М. Домейка. — СПб.: Фолиант, 2004. — 128 с. Инфекции, передаваемые половым путем: Руководство для врачей / Соколовский Е.В. и др. — М.: Медпрессинформ, 2006. — 256 с.
Canadian STD Guidelines. — Canada, 1998. — 239 р.
Radcliffe K. European STD Guidelines / K. Radcliffe // International Journal of STD AIDS. — 2001. — Vol. 12, Suppl. 3. — 107 p.
Guidelines for the Management of Sexually Transmitted Infections. — WHO, 2001. — 79 p.
Van Dick E., Meheus A.Z., Piot P. Laboratory diagnosis of sexually transmitted diseases / E. Van Dick, A.Z. Meheus, P. Piot. — WHO, 1999. — 135 p.
Wentworth B.B., Judson F.N., Gilchrist M.J.R. Laboratory methods for the diagnosis of sexually transmitted diseases / B.B. Wentworth, F.N. Judson, M.J.R. Gilchrist. — USA: St. Mary’s Press, APHA, 1991. — 340 p.
Ison C.A., Savage M., Taylor-Robinson D. Microscopy for STIs / C.A. Ison, M. Savage, D. Taylor-Robinson. — London: Yale Press Ltd., 2001. — 36 p.
Monif G.R.G., Baker D.A. Infectious Diseases in Obstetrics and Gynecology / G.R.G. Monif, D.A. Baker — 5th ed. — London: The Parthenon Publishing Group, 2004. — 723 p.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva, World Health Organization, 2005. —186 р.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions / STI. — 1999. — Vol. 75, Suppl. 1. — 89 p.
48.2. УРОГЕНИТАЛЬНЫЙ КАНДИДОЗ ВО ВРЕМЯ БЕРЕМЕННОСТИ Урогенитальный кандидоз — поражение слизистых оболочек урогенитального тракта (вульвы, влагалища, уретры) дрожжеподобными грибами рода Candida.
СИНОНИМЫ
Кандидозный вульвовагинит.
КОД ПО МКБ-10
В37 Кандидоз.
В37.3+ Кандидоз вульвы и вагины.
В37.4+ Кандидоз других урогенитальных локализаций.
ЭПИДЕМИОЛОГИЯ
Кандидозное поражение слизистой оболочки влагалища (кандидозный вагинит) — распространённое заболевание женщин репродуктивного возраста. Около 70% женщин хотя бы раз в жизни перенесли его. У 40–50% женщин случаются повторные эпизоды заболевания, а у 5% — развивается хронический рецидивирующий кандидоз. Наряду с клинически выраженным заболеванием существует бессимптомная форма колонизации влагалища дрожжеподобными грибами.
Кандидоз не передается половым путём, но может свидетельствовать об изменениях иммунного и/или гормонального статуса.
КЛАССИФИКАЦИЯ
·;Острый урогенитальный кандидоз.
·;Хронический (рецидивирующий) урогенитальный кандидоз. ·;Урогенитальный кандидоз, вызванный не Candida albicans.
ЭТИОЛОГИЯ
Возбудители урогенитального кандидоза — дрожжеподобные грибы Candida, относятся к семейству Cryptococcaceae класса несовершенных грибов Deuteromycota, так как не имеют половых форм размножения и половых спор. Морфологически они представляют собой одноклеточные микроорганизмы, имеют круглую или овальную форму, образуют при линейном расположении почкующихся элементов нитевидные формы — гифы и псевдогифы. Как все эукариоты, грибы рода Candida имеют оформленное ядро, иногда несколько ядер, клеточную стенку, содержащую хитин и целлюлозу. Величина дрожжевой клетки 3–4 мкм, псевдогифов 5–10 мкм. Так же кандиды образуют истинные гифы, имеющие параллельные стенки и септы, в отличие от псевдогифов, которые сужаются на концах.
При исследовании вагинального отделяемого часто выделяют вид Candida albicans (около 90%), а также и другие виды этого рода — C. tropicalis, C. kefyr, C. krusei, C. lusitaniae, C. parapsilosis, C. guillermondii, C. glabrata. В последние годы C. glabrata описывают как опасного возбудителя внутрибольничной инфекции.
Дрожжеподобные грибы рода Candida — условно патогенные, бесспоровые диморфные грибы, факультативные анаэробы. Они хорошо переносят высушивание и замораживание, размножаются многополярным почкованием. При инвазии тканей грибы рода Candida трансформируются в тонкие нитчатые формы, образуя в результате незавершённого почкования дрожжевых клеток псевдомицелий. При этом сформировавшаяся дочерняя клетка сохраняет связь с материнской за счет узкого перешейка.
Грибы рода Candida обнаруживают в воздухе, почве, на овощах, фруктах, кондитерских изделиях. Они входят в состав нормальной микрофлоры кишечника, слизистой оболочки рта, наружных половых органов и зон, прилегающих к естественным отверстиям, которые связаны с резервуарами грибов рода Candida. Так, носительство грибов рода Candida на слизистой оболочке рта имеют около 50% клинически здоровых лиц. Небольшое количество дрожжевых клеток в стуле (от 100 до 1000 на 1 г кала) обнаруживают у клинически здоровых лиц. На остальных участках кожи и в бронхиальном тракте у здоровых лиц они высеиваются редко и в малом количестве. Другие представители нормальной микрофлоры находятся с грибами рода Candida в конкурентных взаимоотношениях.
ПАТОГЕНЕЗ
Колонизация дрожжеподобными грибами рода Candida слизистых оболочек половых органов, как и манифестный кандидоз, — проявление ослабления защиты организма хозяина. Наиболее подвержены этому заболеванию новорождённые, пожилые люди или тяжело больные. Кандидоз — «болезнь больных». К эндогенным предрасполагающим факторам относят эндокринные заболевания (гиперкортицизм, СД, ожирение, гипотиреоз и гипопаратиреоз), тяжёлые общие заболевания (лимфома, лейкемия, ВИЧ–инфекция и др.), осложнённую беременность. Развитию кандидоза способствует применение антибиотиков широкого спектра действия, глюкокортикоидов, цитостатиков, гормональная контрацепция, ряд экзогенных факторов, таких, как повышенная температура и избыточная влажность, приводящие к мацерации кожи и слизистых оболочек, микротравмы, повреждение химическими веществами и др. Воздействие одновременно нескольких предрасполагающих факторов (эндогенных и экзогенных) существенно увеличивает риск развития кандидоза.
Инфицирование плода и новорождённого обычно происходит интранатально при прохождении через инфицированные родовые пути матери. Доказан трансплацентарный и восходящий пути заражения (врождённый кандидоз). Возможно развитие постнатального кандидоза у новорождённых. Инфицированию плода и новорождённого способствует наличие кандидозного вульвовагинита у матери, особенно в третьем триместре беременности, наличие у неё сопутствующих заболеваний, особенно СД.
Кандидоз у взрослых обычно возникает в результате аутогенного суперинфицирования, реже экзогенного (генитальная, перигенитальная области). Дисбактериоз и нарушение защитной системы слизистой оболочки и кожи способствуют адгезии микроорганизма к эпителиоцитам и проникновению его через эпителиальный барьер.
У большинства женщин присутствие Candida albicans вызывает высвобождение цитокинов, которые активируют фагоциты к поглощению и разрушению микроорганизмов. К тому же интерферон-g подавляет способность Candida albicans превращаться в инвазивные формы. Таким образом, иммунный ответ предупреждает пролиферацию микробных клеток до уровня, при котором клинические симптомы не развиваются. Нарушение продукции цитокинов приводит к кандидозу даже при незначительном количестве клеток дрожжеподобных грибов в составе микрофлоры влагалища. Это часто происходит при рецидивирующем кандидозном вульвовагините.
Патогенез осложнений гестации Возможно развитие восходящей инфекции с антенатальным инфицированием плода.
КЛИНИЧЕСКАЯ КАРТИНА
Кандидоз характеризуется образованием беловатого налета (молочница) на гиперемированной слизистой оболочке вульвы и влагалища. Появляются характерные «творожистые» белые выделения. Больных беспокоит мучительный зуд и жжение. Возможно жжение вульвы при мочеиспускании и болезненность при половом акте. Поражение вульвы и влагалища дрожжеподобными грибами отличается большим упорством и склонностью к рецидивам. При хронически рецидивирующем заболевании часто наблюдается обострение перед началом менструации.
Редко встречается кандидозный уретрит.
У новорождённых клинические проявления заболевания развиваются сразу после рождения (при врождённом кандидозе), а также в более поздние сроки в виде локальных поражений кожи и слизистых оболочек или тяжёлых висцеральных поражений вплоть до сепсиса. Однако наиболее часто при наличии кандидозного вульвовагинита у матери ребёнок является носителем дрожжеподобных грибов.
ОСЛОЖНЕНИЯ ГЕСТАЦИИ
Возможно инфицирование плода и новорождённого с развитием внутриутробной инфекции.
ДИАГНОСТИКА
Диагноз ставят на основании клинической картины и микроскопических методов. Исследование нативных мазков из влагалища может проводить врач на приёме. Культуральные и молекулярнобиологические методы выделения дрожжеподобных грибов малоинформативны, так как грибы рода Candida могут находиться и во влагалище здоровых женщин.
АНАМНЕЗ
При рецидивирующем урогенитальном кандидозе важно наличие предрасполагающих факторов, таких, как СД, другая эндокринная патология, длительное лечение антибиотиками, цитостатиками, приём оральных контрацептивов.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Типичная клиническая картина заболевания: признаки воспаления, обильные специфические «творожистые» выделения, белые налеты на слизистой оболочке влагалища.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Микроскопический метод предпочтителен для постановки диагноза урогенитального кандидоза, поскольку у 20% здоровых женщин во влагалище присутствуют кандиды, которые вырастут при посеве, что послужит основанием для необоснованного диагноза кандидоза влагалища. Для микроскопии используют неокрашенные препараты, а также окрашенные по Граму, Романовскому–Гимзе и метиленовым синим. Основанием для диагноза служит обнаружение элементов гриба: единичных почкующихся клеток, псевдомицелия, других морфологических структур (бластоконидии, псевдогифы).
Культуральный метод используется при хроническом рецидивирующем течении заболевания, для идентификации дрожжеподобных грибов (особенно для выявления видов, не относящихся к Candida albicans), при изучении действия лекарственных противомикотических препаратов, при атипичном течении заболевания, когда исключены другие возможные возбудители.
Молекулярнобиологические методы (ПЦР) высоко чувствительны и специфичны, но имеют ограничения из-за присутствия дрожжеподобных грибов в составе микрофлоры влагалища в норме.
Методы ПИФ имеют ограничения вследствие большого количества ложно положительных результатов. Серологические методы не используются из-за низкой иммуногенности дрожжеподобных грибов.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Исследование проводится с использованием вагинального зеркала.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
В связи с тем, что основная жалоба пациенток – это наличие выделений из влагалища, дифференциальный диагноз следует проводить с бактериальным вагинозом и вульвовагинитом другой этиологии (трихомонадным, неспецифическим бактериальным), с цервицитом (гонококковым, хламидийным, бактериальным).
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Кандидоз вульвы и влагалища.
ЛЕЧЕНИЕ
Для назначения рационального лечения необходимо учитывать клиническую форму кандидоза, его распространенность и предрасполагающие факторы (общие и местные). При поверхностном кандидозе половых органов и перигенитальной области — степень обсемененности ЖКТ. При массивной колонизации ЖКТ грибами рода Candida целесообразно назначение препаратов натамицина, леворина, нистатина и др.
ЦЕЛИ ЛЕЧЕНИЯ
Лечение направлено на элиминацию дрожжеподобных грибов рода Candida и нормализацию клинической картины заболевания.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Не используется.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Во время беременности при любом сроке назначают местную терапию (табл. 48-2). Таблица 48-2. Интравагинальные препараты для лечения кандидозного вульвовагинита
Препарат |
Схема лечения |
|
|
Натамицин |
интравагинально по 1 свече перед сном в течение 3–6 дней |
|
|
Сертаконазол |
интравагинально 1 свеча однократно |
|
|
Эконазол |
интравагинально свеча 150 мг перед сном в течение 3 дней |
|
|
Для лечения кандидоза, вызванного не Candida albicans, применяют местную терапию азолами 7–14 дней. Кроме того, может быть использована борная кислота (600 мг в желатиновых капсулах) вагинально 1 раз в день в течение 2 нед.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Не проводят.
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ
Лечение инфекции во время беременности с целью профилактики передачи возбудителя плоду.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При наличии предрасполагающих факторов, таких, как иммунодефицитные состояния, болезни крови, новообразования, эндокринопатии и др., проводится консультация смежными специалистами.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Установленный диагноз – кандидоз – как самостоятельное заболевание госпитализации не требует.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Контроль излеченности не проводится. Инфекция считается излеченной, если у пациентки нет клинических проявлений. Выявление контактов, регистрация не требуются.
Лечение полового партнёра проводят только в том случае, если у него имеется кандидозный баланит/баланопостит.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Врач обсуждает с пациенткой возможность и необходимость обследования на другие ИППП, рекомендует вакцинацию против гепатита В.
Выявляют предрасполагающие и поддерживающие факторы и меры по их предотвращению, особенно при хроническом рецидивирующем процессе.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Айламазян Э.К., Потин В.Е., Тарасова М.А. и др. Гинекология от пубертата до постменопаузы / Под ред. акад. РАМН, проф. Э.К. Айламазяна. — М.: Медпрессинформ, 2006. —491 с.
Инфекции в акушерстве и гинекологии / Под ред. О.В. Макарова, В.А. Алешкина, Т.Н. Савченко. — М.: Медпресс– информ, 2007. — 464 с.
Прилепская В.Н. |
Генитальный кандидоз. Современные подходы к лечению // Акуш. и гинекол. — 1996. — №6. — |
С. 27–30. |
Соколовский Е.В., Домейка М. и др. Методические материалы по диагностике, лечению и |
Савичева А.М., |
профилактике наиболее распространённых инфекций, передаваемых половым путем / Методическое пособие. — СПб.: Издательство Н–Л., 2002. — 112 с.
Савичева А.М. Диагностика и лечение урогенитального кандидоза / Трудный пациент. — 2006. — №9. — Т. 4. — С. 28– 32.
Соколовский Е.В., Савичева А.М., Домейка М. и др. Инфекции, передаваемые половым путём / Руководство для врачей. — М.: Медпрессинформ, 2006. — 256 с.
Canadian STD Guidelines. – Canada, 1998. — 239 р.
European STD Guidelines / Ed.: K. Radcliffe // International Journal of STD AIDS. — 2001. — Vol. 12, Suppl 3. — 107 p. Guidelines for the Management of Sexually Transmitted Infections // WHO. — 2001. — 79 p.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections – a practical guide// WBS. — London, 1999. — 509 p.
Ludviksson D., Thorarensen O., Gudnason T., Halldorson S. Candida albicvans meningitis in a child with mieloperoxydase deficiency // Pediatr. Inf. Dis. — 1993. — Vol. 12. — P. 162–164.
Monif G.R.G, Baker D.A. Infectious Diseases in Obstetrics and Gynecology. – 5th Edition // The Parthenon Publishing Group. – London, 2004. — 723 p.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. – Geneva, World Health Organization. — 2005. — 186 р.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions. STI. —1999. — Vol. 75, Suppl. 1.
– 89 p.
48.3. УРЕАПЛАЗМЕННАЯ И МИКОПЛАЗМЕННАЯ ИНФЕКЦИЯ ПРИ БЕРЕМЕННОСТИ СИНОНИМЫ
Уреаплазмоз, микоплазмоз.
КОД ПО МКБ-10
A49.3 Инфекция, вызванная микоплазмой, неуточнённая.
ЭПИДЕМИОЛОГИЯ
Широкое распространение микоплазм среди здоровых женщин разного возраста позволило большинству исследователей рассматривать их как комменсалов в составе нормального вагинального микробиоценоза, способных при определённых условиях к реализации патогенных свойств. Это мнение подтверждают работы, свидетельствующие о том, что патогенность G. vaginalis, M. hominis, U. urealyticum и анаэробных бактерий связана с массивностью колонизации в очаге инфекции.
Известно, что колонизация новорождённых генитальными микоплазмами происходит при прохождении через родовые пути. Последовательные исследования показали постоянное уменьшение количества микроорганизмов в первый год жизни. Из мочеполовых органов маленьких девочек генитальные микоплазмы (в первую очередь U. urealyticum, реже M. hominis) выделяют значительно чаще, чем у мальчиков, а из глотки и носа — с одинаковой частотой, но преимущественно U. urealyticum.
В препубертатном возрасте генитальные микоплазмы у девочек обнаруживают в 5–22% случаев (8–17% приходится на M. hominis), а у мальчиков редко, значительно чаще их обнаруживают в этом возрасте у детей, подвергшихся сексуальному насилию: в 48% и 34% наблюдений, соответственно. Некоторые исследователи считают, что колонизация генитальными микоплазмами происходит только с началом половой жизни. Также существует мнение, что активная колонизация данными микроорганизмами урогенитального тракта происходит на фоне гормональных изменений вследствие повышения влияния эстрогенов и прогестерона. При достижении половой зрелости колонизация урогенитального тракта генитальными микоплазмами происходит при половых контактах и коррелирует с числом половых партнеров. При этом частота выделения генитальных микоплазм у женщин выше, а количество женщин и мужчин, колонизированных U. urealyticum выше, чем M. hominis.
В настоящее время считают, что M. genitalium — абсолютный патоген, вызывающий патологические состояния, приводящие к нарушению репродуктивной функции как у женщин, так и у мужчин.
Во время беременности частота обнаружения микоплазм увеличивается в 1,5–2 раза, а у женщин с привычным невынашиванием беременности этот показатель и вне беременности достаточно велик и составляет 24,4%. Можно предположить, что более частое обнаружение U. urealyticum у беременных зависит либо от гормонального фона, либо от изменений других условий среды их обитания, связанных с физиологическими процессами в организме человека, в частности от состояния иммунологической реактивности макроорганизма.
ЭТИОЛОГИЯ И КЛАССИФИКАЦИЯ
Микоплазмы выделены в самостоятельный класс Mollicutes из-за своеобразия биологических свойств, отличающих их от бактерий. Это мельчайшие из свободно живущих микроорганизмов, они не имеют клеточной стенки, не окрашиваются по Граму, резистентны к действию антибиотиков, подавляющих синтез клеточной стенки, культивируют эти микроорганизмы на специальных питательных средах.
Из 16 видов микоплазм, вегетирующих на слизистых оболочках человека, 4 вида преимущественно населяют мочеполовые органы. Это M. hominis, M. fermentans, M. genitalium, U. urealyticum, которых можно обнаружить как у
здоровых лиц обоего пола, так и при некоторых заболеваниях. Однако связь присутствия микоплазм с рядом заболеваний трудно доказать определённо, так как колонизация половых органов генитальными микоплазмами зависит от социальноэкономических условий жизни, особенностей сексуальной жизни и от других неизвестных
факторов, определяющих риск заболевания. |
|
|
|
|
|
|
||
Различают орофарингеальные и генитальные виды микоплазм (табл. 48-3). |
|
|
|
|
||||
Таблица 48-3. Основные виды микоплазм человека |
|
|
|
|
|
|
||
Виды микоплазм |
|
Первое сообщение о выделении |
|
Первичная область колонизации |
|
Патогенность |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ротоглотка |
|
Урогенитальный |
|
|
|
|
|
|
|
|
|
|
|
Mycoplasma hominis |
|
1937 |
|
+ |
|
+ |
|
+/- |
|
|
|
|
|
||||
Mycoplasma fermentans |
|
1952 |
|
+ |
|
+ |
|
? |
|
|
|
|
|
||||
Mycoplasma salivarium |
|
1953 |
|
+ |
|
- |
|
- |
|
|
|
|
|
||||
Ureaplasma urealyticum |
|
1954 |
|
+ |
|
+ |
|
+/- |
|
|
|
|
|
||||
Mycoplasma pneumoniae |
|
1962 |
|
+ |
|
- |
|
+ |
|
|
|
|
|
||||
Mycoplasma orale |
|
1964 |
|
+ |
|
- |
|
- |
|
|
|
|
|
||||
Mycoplasma genitalium |
|
1981 |
|
? |
|
+ |
|
+ |
|
|
|
|
|
||||
Mycoplasma spermatophilum |
|
1991 |
|
- |
|
+ |
|
- |
|
|
|
|
|
||||
Mycoplasma penetrans |
|
1991 |
|
- |
|
+ |
|
? |
|
|
|
|
|
|
|
|
|
К патогенным для человека микоплазмам относят только 2 вида: Mycoplasma pneumoniae и Mycoplasma genitalium. Для других видов микоплазм патогенность строго не доказана.
Таким образом, установлены следующие положения.
·M. genitalium — патогенный микроорганизм, способный вызывать уретрит у лиц обоего пола, цервицит.
·Другие микоплазмы (U. urealyticum, U. parvum, M. hominis) присутствуют на слизистых оболочках и в выделениях
урогенитального тракта у 40–80% практически здоровых лиц репродуктивного возраста в количестве менее
104 КОЕ/мл.
· U. urealyticum — условно патогенный микроорганизм, реализация патогенных свойств которого происходит при определённых условиях, способен вызывать уретриты у мужчин и циститы у женщин. В ассоциации с другими патогенными и/или условно патогенными микроорганизмами может принимать участие в развитии различных патологических состояний, в том числе бактериального вагиноза, вагинита, цервицита, ВЗОМТ, осложнений течения беременности, послеродовых и послеабортных осложнений.
·Роль U. parvum в этиопатогенезе воспалительных заболеваний органов урогенитальной системы в настоящее время не установлена.
·M. hominis — условно патогенный микроорганизм, реализация патогенных свойств которого происходит при
определённых условиях. Патогенез осложнений гестации
Восходящая инфекция из нижних отделов урогенитального тракта с проникновением микоплазм в ОВ и развитием хориоамнионита.
КЛИНИЧЕСКАЯ КАРТИНА
Хотя точных доказательств этиологической роли микоплазм нет, при ряде патологических процессов их роль предполагают, если нет других возможных возбудителей. Так, при синдромах уретрита, вульвовагинита, эндоцервицита, если нет других возбудителей, можно говорить о причастности к заболеванию обнаруженных в клинических материалах М. hominis и U. urealyticum. Наличие генитальных микоплазм в верхнем отделе половых органов у женщин может служить моментом, усугубляющим риск преждевременных родов и рождение детей с низкой массой тела.
M. hominis выделены в 1937 г. из абсцесса большой вестибулярной железы. Обычно M. hominis обнаруживают в вагинальном экссудате 50–60% практически здоровых женщин в низком количественном содержании. При бактериальном вагинозе частота и количественное содержание M. hominis увеличивается. При некоторых осложнениях послеродового периода M. hominis выделены из эндометрия и маточных труб.
На начальном периоде изучения роли M. hominis была установлена частая ассоциация обнаружения микроорганизмов и неблагоприятного течения беременности при преждевременных родах, самопроизвольных выкидышах, некоторых заболеваниях новорождённых детей. В настоящее время осложнения беременности и инфекцию у детей склонны связывать с другим видом генитальных мико-плазм — Ureaplasma urealyticum.
Mycoplasma hominis рассматривали как возможный этиологический агент негонококкового уретрита на протяжении последних 40 лет, однако проведенные масштабные исследования показали, что частота колонизации уретры данным микроорганизмом больных уретритом и здоровых лиц со сходным сексуальным анамнезом не имеет достоверных различий, что не позволило считать доказанной клиническое значение Mycoplasma hominis в развитии негонококкового уретрита.
Уреаплазмы описаны в 1954 г. при выделении этих микроорганизмов у чернокожих мужчин с негонококковым уретритом и без такового. В 1967 г. эти микроорганизмы были обнаружены при репродуктивной патологии. Первоначально Ureaplasma urealyticum называли T-микоплазмами. В 1982 г. описаны 14 серотипов U. urealyticum, в 1990 г. они были разделены на 2 геномные группы. В 2002 г. U. urealyticum биовар Parvo был выделен в отдельный вид U. parvum, а биовар T 960 — в U. urealyticum.
Такое разделение видов уреаплазм основано на анализе генов и, возможно, в будущем внесет ясность в разделение на патогенные и непатогенные виды возбудителя. Так, известно, что инвазивные штаммы в 79,4% наблюдений относят к Ureaplasma parvum и чаще они выделяются из ОВ женщин с неблагоприятным исходом беременности. Вид U. parvum содержит 3 подвида, но связь отдельных подвидов с патогенными свойствами и инвазивностью не доказана. Следует помнить, что у одного и того же пациента (пациентки) могут быть обнаружены несколько подвидов и серотипов уреаплазм. При ВЗОМТ U. urealyticum выделяют чаще.
Много внимания уделено изучению роли U. urealyticum в происхождении спонтанных абортов, мертворождении и рождении детей с низкой массой тела. Многочисленные публикации не дали безупречных доказательств причастности этих микроорганизмов к перечисленным патологическим состояниям, и данный вопрос нуждается в дополнительном изучении.
Mycoplasma genitalium описаны сравнительно недавно — в 1981 г. Детальное изучение биологических свойств микроорганизма затруднено в результате сложности его культивирования на питательных средах.
Известно, что целый ряд признаков Mycoplasma genitalium идентичны свойствам другого патогенного для человека вида микоплазм — Mycoplasma pneumoniae.
Есть сведения о таких урогенитальных заболеваниях, обусловленных M. genitаlium, как уретрит у мужчин и цервицит у женщин.
В ряде стран были проведены исследования, доказавшие связь Mycoplasma genitalium с развитием уретрита: Mycoplasma genitalium обнаружены у 23–25% больных с негонококковым уретритом и лишь у 6% здоровых мужчин, что свидетельствует об этиологическом значении данного микроорганизма в развитии уретрита. Подтверждением этих представлений служит эффективность лечения доксициклином больных уретритом при наличии
Mycoplasma genitalium.
Осложнения гестации Генитальные микоплазмы способны вызвать послеабортные и послеродовые осложнения, иногда довольно тяжёлые,
с повышением температуры тела, титра специфических АТ и С-реактивного белка. Восходящая инфекция характерна для преждевременных родов, при этом генитальные микоплазмы проникают в ОВ и при целом околоплодном пузыре. В этих случаях возникают воспалительные очаги в плодных оболочках и эндометрии, обусловленные U. urealyticum. Эти данные лежат в основе современного представления о роли U. urealyticum в происхождении самопроизвольных абортов и преждевременных родов.
Частота амниотической инфекции беременности при преждевременных родах тем выше, чем меньше срок. Однако бессимптомную бактериурию и бактериальный вагиноз значительно чаще, чем присутствие уреаплазм в половом тракте, расценивают как причину преждевременных родов. Восходящее инфицирование ОВ и возникающий воспалительный процесс ассоциируются с продукцией ИЛ и индукцией преждевременных родов.
Остается неясным вопрос, почему у одних беременных при наличии уреаплазм развивается восходящая инфекция, а у других нет. Возможно, играет роль высокая или низкая степень колонизации влагалища уреаплазмами.
Передача генитальных микоплазм от матери ребёнку происходит как антенатально, так и в родах. Колонизация кожных покровов, слизистых оболочек полости рта, глотки, мочеполовых органов обычно не сопровождается выраженными клиническими симптомами. Лишь у недоношенных детей уреаплазмы могут вызвать тяжёлые заболевания лёгких, головного мозга, иногда со смертельным исходом. Уреаплазмы у таких детей обнаруживают в ликворе, жидкости из желудочков мозга, трахеальном аспирате.
Чем выше количественное содержание уреаплазм в половых путях матери, тем чаще наблюдается колонизация ими новорождённых. К тому же степень колонизации строго коррелирует с неблагоприятным действием на мать, плод, новорождённого: ребёнок рождается с низкой массой тела, при этом чаще диагностируют хориоамнионит. При низком уровне колонизации влагалища генитальными микоплазмами не наблюдают влияния на исход беременности. Наблюдения тяжёлых поражений у недоношенных новорождённых, при которых обнаруживали генитальные микоплазмы, описаны преимущественно в 1990–1993 гг. и являются казуистическими.
ДИАГНОСТИКА
Показания к обследованию на M. genitalium:
·воспалительные процессы в нижних отделах мочеполового тракта;
·наличие осложнений (ВЗОМТ, бесплодие и пр.), возможных при инфицировании M. genitalium;
·обследование полового партнера пациента с обнаруженной M. genitalium;
·при смене полового партнера без использования барьерных методов защиты (презерватив);
·обследование женщин при планировании и во время беременности.
Показания к обследованию на другие микоплазмы (U. urealyticum, U. parvum, M. hominis):
·наличие клиниколабораторных признаков воспалительного процесса органов урогенитального тракта при отсутствии патогенных микроорганизмов;
·отягощённый акушерскогинекологический анамнез (невынашивание беременности, бесплодие, перинатальные
потери и др.); · осложнённое течение настоящей беременности, предполагающее возможное инфицирование плода.
АНАМНЕЗ
Возможны жалобы на выделения из влагалища.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При наличии микоплазменной инфекции при осмотре в зеркалах отмечают наличие слизисто-гнойных выделений и признаков воспаления влагалища или цервикального канала. При колонизации влагалища генитальными микоплазмами признаков воспаления нет.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Для обнаружения M. genitalium следует использовать молекулярнобиологические методы: ПЦР и другие методы амплификации нуклеиновых кислот.
Для других микоплазм используют методы, позволяющие произвести количественную оценку содержания микроорганизмов в исследуемом материале. Это культуральные методы, преимущественно с использованием плотных питательных сред и определением количества КОЕ, а также ПЦР в реальном времени. При использовании жидких питательных сред следует определять количество микоплазм.
Для исследования используют материал, полученный из уретры, влагалища, цервикального канала, а также мочу, секрет предстательной железы и эякулят.
Определение чувствительности микроорганизма к антибиотикам следует проводить при неэффективности терапии и рецидивировании процесса.
Ввиду низкой информативности серологических и иммунофлюоресцентных методов диагностики использовать их нецелесообразно.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальный диагноз следует проводить с вульвовагинитом (кандидозным, трихомонадным, неспецифическим), с цервицитом (гонококковым, хламидийным, бактериальным), бактериальным вагинозом.
Следует учитывать, что генитальные микоплазмы могут присутствовать в норме.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При развитии таких осложнений, как цистит, уретрит, необходима консультация уролога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Диагноз устанавливается в соответствии с МКБ-10.
Указывается топический диагноз с уточнением выявленного инфекционного агента (например, цервицит, обусловленный M. genitalium)
ЛЕЧЕНИЕ
Общие принципы лечения:
·лечение инфицированных пациентов предупреждает передачу инфекции половому партнёру, плоду и новорождённому, что особенно важно при выявлении M. genitalium;
·лечение должно быть эффективным (>95%) и обладать высокой комплаентностью;
·больных при обнаружении M. genitalium следует обследовать на наличие ИППП.
Показания к терапии при обнаружении M. genitalium:
·подтверждённая инфекция M. genitalium любой локализации;
·наличие M. genitalium у полового партнера;
·невозможность проведения тестов на M. genitalium у больных с клиническими симптомами воспалительных заболеваний нижних отделов мочеполового тракта.
При обнаружении U. urealyticum и M. hominis лечение следует назначить, если других возбудителей, кроме микоплазм,
не выявлено при:
·наличии клинических и лабораторных признаков воспалительного процесса органов мочеполовой системы;
·предстоящих оперативных или других инвазивных лечебнодиагностических манипуляциях в области мочеполовых
органов;
·отягощённом акушерскогинекологическом анамнезе (невынашивание беременности, бесплодие, перинатальные потери и т.д.);
·осложнённом течении настоящей беременности, предполагающем возможное инфицирование плода.
Лечение следует назначить при наличии клинических проявлений воспалительного процесса и в том случае, если U. urealyticum и M. hominis обнаружены в количестве более 104 КОЕ/мл.
ЦЕЛИ ЛЕЧЕНИЯ
Уменьшение клинических симптомов заболевания. Для M. genitalium — эрадикация возбудителя.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При лечении микоплазменной инфекции у беременных целесообразно назначение джозамицина в соответствии с инструкцией со второго триместра беременности.
Схема этиотропной терапии при выявлении микоплазм (по данным многоцентровых исследований по чувствительности к различным антибиотикам): джозамицин по 500 мг 2–3 раза в сутки в течение 7–10 дней. Этиотропная терапия при обнаружении M. genitalium: азитромицин по 1,0 г однократно или 500 мг 1 раз, затем по 250 мг в сутки 3 дня подряд или джозамицин по 500 мг 2–3 раза в сутки в течение 10 дней.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Контроль излеченности проводят пациентам при обнаружении M. genitalium через 4 нед после окончания терапии с использованием методов амплификации нуклеиновых кислот.
Если проводили лечение с целью элиминации других микоплазм, контролю излеченности подлежат пациенты с сохранившейся клинической симптоматикой воспалительного процесса и беременные.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Генитальные микоплазмы — условно патогенные микроорганизмы. Поэтому они могут присутствовать в отделяемом влагалища в норме.
Обнаружение генитальных микоплазм без наличия клинических симптомов заболевания и при нормальной картине микробиоценоза влагалища расценивают как носительство, не подлежащее лечению, а не заболевание. В этом случае половые партнёры также не подлежат лечению.
Только M. genitalium относят к патогенным микроорганизмам. При инфицировании этим микроорганизмом нужно проводить лечение как пациентки, так и её полового партнёра.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Айламазян Э.К., Потин В.В., Тарасова М.А. и др. Гинекология от пубертата до постменопаузы / Под ред. Э.К. Айламазяна. — М.: Медпрессинформ, 2006. — 491 с.
Башмакова М.А. Микоплазменные инфекции генитального тракта человека // Вестник АМН СССР. 1991. — Т. 6. —
С. 13–16.
Башмакова М.А., Савичева А.М. Генитальные микоплазмы и микоплазменные инфекции // Трудный пациент. — № 2. — Т. 4. — 2006. — С. 24–30.
Инфекции в акушерстве и гинекологии / Под ред. О.В. Макарова, В.А. Алешкина, Т.Н. Савченко. — М.: Медпрессинформ, 2007. — 464 с.
Кисина В., Прилепская В., Соколовский Е., Савичева А. и др. Роль микоплазм в урогенитальной патологии // Врач. — 2007. — № 2 — С. 2–6.
Прилепская В.Н., Кисина В.И., Соколовский Е.В., Савичева А.М. и др. К вопросу о роли микоплазм в урогенитальной патологии // Гинекология. — 2007. — 9(1). — С. 31–38.
Савичева А.М., Башмакова М.А. и др. Микоплазмы и микоплазменные инфекции гениталий // ИППП. — 1996. — № 2. — С. 28–33.
Ary O.P, Tong C.Y.W., Hart C.A. et al. Is Mycoplasma hominis a vaginal pathogen? // Sex. Transm. Inf. — 2001. — Vol. 77. — P. 58–62.
Calleri L., Taccani C., Porcelly A. Ureaplasma urealyticum vaginosis and premature rupture of membranes. What it is role? // Minerva Gyneol. — 2000. — Vol. 52. — P. 49–58.
Kong F., Zhang X. Detecting Mycoplasma hominis and Mycoplasma genitalium in the urogenital tract // Chung Hua. I. Hsuch Tsa. — Chih. — 1997. — Vol. 77. — N 2. — P. 94–96.
Maher C., Haran M., Farrell D. Ureaplasma urealyticum chorioamnionitis // Am. J. Obstet. Gyneol. — 1994. — Vol. 34. — P. 477–479.
48.4. БЕРЕМЕННОСТЬ И ХЛАМИДИЙНАЯ ИНФЕКЦИЯ Хламидийная инфекция — заболевание, относящееся к группе ИППП, характеризующееся многоочаговостью
поражения с вовлечением в воспалительный процесс органов половой сферы, а иногда суставов, органа зрения и дыхательных путей.
СИНОНИМЫ
Хламидиоз; урогенитальная хламидийная инфекция.
КОД ПО МКБ-10
·А55 Хламидийная лимфогранулёма (венерическая).
·А56 Другие хламидийные болезни, передающиеся половым путём.
·А56.0 Хламидийные инфекции нижних отделов мочеполовой системы.
·А56.1+ Хламидийные инфекции органов малого таза и других мочеполовых органов.
·А56.2 Хламидийная инфекция мочеполовой системы неуточнённая.
·А56.3 Хламидийная инфекция аноректальной области.
·А56.4 Хламидийный фарингит.
·А56.8 Хламидийные инфекции, передающиеся половым путём, другой локализации.
ЭПИДЕМИОЛОГИЯ
Хламидийная инфекция в структуре всех ИППП занимает одно из первых мест.
По наблюдениям европейских исследователей, 80% случаев острых воспалительных процессов в органах малого таза развивается в результате ИППП, 60% вызывает Chlamydia trachomatis.
Распространённость урогенитального хламидиоза колеблется в значительных пределах среди различных возрастных групп населения в разных регионах мира, однако повсюду это заболевание регистрируют значительно чаще, чем гонорею. Такому широкому распространению заболевания способствуют имеющиеся изменения в сексуальном поведении людей, наблюдаемые в последние десятилетия: раннее вступление в половую жизнь, частая смена партнёров, применение оральных контрацептивов, снижающих опасение за возникновение беременности, высокая мобильность населения и многочисленные контакты. Медленное развитие клинических проявлений заболевания, часто полное отсутствие выраженных симптомов приводят к запоздалому обращению к врачу либо к случайному установлению диагноза во время осмотров, особенно во время беременности. Бессимптомная инфекция встречается, в зависимости от локализации, с частотой до 80%.
Последствия генитального хламидиоза в виде хронических воспалительных заболеваний придатков матки, трубного бесплодия, эктопической беременности у женщин, а также неблагоприятное влияние хламидийной инфекции на течение и исход беременности для матери и плода — одна из главных проблем в структуре урогенитальных и системных заболеваний, всё это отражается на репродуктивной функции женщин. С 1994 года хламидиоз в России отнесён к группе заболеваний, подлежащих обязательному статистическому учёту.
КЛАССИФИКАЦИЯ
·Хламидийная инфекция нижних отделов половых путей.
·Хламидийная инфекция верхних отделов половых путей.
ЭТИОЛОГИЯ
Поражение половых путей вызывает вид Chlamydia trachomatis, относящийся к порядку Chlamydiales, семейству Chlamydiaceae, роду Chlamydia. Источник инфекции при урогенитальном хламидиозе — человек с острой или хронической формой заболевания, с манифестным или бессимптомным течением процесса.
Основные пути передачи инфекции — половой, контактнобытовой (редко), вертикальный (от матери плоду в родах или антенатально). Ввиду общности путей передачи возбудителей при ИППП хламидии часто встречаются в ассоциации с другими микроорганизмами, такими, как гонококки, трихомонады, микоплазмы, уреаплазмы и др.
ПАТОГЕНЕЗ
Хламидии имеют выраженный тропизм к цилиндрическому эпителию, выстилающему слизистую оболочку уретры, канала шейки матки, прямой кишки, конъюнктивы глаз и область носоглотки. Однако, как и гонококк, хламидии способны поражать вульву у новорождённых девочек, а также влагалищный свод у женщин после операции гистерэктомии.
Инфицирование происходит элементарными тельцами хламидий. Ретикулярные тельца такими свойствами не обладают.
Адгезия элементарных телец на мембране клетки-хозяина и проникновение их внутрь — первый этап взаимодействия хламидий с клеткой. Проникая в клетку, хламидии выключают её важнейший защитный механизм, препятствуя
слиянию лизосомы с фагоцитарной вакуолью. Внедряются элементарные тельца в клетку путём пиноцитоза (фагоцитоза), защищаясь от деструкции фагосомной мембраной. В клетке может одновременно находиться несколько элементарных телец, т.е. в цитоплазме клеток может оказаться несколько микроколоний хламидий. Находясь в эндоплазматической вакуоли (эндосоме), элементарные тельца последовательно через стадию промежуточных телец трансформируются в ретикулярные тельца, которые, в свою очередь, подвергаются бинарному делению. Впоследствии, по завершении периода роста и деления, ретикулярные тельца подвергаются обратной трансформации в элементарные тельца. Новообразованные элементарные тельца выходят из клетки, разрушая её, и инфицируют новые клетки.
Полный внутриклеточный цикл развития при исследовании in vivo продолжается 48–72 ч и зависит от нескольких факторов, в частности от штамма хламидий, природы клеток-хозяев и условий среды. Вне организма хламидии утрачивают инфекционные свойства через 24–36 ч при комнатной температуре, погибают от ультрафиолетового излучения, кипячения, действия дезинфектантов. В то же время установлена возможность сохранения инфекционности заражённого материала до двух суток при температуре 18–19 °С.
Изучение иммунного ответа при этой инфекции показало, что многие осложнения сочетаются с выраженными нарушениями иммунорегуляции. Иммунный ответ на хламидии многообразен и характеризуется продукцией IgМ, IgG, секретируемых IgА, медиаторов воспаления — цитокинов, таких, как интерферон, ИЛ-1, ИЛ-4, ИЛ-6, фактора некроза опухолей и многих других. Помимо гипериммуноглобулинемии в патогенезе хламидийной инфекции большую роль играют поликлональная активация В-лимфоцитов и реакция ГЗТ. При этом хламидии поглощаются периферическими фагоцитами. Моноциты оседают длительно в тканях, превращаясь в тканевые макрофаги, а находящиеся в них хламидии становятся антигенным стимулятором. Тип развития заболевания зависит от состояния иммунитета человека, массивности инфицирования, патогенности и вирулентности инфекционного агента и многих других причин. Осложнения урогенитального хламидиоза чаще всего сочетаются с выраженными нарушениями иммунорегуляции, в частности с уменьшением количества Т-лимфоцитов, Т-хелперов, ухудшением интерферонового статуса больного.
Исследованиями последних лет установлено, что присутствие хламидий сопровождается нарушением функциональной активности универсальных систем регуляции (иммунной, антиоксидантной, эндогенной опиатной, циклических нуклеотидов, ПГ, лейкотриенов), что в конечном итоге ведёт к хронизации процесса и множеству серьёзных осложнений. Наряду с острой инфекцией возможно развитие хронического процесса.
Особое внимание специалистов в последние годы было уделено изучению персистенции хламидий. У персистентных форм изменена не только морфология, но и экспрессия основных хламидийных Аг: обнаружено уменьшение синтеза основных клеточных компонентов, придающих особую прочность клеточной стенке: липополисахириды и МОМР (Mayor Outer Membrane Protein, белок клеточной стенки массой 60 кД). На этом фоне идёт непрерывный синтез белка теплового шока с молекулярной массой 60 кД. Этот белок играет большую роль в иммунопатогенезе персистирующей инфекции и поддержании постоянной воспалительной реакции. Присутствие белка теплового шока ведёт к:
·антигенной перегрузке организма и запуску вторичного гуморального ответа с гиперпродукцией IgG и IgА;
·активации реакции гиперчувствительности замедленного типа, обусловливающей инфильтрацию слизистых оболочек лимфоцитами и моноцитами;
·запуску аутоиммунного перекрёстного ответа, так как белок теплового шока — подобие белков эукариот;
·эффекту «теплового шока» у клетки-хозяина, стимуляции развития стресс-реакции у микроорганизма с остановкой клеточного цикла на стадии ретикулярных телец.
Активированные макрофаги также продуцируют ФНО-a, который опосредованно через ИЛ-1 активирует пролиферацию основных клеток соединительной ткани, способствует фибринообразованию, а также повышает
адгезивную способность лимфоцитов по отношению к эндотелию сосудов и реактивирует макрофаги.
Таким образом, основной механизм, препятствующий редифференциации ретикулярных телец в элементарные тельца, — действие особого спектра цитокинов, ведущее к дефициту компонентов и/или блокаде синтеза белков наружной мембраны элементарных телец хламидий под влиянием факторов, способствующих формированию персистентных форм.
Патогенез осложнений гестации Последствия хламидиоза у беременных проявляются в виде хронических воспалительных заболеваний мочеполовых
путей, шейки матки, патологии беременности с возможным инфицированием плода.
Наиболее часто развивается восходящая инфекция из нижних отделов мочеполовых органов с инфицированием ОВ и развитием хориоамнионита. Аспирация или заглатывание инфицированных ОВ ведёт к инфицированию лёгких, пищеварительного тракта плода с развитием инфекционного процесса ещё до рождения ребёнка. Это может происходить как при ПРПО, так и при интактных оболочках, например при рождении ребёнка путём операции КС. Инфицирование плода хламидиями происходит как внутриутробно (антенатально), так и при контакте с инфицированными родовыми путями во время родов (интранатально).
КЛИНИЧЕСКАЯ КАРТИНА
От 5% до 13% беременных в городах инфицированы хламидиями, у 4–11% генитальный хламидиоз протекает бессимптомно. Поскольку клинических симптомов, патогномоничных для генитального хламидиоза, в том числе и у беременных, не существует, оценку его частоты приходится проводить на основании данных лабораторного исследования по обнаружению хламидий в цервикальном канале.
Прогрессирование беременности при наличии урогенитального хламидиоза без назначения адекватного лечения увеличивает число перинатальных осложнений и заболеваний новорождённого. Наибольшие цифры недонашивания беременности отмечены у тех женщин, в сыворотке крови которых содержатся IgМ к хламидийному Аг, а в шеечном канале матки обнаружены C. trachomatis, что говорит о свежей активной инфекции. Наличие IgG в отсутствии IgМ в сыворотке крови и отсутствие C. trachomatis в цервикальном канале шейки матки свидетельствует о неактивной форме инфекции и об определённой степени иммунологической защиты организма, а соответственно, о меньшей степени влияния на плод.
Возможные осложнения беременности:
·преждевременные роды;
·самопроизвольные выкидыши;
· неразвивающаяся беременность.
Самая частая клиническая форма генитального хламидиоза у беременных, также как у небеременных, — цервицит, однако у беременных это заболевание клинической диагностике поддаётся труднее. Особого внимания у беременных заслуживает острый уретральный синдром, нередко связанный с хламидийным поражением шейки матки и уретры.
Эндометрит встречается в послеродовом или в послеабортном периоде. При остром процессе повышается температура до 38–39 °С, появляются боли внизу живота, обильные слизисто-гнойные выделения из канала шейки матки. Возможно и хроническое течение эндометрита без выраженной клинической симптоматики.
Частота инфицирования новорождённого при диагностированной инфекции у матери достигает 40–70%. Во время родов хламидии передаются при непосредственном контакте плода с инфицированными родовыми путями. У новорождённых и детей раннего детского возраста хламидии чаще всего поражают конъюнктиву и слизистую носоглотки. При этом развивается конъюнктивит, назофарингит и пневмония. В некоторых случаях хламидии вызывают гастроэнтерит, проктит, вульвит у девочек, уретрит у мальчиков.
ДИАГНОСТИКА
В связи с тем, что клинические проявления хламидиоза не патогномоничны, широкое распространение имеют бессимптомные формы заболевания, в диагностике этих инфекций первостепенное значение принадлежит лабораторным методам.
Обследованию на хламидийную инфекцию подлежат:
·женщины со слизисто-гнойными выделениями из цервикального канала, симптомами аднексита, бесплодием;
·лица, вступавшие в половой контакт с больным хламидийной инфекцией;
·лица, проходящие обследование на другие ИППП;
·новорождённые от матерей, перенёсших хламидийную инфекцию во время беременности.
Факторы и группы риска развития заболевания:
·проституция;
·сексуально активные подростки и женщины младше 25 лет;
·ранее перенесённые ИППП;
·контакт с больным хламидийной инфекцией или имеющим симптомы уретрита/цервицита.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При осмотре в зеркалах можно обнаружить признаки цервицита. В некоторых случаях клинические проявления заболевания отсутствуют.
Рекомендуют осматривать протоки парауретральных желёз, при симптомах слабо выраженного воспаления, ощущении боли или жжения при мочеиспускании назначать исследование на хламидии. Как правило, моча у таких женщин содержит лейкоциты и не содержит бактерий, поэтому пиурия у беременных в отсутствии бактерий в моче весьма подозрительна в плане хламидиоза, описанного в литературе под названием острый уретральный синдром.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Исследуемый материал у женщин — соскобы слизистых оболочек мочеполовых органов (уретра, цервикальный канал шейки матки), при экстрагенитальных формах — соскобы из прямой кишки, конъюнктивы, ротоглотки.
Качество полученного клинического материала зависит от физиологического состояния пациентки на момент взятия образца. Наиболее информативным может быть клинический материал, если он получен при следующих условиях:
·мазки взяты при наличии клинических признаков заболевания;
·пациентка не применяла местную терапию, как минимум, в течение последних 48–72 ч;
·пациентка не принимала душ в течение 24 ч;
·пациентка не принимала системные антибактериальные препараты в течение последних 3–4 нед.
Если нет возможности придерживаться упомянутых условий, то следует помнить, что все они могут повлиять на качество исследования и исказить его результаты.
Клинический материал можно получить с помощью ложки Фолькмана, специальной щёточки или ватного/дакронового тампона. Предпочтение во всех случаях следует отдавать дакроновым тампонам.
При проведении оперативных вмешательств возможно исследование операционных материалов (эндометрий, маточные трубы, спайки, перитонеальная жидкость и др.).
У новорождённых обычно исследуют отделяемое конъюнктивы, носоглотки, вульвы у девочек и первую порцию мочи у мальчиков. В случае смерти детей можно исследовать секционные материалы (трахея, лёгкие, печень, селезёнка и др.).
Такие методы диагностики, как выращивание в культуре клеток, ПИФ, ПЦР, ИФА используют для исследования материалов, полученных из цервикального канала, уретры, прямой кишки, носоглотки, конъюнктивы, биопсийных и операционных материалов. Для исследования первой порции мочи и отделяемого влагалища используют только метод ПЦР.
Среди методов лабораторной диагностики можно выделить методы определения возбудителя и его Аг, а также методы обнаружения специфического антительного ответа на C. trachomatis.
Методы обнаружения возбудителя
·Реакция ПИФ с использованием моноклональных АТ, меченых флюоресцеинизотиоцианатом.
·Молекулярнобиологические методы:
G ДНК-гибридизация;
G ПЦР в реальном времени;
G NASBA в реальном времени и др.
· Культивирование возбудителя на культуре клеток (линии McCoy, HeLa-229, L-929 и др.). Этот метод можно использовать для определения чувствительности хламидий к антибиотикам.
ПИФ: метод относительно прост и доступен практически любой лаборатории. Чувствительность и специфичность метода зависят от качества используемых люминесцирующих АТ. Изза возможности получения ложноположительных результатов реакция ПИФ не может быть использована для судебномедицинской экспертизы. Кроме того, этот метод не рекомендуют применять для исследования материалов, полученных из носоглотки и прямой кишки.
Методы амплификации нуклеиновых кислот высоко специфичны и чувствительны, могут быть использованы для скрининга, особенно для исследования клинических материалов, полученных неинвазивным путём (моча, эякулят). Специфичность методов — 100%, чувствительность — 98%. Эти методы не требуют сохранения жизнеспособности возбудителя, однако необходимо следовать строгим требованиям к условиям транспортировки клинического материала, несоблюдение которых может существенно повлиять на результат анализа. К таким методам относят ПЦР и ПЦР в реальном времени. Новый и перспективный метод — NASBA (Nucleic Acid Sequence-based Amplification) в реальном времени позволяет определить жизнеспособного возбудителя и заменить метод культивирования.
Посев на клеточные культуры — приоритетный метод для лабораторной диагностики хламидийной инфекции, особенно для судебномедицинской экспертизы, он более специфичен, чем ПИФ, незаменим при определении излеченности хламидиоза, так как другие методы могут давать искажённые результаты. Однако чувствительность метода остаётся низкой — в пределах 40–60%.
Проведение теста для определения чувствительности хламидий к антибиотикам нецелесообразно. ИФА вследствие низкой чувствительности редко используют для обнаружения Аг хламидий.
Методы обнаружения специфического иммунного ответа — серологические исследования, способные определять
IgM, IgA, IgG к хламидийным Аг, что особенно важно для диагностики хламидиоза при восходящей инфекции (сальпингит, сальпингоофорит, пельвиоперитонит, перигепатит).
Серологические методы (микроиммунофлуоресцентные, иммуноферментные) имеют ограниченную диагностическую ценность и не могут быть использованы для постановки диагноза урогенитальной хламидийной инфекции и, тем более, для контроля излеченности. Обнаружение IgM может быть использовано для диагностики пневмонии у новорождённых и детей первых трёх месяцев жизни. При обследовании женщин с ВЗОМТ диагностически значимым считают обнаружение нарастания титра IgG в 4 раза при исследовании парных сывороток крови. Увеличение концентрации IgG к хламидиям (к сероварам D–K) — основание для обследования пациентки с целью исключения венерической лимфогранулёмы.
Диагноз цервицита устанавливают на основании обнаружения двух критериев одновременно: слизисто-гнойные выделения из канала шейки матки и количество полиморфноядерных лейкоцитов в материале из цервикального канала, превышающее 10 в поле зрения микроскопа при увеличении в 1000 раз (при просмотре не менее пяти полей зрения).
Диагноз уретрита у женщин устанавливают на основании только лабораторных данных: наличие в материале, полученном из уретры, более 10 полиморфноядерных лейкоцитов в поле зрения микроскопа при увеличении в 1000 раз (при просмотре не менее пяти полей зрения).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференцируют с аналогичными заболеваниями нехламидийной этиологии (гонококковой, трихомонадной, неспецифической инфекцией).
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Хламидийный цервицит.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
·Эрадикация возбудителя.
·Исчезновение симптомов заболевания.
·Профилактика развития осложнений.
Поскольку Chlamydia trachomatis — патогенный микроорганизм, а урогенитальную хламидийную инфекцию относят к ИППП, назначение антибактериальных препаратов с целью лечения обязательно. Антибактериальную терапию проводят вне зависимости от того, существуют клинические проявления заболевания или нет.
Антибактериальная терапия урогенитальной хламидийной инфекции в первом триместре беременности нежелательна. Лечение назначают после 12–16 недель гестации.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При обнаружении хламидий у беременных и кормящих назначают один из следующих препаратов:
·эритромицин внутрь по 500 мг четыре раза в сутки в течение 7–10 дней;
·амоксициллин внутрь по 500 мг каждые 8 ч в течение 7–10 дней;
·джозамицин внутрь по 500 мг два раза в сутки в течение 10 дней. Альтернативные схемы:
·азитромицин внутрь по 1,0 г однократно;
·спирамицин внутрь по 3 млн МЕ три раза в сутки в течение 10 дней.
По сравнению с эритромицином предпочтительнее использовать джозамицин или амоксициллин, так как они имеют меньше побочных эффектов и более эффективны.
Внимание! Эритромицина эстолат противопоказан во время беременности. Считалось ранее, что азитромицин, джозамицин, спирамицин необходимо осторожно назначать беременным, однако существуют данные многих экспертов о безопасности этих препаратов во время беременности.
При хламидиозе у новорождённых и младенцев проводят лечение следующими препаратами. · На первой неделе жизни:
G при массе тела <2000 г — эритромицин 20 мг/кг в день внутрь в равных дозах не менее 14 дней; G при массе тела >2000 г — эритромицин 30 мг/кг в день внутрь в равных дозах не менее 14 дней. · От 1 нед до 1 мес жизни:
G эритромицин 40 мг/кг в день внутрь в равных дозах не менее 14 дней.
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ
Своевременное антибактериальное лечение хламидийной инфекции.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
·Выявление половых контактов обязательно и важно.
·Лечение полового партнёра обязательно.
·Регистрация: направляют экстренное извещение в КВД по форме 089/укв.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
При развитии осложнений лечение проводят в специализированных стационарах дерматовенерологического, акушерскогинекологического, ревматологического профиля. Продолжительность стационарного лечения определяется характером клинических проявлений и степенью выраженности воспалительного процесса и составляет от 2 до 6 нед.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
·Контроль излеченности рекомендуют проводить через четыре недели после лечения.
·Рекомендуемые методы — культивирование и ПЦР, а также метод NASBA в реальном времени.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
·Пациенты должны быть предупреждены о том, что при наличии у них урогенитальной хламидийной инфекции они могут заразить полового партнёра. Поиск и обследование половых контактов проводят в зависимости от клинических проявлений заболевания и предполагаемого срока заражения (от 15 дней до 6 мес).
·Лечение пациентки и её полового партнёра — обязательное условие нераспространения инфекции. Пациенты
должны быть проинформированы о том, что при неадекватном лечении возможно развитие осложнений в виде восходящей инфекции органов малого таза, а во время беременности возможно преждевременное её прерывание, а также инфицирование плода и новорождённого.
·Все рекомендации для пациентов должны быть направлены на профилактику распространения инфекции.
·В случае диагностики хламидиоза у беременной, родильницы или роженицы, не получившей своевременного лечения, проводят обследование новорождённого с взятием материала из конъюнктивальных мешков обоих глаз. При обнаружении хламидийной инфекции у новорождённого обследуют его родителей.
·Перинатально полученные C. trachomatis могут персистировать у ребёнка до 3-летнего возраста.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ |
др. Гинекология от |
пубертата до |
постменопаузы |
/ Под ред. |
Айламазян Э.К., Потин В.В., Тарасова М.А. и |
||||
Э.К. Айламазяна. — М.: Медпрессинформ, 2006. — 491 с. |
|
|
|
|
Приказ МЗ РФ №403 от 12.08.2003 «Об утверждении и введении в действие учётной формы №089/укв». |
|
|||
Савичева А.М., Соколовский Е.В., Домейка М. |
и др. Методические |
материалы |
по диагностике, |
лечению и |
профилактике наиболее распространённых инфекций, передаваемых половым путём: Методическое пособие. — СПб.: Издательство Н-Л, 2002. — 112 с.
Соколовский Е.В., Савичева А.М., Домейка М. и др. Инфекции, передаваемые половым путём: Руководство для врачей. — М.: МедпрессИнформ, 2006. — 256 с.
Шипицына Е.В., Савичева А.М. Устойчивость Chlamydia trachomatis к антибиотикам // Журнал акушерства и женских болезней. — 2002. — Т. LI, № 4. — С. 77–83.
Шипицына Е.В., Воробьёва Н.Е., Савичева А.М. и др. Применение метода Nucleic Acid Sequence-based Amplification в реальном времени (NASBA Real-Time) для диагностики урогенитальной хламидийной инфекции // Журнал акушерства и женских болезней. — 2005. — Т. LIV, № 4. — С. 17–21.
Canadian STD Guidelines. — Canada, 1998. — 239 р.
European STD Guidelines; ed. by K Radcliffe // International Journal of STD AIDS. — 2001. — Vol. 12, Suppl 3. — P. 107. Guidelines for the Management of Sexually Transmitted Infections. — WHO, 2001. — 79 p.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections: A practical guide. — London: WBS, 1999. — 509 p.
Monif G.R.G, Baker D.A. Infectious Diseases in Obstetrics and Gynecology. — 5th ed. — London: The Parthenon Publishing Group, 2004. — 723 p.
Sexually transmitted and other reproductive tract infections: A guide to essential practice. — Geneva: World Health Organization, 2005. — 186 р.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions // STI. — 1999. — Vol. 75, Suppl. 1. — P. 89.
Shalepo K., Savicheva A., Shipitsyna E. et al. Diagnosis of Chlamydia trachomatis in Russia — in house PCR assays may be effective but overall optimization and quality assurance are urgently needed // APMIS. — 2006. — Vol. 114, N 7–8. — P. 500– 507.
48.5. БЕРЕМЕННОСТЬ И CИФИЛИС
Cифилис — общее инфекционное заболевание, вызываемое бледной трепонемой, вызывающее поражение кожи, слизистых оболочек, нервной системы, внутренних органов и сопровождающееся иммуно-биологической перестройкой макроорганизма.
СИНОНИМЫ
Lues.
КОД ПО МКБ-10
А50 Врождённый сифилис. А51 Ранний сифилис.
А52 Поздний сифилис.
А53 Другие и неуточнённые формы сифилиса.
ЭПИДЕМИОЛОГИЯ
Сифилис — инфекция, передаваемая половым путем, в случае диагностики на территории России подлежащая обязательной регистрации.
Пути передачи:
·при контакте кожи, слизистых оболочек гениталий, полости рта и ануса с заразными элементами сыпи больного;
·через повреждения на коже и, возможно, через неповреждённую слизистую оболочку.
Почти исключительно передача бледной трепонемы происходит при половом контакте, реже возникает трансфузионное или внутриутробное заражение.
КЛАССИФИКАЦИЯ
Различают:
· инкубационный период сифилиса, средней продолжительностью до 30 дней;
·первичный период сифилиса, средней продолжительностью 45 дней;
·вторичный период сифилиса, продолжительностью от 2 до 4 лет;
·третичный период, возникающий у не леченых или плохо леченых пациентов в срок от 5 до 15 лет и более от момента инфицирования;
·латентный период сифилиса, в котором выделяют скрытый ранний период, давностью до 2 лет, скрытый поздний
период, давностью более 2 лет, и скрытый неуточнённый.
ЭТИОЛОГИЯ
Возбудитель сифилиса — микроорганизм из семейства Spirochaetaceae, рода Treponema, получивший наименование «бледной» трепонемы (Treponema pallidum) ввиду весьма слабой способности воспринимать окраску как в нативном, так и в фиксированном состоянии.
ПАТОГЕНЕЗ
В отличие от других спирохет, T. pallidum — тканевый паразит, способный проникать в клетки и их ядра, сохраняя при этом жизнеспособность. Указанный феномен (незавершённый фагоцитоз) лежит в основе длительного хронического течения заболевания. Поскольку T. pallidum относят к факультативным анаэробам, она хорошо размножается в лимфоидной, нервной и соединительной ткани, где может находиться в спириллярной (высоко патогенной) форме, или же в формах длительного выживания (L-формы, цисты, зёрна). Последние устойчивы к антибиотикам и АТ, их обнаруживают обычно при скрытых и поздних формах сифилиса. Наоборот, на ранних стадиях заболевания T. pallidum присутствует в тканях в основном в спириллярной форме, будучи основным объектом бактериологической диагностики наиболее заразных форм сифилиса: первичного, вторичного свежего и рецидивного. Вследствие иммуноаллергической перестройки макроорганизма в ответ на присутствие возбудителя на ранних стадиях заболевания формируются клеточные инфильтраты в органах и тканях, а в позднем периоде возникают инфекционные гранулёмы. Наличие последних в коже приводит к рубцовым изменениям, а образование и последующий распад гранулём в жизненно важных органах может привести к гибели больного. Одно из наиболее ранних и грозных осложнений сифилиса — патология нервной системы, протекающая на ранних стадиях с поражением мозговых оболочек и сосудов (ранний нейросифилис), на поздних — с признаками деструкции клеток серого вещества головного мозга и развитием слабоумия (прогрессирующий паралич), а также с деструкцией проводящих путей спинного мозга, расстройством функции тазовых органов и резкими болями (спинная сухотка).
КЛИНИЧЕСКАЯ КАРТИНА
Обусловлена стадией заболевания и осложнениями. Болезнь может протекать как с типичными симптомами, так и скрыто, но с положительными результатами серологических тестов на сифилис.
ДИАГНОСТИКА
АНАМНЕЗ
При приобретённом сифилисе — указание на половой контакт, при котором было возможно заражение, при врождённом — наличие не леченого или плохо леченого сифилиса у матери.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Первый симптом при первичном сифилисе — первичная сифилома. Это эрозия или язва (шанкр) хрящевидной плотности, как правило, безболезненная, возникающая в месте внедрения бледной трепонемы. Первичную сифилому характеризуют следующие признаки:
·Первичная сифилома локализуется на вульве, во влагалище, на шейке матки, языке, губах и т.д.;
·Первичная сифилома возникает через 2–6 нед (иногда до 3 мес) после заражения;
·Первичной сифиломе, как правило, сопутствует регионарный склераденит;
·Первичная сифилома может быть незамеченной при локализации в прямой кишке, на шейке матки;
·Существуют атипичные варианты первичной сифиломы: шанкрпанариций, шанкрамигдалит, индуративный отёк;
·Первичную сифилому может осложнять вторичная инфекция;
·Первичная сифилома регрессирует в течение нескольких недель без лечения с образованием рубца или без него.
При вторичном сифилисе:
·возникают распространённые высыпания на коже и слизистых (розеолёзный, папулёзный, везикулёзный, пустулёзный варианты сифилидов);
·сыпь образуется на любой части тела через 3–6 нед после появления первичной сифиломы;
·элементы сыпи заразны, любой физический контакт — сексуальный или несексуальный — с повреждённой кожей или слизистыми оболочками больного может привести к заражению;
·сыпь обычно исчезает без лечения через несколько недель или месяцев;
·присутствуют другие симптомы: слабая лихорадка, утомляемость, головная боль, ангина, выпадение волос (очаговое
или диффузное), увеличение всех групп лимфатических узлов, симптомы могут быть очень слабыми и, подобно первичной сифиломе первичного сифилиса, исчезают без лечения;
·признаки вторичного сифилиса могут возникать и исчезать в течение 1–2 лет;
·возможно развитие симптомов висцерального и нейросифилиса.
Латентный сифилис. При этой разновидности заболевания периоды активности (наличие высыпаний) чередуются с латентными периодами. Будучи не леченным, сифилис может перейти в поздний скрытый период, во время которого больной менее заразен и нет никаких клинических симптомов, но серологические реакции остаются положительными. Третичный сифилис (поздняя стадия). Третичный период сифилиса, морфологической основой которого служит гранулематозное воспаление, наступает через 3–6 лет после заражения. Помимо кожи и слизистых оболочек, могут быть поражены сердце, печень, нервная система, опорно-двигательный аппарат, что приводит к психическим расстройствам, слепоте, неврологическим проблемам, болезням сердца и смерти.
Нейросифилис. Его характеризуют следующие признаки:
·эта стадия может длиться несколько лет или десятилетий;
·у 3–7% лиц с не леченым сифилисом нейросифилис развивается во время ранних стадий инфекции;
·у некоторых пациентов заболевание протекает бессимптомно;
·варианты поражения нервной системы разнообразны;
·для ранних стадий заболевания характерен менингеальный и менинговаскулярный характер поражения, а для поздних — паренхиматозный нейросифилис с соответствующей симптоматикой;
·воспаление мягкой мозговой оболочки вызывает головную боль, ригидность затылочных мышц и лихорадку;
·поражение кровеносных сосудов может привести к развитию симптомов паралича с потерей чувствительности, мышечной слабости, ухудшению зрения и т.д.
Сифилис у беременных. При не леченом сифилисе у беременных инфекция может передаваться плоду, в результате
чего в 25% случаев беременность заканчивается мертворождением или гибелью новорождённого, в 40–70% случаев рождаются дети с врождённым сифилисом При постановке беременной на учёт необходимо провести скрининговое обследование на сифилис, которое
повторяют в третьем триместре беременности. Если женщина не состояла на учёте по беременности, обследование на сифилис проводят во время родов. Новорождённых не выписывают из родильного дома до получения результата анализа на сифилис, если во время антенатального наблюдения результат был сомнительный.
Врождённый сифилис. Его подразделяют на ранний и поздний. Некоторые дети с ранним врождённым сифилисом могут иметь клинические признаки заболевания при рождении, но у большинства эти симптомы развиваются в сроки от двух недель до трёх месяцев после рождения.
К клиническим проявлениям врождённого сифилиса относят следующие признаки:
·морщинистую кожу серо-жёлтой окраски со специфическими высыпаниями, в том числе характерными только для врождённого сифилиса (сифилитическая пузырчатка, диффузные папулёзные инфильтрации);
·поражения опорно-двигательного аппарата;
·лихорадку;
·увеличение печени и селезёнки;
·анемию;
·различные пороки развития.
Возможно скрытое течение врождённого сифилиса. В дальнейшем (после 2 лет) могут развиться симптомы позднего врождённого сифилиса, включающие повреждение костей, зубов, глаз, органа слуха и мозга.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Материалы для исследования: серозное отделяемое с поверхности эрозивных или язвенных дефектов при первичном сифилисе, отделяемое с поверхности сифилидов при вторичном периоде сифилиса. При этом используют микроскопический метод диагностики. Для серологических исследований используют кровь и спинномозговую жидкость, для морфологического исследования — биопсийный материал. Следует подчеркнуть, что при диагностике врождённого сифилиса венозную кровь берут у новорождённого и у матери, пуповинную кровь для серологической диагностики не используют.
Микроскопическую диагностику проводят методами темнопольной микроскопии и прямой иммунофлюоресценции с использованием АТ к T. pallidum. Темнопольную микроскопию не используют для исследования материалов из полости рта и прямой кишки. Для этих клинических материалов применяют метод ПИФ.
Темнопольную микроскопию можно использовать для диагностики во всех случаях, когда на коже или слизистых оболочках есть специфические элементы, с поверхности которых существует возможность получить отделяемое для исследования. Кроме этого, приготовить препарат для микроскопии можно из пунктата регионарных лимфатических узлов (в случае местного использования антисептиков или антибиотиков или эпителизации эрозированных поверхностей), спинномозговой жидкости, АЖ. Присутствие непатогенных трепонем-комменсалов (T. refringens, T. phagedenis в урогенитальном тракте, T. denticola в полости рта) делает трудным и малодостоверным проведение исследования с материалом, полученным с высыпаний на слизистой оболочке полости рта или прямой кишки, так как морфологически эти трепонемы сходны с T. pallidum. При необходимости проведения исследования материала, полученного из этих локализаций, лучше отдать предпочтение методу ПИФ.
T. pallidum имеет свои отличительные особенности, например сгибательное и маятникообразное движение. Последнее встречают только в том случае, если T. pallidum одним своим концом оказывается прикрёпленной к какомулибо объекту — клетке, клеточному детриту, сгустку фибрина и др. При этом возбудитель другим своим концом может совершать маятникообразные (или хлыстообразные, бичеобразные) движения. Кроме этого, в такой ситуации все трепонемы могут искривляться, скручиваться, или изгибаться и искривлять завитки, а также резко возвращаться к прежней змеевидной форме. Но чаще при микроскопии удается наблюдать сгибательные движения, при которых T. pallidum может на любом участке резко согнуться под углом и разогнуться. Именно это движение часто позволяет определить в исследуемом материале наличие возбудителя сифилиса, что служит абсолютным подтверждением диагноза.
ПИФ — реакция иммунофлюоресценции, при которой анти-T. pallidum глобулин, меченый флюорохромом, связывается с возбудителем. Препарат готовят на предметном стекле из любых тканевых жидкостей, отделяемого с поверхности элементов на коже и слизистых оболочках, суспензии ткани, после чего высушивают на воздухе, фиксируют метанолом или этанолом и наносят на него анти-T. pallidum глобулин. При наличии T. pallidum в исследуемом препарате возникает яркозелёная специфическая флюоресценция. Преимущества метода перед темнопольной микроскопией — ограничение работы с живыми патогенными возбудителями, реальная возможность дифференцировки патогенных трепонем от непатогенных при исследовании материала со слизистых оболочек полости рта или прямой кишки и возможность использования материала, полученного при биопсии или аутопсии.
Взятие материала (серозного отделяемого с поверхности эрозии, язвы, мацерированной или эскориированной, эрозированной папулы или бляшки) для темнопольной микроскопии или ПИФ необходимо проводить после тщательной и осторожной, нетравмирующей очистки поверхности специфических элементов с помощью марлевого тампона, смоченного физиологическим раствором. Важно не травмировать поверхность и не получить кровотечения. Наличие в препарате лейкоцитов или клеточного детрита, эритроцитов значительно усложняет исследование. После очистки путём повторного сжатия двумя пальцами под основание эрозии/язвы осторожно стимулируют выделение серозного экссудата, который забирают с поверхности бактериологической петлёй или путём аккуратного прикладывания к поверхности эрозии/язвы покровного стекла. Полученное серозное отделяемое смешивают на предметном стекле с равным количеством физиологического раствора, накрывают покровным стеклом, и полученный
нативный препарат микроскопируют. Необходим определённый опыт для распознавания в препарате T. pallidum, которая выглядит как очень тонкая спираль, длиной 6–20 мкм и толщиной 0,13–0,15 мкм, с равномерными завитками (примерно 10–13) глубиной до 0,5–0,7 мкм.
Серологическая диагностика. В зависимости от используемого Аг серологические реакции делят на две группы: трепонемные и нетрепонемные (табл. 48-4).
Нетрепонемные тесты используют для скрининга, они включают в себя микрореакцию преципитации, тест VDRL, тест быстрых плазменных реагинов (RPR). Достоинства нетрепонемных тестов — техническая простота и скорость получения результата исследования, возможность постановки реакции в количественном варианте с определением титра АТ, что позволяет их использовать для оценки эффективности терапии. VDRL-тест используют для обнаружения специфических АТ в спинномозговой жидкости. Использование этих тестов ограничено следующими моментами: они не позволяют обнаружить АТ в первые 2–4 нед первичного периода сифилиса, также возможны ложноположительные и ложноотрицательные результаты реакции.
Трепонемные тесты позволяют подтвердить результаты нетрепонемных тестов. К ним относят реакцию пассивной гемагглютинации, метод микрогемагглютинации T. pallidum, ИФА и реакцию иммунофлюоресценции с абсорбцией. Несомненное достоинство трепонемных тестов — их высокая специфичность, однако эти тесты не используют при исследовании спинномозговой жидкости (кроме реакции пассивной гемагглютинации) и для контроля эффективности лечения. Эти тесты могут быть положительными при невенерических трепонематозах.
Таблица 48-4. Чувствительность и специфичность методов серологической диагностики сифилиса |
|
|
|||||||
Тип реакции |
Чувствительность при разных стадиях заболевания, % |
|
Специфичность, |
||||||
|
|
|
|
|
|
|
|
% |
|
|
Первичый |
|
Вторичный |
|
Ранний |
|
Поздний/третичный |
|
|
|
сифилис |
|
сифилис |
|
скрытый |
|
сифилис |
|
|
|
|
|
|
|
сифилис |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нетрепонемные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VDRL |
78 (59–87) |
|
100 |
|
95 (88–100) |
|
71 (37–94) |
|
98 (96–99) |
|
|
|
|
|
|
|
|
||
RPR |
86 (77–100) |
|
100 |
|
98 (95–100) |
|
73 |
|
98 (93–99) |
|
|
|
|
|
|
|
|
||
RST |
82 (77–86) |
|
100 |
|
95 (88–100) |
|
– |
|
97 |
|
|
|
|
|
|
|
|
|
|
TRUST |
85 (77–86) |
|
100 |
|
98 (95–100) |
|
– |
|
99 (98–99) |
|
|
|
|
|
|
|
|
|
|
Трепонемные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Микрогемагглютинация |
76 (64–90) |
|
100 |
|
97 (94–100) |
|
97 (94–100) |
|
99 (98–100) |
|
|
|
|
|
|
|
|||
РИФ с абсорбцией |
86 (70–100) |
|
100 |
|
100 |
|
96 |
|
97 (94–100) |
|
|
|
|
|
|
|
|
|
|
Существуют различные причины ложноположительных реакций на сифилис (табл. 48-5). · Нетрепонемные тесты.
G Инфекционные: бактериальный эндокардит, шанкроид, ветряная оспа, инфекционный мононуклеоз, лепра, венерическая лимфогранулёма, малярия, корь, Mycoplasma pneumoniae, пневмококковая пневмония, рикетсиозные заболевания, туберкулёз, вирусные гепатиты, трепонематозы (фрамбезия и пинта).
G Неинфекционные: онкологические заболевания, пожилой возраст, распространённый атеросклероз, хронические заболевания печени, заболевания соединительной ткани (системная красная волчанка), наркотики, миеломная болезнь, беременность.
· Трепонемные тесты.
G Инфекционные: перекрёстная реакция на другие трепонематозы (пинта и фрамбезия), герпесвирусная инфекция, инфекционный мононуклеоз, лепра, болезнь Лайма, малярия.
G Неинфекционные: онкологические заболевания, распространённый атеросклероз, заболевания соединительной
ткани (системная красная волчанка), миеломная болезнь, тиреоидит. |
|
|
|
Таблица 48-5. Интерпретация результатов серологического исследования |
|
|
|
Нетрепонемные тесты: |
Трепонемные специфические тесты: |
Возможная причина |
|
микрореакция |
реакция прямой гемагглютинации, |
|
|
преципитации, VDRL, |
микрогемагглютинация, ИФА, РИФ с |
|
|
RPR |
абсорбцией |
|
|
|
|
|
|
Положительная реакция |
Положительная реакция |
сифилис |
первичныйсифилис |
|
|
вторичныйсифилис |
скрытыйсифилис |
|
|
третичныйтропические трепонематозы |
|
|
|
|
|
Положительная реакция |
Отрицательная рекция |
ложноположительный |
результат |
|
|
нетрепонемных тестов |
|
|
|
|
|
Отрицательная реакция |
Положительная реакция |
сифилис |
первичныйсифилис |
|
|
скрытыйсифилис |
третичныйлеченный |

|
|
ранее сифилистропические трепонематозы, |
|
|
болезнь Лайма |
|
|
|
Отрицательная реакция |
Отрицательная реакция |
инкубационный период сифилисаздоровый |
|
|
пациент |
|
|
|
Диагностика врождённого сифилиса имеет определённые особенности. При этом типе сифилиса на коже и слизистых оболочках присутствуют специфические высыпания, результаты исследования отделяемого из них на T. Pallidum положительны.
Проводят серологическое исследование (нетрепонемные и трепонемные тесты) венозной крови от новорождённого и матери. Превышение титров АТ в нетрепонемных тестах в крови новорождённых по сравнению с титрами АТ в крови матери свидетельствует в пользу развития врождённого сифилиса. Пуповинную кровь для серологических исследований не используют.
Исследуют также спинномозговую жидкость новорождённого, проводят рентгенографию длинных трубчатых костей, морфологическое исследование плаценты.
Развитие врождённого сифилиса можно обоснованно предполагать в случае неадекватного лечения матери во время беременности. Неадекватным лечением следует считать: лечение сифилиса, проведённое после 32 нед беременности (позднее лечение), лечение, проведённое не препаратами пенициллина, лечение, проведённое с нарушением схем и инструкций, лечение, при котором отсутствует адекватный серологический ответ.
СКРИНИНГ
Обследованию на сифилис подлежат:
·беременные женщины при постановке на учёт, при сроке беременности 27–30 нед и в 36–40 нед;
·новорождённые, родившиеся от матерей, не леченых, не получивших профилактического лечения во время беременности.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
·Первичный сифилис дифференцируют с:
G эрозией шейки матки;
G генитальным герпесом;
G трихомонадными эрозиями или язвами; G шанкриформной пиодермией.
· Вторичный сифилис дифференцируют с: G токсикодермией;
G сыпью при других инфекционных заболеваниях (корь, краснуха и др.); G остроконечными кондиломами;
G алопецией;
G постпаразитарной лейкодермой;
G псориазом, микозами (при локализации процесса на ладонях и подошвах).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Обязателен осмотр специалистами в любой стадии болезни для исключения поражения нервной, сердечнососудистой и других систем. К осмотру привлекают невропатолога, офтальмолога, терапевта, оториноларинголога, при необходимости – врачей других специальностей.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА |
|
|
Сифилис первичный (эрозивный примераффект, регионарный склераденит). |
|
|
ЛЕЧЕНИЕ |
|
|
ЦЕЛИ ЛЕЧЕНИЯ |
|
|
Элиминация бледной трепонемы. Профилактика внутриутробного инфицирования. |
|
|
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ |
|
|
Лечение различных форм имеет свои особенности (табл. 48-6). |
|
|
Таблица 48-6. Медикаментозное лечение беременных с различными формами сифилиса |
|
|
Форма сифилиса |
Препараты |
Дозы препаратов |
Специфическое лечение беременных при сроке беременности до 18 недель такое же, как и для небеременных.Для специфического лечения беременных женщин при сроке беременности более 18 недель рекомендуют следующие схемы:
Первичный сифилис |
Прокаин бензилпенициллин© |
1,2 млн ЕД |
внутримышечно |
|
|
ежедневно в течение 10 дней |
|
|
|
|
|
|
Илибензилпенициллина новокаиновая соль© |
600 тыс. ЕД внутримышечно 2 раза |
|
|
|
в день ежедневно в течение 10 |
|
|
|
дней |
|
|
|
|
|
Вторичный и ранний |
Прокаин бензилпенициллин© |
1,2 млн ЕД |
внутримышечно |
скрытый сифилис |
|
ежедневно в течение 20 дней |
|
|
|
|
|
|
Илибензилпенициллина новокаиновая соль© |
600 тыс. ЕД внутримышечно 2 раза |
|
|
|
в день |
ежедневно в течение |
|
|
20 дней |
|
|
|
|
|
Профилактическое Прокаин бензилпенициллин© |
1,2 млн ЕД |
внутримышечно |
|
лечение |
ежедневно в течение 10 дней |
||
|
|
|
|
Первичное лечение сифилиса у беременных проводят сразу после установления диагноза независимо от срока беременности.
Профилактику врождённого сифилиса проводят, начиная с 16-й недели беременности.
Пациентка не заразна уже через 24 ч после начала лечения
Некоторые пациентки, к примеру ВИЧ-положительные, не реагируют на обычные дозы пенициллина, что может потребовать изменения схем лечения.
ЛЕЧЕНИЕ
ВРОЖДЁННОГО
СИФИЛИСА
Ранний врождённый при неизменённых показателях в спинномозговой жидкости: |
|
|
|
|
|
|
||||||||
сифилис |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
бензилпенициллина натриевая соль© |
|
|
|
|
100 тыс. ЕД/кг массы тела в сутки |
||||||||
|
|
|
|
|
|
|
|
внутримышечно |
6 раз в |
сутки |
в |
|||
|
|
|
|
|
|
|
|
течение 14 дней |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||||
|
|
Илибензилпенициллина новокаиновая соль© |
|
|
|
50 тыс. ЕД/кг массы |
тела |
в сутки |
||||||
|
|
|
|
|
|
|
|
внутримышечно |
2 раза в |
сутки |
в |
|||
|
|
|
|
|
|
|
|
течение 14 дней |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Илипрокаин+бензилпенициллин© |
|
|
|
|
50 тыс. ЕД/кг массы |
тела |
в сутки |
|||||
|
|
|
|
|
|
|
|
внутримышечно |
ежедневно |
в |
||||
|
|
|
|
|
|
|
|
течение 14 дней |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||||
|
|
Илибензатина бензилпенициллин |
|
|
|
|
50 |
тыс. ЕД/кг |
массы |
тела |
||||
|
|
|
|
|
|
|
|
внутримышечно |
|
трижды |
с |
|||
|
|
|
|
|
|
|
|
интервалами 7 дней (при условии, |
||||||
|
|
|
|
|
|
|
|
что масса тела новорождённого не |
||||||
|
|
|
|
|
|
|
|
менее 2000 г) |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||||
|
|
при патологии в спинномозговой жидкости или |
|
|
|
|
|
|
|
|
||||
|
|
невозможности её исследования назначают те же |
|
|
|
|
|
|
||||||
|
|
препараты, за исключением бензатина бензилпенициллина |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
Поздний врождённый |
Прокаин бензилпенициллин© |
|
|
|
|
50 тыс. ЕД/кг массы |
тела в сутки |
|||||||
сифилис |
|
|
|
|
|
|
|
внутримышечно |
ежедневно |
в |
||||
|
|
|
|
|
|
|
|
течение |
28 дней, |
затем |
после |
|||
|
|
|
|
|
|
|
|
двухнедельного |
|
перерыва |
||||
|
|
|
|
|
|
|
|
повторный курс в течение 14 дней |
|
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
Илибензилпенициллина новокаиновая соль |
|
|
|
50 тыс. ЕД/кг массы |
тела |
в сутки |
||||||
|
|
|
|
|
|
|
|
внутримышечно |
2 раза в |
сутки |
в |
|||
|
|
|
|
|
|
|
|
течение |
28 дней, |
затем |
после |
|||
|
|
|
|
|
|
|
|
двухнедельного |
|
перерыва |
||||
|
|
|
|
|
|
|
|
повторный курс в течение 14 дней |
|
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
Илибензилпенициллина натриевая соль© |
|
|
|
50 тыс. ЕД/кг массы |
тела |
в сутки |
||||||
|
|
|
|
|
|
|
|
внутримышечно |
6 раза в |
сутки |
в |
|||
|
|
|
|
|
|
|
|
течение |
28 дней, |
затем |
после |
|||
|
|
|
|
|
|
|
|
двухнедельного |
|
перерыва |
||||
|
|
|
|
|
|
|
|
повторный курс в течение 14 дней |
|
|||||
|
|
|
|
|
|
|
||||||||
|
|
Альтернативное |
лечение |
при |
аллергии |
на |
|
В возрастных дозировках в течение |
||||||
|
|
пенициллин:оксациллинилиампициллинили цефтриаксон |
|
|
14 дней |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
Профилактическое |
|
Если мать не получала специфического лечения, лечение |
|
|
|
|
|
|
|
|
||||
лечение |
|
новорождённого проводят так же, как при врождённом |
|
|
|
|
|
|
||||||
новорождённых |
|
сифилисе. |
|
|
|
|
|
|
|
|
|
|
|
|
Если лечение матери было неадекватным, или после адекватного лечения серологические реакции к моменту родов положительные, применяют следующие схемы:
Бензилпенициллина натриевая соль©
Илибензилпенициллина новокаиновая соль©
Илипрокаин бензилпенициллин©
Илибензатина бензилпенициллин
по 100 тыс. ЕД/кг массы тела в сутки внутримышечно 6 раз в сутки ежедневно в течение 10 дней
по 50 тыс. ЕД/кг массы тела в сутки внутримышечно 2 раза в сутки в течение 10 дней
50 тыс. ЕД/кг массы тела в сутки внутримышечно ежедневно в течение 10 дней
по 50 тыс. ЕД/кг массы тела внутримышечно дважды с интервалами 7 дней
Развитие реакции Герксгеймера–Яриша (повышение температуры тела, недомогание, в некоторых случаях усиление яркости кожной сыпи) через 8–12 часов после начала лечения сифилиса — естественный ответ организма на начало специфической терапии. Реакцию наблюдают обычно при лечении ранних форм сифилиса, она носит токсический характер, не является аллергической, проходит самостоятельно через несколько часов, возможно применение жаропонижающих препаратов
При отсутствии результатов от лечения рекомендуют учесть следующие возможные причины:
·ложноположительный результат исследования;
·несоблюдение режима лечения, неадекватная терапия;
·повторный контакт с не леченым партнером;
·инфицирование от нового партнера.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Пациентам, получающим лечение по поводу сифилиса, необходимо периодически проводить серологическое контрольное исследование в сроки до 1,5 лет. Адекватным серологическим ответом на полноценное лечение считают снижение титров АТ (нетрепонемные тесты) не менее чем в 4 раза в течение года после окончания терапии.
Пациенты с нейросифилисом нуждаются в повторных осмотрах и проведении спинномозговой пункции в течение 2 лет после лечения и наблюдении невропатолога.
Затем проводят серологическое исследование (табл. 48-7). Таблица 48-7. Серологические исследования сифилиса
Первичный, вторичный, ранний скрытый и врождённый сифилис На 1, 3, 6,12 и 24 мес после лечения
Поздний скрытый и третичный сифилис |
|
На 12 и 24 мес после лечения |
|
|
|
Нейросифилис |
|
На 6, 12 и 24 мес после лечения |
|
|
|
У ВИЧ-инфицированных |
|
На 1, 3, 6, 12 и 24 мес после лечения и далее |
|
|
ежегодно |
Адекватным серологическим ответом считают уменьшение титров нетрепонемных реакций:
Первичный сифилис
Вторичный сифилис
Ранний скрытый сифилис
На 12 мес — уменьшение титра в 4 раза
На 12 мес — уменьшение титра в 4 раза
На 12 мес титр уменьшается вдвое
При увеличении титров АТ в нетрепонемных тестах в ходе наблюдения без имеющейся реинфекции сифилиса, пациента необходимо повторно обследовать с обязательным исследованием спинномозговой жидкости
Если после проведения лечения нейросифилиса повторное исследование спинномозговой жидкости через 6 и 12 мес не показывает положительной динамики, необходимо проведение повторного лечения
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
·Исключение половых контактов до полного излечения.
·Строгое соблюдение режима лечения и последующего клиникосерологического контроля.
·Невозможность быть донором пожизненно.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Аствацатуров К.Р. Сифилис, его диагностика и лечение. — М.: Медицина, 1971. — С. 26–326.
Дмитриев Г.А., Фриго Н.В. Сифилис. Дифференциальный клиниколабораторный диагноз. — М.: Мед. Кн., 2004. Красносельских Т.В. Нейросифилис. Суставной синдром в практике дерматовенеролога. Нейросифилис / Под. ред. Е.В. Соколовского. — СПб.: Сотис, 2001. 72–270 с.
Кубанова А.А., Лосева О.К., Китаева Н.В. Выбор методик лечения больных различными формами сифилиса: Пособие для врачей. — М., 2003.
Приказ МЗ РФ №403 от 12.08.2003 «Об утверждении и введении в действие учётной формы №089/укв» Соколовский Е.В., Савичева А.М., Домейка М. и др. Инфекции, передаваемые половым путем: Руководство для врачей. – М.: Медпрессинформ, 2006. — 256 с.
Родионов А.Н. Сифилис. Руководство для врачей. — СПб.: Питер, 1997. Canadian STD Guidelines. Canada, 1998. — P. 239.
Center for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines 2006. European STD Guidelines. Ed.: K Radcliffe. International Journal of STD AIDS, 2001, 12, Suppl 3. — P. 107. Guidelines for the Management of Sexually Transmitted Infections. – WHO, 2001. — 79 p.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections — a practical guide // WBS, London, 1999. — P. 509.
Monif G.R.G, Baker D.A. Infectious Diseases in Obstetrics and Gynecology/ 5th Edition // The Parthenon Publishing Group, London, 2004. — P. 723.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva, World Health Organization, 2005. — P. 186.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions. — STI, 1999. — Vol 75. — Suppl. 1. — P. 89.
48.6. БЕРЕМЕННОСТЬ И ГОНОРЕЯ
Гонорея — инфекционное заболевание человека, вызываемое Neisseria gonorrhoeae, передаваемое преимущественно половым путём.
КОД ПО МКБ-10
А54 Гонококковая инфекция.
А54.0 Гонококковая инфекция нижних отделов мочеполового тракта без абсцедирования периуретральных и придаточных желёз.
А54.1 Гонококковая инфекция нижних отделов мочеполового тракта с абсцедированием периуретральных и придаточных желёз.
А54.2 Гонококковый пельвиоперитонит и другая гонококковая инфекция мочеполовых органов. А54.3 Гонококковая инфекция глаз.
А54.4 Гонококковая инфекция костно-мышечной системы. А54.5 Гонококковый фарингит.
А54.6 Гонококковая инфекция аноректальной области. А54.8 Другие гонококковые инфекции.
A54.9 Гонококковая инфекция неуточнённая.
ЭПИДЕМИОЛОГИЯ
Гонорея – одна из самых распространённых ИППП. Заболевание подлежит обязательной регистрации при выявлении на территории РФ. На распространённость гонореи существенное влияние оказывают социальные, демографические и поведенческие факторы. В последние годы отмечают относительно невысокую заболеваемость гонореей, что, повидимому, обусловлено неполным учётом больных вследствие обращения части пациентов в коммерческие медицинские учреждения, недостаточным обследованием, широким и бесконтрольным применением антибиотиков, ограниченным использованием методов культуральной диагностики.
ЭТИОЛОГИЯ
Возбудителем гонореи является грамотрицательный диплококк Neisseria gonorrhoeae, входящий в состав семейства Neisseriaceae рода Neisseria. Это бобовидной формы кокк, клетки которого располагаются парами, вогнутыми сторонами друг к другу. Размеры кокков — 1,25–1,60 мкм в длину и 0,7–0,8 мкм в поперечнике.
ПАТОГЕНЕЗ
Инфицирование гонококками вызывает воспалительный процесс, что приводит к дегенеративным и инфильтративным изменениям органов мочеполового тракта, прямой кишки, ротоглотки, конъюнктивы. У женщин первично поражается цервикальный канал с возможным последующим распространением воспалительного процесса на матку, маточные трубы, яичники. В поражённом органе первично формируется клеточный инфильтрат, впоследствии замещающийся соединительной тканью.
Патогенез осложнений гестации Не леченая инфекция может распространяться интраканаликулярно восходящим путём с развитием амнионита или
хориоамнионита, приводящим к гибели плода, преждевременному излитию ОВ, преждевременным родам. Не доказан трансплацентарный путь передачи гонококков.
Инфицирование плода возможно как антенатально (при гонококковом хориоамнионите), так и интранатально (при прохождении через инфицированные родовые пути матери).
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период гонореи составляет от 3 до 14 дней (в среднем 5–6 дней). Нередко отмечается хроническое рецидивирующее течение. Наиболее частые заболевания — уретрит, цервицит, проктит, не исключён сальпингоофорит, который встречается редко. Клиническая картина гонореи у беременных не имеет особенностей.
Основные клинические симптомы
У женщин:
·вагинальные выделения;
·дизурия;
·ациклические кровотечения;
·боли внизу живота;
·диспареуния;
·боли в области прямой кишки и выделения из неё при наличии проктита. У новорождённых:
·конъюнктивит;
·сепсис.
Основные проявления болезни
У женщин:
·цервицит;
·ВЗОМТ;
·уретрит;
·перигепатит;
·бартолинит;
·фарингит;
·конъюнктивит;
·проктит;
·диссеминированная гонококковая инфекция: артрит, дерматит, эндокардит, менингит. У новорождённых и младенцев:
·офтальмия новорождённых;
·синдром инфицирования АЖ;
·диссеминация гонококковой инфекции.
Возможные осложнения у женщин:
·ВЗОМТ (эндометрит, сальпингит, сальпингоофорит и др.);
·бесплодие;
·эктопическая беременность;
·синдром Рейтера.
ДИАГНОСТИКА
Диагностика базируется на следующих критериях:
·данных анамнеза (указание на половой контакт с больным или возможно инфицированным гонореей партнером);
·оценке субъективных и объективных симптомов заболевания;
·обнаружении гонококков при лабораторных исследованиях.
АНАМНЕЗ
В анамнезе у взрослых отмечают указание на половой контакт. При расспросе пациентки выявляют возможный источник инфицирования.
Важно уточнить:
·время, прошедшее от момента последнего сексуального контакта с предполагаемым источником заражения до появления симптомов заболевания;
·результаты обследования полового партнёра на гонорею.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Необходимо осмотреть пациентку полностью для исключения проявлений других ИППП, оценить состояние всех групп лимфатических узлов. Пальпируют все отделы живота, большие вестибулярные и периуретральные железы, уретру, проводят бимануальное влагалищное исследование.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Лабораторная диагностика гонореи включает (табл. 48-8):
·микроскопию мазков, окрашенных метиленовым синим и по Граму;
·культуральный метод. Его используют для диагностики гонореи у беременных, несовершеннолетних, при наличии
цервицита и ВЗОМТ у женщин. При его проведении требуется постановка антибиотикочувсвительности выделенных гонококков; · некультуральные методы (молекулярнобиологические — ПЦР).
При наличии показаний проводят культуральное исследование. Учитывая высокую чувствительность гонококков к высыханию и температуре, посев рекомендуют делать сразу на шоколадный агар или другую питательную среду для выделения гонококков. При невозможности проведения посева клинического материала на питательную среду для гонококков необходимо использовать специальные транспортные среды.
В качестве критерия излеченности используют сочетание микроскопического и культурального методов. Дополнительное использование при этом некультуральных методов (ПЦР) возможно не ранее чем через 3 нед после окончания лечения.
Серологические методы для диагностики гонореи не применяют. Выделяют следующие основные области для взятия материала:
·цервикальный канал шейки матки и уретра;
·прямая кишка при указании на аногенитальный контакт;
·глотка при указании на орогенитальный контакт.
Возможно взятие материала для обнаружения гонококка и из других областей:
·прямой кишки и уретры, если шейка матки удалена;
·органов малого таза при проведении лапароскопии у женщин с ВЗОМТ;
·крови и других жидкостей (гной) при диссеминации инфекции;
·синовиальной жидкости;
·конъюнктивы нижнего века;
·первой порции свободно выпущенной мочи (10–15 мл) для метода ПЦР (редко).
СКРИНИНГ
Обследованию на гонорею подлежат:
· женщины с клиническими проявлениями слизисто-гнойного цервицита, симптомами аднексита;
·лица, имевшие половой контакт с больным гонореей;
·лица, проходящие обследование на другие ИППП;
·беременные при постановке на учет по беременности;
·беременные, направленные на прерывание беременности;
·новорождённые с гнойным конъюнктивитом (при подтверждении гонорейной этиологии процесса необходимо
обследование родителей).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику гонореи проводят с цервицитом, вызванным другими микроорганизмами, прежде всего хламидиями.
При поражении кожи — с кератодермией при болезни Рейтера.
При поражении суставов — с реактивными артритами, болезнью Рейтера, артритами другой этиологии. При наличии симптомов конъюнктивита — с конъюнктивитами хламидийной, вирусной этиологии.
При менингите у детей — с менингитами менингококковой этиологии, вирусными поражениями ткани и оболочек
головного мозга. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Неосложнённая гонококковая инфекция нижних отделов мочеполового тракта (уретрит, цервицит). |
|
|
|
|
|||||||||||
Таблица 48-8. Лабораторные методы диагностики гонореи и их особенности |
|
|
|
|
|
|
|
||||||||
Область взятия |
|
Метод диагностики |
|
|
|
|
Комментарии |
|
|
||||||
материала |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Эндоцервикс/уретра |
(у |
Микроскопический с окраской по Граму |
для |
Чувствительность метода ниже, |
чем при |
||||||||||
взрослых женщин) |
|
обнаружения внутри-клеточных диплококков |
|
использовании материала из уретры у |
|||||||||||
|
|
|
|
|
|
|
|
мужчин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Культуральный |
|
|
|
|
|
Для подтверждения диагноза (выделение |
|||||||
|
|
|
|
|
|
|
|
и |
идентификация |
нейссерий) |
и |
||||
|
|
|
|
|
|
|
|
проведения теста чувствительности |
к |
||||||
|
|
|
|
|
|
|
|
антибиотикам |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Некультуральный (ПЦР) |
|
|
|
|
Только |
в |
качестве |
|
скрининга |
с |
|||
|
|
|
|
|
|
|
|
последующим |
подтверждением |
другими |
|||||
|
|
|
|
|
|
|
|
методами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Глотка |
|
Только культуральный |
(микроскопический |
с |
Подтверждение диагноза |
(выделение |
и |
||||||||
/конъюнктива/прямая |
|
окраской по Граму не применяется) |
|
|
идентификация нейссерий) и проведение |
||||||||||
кишка |
|
|
|
|
|
|
|
теста чувствительности к антибиотикам |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Некультуральный (ПЦР) |
|
|
|
|
Только |
в |
качестве |
|
скрининга |
с |
|||
|
|
|
|
|
|
|
|
последующим |
|
подтверждением |
|||||
|
|
|
|
|
|
|
|
культуральным методом |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Моча |
|
Некультуральный (ПЦР) |
|
|
|
|
Только |
в |
качестве |
|
скрининга |
с |
|||
|
|
|
|
|
|
|
|
последующим исследованием материала |
|||||||
|
|
|
|
|
|
|
|
из уретры и цервикального канала и |
|||||||
|
|
|
|
|
|
|
|
обнаружением |
нейссерий |
другими |
|||||
|
|
|
|
|
|
|
|
методами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Сепсис |
|
Микроскопический метод с окраской по Граму для |
Скрининговый |
метод. |
|
Обязательно |
|||||||||
|
|
клинических |
материалов |
из |
уретры |
и |
исследование |
материала |
из |
других |
|||||
|
|
цервикального канала, кожных высыпаний |
|
локализаций культуральным методом |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Культуральный |
метод |
|
для |
клинических |
Основной |
|
метод |
|
диагностики, |
||||
|
|
материалов из уретры и цервикального канала, |
подтверждение |
диагноза |
(выделение |
и |
|||||||||
|
|
кожных высыпаний, прямой кишки, носо-глотки, |
идентификация нейссерий) и проведение |
||||||||||||
|
|
спинномозговой |
жидкости, |
синовиальной |
теста чувствительности к антибиотикам |
|
|||||||||
|
|
жидкости, крови |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Некультуральный (ПЦР) |
|
|
|
|
Только |
в |
качестве |
|
скрининга |
с |
|||
|
|
|
|
|
|
|
|
последующим |
|
подтверждением |
|||||
|
|
|
|
|
|
|
|
культуральным методом |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Эрадикация гонококков, разрешение воспалительного процесса, профилактика осложнений.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Гонорея у беременных; осложнённое течение гонококковой инфекции (конъюнктивит, поражение сердечнососудистой, нервной системы, опорно-двигательного аппарата и т.п.) требуют стационарного лечения.
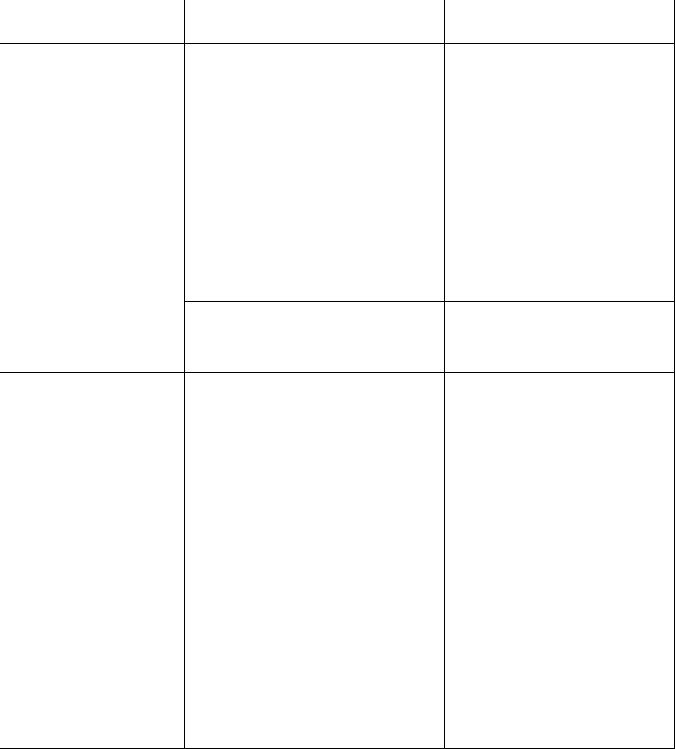
Продолжительность стационарного лечения определяется характером клинических проявлений и степенью тяжести воспалительного процесса и составляет 2–4 нед.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При наличии осложнений могут быть использованы методы физиотерапевтического лечения после консультации врачафизиотерапевта в зависимости от выраженности заболевания и состояния пациентки.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Лечение беременных осуществляют на любом сроке гестации в условиях стационара антибактериальными средствами, не оказывающими патологического влияния на плод. Выбор препарата для лечения зависит от проявлений заболевания (табл. 48-9).
При отсутствии результатов от лечения рекомендуется учесть следующие возможные причины:
·ложноположительный результат исследования;
·несоблюдение режима лечения, неадекватная терапия;
·повторный контакт с не леченым партнёром;
·инфицирование от нового партнёра;
·инфицирование другими микроорганизмами.
Таблица 48-9. Лекарственные средства, используемые для лечения и профилактики гонореи
Показания к применению Лекарственные средства выбора Альтернативные лекарственные средства
Гонорея у беременных |
и Цефтриаксон* |
внутримышечно |
250 мг Эритромицин внутрь первые 2 дня по |
|||
кормящих матерей |
|
однократно |
|
|
|
400 тыс ЕД 6 раз в сутки, затем по 400 |
|
|
или |
|
|
|
тыс ЕД 5 раз в сутки (курсовая доза 8,8 |
|
|
|
|
|
|
млн ЕД) |
|
|
|
|
|
|
или |
|
|
Спектиномицин |
внутримышечно |
2,0 г |
|
Азитромицин внутрь 1,0 г однократно |
|
|
однократно |
|
|
|
|
|
|
или |
|
|
|
|
|
|
Цефиксим* внутрь 400 мг однократно |
|
|
|
|
|
|
|
|
|
||
Конъюнктивит |
|
Цефтриаксон* |
внутримышечно |
1,0 г |
|
|
|
|
однократно |
|
|
|
|
|
|
|
|
|||
Офтальмия новорождённых |
|
Цефтриаксон* |
внутримышечно 25–50 мг/кг |
|
|
|
|
|
массы тела (не более 125 мг) однократно или |
||||
|
|
внутривенно 1 раз в сутки в течение 2–3 дней |
||||
|
|
или |
|
|
|
|
Цефотаксим* внутримышечно 100 мг/кг массы тела однократно плюс обильные промывания конъюнктивы изотоническим раствором натрия хлорида
Профилактика |
офтальмии |
уСеребра нитрат наружно 1% водный раствор |
|
|
|||||||
новорождённых |
|
|
|
однократно 2–3 капли в каждый глаз |
|
|
|
|
|
||
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
Эритромицин |
наружно глазная мазь |
0,5% |
|
|
|
|
|
|
|
|
|
однократно |
|
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
Тетрациклин наружно глазная мазь 1% |
|
|
|
|
|||
|
|
|
|
однократно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Фарингит |
|
|
|
Цефтриаксон* |
внутримышечно |
250 мг |
|
|
|
|
|
|
|
|
|
однократно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Аноректальная инфекция |
|
|
Цефтриаксон* |
внутримышечно |
250 мг |
|
Цефуроксим |
внутримышечно |
1,5 г |
||
|
|
|
|
однократно |
|
|
|
|
однократно |
|
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
Цефодизим |
внутримышечно |
500 мг |
|
|
|
|
|
|
|
|
|
однократно |
|
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
Aзитромицин внутрь 1,0 г однократно |
||
|
|
|
|
|
|
||||||
Осложнения |
неонатальной |
|
Цефтриаксон* |
внутримышечно |
или |
|
|
|
|
||
гонококковой |
инфекциивнутривенно |
из |
расчёта 25–50 мг/кг |
массы |
|
|
|||||
(менингит) |
|
|
|
тела 1 раз в сутки в течение 7 дней (при |
|
|
|||||
|
|
|
|
менингите — не менее 10–14 дней) |
|
|
|
|
|
||
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
Цефотаксим* |
|
внутримышечно |
или |
|
|
|
|
|
|
|
|
внутривенно из расчета 25 мг/кг массы тела |
|
|
|
|
|
2 раза в сутки в течение 7 дней (при |
|
|
|
|
|
менингите — не менее 10–14 дней) |
|
|
|
|
|
||
Профилактика |
гонореи |
у |
Цефтриаксон* внутримышечно из расчёта |
||
новорождённых, родившихся от |
25–50 мг/кг массы тела (не более |
125 мг) |
|||
матерей, |
больных |
этой |
однократно |
|
|
инфекцией |
|
|
|
или |
|
|
|
|
|
Спектиномицин внутримышечно |
40 мг/кг |
|
|
|
|
массы тела (не более 2,0 г) однократно |
|
|
|
|
|
|
|
Примечание: * Цефиксим, цефотаксим и цефтриаксон не назначают пациентам с аллергией на цефалоспорины или препараты пенициллиновой группы в анамнезе.
При необходимости возможно применение другого варианта лечения. Терапию основным или одним из альтернативных препаратов продолжают не менее 24–48 ч.
С целью профилактики возможной сопутствующей хламидийной инфекции одновременно назначают лечение, используя схемы, как и при хламидийной инфекции.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценку эффективности лечения проводят на основании клиниколабораторных и инструментальных исследований, подтверждающих эрадикацию гонококка и разрешение воспалительного процесса.
Ведение контактных лиц
Обследование пациентов проводят в зависимости от наличия в анамнезе половых контактов, выраженности клинической симптоматики и предполагаемого срока заражения (при остром течении гонореи — от 3 дней до 3 мес; при торпидном и малосимптомном течении — 6 мес).
У новорождённого, рождённого от матери, больной гонореей, берут материал из вульвы и конъюнктивы обоих глаз для микроскопии и культурального исследования. При выявлении гонореи у новорождённого обследуют его родителей.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
·Выявление половых контактов обязательно и важно.
·Лечение полового партнёра обязательно.
·Регистрация: направляют экстренное извещение в КВД по форме 089/укв.
ПРОФИЛАКТИКА
Профилактика гонореи включает мероприятия, общие для всех ИППП, и подразделяется на первичную и вторичную. Первичная профилактика направлена на изменение модели поведения в группах высокого риска с целью избежать заражения. Необходимо вести пропаганду здорового образа жизни, безопасных форм сексуальных отношений через средства массовой информации, а также в учебных и медицинских учреждениях. Нужно доступно рассказывать о клинических проявлениях половых инфекций, путях заражения, способах профилактики с учётом образовательного уровня аудитории. Важно объяснять вред самолечения и лечения у непрофессионалов.
Вторичная профилактика направлена на:
·обследование и лечение пациентов с диагностированными ИППП для снижения вероятности передачи инфекции своим половым партнёрам;
·уменьшение риска повторного заражения среди больных или ранее перенёсших инфекцию людей;
·эффективную диагностику и при необходимости лечение контактных лиц.
Обязательному обследованию и лечению подлежат все половые партнёры пациентов с симптомами гонореи, если они имели половой контакт в последние 14 дней.
При отсутствии симптомов заболевания у пациентки с гонореей обследованию подлежат все половые партнёры, вступавшие с ней в половой контакт за последние 60 дней.
Специфические профилактические мероприятия у новорождённых заключаются в закладывании за нижнее веко в первые минуты после рождения эритромициновой глазной мази.
Проведение эпидемиологических мероприятий среди контактных лиц (санация эпидемического очага) осуществляется совместно с районным эпидемиологом:
·осмотр и обследование контактных лиц;
·оценка лабораторных данных;
·решение вопроса о необходимости лечения, его объёме и сроках наблюдения.
В случае проживания контактных лиц на других территориях, посылается нарядталон в территориальное КВУ.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Необходимо исключить половые контакты до полного выздоровления, строго соблюдать режим приёма лекарственных средств и своевременно явиться к врачу для определения критериев излеченности.
ПРОГНОЗ
Прогноз при своевременно начатом лечении благоприятный.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Васильев М.М. Диагностика, клиника и терапия гонорейной инфекции // РМЖ. — 1998. — С. 994–998. Приказ МЗ РФ №403 от 12.08.2003 «Об утверждении и введении в действие учётной формы №089/укв».
Инфекции, передаваемые половым путём / Е.В. Соколовский и др. Руководство для врачей. — М.: Медпрессинформ, 2006. — 256 с.
Canadian STD Guidelines. — Canada, 1998. — P. 239.
European STD Guidelines./ Ed. K. Radcliffe. // International Journal of STD AIDS. — 2001. — 12, Suppl 3. – P. 107. Guidelines for the Management of Sexually Transmitted Infections. – WHO, 2001. — P. 79.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections — a practical guide // London: WBS, 1999. — P. 509.
Chlamydia trachomatis among patients infected with and treated for Neisseria gonorrhoeae in sexually transmitted disease clinics in the United States / S.B. Lyss et al. // Ann. Intern. Med. — 2003. — N 139. —Р. 178–185.
Marrazzo J.M., Handsfield H.H., Whittington W.L. Predicting chlamydial and gonococcal cervical infection: implications for management of cervicitis // Obstet. Gynecol. — 2002. — N 100. — Р. 579–584.
Monif G.R., Baker D.A. Infectious Diseases in Obstetrics and Gynecology. — 5th edition. — London: The Parthenon Publishing Group, 2004. — P. 723.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva, World Health Organization, 2005. — P. 186.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions. // STI. — 1999. — Vol. 75. — Suppl. 1 — P. 89.
Laboratory diagnosis of Neisseria gonorrhoeae in St. Petersburg, Russia: inventory, performance characteristics and recommended optimizations Unemo M. et al. // Sex. Transmitted Infect. — 2006. — Feb. 82 (1) — P. 41–44.
48.7. БЕРЕМЕННОСТЬ И ТРИХОМОНОЗ
Трихомоноз — ИППП, возбудителем которого является влагалищная трихомонада (Trichomonas vaginalis).
КОД ПО МКБ-10
А59 Трихомоноз.
А59.0 Урогенитальный трихомоноз. А59.8 Трихомоноз других локализаций. А59.9 Трихомоноз неуточнённый.
ЭПИДЕМИОЛОГИЯ
Трихомоноз — одна из распространённых инфекций среди всех ИППП. По данным ВОЗ, ежегодно в мире заболевают трихомонозом более 180 млн человек.
КЛАССИФИКАЦИЯ
В клинической классификации выделяют неосложнённые и осложнённые формы трихомоноза. По клиническому течению различают: свежий трихомоноз с давностью заболевания до 2 мес, имеющий острое, подострое и торпидное течение, а также хронический трихомоноз, протекающий более 2 мес.
ЭТИОЛОГИЯ
Возбудителем трихомоноза является Trichomonas vaginalis — простейшее из класса жгутиковых (Flagellata). Трихомонады вызывают заболевания урогенитального тракта как мужчин, так и женщин. Имеется лишь одна форма или стадия развития влагалищных трихомонад — трофозоит, цист Trichomonas vaginalis не образует. Паразит представляет собой клетку, ограниченную клеточной мембраной. Форма клетки овоидная или грушевидная с ядром, расположенным ближе к тому концу клетки, на котором расположены четыре жгутика. Вдоль клетки тянется ундулирующая мембрана, по всему телу проходит аксостиль. Величина клетки в длину — 10 мкм, в ширину — 5 мкм. Все элементы строения влагалищной трихомонады выявляют при специальных методах окраски, при обычных диагностических анализах ориентируются на величину клетки, её форму и подвижность.
ПАТОГЕНЕЗ
Присутствие трихомонад на слизистой оболочке органов мочеполового тракта приводит к развитию воспалительного процесса, а впоследствии к дегенеративноинфильтративным изменениям поражённых органов. Трихомонады могут фагоцитировать микроорганизмы, вызывающие ИППП (хламидии, гонококки). Благодаря подвижности трихомонад названные патогены распространяются на верхние отделы мочеполового тракта. Всё это способствует хроническому воспалению органов репродуктивной системы у женщин, результатом которого является спаечный процесс в полости малого таза и брюшной полости, и, как следствие, высокая вероятность внематочной беременности.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период составляет от 3 дней до 3–4 нед (в среднем 5–6 дней).
Клинические проявления трихомоноза зависят от локализации воспалительного процесса и тяжести его течения. К наиболее частым симптомам заболевания относят желтозелёные пенистые выделения с неприятным запахом, зуд, кольпит и цервицит, иногда явления уретрита. У 10–50% женщин заболевание протекает бессимптомно.
Осложнения гестации Существуют данные, указывающие на связь между наличием трихомоноза и преждевременными родами,
преждевременным излитием ОВ и низкой массой тела новорождённых. Точный механизм действия Trichomonas vaginalis на хорионамниотические оболочки пока не изучен. Неизвестно, способна ли Trichomonas vaginalis вызывать послеродовые инфекционные поражения как самостоятельно, так и в ассоциации с другими микроорганизмами.
У новорождённых, родившихся от инфицированных матерей, неонатальная инфекция встречается не часто (около 5%). В основном это проявления вульвита и вульвовагинита у девочек.
ДИАГНОСТИКА
Диагностика трихомоноза базируется на следующих критериях:
·данных анамнеза (указание на половой контакт с больным или возможно инфицированным трихомонадной инфекцией партнёром);
·оценке субъективных и объективных симптомов заболевания;
·обнаружении трихомонад при лабораторных исследованиях.
АНАМНЕЗ
Выявляют возможный источник инфицирования. Важно уточнить:
·время, прошедшее от момента последнего сексуального контакта с предполагаемым источником заражения до появления симптомов заболевания;
·результаты обследования полового партнёра на трихомоноз.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Необходимо тщательно осмотреть пациентку для исключения проявлений других ИППП. Оценивают состояние всех групп лимфатических узлов. Пальпируют все отделы живота, большие вестибулярные и парауретральные железы, уретру, проводят бимануальное влагалищное исследование.

ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Основной метод лабораторной диагностики трихомоноза — микроскопия нативного препарата (обнаружение подвижных форм трихомонад). В некоторых случаях проводят посев на специальные питательные среды. Чувствительность микроскопического исследования нативного и окрашенного метиленовым синим по Граму препарата составляет 40–60%, культурального метода — 95%.
В настоящее время отсутствуют рандомизированные клинические исследования, подтверждающие необходимость выполнения провокационной пробы для повышения эффективности диагностики трихомонадной инфекции.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Проводят кольпоскопию с целью выявления изменений шейки матки в любом периоде болезни.
СКРИНИНГ
Обследованию на трихомоноз подлежат следующие группы людей:
·женщины с клиническими проявлениями слизисто-гнойного цервицита, симптомами аднексита;
·лица, бывшие в половом контакте с больным трихомонозом;
·лица, проходящие обследование на другие ИППП.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с цервицитом хламидийной и неспецифической этиологии; аллергическим или химическим вульвовагинитом, вульвовагинитом другой этиологии; наличием инородного тела во влагалище; цервикальной, вагинальной или вульварной неоплазией. При наличии ВЗОМТ — с другими этиологическими факторами, прежде всего с гонорейной, хламидийной инфекциями, условнопатогенными микроорганизмами.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 15 нед. Неосложнённый трихомоноз нижних отделов мочеполового тракта (уретрит, цервицит).
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Основная цель лечения трихомоноза — эрадикация трихомонад.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Трихомоноз у беременных, осложнённое течение трихомонадной инфекции требует лечения в условиях стационара. Продолжительность лечения определяется характером клинических проявлений и степенью тяжести воспалительного процесса и составляет 2–4 нед.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Перед медикаментозным лечением трихомоноза все пациенты должны быть обследованы на другие ИППП и при необходимости пролечены.
До начала терапии у пациентки необходимо получить информированное согласие на лечение.
Половые партнёры больных трихомонозом должны быть обследованы и пролечены, даже при отсутствии у них трихомонад.
В I триместре беременности лечение протистоцидными препаратами не показано, так как в результате патогенного действия метронидазола у эмбриона и плода возможно поражение органов и систем, находящихся в процессе дифференцировки. Рекомендуют ежедневное смазывание мочеиспускательного канала и влагалища 4% водным раствором метиленового синего, бриллиантового зелёного или раствором марганцовокислого калия (1:10 000).
Со II триместра беременности применяют вагинальные свечи с метронидазолом (по 1 свече на ночь в течение 7 дней). В табл. 48-10 представлены схемы системной медикаментозной терапии у беременных.
При отсутствии результатов от лечения рекомендуется учесть следующие возможные причины:
·ложноположительный результат исследования;
·несоблюдение режима лечения, неадекватная терапия;
·повторный контакт с не леченым партнером;
·инфицирование от нового партнёра;
·инфицирование другими микроорганизмами.
Таблица 48-10. Медикаментозное лечение трихомоноза
Показания к применению Лекарственные средства выбора Альтернативные лекарственные средства
Трихомоноз у беременных (лечение проводят Орнидазол внутрь 1,5 г однократноТинидазол внутрь 2,0 г однократно |
||||||
со второго триместра)* |
|
перед сном |
|
|
|
перед сном |
|
|
или |
|
|
|
|
|
|
Метронидазол |
внутрь |
2,0 г |
|
|
|
|
однократно перед сном |
|
|
|
|
Примечание: Возможно одновременное применение местнодействующих протистоцидных и противовоспалительных препаратов.
*Следует с осторожностью назначать метронидазол и тинидазол на последних сроках беременности, непосредственно перед родами и в период лактации в связи с возможностью проявления мутагенных и канцерогенных эффектов.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценку эффективности лечения осуществляют на основании клиниколабораторных и инструментальных исследований, подтверждающих эрадикацию трихомонады и разрешение воспалительного процесса.
ВЕДЕНИЕ КОНТАКТНЫХ ЛИЦ
Одновременное обследование всех контактных лиц является обязательным условием успешного лечения. В период лечения рекомендуют исключить половые контакты или использовать презерватив.
ПРОФИЛАКТИКА
Профилактика трихомоноза включает мероприятия, общие для всех ИППП, и подразделяется на первичную и вторичную.
Первичная профилактика направлена на изменение модели поведения в группах высокого риска с целью избежать заражения. Необходимо вести пропаганду здорового образа жизни, безопасных форм сексуальных отношений через средства массовой информации, а также в учебных и медицинских учреждениях. Нужно доступно рассказывать о клинических проявлениях половых инфекций, путях заражения, способах профилактики с учётом образовательного уровня аудитории. Важно объяснять вред самолечения и лечения у непрофессионалов.
Вторичная профилактика направлена:
·на обследование и лечение пациентов с диагностированными ИППП, для снижения вероятности передачи инфекции своим половым партнёрам;
·на уменьшение риска повторного заражения среди больных или ранее перенёсших инфекцию людей;
·на эффективную диагностику и при необходимости лечение контактных лиц.
Обязательному обследованию и лечению подлежат все половые партнеры пациентов с симптомами трихомоноза, если они имели половой контакт в последние 14 дней.
При отсутствии симптомов заболевания у пациентки с трихомонозом обследованию подлежат все половые партнёры, вступавшие с ним в половой контакт за последние 60 дней.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Необходимо исключить половые контакты до полного выздоровления, строго соблюдать режим приёма лекарственных средств и своевременно явиться к врачу для определения критериев излеченности.
ПРОГНОЗ
Прогноз при своевременно начатом лечении благоприятный.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Приказ МЗ РФ №403 от 12.08.2003 «Об утверждении и введении в действие учётной формы №089/укв».
Протокол ведения больных «Урогенитальный трихомониаз» // Пробл. стандарт. в здравоохр. — 2005. — № 2. – С. 130–145.
Инфекции, передаваемые половым путём / Е.В. Соколовский и др. Руководство для врачей. — М.: Медпрессинформ, 2006. — 256 с.
Canadian STD Guidelines. — Canada, 1998. — 239 р.
Drug resistance in the sexually transmitted protozoan Trichomonas vaginalis. R.L. Dunne et al. // Cell Research. — 2003. — 13 (4). — P. 236–249.
European STD Guidelines. Ed.: K. Radcliffe // International Journal of STD AIDS. — 2001. — 12, Suppl 3. — 107 p.
Fugere P., Verschelden G., Caron M. Single oral dose of ornidasol in women with vaginal trichomoniasis // Obstet. Gynecol. — 1983. – Vol. 62, N4. – P. 502–505.
Guidelines for the Management of Sexually Transmitted Infections. — WHO, 2001. — 79 p.
Gulmezoglu A.M., Garner P. Trichomoniasis treatment in women: a systematic review // Trop. Med. Int. Health. — 1998. — Vol. 3, N 7. — P. 553–558.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections — a practical guide // London: WBS, 1999. — 509 p.
Monif G.R.G, Baker D.A. Infectious Diseases in Obstetrics and Gynecology. — 5th edition.— London: The Parthenon Publishing Group, 2004. — 723 p.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva, World Health Organization, 2005. — 186 р.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions.// STI, 1999. — Vol. 75, Suppl.1. — 89 p.
Doublestranded RNA viral infection of Trichomonas vaginalis infecting patients attending a sexually transmitted diseases clinic. K.A. Wendel [et al.]. // Infect. Dis. J. — 2002. — 186 (4). — P. 558–561.
48.8. БЕРЕМЕННОСТЬ И ТУБЕРКУЛЁЗ Туберкулёз — специфическое инфекционновоспалительное заболевание с преимущественным деструктивным
поражением лёгочной ткани, вызываемое микобактериями туберкулёза.
СИНОНИМЫ
Беременность и роды при специфических инфекциях.
КОД ПО МКБ-10
O00–O99 Беременность, роды и послеродовый период. A15–A19 Туберкулёз.
ЭПИДЕМИОЛОГИЯ ТУБЕРКУЛЁЗА
Туберкулёз — одно из самых распространённых заболеваний в мире. В России в 2003 г. на 100 000 жителей приходилось 86 человек, больных туберкулёзом. Максимально подвержены заболеванию туберкулёзом молодые: 70% больных — это лица 20–40 лет. Сочетание туберкулёза и беременности составляет 3–7 случаев на 10 000 родов.
У беременных:
·обычно обнаруживают одностороннее поражение; двусторонний туберкулёз наблюдают в 22% случаев;
·инфильтративная форма туберкулёза преобладает над очаговой и встречается в 58% случаев;
·нередко регистрируют случаи туберкулёза на стадии распада (18%), а в 64% случаев беременные оказываются
выделителями микобактерий; · внелёгочные формы туберкулёза казуистичны.
Туберкулёз часто сочетается с другими специфическими инфекциями: ВИЧ-инфекцией (15%), сифилисом (10%) и вирусными гепатитами (4%).
СКРИНИНГ
Важную роль в диагностике туберкулёза при беременности играет флюорография членов семьи. Туберкулиновые пробы широко используют при массовых обследованиях на инфицированность микобактериями. В диагностике активных форм туберкулёза они неэффективны в связи с низкой чувствительностью и специфичностью.
КЛАССИФИКАЦИЯ
Различают туберкулёз лёгких и внелёгочный туберкулёз; первичный и вторичный туберкулёз.
ЭТИОЛОГИЯ
К возбудителям туберкулёза относят Mycobacterium tuberculosis, Mycobacterium bovis и Mycobacterium africanum. Эти три вида микобактерий объединяют в комплекс Mycobacterium tuberculosis.
Путь передачи возбудителя — воздушно-пылевой.
Риск заражения зависит от характера и продолжительности контакта с источником инфекции. Высока вероятность заражения среди асоциальных слоёв населения.
ПАТОГЕНЕЗ
После заражения Mycobacterium tuberculosis альвеолярные макрофаги выделяют цитокины: ИЛ-1, ИЛ-6 и фактор некроза опухолиa. В результате начинается пролиферация лимфоцитов CD4+, играющих роль в защите от Mycobacterium tu-berculosis. С развитием клеточного иммунитета и накоплением в первичном очаге большого количества активированных макрофагов формируется туберкулёзная гранулёма.
Патогенез осложнений гестации Специфичности влияния туберкулёза на течение беременности, родов и послеродовый период не установлено.
Практически все изменения, обнаруживаемые у беременной, роженицы или родильницы, характеризуются как типовая реакция организма на воспаление.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническое значение у беременных имеет массивное поражение лёгочной ткани, когда появляются признаки дыхательной недостаточности, а в отдельных случаях развивается РДС.
При туберкулёзном процессе у беременных отмечают увеличение количества анемий (24%), ранних и поздних гестозов (18%), ПН (20%), несвоевременного излития ОВ (12%). Неосложнённое течение беременности регистрируют в 46,0%.
Преждевременные роды при туберкулёзе наблюдают в 6% случаев, а запоздалые роды крайне редки. Физиология родового акта характеризуется высокой стабильностью и не подвержена влиянию специфических инфекционных заболеваний. Туберкулёз не оказывает влияния ни на один из периодов родов.
Послеродовый период у родильниц в большинстве случаев имеет благоприятное течение.
От матерей, страдающих туберкулёзом лёгких, 82,0% детей рождаются практически здоровыми. В структуре патологии новорождённых, связанной с течением беременности, в 66,7% случаев — это замедление роста и недостаточность питания плода, а в остальных — расстройства, связанные с укорочением срока беременности и малой массой тела при рождении. ВПР плода и родовые травмы встречаются не чаще, чем при физиологически протекающих беременности и родах.
Есть значимые различия в динамике веса среди новорождённых от здоровых матерей и матерей, страдающих туберкулёзом, но кривые снижения веса идентичны. У таких новорождённых наблюдают нарушения периода адаптации, что сопровождается изменениями со стороны ЦНС, развитием дыхательных расстройств.
ДИАГНОСТИКА
К основным методам диагностики туберкулёза относят микроскопию, бактериологическое исследование, рентгенологические исследования и туберкулиновые пробы. При подозрении на внелёгочный туберкулёз также показаны инвазивные диагностические процедуры.
У пациенток с туберкулёзом перед родами изменения в общем анализе крови не носят специфического характера, а количество лейкоцитов, нейтрофилов и лейкоцитарная формула практически не отличаются от нормативных показателей.
Содержание белка крови у женщин с туберкулёзом лёгких достоверно выше, чем у практически здоровых, что обусловлено гиперглобулинемией.
При туберкулёзе во время беременности и после родов обнаруживают дефицит Т-хелперов, значительное угнетение функционального состояния нейтрофилов крови, увеличение числа CD8+ Т-лимфоцитов, а также увеличение содержания циркулирующих иммунных комплексов на фоне некоторого снижения активности иммуноглобулинов класса А и М. Концентрация IgG находится в пределах физиологической нормы.
АНАМНЕЗ
Особое внимание необходимо обратить на социальный статус пациентки. Риск развития активного туберкулёза повышается на фоне силикоза, лимфом, лимфогранулематоза, лейкозов, других злокачественных новообразований, гемофилии, СД 1-го типа, иммуносупрессивной терапии, истощения. Кроме того, важна регистрация контактов беременной с больными туберкулёзом.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Данные физикального исследования при туберкулёзе лёгких скудны. У большинства при аускультации изменений не обнаруживают, в остальных случаях над поражёнными участками выслушивают влажные хрипы.
Методика физикального исследования и его картина при оценке гинекологического статуса ничем не отличается от таковой у здоровых.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При лабораторных исследованиях чаще всего находят лёгкую анемию и лейкоцитоз, а иногда гипонатриемию. Диагноз основывается на обнаружении микобактерий в мазках мокроты или в биоптатах. Сейчас применяют новые методы (радиометрический и метод олигонуклеотидных зондов) для идентификации возбудителя и обнаружения специфических участков ДНК микобактерий с помощью ПЦР.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Подозрение на туберкулёз лёгких возникает при обнаружении изменений на обзорной рентгенограмме грудной клетки. Для улучшения визуализации показано проведение спиральной КТ. Однако ни один рентгенологический признак не считают патогномоничным.
При подозрении на активный туберкулёз лёгких необходимо проведение рентгенологического исследования независимо от срока беременности. При рентгено-графии у беременных используют средства, которые сводят к минимуму возможность лучевого повреждения плода.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Основные заболевания, с которыми следует дифференцировать туберкулёз лёгких, — очаговая пневмония и новообразования. Для уточнения диагноза туберкулёза внелёгочной локализации используют МРТ, ультрасонографию, эндоскопические методы.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Планирование и ведение беременности, родов и послеродового периода у больной туберкулёзом необходимо осуществлять совместно с фтизиатром.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 38 нед, инфильтративный туберкулёз левого лёгкого (M. tuberculosis –).
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Цель — лечение активного туберкулёзного процесса и связанных с ним осложнений, таких, как кровотечение и дыхательная недостаточность.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
При обнаружении туберкулёза у беременных необходимо начать комплексную специфическую терапию. Плановую госпитализацию при туберкулёзе проводят три раза: в первые 12 недель беременности, на 30–36 и 36–40 неделях. В остальные месяцы беременности лечение проводят в туберкулёзном диспансере.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Показано санаторнокурортное лечение и фитотерапия, а также богатая белками диета.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Противотуберкулёзные средства (табл. 48-11) подразделяют на препараты первого и второго ряда. Курс лечения включает двухмесячный первый этап (бактерицидный) и четырехмесячный второй этап (стерилизующий).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Оперативное вмешательство выполняют при осложнениях туберкулёза лёгких по жизненным показаниям. Прерывание беременности при туберкулёзе показано при:
·фиброзно-кавернозном туберкулёзе лёгких;
·активной форме туберкулёза костей и суставов;
·двустороннем туберкулёзе почек.
При наличии показаний прерывание беременности следует проводить в ранние сроки. Прерывание в более поздние сроки выполняют по решению клиникоэкспертной комиссии.
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ
Среди беременных к группам высокого риска относят:
·пациенток с недавно перенесённым туберкулёзом — менее одного года после окончания лечения;
·пациенток моложе 20 лет и старше 35 лет с туберкулёзом любой локализации;
·беременных с распространённым туберкулёзным процессом независимо от его фазы;
·беременных, имеющих контакты с больными туберкулёзом;
·беременных с впервые установленным виражом, гиперэргической или нарастающей туберкулиновой чувствительностью (по пробе Манту с 2 ТЕ).
Таблица 48-11. Противотуберкулёзные препараты, применяемые во время беременности
Препараты |
Дозы |
|
|
|
|
При беременности |
|
При грудном вскармливании |
||||||
|
|
|
|
|||||||||||
Изониазид |
Энтерально 4–6 мг/кг в |
С осторожностью. Возможны задержка |
С осторожностью. Проникает в |
|||||||||||
|
сутки в один приём. |
|
психомоторного |
развития ребёнка, |
грудное |
молоко. |
Возможно |
|||||||
|
Парентерально |
0,2– |
миеломенингоцеле, |
гипоспадия, |
развитие |
гепатита |
и |
|||||||
|
0,3 г в сутки |
|
|
|
|
геморрагии |
(в |
результате |
периферического |
неврита |
у |
|||
|
|
|
|
|
|
гиповитаминоза К) |
|
|
ребёнка |
|
|
|
||
|
|
|
|
|
|
|
||||||||
Пиразинамид |
1,5–2 г/сут в один приём |
С |
осторожностью. |
Данных |
об |
С осторожностью. Проникает в |
||||||||
|
или 2–2,5 г/сут 3 раза в |
увеличении |
числа |
врождённых |
грудное |
|
молоко. |
|||||||
|
неделю |
|
|
|
|
аномалий нет |
|
|
|
Отрицательного |
влияния |
не |
||
|
|
|
|
|
|
|
|
|
|
|
обнаружено |
|
|
|
Этамбутол |
15–20 мг/кг |
в |
сутки |
в |
|
|
|
|
|
|
— // — |
|
||
|
один приём |
или |
30– |
|
|
|
|
|
|
|
|
|
||
|
40 мг/кг |
3 раза |
|
в |
|
|
|
|
|
|
|
|
|
|
|
неделю |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Протионамид |
15–20 мг/кг |
в |
сутки |
не |
С |
осторожностью. |
Данных |
об |
С осторожностью |
|
|
|||
|
более 1 г в 1–3 приёма |
увеличении |
числа |
врождённых |
|
|
|
|
||||||
|
|
|
|
|
|
аномалий нет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Рифабутин |
0,15–0,6 г/сут |
в |
один |
Противопоказан |
|
|
|
Противопоказан |
|
|
||||
|
приём |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Этионамид |
15–20 мг/кг |
в |
сутки |
не |
Противопоказан. |
|
Тератогенное |
С осторожностью |
|
|
||||
|
более 1 г в 1–3 приёма |
действие у животных |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Капреомицин |
15–30 мг/кг |
в |
сутки |
не |
Противопоказан. |
|
Капреомицин |
Противопоказан |
|
|
||||
|
более |
|
|
|
1 г |
обладает тератогенным |
действием |
у |
|
— // — |
|
|||
|
внутримышечно |
|
|
животных |
|
|
|
|
— // — |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
— // — |
|
|

Циклосерин |
По 0,25 г 2 раза в день |
Противопоказан |
|
||
|
2 нед, затем 10–20 мг/кг |
|
— // — |
||
|
в сутки в два приёма |
|
|
— // — |
|
|
|
|
|
|
|
Аминосалициловая |
10–12 г/сут |
в |
3– |
|
|
кислота |
4 приёма |
|
|
|
|
|
|
|
|
||
Тиоацетазон |
2,5 мг/кг в сутки в один |
|
|
||
|
приём |
|
|
|
|
|
|
|
|
|
|
Эти женщины с ранних сроков беременности должны наблюдаться акушером-гинекологом совместно с фтизиатром. Их необходимо госпитализировать при возникновении осложнений.
ПРИМЕРНЫЕ СРОКИ НЕТРУДОСПОСОБНОСТИ
Сроки нетрудоспособности определены Федеральным законом «Об обеспечении пособиями по временной нетрудоспособности по беременности и родам граждан, подлежащих обязательному социальному страхованию».
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Лечение туберкулёза лёгких может продолжаться не только в течение всего периода беременности, но и во время лактации. В том случае, если терапия была начата своевременно и проведена рационально, то к моменту родов и в послеродовом периоде, как правило, наблюдают положительную клиникорентгенологическую динамику течения заболевания.
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
Роды стараются вести через естественные родовые пути. Показанием к КС считают тяжёлую акушерскую патологию (клинически и анатомически узкий таз, предлежание плаценты, значительное кровотечение при неподготовленных родовых путях, поперечное положение плода).
ПРОФИЛАКТИКА ТУБЕРКУЛЁЗА У НОВОРОЖДЁННЫХ
Всех новорождённых необходимо подвергать профилактической вакцинации БЦЖ.
После выписки из родильного дома женщина и новорождённый должны находиться под наблюдением в туберкулёзном диспансере, женской и детской консультациях.
Новорождённых от матерей с активным туберкулёзом необходимо изолировать сразу после первичной обработки. Грудное вскармливание разрешается всем родильницам с неактивным туберкулёзом. Вопрос о возможности вскармливания новорождённых родильницами, у которых прекратилось выделение микобактерий, решает консилиум с участием фтизиатра, акушерагинеколога и педиатра. Если принято положительное решение о кормлении новорождённого грудью, то на протяжении всего периода вскармливания проводят антибактериальную терапию.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
При планировании беременности рекомендовано обследование на инфицированность туберкулёзом (проведение флюорографии, постановка туберкулиновой пробы).
ПРОГНОЗ
Ранняя диагностика и раннее начало лечения туберкулёза у беременных обеспечивают благоприятный исход беременности и родов для матери и плода.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Каюкова С.И. Взаимовлияние беременности, родов, послеродового периода и туберкулёза органов дыхания у женщин в условиях мегаполиса: Дис. … канд. мед. наук. — М.: 2004. — 136 с.
Омарова Х.М. Родовспоможение при туберкулёзе у женщин: Дис. … канд. мед. наук. — М.: 2000. — 136 с. Страчунский Л.С., Козлов С.Н. Современная антимикробная химиотерапия. — М.: Боргес, 2002. — 436 с. Чеботарева Т.В. Проблема туберкулёза и материнства // Вестн. Ивановской медицинской академии. — 2000. — Т. 5, №1. — С. 57–61.
Bothamley G. Drug treatment for tuberculosis during pregnancy: safety considerations // Drug. Saf. — 2001. — Vol. 24, №7. — P. 553–565.
Czeizel A.E., Rockenbauer M., Olsen J. et al. A population-based case-control study of the safety of oral anti-tuberculosis drug treatment during pregnancy // Int. J. Tuberc. Lung. Dis. — 2001. — Vol. 5, №6. — P. 564–568.
Figueroa-Damian R., Arredondo-Garcia J.L. Neonatal outcome of children born to women with tuberculosis // Arch. Med. Res. — 2001. — Vol. 32, №1. — P. 66–69.
Lessnau K.D., Qarah S. Multidrug-resistant tuberculosis in pregnancy: case report and review of the literature // Chest. — 2003. — Vol. 123, №3. — P. 953–956.
Ray M., Goraya J.S., Basu S. et al. Perinatal tuberculosis // Indian J. Pediatr. — 2001. — Vol. 68, №4. — P. 343–345.
Shin S., Guerra D., Rich M. et al. Treatment of multidrug-resistant tuberculosis during pregnancy // Clin. Infect. Dis. — 2003. — Vol. 36, №8. — P. 996–1003.
Toyota E., Minoura S., Miyazawa H. Management of tuberculosis during pregnancy and puerperium // Kekkaku. — 2002. — Vol. 77, №11. — P. 703–708.
48.9. БЕРЕМЕННОСТЬ И ВИРУСНЫЕ ГЕПАТИТЫ Вирусные гепатиты — группа заболеваний человека, вызванных различными гепатотропными вирусами с
множественными механизмами передачи и проявляющихся преимущественным поражением печени с нарушением её функций, интоксикационным, диспепсическим синдромами и нередко гепатомегалией и желтухой.
Группу наиболее распространённых и изученных вирусных гепатитов |
человека |
составляют гепатит А, гепатит В, |
|||||||
гепатит С, гепатит D, гепатит Е (табл. 48-12). Обсуждаются новые кандидаты на роль возбудителей гепатитов. Это |
|||||||||
вирусы G, F, TTV, SEN V и др. Серьёзную проблему в наши дни представляют микстгепатиты. |
|||||||||
Таблица 48-12. Характеристика основных типов вирусных гепатитов |
|
|
|
|
|
|
|||
Вирус |
HAV |
HBV |
|
HCV |
|
HDV |
|
HEV |
|
|
|
|
|
|
|
|
|
|
|
Семейство |
|
Picornaviridae |
|
Hepadnaviridae |
|
Flaviviridae |
|
Satellite |
|
Calcilike |
|
|
|
|
|
|
|
|
|
|
|
Род |
|
Heparnavirus |
|
Hepadnavirus |
|
Hepacivirus |
|
- |
|
Calcivirus |
|
|
|
|
|
|
|
|
|
|
|
Геном |
|
+ RNA |
|
+ DNA |
|
+RNA |
|
- RNA |
|
+ RNA |
|
|
|
|
|
|
|
|
|
|
|
Размер |
|
27 нм |
|
42 нм |
|
38 нм |
|
35 нм |
|
27 нм |
|
|
|
|
|
|
|
|
|
|
|
Передача: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
фекально-оральная; |
|
+++ |
|
- |
|
- |
|
- |
|
+++ |
|
|
|
|
|
|
|||||
гемоконтактная; |
|
- |
|
+++ |
|
+++ |
|
+++ |
|
- |
|
|
|
|
|
|
|||||
половая; |
|
-/+ |
|
+++ |
|
+ |
|
+ |
|
- |
|
|
|
|
|
|
|||||
вертикальная |
|
- |
|
+++ |
|
+ |
|
+ |
|
- |
|
|
|
|
|
|
|
|
|
|
|
Инкубация (дни) |
|
15–45 |
|
40–120 |
|
15–50 |
|
25–75 |
|
20–80 |
|
|
|
|
|
|
|
||||
Риск хронизации |
|
- |
|
взрослые <10%новорождённые |
|
>80% |
|
>50% |
|
- |
|
|
|
|
|
|
|||||
Рак печени |
|
- |
|
>90% + |
|
++ |
|
+ |
|
- |
|
|
|
|
|
|
|
|
|||
Профилактика |
|
вакцина |
|
вакцина |
|
- |
|
- |
|
- |
|
|
|
|
|
|
|
|
|
|
|
ВИРУСНЫЕ ГЕПАТИТЫ С ФЕКАЛЬНО-ОРАЛЬНЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ ГЕПАТИТ A
Гепатит A — острая циклическая вирусная инфекция с фекально-оральной передачей возбудителя, характеризующаяся нарушением функций печени.
Синонимы
Hepatitis А.
КОД ПО МКБ-10
B15 Острый гепатит A.
ЭПИДЕМИОЛОГИЯ
Гепатит A — кишечная инфекция, строгий антропоноз. Источник инфекции — больные инаппарантными и манифестными формами гепатита A. Наибольшее эпидемиологическое значение имеют лица с субклиническими, стёртыми и безжелтушными формами заболевания, число которых может многократно превышать число больных с желтушными формами гепатита А. Инфицирование контактных лиц возможно уже с конца инкубационного периода, наиболее интенсивно продолжается во время продромального (преджелтушного) периода и сохраняется в первые дни разгара болезни (желтухи). Общая продолжительность выделения вируса с фекалиями обычно не превышает 2– 3 нед. В последние годы показано, что вирусемия при гепатите А может быть более продолжительной (78–300 дней и более).
Фекальнооральный механизм передачи возбудителя реализуется водным, пищевым и контактнобытовым путём с безусловным преобладанием водного пути, который и обеспечивает вспышки и эпидемии гепатита А.
Доказана возможность гемоконтактного (парентерального) пути передачи вируса гепатита А (около 5%) от больных манифестными и инаппарантными формами инфекции (посттранфузионное заражение гепатитом А больных гемофилией, инфицирование внутривенных потребителей наркотических средств).
Не исключается половой путь передачи возбудителя, которому способствует промискуитет, наличие других ИППП, нетрадиционное проведение полового акта (прежде всего оральноанальные контакты).
Встречается преимущественно у детей и молодых людей; в последние годы заметно участились случаи гепатита А у людей старше 30 лет и даже 40 лет. Для заболевания характерна сезонность (в основном, летнеосенний период). Периодичность подъёмов и спадов заболевания колеблется от 5 до 20 лет.
Восприимчивость к гепатиту А высокая.
КЛАССИФИКАЦИЯ
Выделяют инаппарантную (субклиническую) и манифестную формы гепатита А. Последняя включает стёртую, безжелтушную и желтушную формы. По тяжести течения различают лёгкую, средней тяжести и тяжёлую формы, по течению — острую и затяжную. Хронические формы гепатита А не наблюдают.
ЭТИОЛОГИЯ
Возбудитель — Hepatitis A virus (HAV) — относят к семейству Picornaviridae, роду Hepatovirus. Открыт в 1973 году С. Фейнстоуном. HAV — мелкий вирус, содержащий рибонуклеиновую кислоту (РНК), имеет один специфический Аг (HAAg), обладающий высокой иммуногенностью. Известны четыре генотипа HAV, которые принадлежат к одному серотипу, что служит причиной развития перекрёстного иммунитета.
АнтиHAV IgM циркулируют в крови с первых дней болезни короткое время (2–4 мес), а появляющиеся позже HAV IgG сохраняются в организме длительное время.
Вирус гепатита А весьма устойчив в окружающей среде, однако чувствителен к ультрафиолетовому облучению и кипячению (погибает через 5 мин).
ПАТОГЕНЕЗ
Входные ворота — слизистые оболочки ЖКТ. В эндотелии сосудов тонкой кишки и мезентеральных лимфатических узлах происходит первичная репликация вируса. Затем следует вирусемия (в клинической картине проявляется интоксикационным синдромом), вслед за которой происходит диссеминация возбудителя в печень (следствие гепатотропности вируса). Репликация HAV в гепатоцитах приводит к нарушению функций клеточных мембран и внутриклеточного обмена с развитием цитолиза и дистрофии клеток печени. Одновременно с цитопатическим действием вируса (при гепатите А ведущий) определённую роль отводят иммунным повреждающим механизмам. В результате развиваются характерные для гепатитов клиникобиохимические синдромы — цитолитический, мезенхимальновоспалительный, холестатический.
Патогенез осложнений гестации Патогенез осложнений гестации при гепатите А изучен недостаточно, в том числе из-за их большой редкости.
КЛИНИЧЕСКАЯ КАРТИНА
Гепатит А отличается полиморфизмом клинических проявлений и самолимитирующим характером с обратимыми структурно-функциональными изменениями печени.
По частоте преобладает инаппарантная форма, диагностика её возможна только с помощью ИФА при обследовании контактных и больных лиц (в эпидемических очагах).
Манифестные формы протекают с последовательной сменой периодов: инкубационного, продромального (преджелтушного при желтушной форме заболевания), разгара (желтушного при наличии желтухи), реконвалесценции. Нечасто, но возможны рецидивы и осложнения инфекции.
Продолжительность инкубационного периода в среднем составляет 15–45 дней. Продромальный период продолжается 5–7 дней, протекает с разнообразной клинической симптоматикой. По ведущему синдрому принято выделять гриппоподобный (лихорадочный), диспепсический, астеновегетативный и наиболее часто наблюдаемый смешанный вариант продрома с соответствующими клиническими проявлениями.
Через 1–4 дня после первых признаков заболевания изменяется цвет мочи (до коричневого цвета разной интенсивности), обесцвечивается кал (ахолия), приобретая консистенцию и цвет белой (серой) глины. Уже в продромальный период возможна гепатомегалия с болезненностью печени при пальпации. Иногда незначительно увеличивается и селезёнка.
Период разгара продолжается в среднем 2–3 нед (с колебаниями от 1 нед до 1,5–2 мес, при развитии рецидива — до 6 мес и более). Начало этого периода при желтушной форме знаменуется желтушным прокрашиванием видимых слизистых оболочек и кожи. При этом самочувствие больных заметно улучшается, признаки продромального периода смягчаются или исчезают совсем. Вместе с тем увеличение печени может продолжаться — больных беспокоят тяжесть и распирание в эпигастральной области, умеренные боли в правом подреберье. В 1/3 случаев в этот период отмечают спленомегалию.
С исчезновением желтухи, восстановлением нормального цвета мочи и кала наступает период реконвалесценции. Его длительность колеблется от 1–2 до 8–12 мес (в зависимости от наличия или отсутствия рецидивов, обострений и особенностей течения заболевания).
Стёртые и безжелтушные формы гепатита А протекают обычно легко, малосимптомно, с быстрым выздоровлением. Частота затяжных манифестных форм не превышает 5–10%, в этих случаях отмечают увеличение либо периода разгара, либо периода реконвалесценции (с рецидивами, обострениями или без них) с последующим клиниколабораторным выздоровлением.
Гепатит А у беременных протекает так же, как у небеременных. Риска антенатальной передачи возбудителя нет. Осложнения гестации При редких тяжёлых и затяжных формах гепатита А возможны преждевременные роды, в единичных случаях —
самопроизвольные выкидыши. Возможны угроза прерывания беременности, преждевременное или раннее излитие ОВ. У беременных, болеющих гепатитом А, как и при других экстрагенитальных заболеваниях, несколько чаще, чем в популяции, развиваются ранний токсикоз, гестоз (в том числе в родах).
ДИАГНОСТИКА
Анамнез Диагноз гепатита устанавливают на основании эпидемиологических предпосылок (контакт с больным гепатитом А),
анамнестических данных (симптомокомплексы продромального периода), указаний на потемнение мочи и ахолию кала.
Физикальное исследование При объективном обследовании основными симптомами выступают желтушность видимых слизистых оболочек
(уздечка языка, склеры), кожных покровов, незначительное или умеренное увеличение и чувствительность/болезненность печени при пальпации, значительно реже — небольшая спленомегалия. Лабораторные исследования Наиболее постоянным и диагностически значимым биохимическим признаком гепатита считают повышение
активности печёночноклеточного фермента АЛТ в 10 раз и более по сравнению с нормой. Гипертрансфераземия — главный маркёр синдрома цитолиза. Нарастание активности АЛТ начинается уже в конце продромального периода, достигает максимума в период разгара гепатита, постепенно снижается и нормализуется в период реконвалесценции, свидетельствуя о выздоровлении. Гиперферментемия свойственна не только желтушным, но и безжелтушным формам гепатита. Нарушение пигментного обмена знаменуется появлением уробилиногена и желчных пигментов в моче, увеличением содержания билирубина в крови, главным образом, конъюгированного (связанный, прямой билирубин). Мезенхимально-воспалительный синдром выявляют определением белковоосадочных проб. При гепатитах тимоловая проба повышается, а сулемовый титр снижается. Степень их отклонения от нормы пропорциональна тяжести течения инфекции. Во многих случаях отмечают гипохолестеринемию из-за снижения его синтеза повреждёнными гепатоцитами. Для гепатитов, протекающих без бактериальных наслоек, характерна лейкопения, нейтропения, относительные и абсолютные лимфоцитоз и моноцитоз, нормальная СОЭ (нередко 2– 3 мм/ч).
Верификация гепатита А достигается использованием ИФА. Диагноз гепатита А считают подтверждённым при определении в сыворотке крови анти-HAV IgM в продромальный период и в период разгара. АнтиHAV IgG обнаруживают обычно уже в период реконвалесценции.
Инструментальные исследования При проведении ультразвукового сканирования иногда определяют диффузные изменения печени и повышение её
эхогенности. Характерных признаков гепатитов при УЗИ нет. Дифференциальная диагностика
Гепатит А дифференцируют прежде всего с другими этиологическими формами гепатита (В и С, микстгепатиты), поскольку в 40–70% случаев желтухи у беременных имеют вирусную природу. Основа их разграничения — использование и правильная трактовка результатов ИФА. Иногда возникает необходимость дифференцировать вирусные гепатиты, в том числе гепатит А, от так называемых гепатитовспутников (при инфекционном мононуклеозе, псевдотуберкулёзе, кишечном иерсиниозе, лептоспирозе и т.д.). В этих случаях основа разграничения поражения печени — правильная оценка симптомов, не просто сопутствующих гепатиту-спутнику, а определяющих клинический облик заболеваний. Окончательное решение проблемы дифференциации вирусных гепатитов и других инфекционных поражений печени — использование соответствующих специфических бактериологических и серологических методов исследования.
В ряде случаев более трудна дифференциальная диагностика вирусных гепатитов и желтух, непосредственно связанных с беременностью. При ХГБ на первый план выходит кожный зуд различной интенсивности при обычно мало выраженной желтухе. Гепатоспленомегалии при ХГБ не бывает, равно как интоксикации. Для гепатоза характерен лейкоцитоз и увеличение СОЭ. Содержание конъюгированного билирубина в сыворотке повышается незначительно, гиперферментемии (АЛТ) в большинстве случаев нет. Однако у некоторых беременных активность АЛТ всё-таки бывает повышенной — такие варианты наиболее сложны для дифференциальной диагностики. Содержание холестерина, как правило, повышено. Наконец, при ХГБ отсутствуют маркёры вирусных гепатитов (исключения из этого правила возможны, если ХГБ развивается на фоне хронических гепатитов В и С, т.е. при сочетанной патологии, частота которой в последние годы возрастает повсеместно).
Наибольшие трудности возникают при разграничении тяжёлых форм гепатитов (чаще гепатита В) и синдрома Шихана — острого жирового гестоза беременных. Их клиническое сходство может быть очень значительным. Правильной дифференциации гепатитов и острого жирового гестоза беременных больше всего способствует развёрнутое биохимическое исследование, особенно при указаниях на лечение беременной антибиотиками тетрациклинового ряда в больших дозах в III триместре гестации. Печень при остром жировом гестозе беременных обычно не увеличена, отмечают признаки ДВС-синдрома, гипопротеинемию (часто с асцитом), азотемию, высокий лейкоцитоз. Содержание прямого (конъюгированного) билирубина повышается умеренно или мало, активность маркёров цитолиза (АЛТ, АСТ) невелика. Активность ЩФ повышена, сулемовая проба снижена, однако эти показатели не имеют дифференциальнодиагностической ценности, поскольку характерны и для гепатитов, равно как и снижение протромбина. Напротив, высоко информативны гипогликемия, почти не поддающаяся коррекции, и декомпенсированный метаболический ацидоз, свойственные острому жировому гестозу беременных и нехарактерные для гепатитов. Маркёры гепатитов отсутствуют, если речь не идёт о сочетанной патологии.
В настоящее время редкий вариант дифференциальной диагностики — гепатиты и гестоз с поражением печени. Последний — крайняя степень выраженности гестоза со всеми его проявлениями, неуклонно нарастающими по времени при неадекватной терапии тяжёлой нефропатии. Биохимические признаки цитолиза, пигментных нарушений выражены при гестозе умеренно или мало и не коррелируют с тяжестью других проявлений осложнения беременности и общего состояния больной.
Изредка возникают ошибки диагностики вирусных гепатитов, в первую очередь гепатита А, у беременных с желтухой, возникающей при тяжёлом раннем токсикозе. В этом случае на первый план выступает многократная «чрезмерная» рвота и обезвоживание. Течение осложнения, в отличие от гепатита, не имеет цикличности, желтуха выражена слабо, интоксикационный синдром представлен незначительно, печень и селезёнка остаются в пределах обычных размеров. Содержание билирубина редко превышает норму больше чем в 2 раза и увеличивается обычно за счёт неконъюгированной (непрямой, несвязанной) фракции. Повышения активности АЛТ обычно нет, как нет и ДВСсиндрома. Нередко при токсикозе развивается ацетонурия, чего не бывает при гепатитах. Наконец, при раннем токсикозе не определяются иммуносерологические маркёры гепатитов.
При дифференциации гепатита А (и других гепатитов) с HELLP-синдромом опорными моментами считают наличие при последнем гемолитической анемии, тромбоцитопении, повышения уровня неконъюгированного (непрямого, свободного) билирубина. АГ может помочь в дифференциальной диагностике, так как при гепатите А отмечают тенденцию к гипотонии (если больной не страдает гипертонической болезнью или почечной патологией). Отягощающее влияние на течение HELLP-синдрома гепатит А не оказывает.
Показания к консультации других специалистов При появлении синдрома желтухи (желтушное прокрашивание видимых слизистых оболочек и кожных покровов,
потемнение мочи, ахолия кала, повышенное содержание билирубина), гепатомегалии, спленомегалии, интоксикационного синдрома и лихорадки, повышения активности печёночноклеточных ферментов (АЛТ) на фоне лейкопении и нормальной/сниженной СОЭ показана консультация инфекциониста и его совместное с акушером наблюдение за беременной.
Пример формулировки диагноза Вирусный гепатит А, желтушная форма, тяжёлое течение. Рецидив от 05.05.2007. Беременность 32–34 недели.
ЛЕЧЕНИЕ
Немедикаментозное лечение Большинство больных гепатитом А, в том числе беременных, не нуждаются в активной медикаментозной терапии.
Основой лечения больных считают щадящий режим и рациональную диету. В период разгара инфекции показан постельный режим. Важен объём потребляемой жидкости (лучше щёлочной минеральной) — не менее 2–3 л в сутки. В течение 6 мес после выздоровления ограничивают физические нагрузки и рекомендуют щадящую (механически и термически) диету с исключением острых, жирных продуктов и алкоголя.
Медикаментозное лечение При выраженной интоксикации проводят внутривенную дезинтоксикацию (солевые растворы, 5% раствор глюкозы,
декстраны, альбумин). Хороший эффект дают дезинтоксиканты для приёма внутрь: полифепан©, повидон, регидрон© и др.
В период реконвалесценции для восстановления нарушенного метаболизма назначают поливитамины, гепатопротекторы (силибинин, эссенциале© и т.п.). При постгепатитных дискинезиях желчевыводящих путей назначают спазмолитики (лучше атропинового ряда, в т.ч. красавку, беладонну) и желчегонные средства.
Хирургическое лечение Хирургическое лечение гепатита А не проводят. Прерывание беременности при гепатитах не показано, поскольку
может ухудшить прогноз заболевания. Исключения — возникновение отслойки плаценты с кровотечением, угроза разрыва матки.
Профилактика и прогнозирование осложнений гестации В последние 10–15 лет госпитализация больных с гепатитом А необязательна. Больные могут пребывать в домашних
условиях под наблюдением врача амбулаторной службы (исключение — лица, проживающие в общежитиях, что продиктовано противоэпидемическими соображениями).
Что касается беременных с гепатитом А, то их следует госпитализировать в инфекционный стационар для контроля и своевременного выявления угрозы возникновения осложнений гестации и предупреждения неблагоприятных исходов беременности. В стационаре беременную должны наблюдать два лечащих врача — инфекционист и акушер.
Особенности лечения осложнений гестации Осложнения гестации, возникшие у больной гепатитом А в любом триместре, корригируют по принятым в акушерстве
принципам соответствующими методами и средствами. Сказанное относится и к осложнениям в родах и в послеродовой период.
Показания к госпитализации Беременных, больных гепатитами, в том числе гепатитом А, госпитализируют в инфекционный стационар по
клиническим показаниям (для наблюдения за ходом гестации, профилактики и своевременной коррекции возможных осложнений беременности).
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Терапия гепатита А разработана достаточно хорошо, большинство больных полностью выздоравливают. Летальность не превышает 0,2–0,4% и связана с тяжёлой сопутствующей патологией.
При адекватной тактике ведения беременной и должном совместном наблюдении акушера и инфекциониста исходы беременности у женщин при гепатите А также благоприятны (для матери, плода и новорождённого).
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
Наилучшей тактикой в отношении родоразрешения больной гепатитом А считают срочные роды per vias naturalis.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Гепатит А — острая кишечная инфекция, следовательно, одно из главных условий собственной защиты от него — неукоснительное соблюдение правил личной гигиены. Во избежание полового заражения (весьма редкого) необходимо исключить оральноанальные сексуальные контакты. При развитии заболевания у беременной госпитализация обязательна. Определение у новорождённого анти-HAV IgM в течение 3–6 мес не свидетельствует об его инфицированности, поскольку они передаются от матери. Кормление грудью разрешается при условии соблюдения всех правил гигиены (уход за сосками и т.п.). Применение гормональных контрацептивов допустимо не ранее чем через 8–12 мес после заболевания. Противопоказаний для других контрацептивов нет. Повторная беременность возможна через 1–2 года после перенесённого гепатита.
ГЕПАТИТ Е Гепатит Е — острая вирусная кишечная инфекция с поражением печени, протекающая циклически, склонная к
эпидемическому распространению, главным образом в регионах с тропическим и субтропическим климатом; характеризуется особой тяжестью и высокой частотой неблагоприятных исходов у беременных.
СИНОНИМЫ
Hepatitis Е; гепатит ни А, ни В с фекально-оральным механизмом заражения.
КОД ПО МКБ-10
B17 Другие острые вирусные гепатиты.
B17.2 Острый гепатит E.
ЭПИДЕМИОЛОГИЯ
Эпидемиология гепатита Е имеет много сходства с эпидемиологией гепатита А (см. выше). Резервуарами возбудителя гепатита E могут быть грызуны, свиньи. Основной путь передачи вируса гепатита Е — водный, реже — алиментарный (в том числе при употреблении сырых или плохо обработанных термически моллюсков и ракообразных). Контактнобытовой путь отмечают очень редко. Инфицирующая доза возбудителя гепатита E в 2 раза выше, чем вируса гепатита А.
Восприимчивость всеобщая. Чаще болеют лица 15–40 лет, а среди них — мужчины, жители сельской местности. Возможны крупные вспышки и эпидемии, главным образом осенью, в тропиках — в сезон дождей. Возможен занос инфекции в среднюю полосу («гепатит путешественников»), однако он не сопровождается распространением заболевания и вспышками.
КЛАССИФИКАЦИЯ
Различают инаппарантные и манифестные формы, как при гепатите А. У беременных, заразившихся после 24 недели гестации, возможны молниеносные (фульминантные) формы с высокой летальностью (20–25%); описаны вспышки с летальностью в 40–80% случаев. По тяжести течения у беременных выделяют лёгкие (до 4%), средней тяжести (около 70%) и тяжёлые (25–28%) формы. Хронических форм гепатита E не бывает.
ЭТИОЛОГИЯ
Возбудитель Hepatitis E virus (HEV), РНК-содержащий. Известны три генотипа, выделенные в разных регионах. HEV в окружающей среде устойчив менее, чем HAV.
ПАТОГЕНЕЗ
В основных чертах сходен с патогенезом гепатита А. Главным звеном считают прямое цитопатическое действие HEV с цитолизом гепатоцитов. Иммунопатологические процессы существенной роли не играют. Иммунный ответ возникает быстро, что приводит к купированию заболевания. Как и гепатит А, гепатит E — самолимитирующаяся инфекция.
Причины и механизм особо тяжёлого течения гепатита E у беременных не изучены. При фульминантных формах гепатита E у беременных отмечают массивный или субмассивный некроз печени.
Патогенез осложнений гестации
Патогенез осложнений гестации при гепатите E в деталях не известен. При фульминантном течении инфекции в первые дни заболевания (не позднее 17-го дня болезни) развивается острая печёночная недостаточность вплоть до печёночной комы; почти у половины беременных одновременно появляется и прогрессирует почечная недостаточность. ДВС-синдром как компонент печёночной недостаточности способствует возникновению кровотечений и большой кровопотере в родах. На этом фоне часто происходят самопроизвольное прерывание беременности, антенатальная гибель плода, мёртворождение. Рождённые живыми дети имеют признаки тяжёлой гипоксии, ЗРП, они не адаптированы к внеутробной жизни и обычно погибают в первые три месяца после рождения.
КЛИНИЧЕСКАЯ КАРТИНА
Инкубационный период колеблется от 20 до 80 дней. Продолжительность продромального периода составляет обычно 3–7 дней и клинически протекает как при гепатите А. Некоторые больные жалуются на артралгии и диарею.
В разгар гепатита E, когда появляется желтуха, самочувствие, в отличие от гепатита А, обычно не улучшается. У мужчин и небеременных женщин гепатит E протекает с тем же симптомокомплексом, что и при гепатите А. Как правило, отмечают гепатомегалию; спленомегалия встречается очень редко.
Манифестация заболевания длится 3–4 нед и заканчивается выздоровлением (в абсолютном большинстве случаев). Период реконвалесценции протекает более длительно, чем при гепатите А.
Осложнения гестации Высокий риск осложнений беременности для матери и плода, часто с фатальным исходом, отмечают при тяжёлых и
особенно молниеносных формах гепатита E. Наиболее опасны случаи, когда беременная женщина заражается HEV во второй половине гестации (позже 24 нед). При этих формах гепатита E клиническая картина больше напоминает самые тяжёлые формы гепатита В (см. ниже). Желтуха неуклонно нарастает, усиливается лихорадка, стремительно развивается печёночная и почечная недостаточность, усиливаются признаки ДВС-синдрома. При гепатите E у беременных нередко возникает усиленный гемолиз эритроцитов с гемоглобинурией, что усугубляет почечную недостаточность. Гемоглобинурия — ранний признак начинающегося ухудшения состояния беременной и тяжёлого прогноза для её жизни и здоровья.
При самопроизвольном прерывании беременности состояние женщины резко ухудшается, возможен летальный исход.
В родах крайне велика вероятность массивного кровотечения, равно как и в послеродовой период. Некоторые авторы не исключают возможности вертикальной передачи возбудителя.
Тяжелейшим осложнением гестации выступает также анте-, интра и постнатальная гибель плода. Вероятность рождения здорового ребёнка практически отсутствует, возможность выживания новорождённого очень невелика.
ДИАГНОСТИКА
Анамнез
Распознавание гепатита E возможно с учётом эпидемиологического анамнеза (пребывание в эндемичных по гепатиту E районах), анамнеза заболевания.
Лабораторные исследования
Верификацию гепатита E проводят путём обнаружения в крови анти-HEV IgM при ИФА. Эти АТ появляются в крови на 10–12 день заболевания и циркулируют в течение 1–2 мес. В ранние сроки инфекции возможна детекция РНК HEV в крови и фекалиях с помощью ПЦР. Иногда выделение HEV проводят из фекалий и определяют его в биоптатах печени методом иммунофлюоресценции.
Дифференциальная диагностика Проводится с другими этиологическими формами вирусных гепатитов и поражениями печени, связанными с собственно беременностью (см. гепатит А).
Показания к консультации других специалистов Показания к консультации других специалистов такие же, как при гепатите А. Пример формулировки диагноза
Беременность 28–30 недель. Гепатит Е, желтушная форма, фульминантное течение. Гемоглобинурия. Энцефалопатия. ОПН. Угроза самопроизвольного прерывания беременности.
ЛЕЧЕНИЕ
Медикаментозное лечение Этиотропные (противовирусные) препараты отсутствуют. Терапия, как правило, патогенетическая, направленная на
купирование интоксикации и (при фульминантных формах) на борьбу в режиме реанимации с острой печёночной и почечной недостаточностью, кровотечением, угрозой прерывания беременности.
Хирургическое лечение
Прерывание беременности любым способом при гепатите E категорически противопоказано. Лишь в ранние сроки гестации возможно искусственное прерывание беременности, но только в период реконвалесценции.
Профилактика и прогнозирование осложнений гестации
При обычном течении гепатита E лечение проводят в стационаре с использованием всестороннего обследования матери и плода для определения ранних признаков неблагополучия и их коррекции. При фульминантных формах проводят те же мероприятия в режиме интенсивного наблюдения и реанимации, но они, к сожалению, малоэффективны.
Особенности лечения осложнений гестации Основное место в терапии осложнений гестации принадлежит акушеру, который использует все необходимые
исследования по прогнозированию беременности и улучшению состояния плода. Одновременно с ним должны работать инфекционист и реаниматолог, обеспечивающие дезинтоксикацию и терапию печёночной комы, почечной
недостаточности. Совместные усилия врачей направляются на борьбу с кровотечением. При необходимости в спасении беременных принимают участие нефрологи и гематологическая бригада врачей.
Показания к госпитализации
Беременных с гепатитом E следует госпитализировать в инфекционный стационар, где есть акушерское отделение (палаты), в обязательном порядке.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
В общей популяции эффективность терапии хорошая, выздоровление наступает у абсолютного большинства больных. Терапия гепатита E у беременных неудовлетворительная, каждая четвёртая-пятая женщина, заболевшая после 24 недели гестации, погибает. Описаны вспышки и эпидемии с летальностью беременных в 40–80% случаев.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
Необходимо обеспечить пребывание беременной, переносящей гепатит E, в акушерском отделении (палате) инфекционного стационара с проведением всех мероприятий для пролонгирования беременности до срочных родов.
ВИРУСНЫЕ ГЕПАТИТЫ С ГЕМОКОНТАКТНОЙ ПЕРЕДАЧЕЙ ВОЗБУДИТЕЛЯ ГЕПАТИТ B
Гепатит B — вирусная инфекция, протекающая с преимущественным поражением печени и полиморфизмом клинических проявлений от вирусоносительства и острого гепатита до прогрессирующих хронических форм и исходом в цирроз печени и гепатокарциному.
СИНОНИМЫ
Hepatitis B, сывороточный гепатит, шприцевой гепатит.
КОД ПО МКБ-10
B16 Острый гепатит B.
B18 Хронический вирусный гепатит.
ЭПИДЕМИОЛОГИЯ
Гепатит B — острый антропоноз. Резервуаром возбудителя и источником инфекции выступают больные острой и хронической формой гепатита B, вирусоносители (это тоже больные с инаппарантными формами заболевания, число которых в 10–100 раз больше, чем больных манифестными формами инфекции). Последние представляют наибольшую эпидемиологическую опасность для окружающих. При остром гепатите B больной заразен с середины инкубационного периода до периода разгара и полного освобождения организма от вируса. При хронических формах заболевания, когда отмечают пожизненную персистенцию возбудителя, больные представляют постоянную опасность как источники инфекции.
Механизм заражения гемоконтактный, нетрансмиссивный. Различают естественные и искусственные пути инфицирования.
Естественные пути — половой и вертикальный. Половой путь позволяет считать гепатит B ИППП. Вертикальный путь реализуется, главным образом, во время родов, внутриутробно инфицируются около 5% плодов. При заражении женщины в III триместре беременности риск заражения ребёнка достигает 70%, при носительстве HBSAg — 10%. Наибольший риск передачи вируса от матери плоду наблюдают в случаях одновременного наличия в крови беременной HBSAg и HBEAg (репликативная фаза инфекции), высокой степени вирусемии. Возможна бытовая гемоконтактная передача вируса (пользование общими бритвами, ножницами, зубными щётками и другими предметами, когда может происходить контакт с кровью больного).
К искусственным (артифициальным) путям передачи гепатита B относят переливание крови и её компонентов (значение этого пути в последние годы падает), диагностические и лечебные инвазивные манипуляции, выполненные инструментами, плохо простерилизованными, т.е. контаминированными кровью. В последние десятилетия на первый план выдвинулись немедицинские парентеральные вмешательства — внутривенные введения наркотических средств и их суррогатов. Немалую опасность несёт нанесение татуировок, разного рода насечек, обрезание и т.п.
Основной фактор передачи вируса гепатита B — кровь; для заражения от больного достаточно попадания в организм восприимчивого человека минимальной инфицирующей дозы крови (7–10 мл). Возбудитель гепатита B может быть обнаружен и в других биологических жидкостях (отделяемое половых путей) и тканях.
Восприимчивость к гепатиту B высокая во всех возрастных группах. К группам высокого риска заражения относят:
·реципиентов донорской крови (больные гемофилией, другими гематологическими заболеваниями; больные на хроническом гемодиализе; больные, получившие трансплантацию органов и тканей; больные с тяжёлой сопутствующей патологией, имевшие многочисленные и разнообразные парентеральные вмешательства);
·потребителей внутривенных наркотиков;
·мужчин с гомо- и бисексуальной ориентацией;
·представительниц коммерческого секса;
·;лиц, имеющих многочисленные и беспорядочные половые связи (промискуитет), особенно с больными ИППП;
·детей первого года жизни (в результате возможного заражения от матери или вследствие медицинских манипуляций);
·медицинских работников, имеющих непосредственный контакт с кровью (риск профессионального заражения достигает 10–20%).
Сезонные колебания для гепатита B не характерны. Распространение инфекции повсеместное. Заболеваемость колеблется в широких пределах. Россия относится к территории умеренной интенсивности распространения
гепатита B. Более 2/3 всех инфицированных гепатитом B проживают в азиатском регионе.
КЛАССИФИКАЦИЯ
Гепатит B имеет широкий спектр клинических проявлений. Различают: острый циклический (самолимитирующийся) гепатит B (субклиническая, или инаппарантная, безжелтушная, желтушная с преобладанием цитолиза или холестаза формы); острый ациклический прогрессирующий гепатит B (молниеносная, или фульминантная, злокачественная форма).
По тяжести течения выделяют лёгкие, средней тяжести и тяжёлые формы.
У хронического гепатита B может быть две фазы — репликативная и интегративная с разной степенью морфологической и клиникобиохимической активности. К хроническому гепатиту B относят также цирроз печени и
первичную гепатоцеллюлярную карциному. Некоторые авторы предпочитают называть последние две формы исходами хронического гепатита B.
ЭТИОЛОГИЯ
Возбудитель Hepatitis В virus (HВV) — ДНК-содержащий вирус (вирион — частица Дейна), имеющий сложную антигенную структуру. Выделены антигенные системы вириона: HBSAg (обнаруживают в крови, гепатоцитах, сперме, влагалищном секрете, спинномозговой жидкости, синовиальной жидкости, грудном молоке, слюне, слезах, моче); сердцевидный Аг — HВcAg (определяют в ядрах и перинуклеарной зоне гепатоцитов, в крови его нет); HВеAg находится в крови и подтверждает наличие HВcAg в клетках печени.
Описаны различные антигенные варианты HBV, в том числе мутантные штаммы возбудителя, резистентные к противовирусной терапии.
Вирус гепатита B устойчив во внешней среде. Инактивируется при автоклавировании (30 мин), стерилизации сухим паром (160 °C, 60 мин).
ПАТОГЕНЕЗ
Из входных ворот вирус гепатита B гематогенно попадает в печень, где происходит репликация возбудителя и его Аг. HВV не обладает, в отличие от HAV и HEV, прямым цитопатическим действием; поражение печени происходит иммуноопосредованно, его степень зависит от многих факторов, связанных с инфицирующей дозой, генотипом вируса, вирулентностью, а также иммуногенетическим статусом организма, активности интерферона и других элементов специфической и неспецифической защиты. В результате в печени развиваются некробиотические и воспалительные изменения, соответствующие мезенхимальновоспалительному, холестатическому синдромам, и синдромы цитолиза.
Острая циклическая форма гепатита B соответствует нормальному ответу на агрессию возбудителя. Исчезновение вируса из организма и, следовательно, выздоровление — результат разрушения всех инфицированных клеток и подавления всех фаз репликации возбудителя интерфероном. Одновременно накапливаются АТ к Аг вируса гепатита B. Образующиеся иммунные комплексы (Аг вируса, АТ к ним, С3-компонент комплемента) фагоцитируются макрофагами, вследствие чего возбудитель покидает организм больного.
Молниеносные (ациклические, злокачественные) формы гепатита B обеспечиваются прежде всего генетически детерминированной гиперергической реакцией иммунных клеток на чужеродные в антигенном отношении вирусы при низком интерфероновом ответе.
Механизмы прогрессирования и хронизации связаны с неадекватным иммунным ответом на фоне высокой репликативной активности вируса или низкой активности репликации с интеграцией генетического материала HBV в геном гепатоцита; мутацией вируса, снижением синтеза a-интерферона, аутоиммунными реакциями, особенностями конституционального иммунитета.
Развивающиеся в ряде случаев аутоиммунные механизмы связаны с интерференцией вирусспецифических белков вируса и структурных субъединиц гепатоцитов.
При прогрессировании тяжёлых форм острого и хронического гепатита B возможно развитие токсической дистрофии, массивного и субмассивного некроза печени с острой печёночной недостаточностью, при которой страдают все виды обмена веществ («метаболическая буря»). Вследствие этого развивается энцефалопатия, массивный геморрагический синдром, которые и становятся причиной гибели больных.
Другим вариантом прогрессирования гепатита B бывает развитие фиброза печени на фоне разной степени активности гепатита с дальнейшей эволюцией в цирроз печени, а затем в первичную гепатоцеллюлярную карциному.
В поражённых гепатоцитах при всех формах гепатита B часто обнаруживают HBV и его Аг (метод иммунофлюоресценции, окраска орцеином, ПЦР).
Патогенез осложнений гестации
Тяжёлые метаболические расстройства при тяжёлом течении гепатита B — главная причина осложнений гестации. Наиболее частые из них — угроза прерывания и досрочное самопроизвольное прерывание беременности, особенно в разгар заболевания и в III триместре беременности. Преждевременные роды при гепатите B отмечают в 1,5 раза чаще, чем при гепатите А. Гепатит B, как и другие гепатиты, может спровоцировать или усугубить течение гестоза у беременной, преждевременное или раннее излитие ОВ, нефропатию в родах. Особого наблюдения требует плод больной матери из-за возможности гипоксии, ЗРП. При родах в разгар гепатита B новорождённые хуже приспособлены к внеутробной жизни, у них, как правило, выявляют более низкие оценки по шкале Апгар. При родах в период реконвалесценции гепатита B осложнения гестации практически отсутствуют. Это касается и матери, и плода, и новорождённого. При хронических гепатитах частота и тяжесть осложнений гестации существенно ниже.
КЛИНИЧЕСКАЯ КАРТИНА
Самым частым среди многообразных манифестных форм гепатита B бывает острый циклический желтушный гепатит с циклическим синдромом.
Инкубационный период при этой форме гепатита B колеблется от 50 до 180 дней и никаких клинических признаков не имеет. Продромальный период (преджелтушный) продолжается в среднем 4–10 дней, очень редко увеличивается до 3–4 нед. Симптоматика этого периода в основном такая же, как при гепатите А. Особенности — менее частая при гепатите B лихорадочная реакция, нередкое развитие артралгий (артралгический вариант продрома). Встречается (5– 7%) и латентный вариант этого периода, когда первым клиническим проявлением заболевания становится желтуха.
В конце продрома увеличивается печень и, реже, селезёнка; темнеет моча, обесцвечивается кал, в моче появляются уробилирубин, иногда желчные пигменты, в крови определяют повышение HBs-Ag и активности АЛТ.
Желтушный период (или период разгара) длится, как правило, 2–6 нед с возможными колебаниями. Протекает как при гепатите A, но интоксикация в большинстве случаев не только не исчезает или смягчается, но может и нарастать. Печень продолжает увеличиваться, поэтому сохраняются тяжесть и боли в правом подреберье. При наличии холестатического компонента может появиться зуд.
Опасный симптом — сокращение размеров печени (до степени «пустого подреберья»), что при сохранении желтухи и интоксикации свидетельствует о начинающейся острой печёночной недостаточности.
Постепенное уплотнение печени, заострение её края при продолжающейся желтухе могут быть указаниями на хронизацию гепатита B.
Период реконвалесценции протекает по-разному: от 2 мес при гладком течении инфекции до 12 мес при развитии клиникобиохимических или биохимических рецидивов.
У беременных гепатит B протекает так же, как у небеременных, но у них тяжёлую форму заболевания (10–11%) отмечают чаще.
Самым опасным осложнением тяжёлых форм гепатита B как вне, так и во время беременности выступает острая печёночная недостаточность, или печёночная энцефалопатия. Выделяется четыре стадии острой печёночной недостаточности: прекома I, прекома II, кома, глубокая кома с арефлексией. Их общая продолжительность колеблется от нескольких часов до нескольких дней.
Первыми угрожающими в отношении развития острой печёночной недостаточности симптомами бывают прогрессирующая гипербилирубинемия (за счёт конъюгированной фракции и нарастания фракции непрямого, свободного билирубина) при одновременном уменьшении активности АЛТ, резкое (ниже 45–50%) снижение протромбина и других факторов свёртывания крови, нарастающий лейкоцитоз и тромбоцитопения.
Острая печёночная недостаточность полностью доминирует в клинической картине молниеносной формы гепатита B, которая начинается и развивается бурно и в течение 2–3 нед завершается гибелью больных.
У 10–15% больных острым гепатитом B развивается хронический гепатит, который диагностируют обычно после 6 мес клиникобиохимических проявлений заболевания. В ряде случаев (при нераспознанном остром периоде заболевания, при инаппарантных, безжелтушных формах гепатита B) диагноз хронического гепатита устанавливают уже при первом обследовании больного.
Хронический гепатит у многих больных протекает малосимптомно; его нередко выявляют при обследовании по случаю «неясного диагноза» по результатам биохимического анализа (повышение активности АЛТ, протеинемия, маркёры HBV и др.). При адекватном клиническом обследовании у таких больных можно определить гепатомегалию, плотную консистенцию печени, её заострённый край. Иногда отмечают спленомегалию. При прогрессировании заболевания появляются внепечёночные знаки — телеангиэктазии, пальмарная эритема. Постепенно развивается геморрагический синдром (кровоизлияния в кожу, сначала в местах инъекций; кровоточивость дёсен, носовые и другие кровотечения). При включении аутоиммунных механизмов развиваются васкулиты, гломерулонефрит, полиартрит, анемия, эндокринные и другие расстройства. По мере развития хронического гепатита B появляются признаки формирования цирроза печени — портальная гипертензия, отёчноасцитический синдром, гиперспленизм и др.
Так называемое носительство HВsAg считают вариантом хронического гепатита B с минимальной активностью патологического процесса, субклиническим течением в интегративной фазе инфекции.
Обострение хронического гепатита B проявляется интоксикацией, обычно с повышением температуры тела до субфебрильных значений, астеновегетативными симптомами, желтухой (умеренной в большинстве случаев), геморрагическим синдромом, усилением внепечёночных знаков.
30–40% случаев гепатита B в репликативной фазе заканчиваются циррозом и первичным раком печени, при этом в крови и в тканях печени можно обнаружить маркёры HBV.
На любой стадии хронического гепатита B возможно развитие острой печёночной недостаточности, портальной гипертензии, кровотечения из варикознорасширенных вен пищевода, нередко присоединение бактериальной флоры с развитием, в частности, флегмоны кишки.
У беременных женщин хронический гепатит B протекает так же, как и у небеременных, с теми же осложнениями и исходами. Главной причиной смерти беременных с гепатитом B служит острая печёночная недостаточность, точнее, её терминальная стадия — печёночная кома. Летальность беременных при остром гепатите B в 3 раза выше, чем у небеременных, и чаще встречается в III триместре гестации, особенно на фоне уже имеющихся акушерских осложнений беременности.
ОСЛОЖНЕНИЯ ГЕСТАЦИИ
Характер и спектр осложнений гестации при гепатите B такие же, как при других гепатитах. Наиболее опасны внутриутробная гибель плода (на высоте интоксикации и желтухи у матери), мёртворождение, выкидыши и преждевременные роды, которые могут приводить к критическому ухудшению состояния больной, переносящей тяжёлую форму гепатита B. При хроническом гепатите B невынашивание беременности наблюдают редко. В родах в разгар заболевания велика вероятность массивного кровотечения, как и в послеродовой период. В случае состоявшейся вертикальной передачи HBV от матери к плоду у 80% новорождённых развивается хронический гепатит B.
ДИАГНОСТИКА
Анамнез
Распознаванию гепатита B способствует правильно и тщательно собранный эпидемиологический анамнез, позволяющий отнести больного, в том числе беременную, к группе высокого риска заражения гепатитом B (см. выше). Большое значение имеет анамнестический метод, позволяющий определить периодичность развития заболевания и жалобы, характерные для каждого периода заболевания.
Физикальное исследование Подтверждают наличие у больной гепатита появление желтухи, гепатомегалии, болезненность печени при пальпации,
спленомегалия. При хроническом гепатите B диагностика опирается на определение гепатоспленомегалии, особенностей консистенции печени, состояния её края, астеновегетативного синдрома, желтухи, телеангиэктазий, пальмарной эритемы, а в далеко зашедших стадиях — портальной гипертензии, отёчно-асцитического синдрома, геморрагических проявлений.
Лабораторные исследования Нарушение функций печени определяют биохимическими методами (характерна повышенная активность АЛТ,
повышение концентрации конъюгированного билирубина, снижение содержания общего белка и альбумина, диспротеинемия, гипохолестеринемия, нарушения свёртывающей системы крови).
Верификацию гепатита B проводят с помощью реакции повреждения гранулоцитов, реакции непрямой гемагглютинации, встречного иммуноэлектрофореза, а в настоящее время чаще всего ИФА (табл. 48-13). Таблица 48-13. Диагностическое значение маркёров HBV
Маркёр Периоды и фазы инфекционного процесса
ы
HBSAg
антиHBC IgM
антиHВC IgG HBEAg
анти-HBE
анти-HBS
ДНКHBV
Выделяют хронический гепатит B с высокой и низкой репликативной активностью, от чего зависит характер и темпы развития патологического процесса в печени. Длительная циркуляция HBEAg свидетельствует об активной репликации вируса. В этих случаях в крови обнаруживают HBSAg, анти-HBC IgM, ДНК HBV (в ПЦР). Хронический репликативный тип гепатита B характеризуется достаточно часто либо неуклонным прогрессированием, либо чередованием клинико-биохимических обострений и ремиссий с умеренной или значительной активностью патологического процесса в печени (по данным изучения прижизненных биоптатов).
При хроническом гепатите B с низкой репликативной активностью в крови определяют HBSAg, анти-HBE IgG и антиHВC IgG. Всё это даёт основания (особенно при нормальной или незначительно повышенной активности АЛТ) диагностировать интегративный тип хронического гепатита B, протекающий доброкачественно. Однако и в таких обстоятельствах в печени возможны опухолевые преобразования и развитие первичной гепатоцеллюлярной карциномы. В 10–15% случаев интегративная фаза хронического гепатита B может трансформироваться в репликативную фазу.
При лабораторном исследовании крови носителей HВsAg обнаруживают функциональную недостаточность печени (гипербилирубинемию, снижение протромбинового индекса, гипо- и диспротеинемию с гипербилирубинемией, гипохолестеринемию и т.д.).
В ткани печени (биопсия, материал аутопсии) методом иммунофлюоресценции или при электронной микроскопии могут быть обнаружены вирионы HBV, а также HBсAg и другие Аг вируса. С помощью реакции связывания комплемента in situ определяют ДНК HBV.
Дифференциальная диагностика Дифференциальная диагностика проводится так же, как при других вирусных гепатитах. В последние годы
актуализировалась необходимость дифференциальной диагностики гепатита B с токсическим поражением печени (суррогаты алкоголя, другие яды). Для разграничения этих поражений печени большую роль играет неформальный сбор анамнестических сведений, закономерное развитие признаков нефропатии токсического генеза на фоне клинико-лабораторных симптомов функциональной недостаточности печени, нередко выявление энцефалопатии. Показания к консультации других специалистов Показания к консультации других специалистов такие же, как при других вирусных гепатитах.
Пример формулировки диагноза
Беременность 30–32 недели. Угроза прерывания беременности. Острый гепатит B, желтушная форма, тяжёлое течение, репликативная фаза инфекции.
ЛЕЧЕНИЕ Цели лечения
Терапия гепатита B зависит от формы тяжести инфекции, её фазы, наличия или отсутствия продвинутых стадий хронического гепатита B. Цели терапии такие же, как при других гепатитах.
Медикаментозное лечение В последние годы для лечения больных гепатитом В широко применяют этиотропные противовирусные
химиопрепараты и интерферон альфа, однако во время беременности они противопоказаны. В этих случаях доминирует патогенетическая терапия, направленная на снижение интоксикации, борьбу с геморрагическим и отёчно-асцитическим синдромами.
Хирургическое лечение
Хирургическое лечение при гепатите B не проводят. Профилактика и прогнозирование осложнений гестации
Профилактику и прогнозирование осложнений гестации, направленные на тщательный контроль состояния матери и плода, осуществляют в условиях инфекционного стационара с наличием акушерского отделения (палат). Особенности лечения осложнений гестации
Терапия осложнений гестации у беременных с гепатитом B особенностей не имеет. Наибольшего внимания требуют беременные в III триместре беременности. В родах и послеродовой период необходима особая настороженность в отношении возможного массивного кровотечения в случаях тяжёлого течения заболевания.
Показания к консультации других специалистов Показания к консультации других специалистов возникают при развитии острой печёночной недостаточности, когда в
спасении больной должны участвовать реаниматологи, акушеры и инфекционисты. При массивном кровотечении к терапии необходимо привлекать специалистов-гематологов.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Все больные со всеми формами гепатита B, беременные и небеременные, курс обследования и лечения проходят в инфекционном стационаре и в обязательном порядке.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
При лёгких формах и формах средней тяжести острого гепатита B эффект терапии хороший, при тяжёлых формах сомнительный. Эффективность хронического гепатита B в разные стадии патологического процесса различна, но
всегда требует настойчивости и адекватного наблюдения. С развитием трансплантологии печени заметного успеха можно достичь даже в далеко зашедших стадиях заболевания.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ Искусственное прерывание беременности возможно (по желанию матери) только в период реконвалесценции острого
гепатита B. Лучшая тактика — пролонгирование беременности до срочных родов через естественные родовые пути. То же относится и к хроническому гепатиту B.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Планируя беременность, женщина по совету врача-акушера должна провести вакцинацию против гепатита B. Хронический гепатит B не служит противопоказанием к беременности. Если больная имеет АТ к HBV (вакцинирована), кормление ребёнка грудью возможно при соблюдении правил ухода за сосками и строгой личной гигиены. При наличии маркёров репликативной активности гепатита B (см. табл. 48-13) от кормления грудью следует воздержаться. Женщина, родившая ребёнка без HBSAg в крови, обязана дать согласие на вакцинацию новорождённого против гепатита B.
ГЕПАТИТ D
Гепатит D самостоятельного значения не имеет: его возбудитель HDV не способен к репликации в отсутствие HBV, поскольку формирует свою оболочку из HBSAg. Существует исключительно как коинфекция или суперинфекция при гепатите B. Такого рода микстинфекция (гепатит B + гепатит D) имеет склонность к тяжёлому и хроническому течению. СИНОНИМЫ
Hepatitis D, дельта-инфекция ЭПИДЕМИОЛОГИЯ
Встречается часто в регионах с жарким и тёплым климатом, нередко и в странах Европы. Возможность инфицирования в средней полосе невелика.
ГЕПАТИТ C
Гепатит C — вирусная антропонозная инфекция с преимущественным поражением печени, склонная к длительному хроническому малосимптомному течению, и исходом в цирроз печени и первичную гепатоцеллюлярную карциному. СИНОНИМЫ
Hepatitis C; вирусный гепатит ни A, ни B с парентеральным механизмом передачи. КОД ПО МКБ-10
B17.1 Острый гепатит C.
B18.2 Хронический вирусный гепатит C. ЭПИДЕМИОЛОГИЯ
Источник и резервуар гепатита C — больной острой или хронической инфекцией. HCV-РНК можно обнаружить в крови очень рано, уже через 1–2 нед после заражения. В эпидемиологическом отношении наиболее неблагоприятны инаппарантные (субклинические) формы гепатита C, преобладающие при этом заболевании. Распространённость инфекции до определённой степени характеризует инфицирование доноров: в мире она колеблется от 0,5 до 7%, в России составляет 1,2–4,8%.
Гепатит C, как и гепатит B, имеет гемоконтактный путь заражения, у них совпадают факторы передачи и группы высокого риска инфицирования. Инфицирующая доза HCV в несколько раз выше, чем HBV: вероятность заражения гепатитом C при уколе контаминированной возбудителем иглой достигает 3–10%. Контакт инфицированной крови с неповреждёнными слизистыми оболочками и кожными покровами к заражению не приводит. Вертикальная передача HCV — явление редкое, некоторые авторы её отрицают. Низка вероятность бытового и профессионального заражения, однако заболеваемость гепатитом C медицинских работников всё-таки выше (1,5–2%), чем в целом в популяции (0,3–0,4%).
Ведущая роль в группах риска принадлежит потребителям наркотиков (гепатит наркоманов). Роль половых и внутрисемейных контактов в заражении гепатитом C незначительна (около 3%). Для сравнения: риск половой передачи HBV — 30%, ВИЧ — 10–15%. В случае инфицирования половым путём передача возбудителя чаще происходит от мужчины к женщине.
Гепатит C встречается повсеместно. Считают, что в мире HCV инфицировано не менее 500 млн человек, т.е. инфицированных HCV существенно больше, чем носителей HBSAg.
Выделено 7 генотипов и более 100 субгенотипов вируса гепатита C. В России доминирует один генотип, встречается три генотипа.
Нарастание заболеваемости в мире и стране отчасти носит регистрационный характер (улучшение диагностики по всей стране с началом обязательной регистрации гепатита C в 1994 году), но имеет место и истинное увеличение числа больных.
КЛАССИФИКАЦИЯ
Выделяют острую и хроническую форму (фазу) гепатита C. Последнюю принято разделять на субклиническую и манифестную (фаза реактивации).
ЭТИОЛОГИЯ
Возбудитель гепатита C (HCV) — РНК-содержащий вирус. Отличается крайней вариабельностью, что препятствует созданию вакцины. В составе вируса различают структурные белки: core (сердцевидный), Е1 и Е2 и белки неструктурные (NS2, NS3, NS4A, NS4B, NS5A и NS5B), на обнаружении которых строится верификация диагноза гепатита C, в т.ч. его формы (фазы).
ПАТОГЕНЕЗ Попав в организм человека через входные ворота, возбудитель проникает в гепатоциты, где реплицируется. Доказано
прямое цитопатическое действие HCV, но вирус гепатита C обладает слабой иммуногенностью, поэтому элиминации возбудителя не происходит (так же, как HAV, обладающий прямым цитопатическим действием). Антителообразование при гепатите C несовершенно, что также препятствует нейтрализации вируса. Спонтанное выздоровление отмечают редко. У 80% и более инфицированных HCV развивается хронический гепатит с длительной персистенцией возбудителя в организме, механизм которой отличен от персистенции HBV. При гепатите C не бывает интегративных форм в силу особого строения вируса (у него нет ни матричной, ни промежуточной ДНК). Персистирование
возбудителя при гепатите C объясняют тем, что скорость мутаций вирусов значительно превышает скорость их репликации. Образующиеся АТ высокоспецифичны и не могут нейтрализовать быстро мутирующие вирусы («иммунное ускользание»). Длительной персистенции способствует и доказанная способность HCV реплицироваться вне печени: в клетках костного мозга, селезёнки, лимфатических узлов, периферической крови.
Для гепатита C характерно включение аутоиммунных механизмов, влекущих за собой многочисленные внепечёночные проявления хронического гепатита C.
Отличает гепатит C от других вирусных гепатитов торпидное субклиническое или малосимптомное течение и одновременно малосимптомное, но неуклонное прогрессирование патологического процесса в печени и других органах, особенно у лиц старшего возраста (50 лет и более), страдающих сопутствующей патологией, алкоголизмом, наркозависимостью, белково-энергетической недостаточностью и т.п.
Большинство исследователей считают, что генотип вируса не оказывает влияния на прогрессирование заболевания и его темпы. К гепатиту C возможна иммуногенетическая предрасположенность.
Хронический гепатит C протекает обычно с минимальной или слабой активностью патологического процесса и невыраженным или умеренно выраженным фиброзом (по результатам прижизненных биопсий печени), но часто темпы фиброза достаточно велики.
ПАТОГЕНЕЗ ОСЛОЖНЕНИЙ ГЕСТАЦИИ Патогенез, как и спектр осложнений гестации, такой же, как при других гепатитах, однако встречаются они очень редко.
КЛИНИЧЕСКАЯ КАРТИНА
У большинства больных острый гепатит C протекает субклинически и, как правило, не распознаётся. При исследовании очага инфекции у больных без клинических проявлений определяют умеренное повышение активности АЛТ, АТ к возбудителю гепатита C (анти-HCV) и/или РНК-вируса в ПЦР. Манифестные формы протекают обычно легко, без желтухи. Продолжительность инкубационного периода в связи с этим определить очень трудно. Продромальный период сходен с аналогичным периодом гепатитов A и B, его продолжительность оценить затруднительно. В период разгара у некоторых больных появляется невыраженная быстро проходящая желтуха, возможна тяжесть в эпигастральной области, правом подреберье. Печень увеличена мало или умеренно. Сероконверсия (появление анти-HCV) происходит через 6–8 нед после заражения. РНК HCV можно выявить из крови инфицированного человека через 1–2 нед.
Хронический гепатит C протекает почти всегда субклинически или малосимптомно, однако вирусемия при этом сохраняется, чаще с небольшой вирусной нагрузкой, но возможна и высокая репликативная активность возбудителя. В этих случаях вирусная нагрузка может быть большой. С течением заболевания отмечают периодическое волнообразное повышение активности АЛТ (в 3–5 раз превышая норму) при хорошем самочувствии больных. При этом в крови определяют анти-HCV. Возможно и выделение РНК HCV, но непостоянно и в малых концентрациях. Продолжительность хронического гепатита С может быть различной, чаще это 15–20 лет, но нередко и больше. В некоторых случаях сроки заболевания заметно уменьшаются при суперинфекции, а более всего при микстинфекции
HCV+HIV.
Фаза реактивации гепатита C проявляется манифестацией симптоматики хронического заболевания с последующим исходом в цирроз печени и первичный гепатоцеллюлярный рак на фоне прогрессирующей печёночной недостаточности, гепатомегалии, часто со спленомегалией. Одновременно ухудшаются биохимические признаки поражения печени (повышение АЛТ, ГГТ, диспротеинемия и пр.).
Для хронического гепатита C характерны внепечёночные признаки (васкулиты, гломерулонефриты, криоглобулинемия, тиреоидит, нейромышечные нарушения, суставной синдром, апластическая анемия и другие аутоиммунные расстройства). Иногда именно эта симптоматика становится первым признаком хронического гепатита C, и больным впервые устанавливают правильный диагноз. Таким образом, при аутоиммунных симптомах необходимо обязательное обследование больных на гепатит C молекулярно-биологическими и иммуносерологическими методами. Исходами хронического гепатита C бывает цирроз и рак печени с соответствующей симптоматикой. Важно, что риск рака печени при гепатите C в 3 раза выше, чем при гепатите B. Он развивается у 30–40% больных с циррозом печени. Первичная гепатома при гепатите C прогрессирует быстро (отмечают кахексию, печёночную недостаточность, желудочно-кишечные проявления).
Осложнения гестации
В большинстве случаев гепатит C протекает как у небеременных. Осложнения очень редки. Ведение беременной, больной гепатитом C, включает тщательное наблюдение для своевременного определения возможной угрозы прерывания беременности и гипоксии плода. У некоторых беременных изредка отмечают клинико-биохимические признаки холестаза (кожный зуд, повышение активности ЩФ, ГГТ и др.), возможно развитие гестоза, частота которого обычно повышается при экстрагенитальных заболеваниях.
ДИАГНОСТИКА
Распознавание гепатита C — клинически нелёгкая задача из-за особенностей течения и слабо выраженной или отсутствующей долгое время симптоматики.
Анамнез Важен грамотно проведённый эпидемиологический анамнез, в ходе которого можно определить предрасположенность
пациентки к группе высокого риска заражения гепатитом C (как при гепатите B). Собирая анамнез, следует обращать особое внимание на эпизоды неясных недомоганий в прошлом и признаков, свойственных продромальному периоду вирусных гепатитов. Указание в анамнезе на желтуху, даже едва выраженную, обязывает обследовать больную, в том числе беременную, на гепатиты, включая гепатит C.
Лабораторные исследования Основное значение имеет диагностика гепатита биохимическими методами, как при других этиологических формах
вирусных гепатитов. Решающее, верифицирующее значение имеют результаты обнаружения маркёров гепатита C. В крови определяют анти-HCV методом ИФА, проводят референс-тест. Наибольшую диагностическую ценность имеет обнаружение РНК HCV в крови или ткани печени методом ПЦР, поскольку свидетельствует не только об этиологическом диагнозе, но и о продолжающейся репликации вируса. Наличие анти-HCV имеет значение для
верификации гепатита C, одновременное определение АТ к неструктурным белкам (особенно анти-HCV NS4) указывает на хронический гепатит C. Высокая вирусная нагрузка при количественном определении РНК HCV может коррелировать с высокой активностью патологического процесса и ускоренными темпами формирования цирроза печени; кроме того, по этому показателю судят об эффективности противовирусной терапии.
При хроническом гепатите C важное место в диагностике и определении прогноза занимает прижизненная биопсия печени с оценкой активности патологического процесса (минимальная, низкая, умеренная, выраженная) и степени развития фиброза.
Беременных женщин в обязательном порядке (как и при гепатите B) обследуют на гепатит С. Дифференциальная диагностика Дифференциальную диагностику проводят как при других вирусных гепатитах.
Показания к консультации других специалистов
Наблюдение за беременными с гепатитом C осуществляют инфекционист и акушер-гинеколог. При аутоиммунных признаках хронического гепатита C может потребоваться помощь специалистов соответствующего профиля, у наркозависимых женщин — нарколога, психолога.
Пример формулировки диагноза
Беременность 17–18 недель. Хронический гепатит C, низкая степень активности патологического процесса, слабый фиброз.
ЛЕЧЕНИЕ
При манифестных формах гепатита C (острого и хронического) терапию проводят, как при гепатите B, используя методы медикаментозной патогенетической и симптоматической терапии.
Медикаментозное лечение Вне беременности основа терапии — противовирусные препараты интерферона альфа (с 6-месячным курсом при
остром гепатите и 6–12-месячным курсом при хроническом).
Если через 3 мес от начала терапии интерфероном сохраняется циркуляция РНК HCV (или при рецидиве гепатита C после завершения курса интерфероном альфа), лечение больных дополняют рибавирином.
Во время беременности этиотропная противовирусная терапия гепатита C противопоказана, при необходимости проводят патогенетическое и симптоматическое лечение больных.
Профилактика и прогнозирование осложнений гестации Профилактика и прогнозирование осложнений гестации проводится по общим правилам, принятым в акушерстве. Особенности лечения осложнений гестации
Особенности лечения осложнений гестации отсутствуют, в том числе в каждом из триместров, в родах и послеродовой период.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При развитии аутоиммунных признаков гепатита C показаны консультации специалистов необходимого профиля для согласования с ними методов терапии. В случае ухудшения течения заболевания обеспечивают наблюдение инфекциониста.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Во многих случаях хронического гепатита C возможно ведение беременных в амбулаторных условиях (при благоприятном течении инфекции и гестации). При острой фазе гепатита C у беременных необходима госпитализация в инфекционный стационар и обеспечение наблюдения акушера-гинеколога.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
При правильной тактике ведения беременных с гепатитом C эффективность терапии возможных редких осложнений такая же, как у небеременных.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
Все усилия акушеров должны быть направлены на то, чтобы роды у больных гепатитом C прошли в срок через естественные родовые пути.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Передача возбудителя гепатита C плоду вертикальным путём возможна, но встречается крайне редко. С молоком матери HCV не передаётся, следовательно, от грудного вскармливания отказываться нет необходимости. Страдающим хроническим гепатитом С женщинам, планирующим беременность, следует провести полный цикл вакцинации против гепатита B, во избежание в последующем микстинфекции В+С. То же следует сделать после родоразрешения (если до беременности вакцинации против гепатита B не было).
Определение анти-HCV у новорождённого в течение 18 мес не считают признаком его инфицирования (АТ имеют материнское происхождение). Дальнейшее наблюдение за ребёнком подразумевает его обследование в 3 и 6 мес жизни с помощью ПЦР для возможного выявления РНК HCV, наличие которой (при обнаружении не менее 2 раз)
будет указывать на инфицирование (при одинаковом генотипе вируса у матери и ребёнка). СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Антонов М.М., Аравийская Е.Р., Беляева Т.В. и др. Методические рекомендации по диагностике, лечению и профилактике наиболее распространённых инфекций, передаваемых половым путём / Под ред. Э.К. Айламазяна. — СПб.: Издательство Н-Л, 2002. — 112 с.
Гилязутдинова З.Ш., Баширова Д.К., Фассахов Р.С. и др. Экстрагенитальная патология и беременность. Практическое руководство. — М.: МЕДпресс, 1998. — 418 с.
Рахманова А.Г., Яковлев А.А., Виноградова Е.Н. и др. Хронические вирусные гепатиты и цирроз печени. Руководство для врачей/ Под ред. А.Г. Рахмановой. — СПб.: СпецЛит, 2006. — 413 с.
Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. Пер. с англ. — М., 2002. — 860 с.
Шувалова Е.П. Инфекционные болезни. Учебник для медицинских вузов. — М.: Медицина, 2004. — 648 с. 48.10. БЕРЕМЕННОСТЬ И ВИЧ/СПИД ВИЧ —вирус иммунодефицита человека.
СПИД — синдром приобретённого иммунодефицита.
ВИЧ-инфекция — стадийно развивающееся ретровирусное заболевание человека с парентеральным путём передачи возбудителя, характеризующееся хроническим течением и неуклонно прогрессирующим поражением иммунной, нервной и других систем с постепенным развитием СПИДа, проявляющегося оппортунистическими инфекциями, своеобразными опухолевыми поражениями и иммунопатологическими процессами.
СИНОНИМЫ
AIDS (Acquired Immune Deficiency Syndrome).
КОД ПО МКБ-10
R75 — лабораторное обнаружение ВИЧ.
Z11.4 — специальное скрининговое обследование с целью выявления инфицирования ВИЧ. Z71.7 — консультирование по вопросам, связанным с ВИЧ.
ЭПИДЕМИОЛОГИЯ ВИЧ/СПИД — строгий антропоноз. Источник и резервуар инфекции — инфицированный человек в любой стадии
(фазе) инфекционного процесса.
Механизм заражения — парентеральный (нетрансмиссивный). Достоверных фактов о других возможностях естественной циркуляции вируса у человека нет.
В механизме передачи возбудителя различают естественные и искусственные пути. К естественным путям относят половой и вертикальный (внутриутробно, чаще в родах), а также при грудном вскармливании.
Риск половой передачи возбудителя при незащищённом гетеросексуальном вагинальном контакте составляет около 30% и резко возрастает при промискуитете. Среди мужчин, имеющих половые связи с инфицированными ВИЧ мужчинами, риск заражения ранее достигал 60–70%, он ещё больше возрастал в случаях половых перверсий, сопровождающихся травматизацией кожи и слизистых оболочек, а также при сопутствующих ИППП, гепатитах В и С (риск при наличии последних увеличивается в 20 и более раз). В последние годы гетеросексуальные контакты в передаче ВИЧ стали преобладать (ранее преобладали гомо- и бисексуальные связи). Число инфицированных ВИЧ женщин почти сравнялось с ВИЧ+ мужчинами. Трагедией последних лет стало возрастание числа ВИЧинфицированных беременных женщин, частота их выявления увеличилась за это время в 600 раз (с 0,2 на 100 тыс. обследованных в 1995 г. до 119,4 на 100 тыс. обследованных в 2007 г.), а в некоторых регионах и выше.
Риск вертикальной передачи ВИЧ колеблется в различных регионах от 13 до 52% (в среднем — 30–35%). В период беременности (если не проводилась программная противовирусная защита) возбудитель передаётся плоду в 20–25% случаев; при проведении названной программы риск можно снизить до 7,5%. 80% плодов инфицируются во время родов, причём в случае рождения двойни риск заражения первого ребёнка вдвое выше, чем у второго. У 10–20% родившихся детей инфицирование может происходить во время грудного вскармливания. Описаны случаи (1989 г., Россия, Элиста) заражения матери во время кормления грудным молоком ребёнка, инфицированного в ходе медицинских манипуляций.
Искусственные пути многочисленны и практически совпадают с путями передачи ГВ и ГС (см. раздел
«Вирусные гепатиты»). В конце XX в. около 90% заболеваемости ВИЧ/СПИД обусловливали внутривенные потребители наркотиков и их суррогатов. Риск заражения при гемотрансфузиях в наши дни ничтожно мал (1 случай на 1 000 000 переливаний) благодаря обязательному тестированию на ВИЧ донорской крови и тканей. Однако характерный для ВИЧ-инфекции феномен серонегативного окна (продолжающийся от 1 нед до 3 мес, по некоторым данным до 5 мес), когда антитела в сыворотке инфицированного либо отсутствуют, либо их концентрация ниже чувствительности тест-систем для их обнаружения, не позволяет дать полную гарантию безопасности переливания даже ВИЧ-инактивированной крови. В связи с этим в большинстве стран мира (но, к сожалению, не в России) донорскую кровь вводят реципиенту только через 3–6 мес хранения и обязательного повторного обследования доноров на ВИЧ.
Риск профессионального заражения при контакте с инфицированными биологическими жидкостями, в первую очередь кровью, и при условии повреждения целостности кожных покровов составляет 0,3–0,35%.
У 15–18% ВИЧ-инфицированных достоверно установить источник заражения и путь передачи возбудителя невозможно.
Восприимчивость людей к ВИЧ высокая. Есть наблюдения, свидетельствующие о том, что некоторые люди (их больше всего среди русских, татар) менее чувствительны и даже резистентны к возбудителю, так как на их CD4+ клетках (макрофагах) отсутствуют или экспрессированы в низкой концентрации хемокиновые рецепторы CCR5.
Контингенты и факторы высокого риска заражения ВИЧ аналогичны таковым при ГВ и ГС.
Заболевание имеет склонность к эпидемическому и пандемическому распространению. За время изучения инфекции от неё умерли около 30 млн человек. В последние годы в связи с широкими профилактическими мероприятиями глобального уровня и разработкой программ оптимизированной терапии различного назначения темпы роста заболеваемости удалось замедлить, но она продолжает нарастать, однако эпидемия до сих пор находится на ранних стадиях своего развития.
КЛАССИФИКАЦИЯ
Наибольшее распространение получили классификации, предложенные CDС (1993 г.) для взрослых и подростков
(табл. 48-14), классификация CDС (1994 г.) для детей моложе 13 лет. |
|
|
||
Таблица 48-14. Классификация ВИЧ-инфекции у взрослых и подростков (CDС, 1993 г.) |
|
|||
Лабораторные категории |
Клинические категории |
|
|
|
А |
В |
С |
||
|
||||
Абсолютное и процентное содержание |
Бессимптомная, острая |
Манифестная, |
СПИД- |
|
(первичная) ВИЧ-инфекция, ПГЛ |
индикаторные |
|||
CD4+ Т-лимфоцитов в 1 мкл крови |
но не А и не С |
|||
|
(PGL) |
|
состояния |
|
³500 (³29%) |
А1 |
В1 |
С1 |
|
299–499 (14–28%) |
А2 |
В2 |
С2 |
|
<200 (<14%) |
А3 |
В3 |
С3 |
|
Клинические категории А3, В3 и С1–С3 соответствуют ВИЧ-инфекции в стадии СПИД.
Классификация ВИЧ/СПИД для детей моложе 13 лет (CDС, 1994) предусматривает 4 клинические категории (Н — бессимптомная, А — со слабо выраженными симптомами, В — с умеренно выраженными и С — с тяжёлыми симптомами СПИД), каждая подразделяется на 3 подкатегории в зависимости от степени выраженности иммуносупрессии (по уровню CD4+ Т-лимфоцитов в периферической крови) и характеризуется различными вторичными индикаторными заболеваниями.
В России используют классификацию В.И. Покровского (2001 г.), согласно которой различают следующие стадии и фазы заболевания.
·I — стадия инкубации.
·II — стадия ранней ВИЧ-инфекции:
варианты течения:
G бессимптомная сероконверсия;
G острая ВИЧ-инфекция без вторичных заболеваний.
·III — субклиническая стадия.
·IV — стадия вторичных заболеваний:
G А — потеря массы тела менее 10%, поверхностные грибковые, вирусные или бактериальные поражения кожи и слизистых оболочек, опоясывающий лишай, повторные фарингиты, синуситы;
G Б — прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 мес, «волосистая» лейкоплакия языка, туберкулёз лёгких; повторные или стойкие вирусные, бактериальные, грибковые и протозойные поражения кожи и слизистых оболочек, повторный или диссеминирующий опоясывающий лишай, локализованная форма саркомы Капоши; Фазы: прогрессирование (спонтанное, после ранее проводимой противовирусной терапии, на фоне проводимой
противовирусной терапии), ремиссия (спонтанная, после ранее проводимой противовирусной терапии, на фоне проводимой противовирусной терапии);
G В — кахексия, генерализованные бактериальные, вирусные, грибковые, протозойные, паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелёгочный туберкулёз, кахексия, диссеминированная саркома Капоши, поражения нервной системы различной этиологии.
· V — терминальная стадия. ЭТИОЛОГИЯ
Возбудитель заболевания — Вирус иммунодефицита человека из семейства Retroviridae, представлен двумя типами: ВИЧ-1 (HIV-1) и ВИЧ-2 (HIV-2) с многочисленными подтипами. ВИЧ-1 — пандемический вирус, больше распространён в Северной Америке и Европе. ВИЧ-2 встречается главным образом в Западной Африке. В Индии выделяют ВИЧ-1 и ВИЧ-2.
ВИЧ устроен сложно, в наши дни его строение изучено весьма подробно, выявленные особенности его строения и жизненного цикла крайне важны для верификации диагноза, эпидемиологического исследования и противоэпидемических мероприятий.
Ежесуточно в организме инфицированного человека образуется около 10´109 вирионов, способных поражать почти 2´109 CD4+ Т-лимфоцитов в день. Такая сверхинтенсивная репликация вируса обусловливает исключительно высокую степень его устойчивости. Всё это приводит к различной цитопатической активности ВИЧ, «ускользанию» от иммунного надзора противовирусного эффекта сенсибилизированных лимфоцитов и специфических АТ, быстрой выработке резистентности к препаратам и, наконец, малым шансам в обозримом будущем создать действенную профилактическую вакцину против ВИЧ/СПИД.
ВИЧ неустойчив в окружающей среде, очень чувствителен к нагреванию: инактивируется при 56 °С за 30 мин, при кипячении — за 5 мин, погибает при действии пероксида водорода и других дезинфицирующих средств. Устойчив к воздействию УФ-лучей и радиации.
ПАТОГЕНЕЗ Из входных ворот возбудитель с кровью и внутри макрофагов попадает во все органы и ткани, в том числе в ЦНС
(проходя через гематоэнцефалический барьер), после чего внедряется в клетки-мишени, имеющие CD4-протеин: Т4- лимфоциты, тимоциты, дендритные лимфоциты, часть В-лимфоцитов (5% пула), моноциты (40% пула) и резидентные макрофаги, мегакариоциты, стволовые клетки и фибробласты костного мозга, эозинофилы, нейроглию, астроциты, миоциты, эндотелий сосудов, М-клетки кишечника, клетки хорионтрофобласта плаценты; возможно, в сперматозоиды. Затем происходит слияние (фузия) вирусной и клеточной оболочек с последующим эндоцитозом вирусного нуклеотида в цитоплазму клетки-мишени. После соответствующих преобразований (раздевание РНК-ВИЧ, синтез на её матрице вирусной ДНК, затем её копии) ДНК вируса встраивается в геном (ДНК) клетки-мишени. Через 2,6 дня после эндоцитоза новая генерация вируса покидает клетку-мишень, захватывает часть клеточной оболочки, приводя к гибели инфицированной клетки (цитопатический эффект ВИЧ). Последний более выражен в отношении Т4- лимфоцитов 1-го типа и не выражен в макрофагах. Постепенно пул клеток-мишеней истощается, нарушается иммунный гемостаз.
В результате прогрессирующих расстройств иммунной системы происходит снижение защитных свойств кожи и слизистых оболочек, уменьшение воспалительных реакций на воздействие микрофлоры. Подобные условия располагают к развитию оппортунистической инфекции (вирусной, бактериальной, протозойной, грибковой, гельминтной), возникновению опухолей (саркома Капоши, неходжкинские лимфомы и др.), появлению аутоиммунных процессов. Развитие таких симптомов знаменует собой картину СПИДа с последующей неминуемой гибелью больного.
Патогенез осложнений гестации Спектр, характер, тяжесть, частота и патогенез осложнений гестации у ВИЧ-инфицированных практически такие же,
как в популяции. Особенностью можно назвать риск вертикальной передачи возбудителя плоду, связанный с виремией на всех стадиях заболевания.
КЛИНИЧЕСКАЯ КАРТИНА Продолжительность инкубационного периода от 2 нед до 2 мес (иногда до 6 мес). Клинические проявления полностью
отсутствуют, но из-за высокой виремии инфицированные лица выступают как активный источник инфекции.
Представление о разнообразии клинических проявлений ВИЧ-инфекции можно получить, изучив разделы «Классификация» и «Дифференциальная диагностика». В табл. 48-15 представлены наиболее частые возбудители оппортунистических инфекций, которые характеризуют течение заболевания категории С (CDС, 1993) или стадии III Б, В (Покровский В.И. и др., 2001), т.е. собственно СПИДа.
Таблица 48-15. Наиболее частые возбудители СПИД-ассоциированных инфекций
Возбудите |
Представители различных царств и типов возбудителей |
ли |
|
Вирусы |
Herpes simplex, Cytomegalovirus hominus, Varicella zoster, Rotavirus, Adenovirus |
Бактерии |
Mycobacterium avium-intracellulare, Mycobacterium tuberculosis, Shigella spp., Salmonella spp., |
|
Legionella spp. |
ПростейшиToxoplasma gondii, Cryptosporidium parvum, Isospora belli, Cyclospora, Lamblia.
е
Гельминты Strongyloides stercoralis
Грибы Candida albicans, Cryptococcus neoformans, Histoplasma capculatum, Coccidioides
Каждый из возбудителей может вызвать типичную и атипичную картину соответствующего заболевания. Часто эти возбудители участвуют в развитии различных микстинфекций и микстинвазий. При СПИДе часты неврологические нарушения. Они развиваются за счёт фиксации ВИЧ на нервных клетках (мультифокальная лейкоэнцефалопатия с ВИЧ-деменцией), либо являются результатом вирусного, бактериального, микотического поражения головного мозга (менингоэнцефалит), либо исходом формирования абсцесса головного мозга токсоплазменной природы. Здесь же могут развиваться первичная лимфома или метастазы других опухолей. Частый спутник СПИДа — саркома Капоши и другие лимфомы с соответствующей симптоматикой. В стадии СПИДа нередки поражение глаз, эндокринной системы, аутоиммунные проявления. На ранних сроках СПИДа и на фоне адекватной терапии все симптомы могут развиваться довольно медленно, торпидно, но с течением времени темпы и тяжесть возникших осложнений усугубляются, и заболевание приводит к смерти.
Общая продолжительность болезни может быть различной — от нескольких лет до нескольких десятилетий. Осложнения гестации Во время беременности у ВИЧ-позитивной женщины возможны любые акушерские и экстрагенитальные осложнения
гестационного периода, но, по мнению большинства акушеров, их частота практически не превышает частоты таких же осложнений в целом в популяции беременных женщин в данное время и в данном регионе. Наиболее частым и тяжёлым осложнением гестации является перинатальное инфицирование плода ВИЧ, которое в отсутствие мероприятий по предотвращению передачи ВИЧ от матери к ребёнку в полном объёме может достигать 30-60% (при адекватной профилактике трансмиссии вируса от матери к плоду этот процент снижается до 8% и ниже (Россия), в некоторых странах до 1%).
ДИАГНОСТИКА
АНАМНЕЗ Анамнестические данные (эпидемиологические и данные анамнеза заболевания) имеют очень большое значение,
особенно в ранние сроки заболевания. В первую очередь речь идёт о принадлежности больного к группе высокого риска заражения ВИЧ и/или указании на половой контакт с партнёром из этих групп, продолжительные, рецидивирующие ИППП, пребывание в эндемичных по СПИДу регионах.
Диагностическое значение имеет указание на наличие у пациентки в течение 1 мес и более лихорадки неясного генеза выше 38 °С, диареи неустановленной природы, необъяснимой потери массы тела на 10% и более, выраженной потливости, персистирующего кашля, особенно ночью, неясного происхождения или неподдающейся обычной терапии затяжной или рецидивирующей пневмонии, выраженной слабости и утомляемости.
При клиническом наблюдении выявление ряда признаков обязывает врача обследовать больного на ВИЧ/СПИД: длительно протекающие и плохо поддающиеся лечению инфекционные и неинфекционные поражения кожных покровов и слизистых оболочек (простой герпес, лейкоплакия, микозы, папилломы и т.п.); другие рецидивирующие вирусные, бактериальные, протозойные, грибковые болезни; сепсис; увеличение лимфатических узлов в течение 1 мес и более в двух группах и более; симптомы лимфом, а также саркомы Капоши; туберкулёз лёгких, повторные пневмонии, резистентные к терапии; энцефалопатия (в возрасте моложе 50 лет).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ При первичном обращении женщины в женскую консультацию по поводу беременности проводят анамнестическое
обследование и акушерско-гинекологический осмотр, уточняют возможные факторы риска ВИЧ-инфицирования, определяют факторы риска осложненного течения беременности. Далее женщине предлагают пройти лабораторные обследования, рекомендованные при беременности.
Специфическая диагностика ВИЧ-инфекции проводится только с согласия больного (или его юридических правопреемников). Выделение и идентификацию ВИЧ осуществляют в лабораториях, оборудованных для работы с возбудителями 1-й и 2-й группы опасности.
Согласно приказу Минздрава №606 и приказу Минздравсоцразвития №375 тест на ВИЧ включён в перечень рутинных тестов, предлагаемых во время беременности всем женщинам, планирующим сохранение беременности. Российское законодательство определяет, что тестирование беременной женщины на ВИЧ является добровольным и должно сопровождаться дотестовым и послетестовым консультированием. Во время наблюдения беременной в женской консультации проводят двукратное тестирование: при первичном обращении по поводу беременности и, если инфицирования не было выявлено при первом тестировании, то проводят повторное тестирование в третьем триместре беременности (34–36 нед).
Лабораторная диагностика основана на определении циркулирующих АТ, Аг, иммунных комплексов; изоляции вируса из крови, спермы, ликвора, мочи и других биологических жидкостей (или в аутопсийном материале), выявлении его геномного материала и ферментов, а также оценке функций клеточного звена иммунитета.
Наибольшее распространение в практической деятельности получили серологические методы. Для выявления АТ к ВИЧ используют методы ИФА, позволяющие получить положительные результаты через 1–1,5 мес после заражения. Однако они требуют подтверждения методом иммуноблоттинга (верификация АТ к различным вирусным белкам).
Достоверным результатом считают выявление АТ к 4 и более белкам возбудителя. АТ к вирусным протеинам появляются в разное время, поэтому верификацию их проводят повторно в течение 6–12 нед. Серологическое обследование детей, родившихся от ВИЧ-позитивных матерей, приобретает достоверность через 18 мес после рождения (при исключении грудного вскармливания).
Высокоспецифичны и чувствительны для подтверждения диагноза ВИЧ/СПИД методы количественного определения РНК ВИЧ с помощью ПЦР, ДНК-провируса и методы молекулярной гибридизации нуклеиновых кислот с оценкой интенсивности репликации ВИЧ («вирусная нагрузка», или viral load). ПЦР выявляет РНК-ВИЧ уже на 11–15 день от момента заражения. Использование этого метода в динамике позволяет оценить эффективность этиотропной терапии и способствует уточнению прогноза заболевания.
Разработаны чувствительные тест-системы для экспресс-диагностики ВИЧ-инфекции (Serodia HIV-1/2, Fujirebic Inc. и др.). Их используют, в частности, у беременных, поступающих на роды без предшествующего обследования на ВИЧинфекцию, т.е. не наблюдавшихся в женской консультации, с неизвестным ВИЧ-анамнезом (маргинальные контингенты женщин).
Иммунологические методы, применяемые для оценки глубины нарушений иммунитета, уточнения стадии заболевания, прогноза и оценки эффективности противовирусной терапии, включают определение численности популяций CD4 и CD8-лимфоцитов, их соотношения, продукции интерферонов (a и c), ИЛ и др.
В стадии СПИДа используют все необходимые методы для выявления и подтверждения СПИД-ассоциированных инфекций, диагностики лимфом, характера поражения головного мозга.
Наблюдение за больными ВИЧ/СПИД (клинико-лабораторное, инструментальное, например, рентгенологическое) проводят регулярно, не реже чем каждые 36 мес, а на фоне специфической противовирусной терапии чаще, что позволяет оценить динамику заболевания и своевременно выявлять СПИД-ассоциированные болезни. Наблюдение осуществляют врачи-инфекционисты, специально подготовленные в Центрах борьбы со СПИДом (республиканских, областных, городских), в отделениях для больных ВИЧ/СПИД инфекционных стационаров. Ведение беременных, инфицированных ВИЧ, проводят там же, родоразрешение — в акушерском отделении инфекционной больницы или обсервационном родильном доме.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ Больные ВИЧ/СПИД регулярно (через 3–6 мес) подвергаются клинико-лабораторному и инструментальному
обследованиям, спектр последнего определяется прежде всего вторжением новой симптоматики.
Для определения состояния плода инфицированной беременной женщины используют методы, показанные для этой цели: ультразвуковое трансабдоминальное и трансвагинальное обследование в реальном масштабе времени с допплерометрической оценкой скорости кровотока в сердце и сосудах плода (в идеальном случае с получением цветного изображения потоков крови), а также пуповины и в маточных артериях. Кратность ультразвукового обследования определяет врач, ориентируясь на клиническую ситуацию, но не менее 3-х раз за время беременности. В ходе ультразвукового сканирования плода с использованием разработанных таблиц органометрических параметров плода в зависимости от срока беременности можно выявить с достаточно высокой точностью отклонения в развитии практически всех органов и костных образований плода. Для наблюдения за состоянием плода ВИЧ-инфицированной женщины используют также кардиотокографию (КТГ) для непрерывной одновременной регистрации частоты сердечных сокращений плода и тонуса матки как во время беременности (особенно в III триместре), так и во время родов с последующим анализом и оценкой важнейших показателей КТГ.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА Клинико-анамнестические проявления ВИЧ/СПИД на разных стадиях заболевания полиморфны и многочисленны и
могут иметь сходство с десятками болезней. В этих условиях дифференциальная диагностика только на основе анамнеза и клиники вряд ли возможна. Требуется высокая насторожённость врача любого профиля в отношении ВИЧ/СПИД и своевременное назначение скринингового обследования на АТ к ВИЧ методом ИФА.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ Носителей ВИЧ наблюдают специально подготовленные врачи, в стадии СПИДа при необходимости для консультации
приглашают гастроэнтеролога, невролога, пульмонолога, дерматолога, психолога, психиатра и врачей других специальностей с учётом особенностей клинического течения заболевания.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 16–17 недель. ВИЧ-инфекция, стадия II В (персистирующая генерализованная лимфаденопатия). ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Cупрессия ВИЧ, коррекция иммунных нарушений, лечение оппортунистических инфекций, опухолевых, аутоиммунных болезней.
Лечение проводят с учётом стадии и фазы заболевания, степени вирусной нагрузки, глубины иммунологических нарушений, возраста больного, наличия сопутствующих болезней. Разработаны программы противовирусной терапии ВИЧ/СПИД у беременных с главной целью — предотвратить (или максимально снизить риск) инфицирование плода и новорождённого.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ Лечение СПИД-ассоциированных болезней проводят с учётом их этиологии и тяжести, в большинстве случаев проводят политропную массивную терапию.
В последние годы активно разрабатывают новые подходы к терапии ВИЧ-инфицированных больных с использованием генноинженерных технологий (CD4-soluble, блокаторы хемокиновых рецепторов, ингибиторы регулярных генов, вакцинотерапия и пр.).
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Основа современного лечения больных ВИЧ/СПИД — высокоактивная антиретровирусная терапия (Highly Active Antiretroviral Therapy). В настоящее время созданы и применяют несколько десятков препаратов из 4 групп: нуклеозидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы обратной транскриптазы, ингибиторы протеазы. В 2002 году создан первый препарат группы ингибиторов фузии, который препятствует слиянию вируса и клетки-мишени и тем самым не допускает проникновения ВИЧ в клетки человека.
Возможна монотерапия (одним препаратом), но обычно назначают комбинированную терапию из нескольких средств различных групп. Наибольшее распространение в мире получила терапия тремя препаратами. Созданы готовые комбинированные препараты, исходно содержащие 2–3 препарата в одной таблетке. Продолжительность терапии зависит от её переносимости пациентом и эффективности лечения.
Выбор препаратов и их комбинирование — сложнейшая и ответственная процедура; её проводят специалисты по СПИДу под постоянным клиническим и лабораторным контролем.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ В случае возникновения у ВИЧ-положительного человека, в том числе у беременной женщины, клинических признаков
хирургического заболевания или осложнения беременности, требующих оперативного вмешательства (аборт, малое кесарево сечение, кесарево сечение и пр.), оно проводится как у неинфицированных ВИЧ лиц с особым вниманием на выполнение всех регламентированных противоэпидемических мероприятий. Операция кесарева сечения, потенциально снижающая риск передачи ВИЧ от матери ребенку, в 2005 году, например, выполнена у 17,2% женщин (преимущественно по акушерским показаниям).
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ Значительная часть ВИЧ-инфицированных предпочитают прерывание беременности на ранних сроках. В стадии
СПИДа беременность встречается редко. У ВИЧ-инфицированных беременных на ранних сроках заболевания гестация протекает без особенностей, частота её осложнений, как правило, не превышает популяционного уровня. Главное осложнение — риск заражения плода и новорождённого ВИЧ.
К достижениям последних лет можно отнести разработку антиретровирусной монотерапии беременных с ВИЧ/СПИД для профилактики инфицирования плода. Используют зидовудин из группы нуклеозидных ингибиторов обратной транскриптазы: по 0,1 г перорально 5 раз в сутки за 1434 нед до родов, в период родов внутривенно по 2 мг/кг в первый час и по 1 мг/кг в час до окончания родов. Альтернатива зидовудина — невирапин из группы ненуклеозидных ингибиторов обратной транскриптазы по 200 мг 2 раза в день. По показаниям беременным проводят и тритерапию. Новорождённому назначают Азидотимидин в сиропе по 2 мг/кг (при необходимости внутривенно по 1,5 мг/кг) 4 раза в сутки в течение 6 нед.
Если у ВИЧ-инфицированной женщины возникают те или иные осложнения гестации в любом триместре, в родах и послеродовом периоде, то их терапия ничем не отличается от лечения неинфицированных беременных (за исключением антиретровирусной терапии).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ В абсолютном большинстве случаев ВИЧ-инфицированную беременную ведут акушер-гинеколог и специалист по
СПИДу. При возникновении СПИД-ассоциированных инфекций и других болезней показана консультация соответствующих специалистов.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ ВИЧ/СПИД больных госпитализируют при наличии клинической симптоматики и необходимости дополнительной
терапии, а также для коррекции терапии и осложнений. ВИЧ-инфицированных без клинических проявлений можно наблюдать и лечить в амбулаторных условиях.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ Оценку эффективности терапии проводят по клиническим данным (если они есть), но главное — по величине
вирусной нагрузки и данным количественной оценки клеточного звена иммунитета. ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
Беременность может быть прервана (по желанию женщины) в принятые в акушерстве сроки. Если женщина намерена вынашивать плод, то следует добиваться срочных родов через естественные родовые пути.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ ВИЧ-инфицированная женщина должна неукоснительно выполнить все указания и сроки обследования, назначаемые
врачом. Безукоризненное соблюдение режима назначенной терапии антиретровирусными препаратами позволит снизить риск заражения плода (до 8% и ниже; без терапии риск достигает 30%). На любом сроке гестации при выявлении ИППП необходимо провести их терапию. Грудное вскармливание ребёнка не допускается. Медицинским работникам в случае повреждения кожи в процессе работы с ВИЧ/СПИД больными и при попадании инфицированного материала на слизистые оболочки показана экстренная постэкспозиционная профилактика ВИЧинфекции. Её режим зависит от глубины травмы и от ВИЧ-статуса (по результатам определения РНК ВИЧ) и иммунного статуса (по уровню CD4+ клеток) пациентки. При невысоком или умеренно выраженном риске заражения (неглубокие повреждения и низкая репликация ВИЧ у пациентки с благополучным иммунным статусом) проводят основной режим химиопрофилактики: зидовудин 0,6 г в 2–3 приёма в день и ламивудин по 0,15 г дважды в день (или комбивир© по 1 таблетке 2 раза в день). При высоком риске заражения (глубокая травма и интенсивная репликация ВИЧ у пациентки с выраженным иммунодефицитом и симптомами СПИДа) основной режим дополняют трёхкратным приёмом в сутки нелфинавира по 0,75 г или криксивана по 0,8 г. Постэкспозиционная профилактика начинается не позднее 24 ч после травмы и продолжается в течение 4 нед.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Лысенко А.Я. ВИЧ-инфекция и СПИД-ассоциированные заболевания / А.Я. Лысенко и др. — М., 1996. — 624 с.
Покровский В.И. Клиническая классификация ВИЧ-инфекции / В.И. Покровский, В.В. Покровский, О.Г. Юрин // Эпидемиология и инфекционные болезни. — 2001. — №1. — С. 710.
Рахманова А.Г., Виноградова Е.Н., Воронин Е.Е., Яковлев А.А. ВИЧ-инфекция. – СПб., 2004. – 696 с.
Шувалова Е.П. Инфекционные болезни: Учебник для медицинских вузов / Е.П. Шувало-ва. — 6-е изд., перераб. и доп.
— М.: Медицина, 2005. — 696 с.
48.11. БЕРЕМЕННОСТЬ И ПАПИЛЛОМАВИРУСНАЯ ИНФЕКЦИЯ Папилломавирусная инфекция — поражение слизистых оболочек урогенитального тракта (вульва, влагалище, цервикальный канал) вирусом папилломы человека.
СИНОНИМЫ Инфекция, вызванная ВПЧ; генитальные бородавки. КОД ПО МКБ 10
А63 Другие болезни, передающиеся преимущественно половым путем, не классифицированные в других рубриках. А63.8 Другие уточнённые ИППП.
В97.7 Папилломавирусы как причина болезней, классифицированных в других рубриках. ЭПИДЕМИОЛОГИЯ
ВПЧ — причина доброкачественных и злокачественных новообразований. Вирус поражает многослойный плоский эпителий кожи и слизистых оболочек. Путь передачи — контактный, в том числе половой. Передача папилломавирусной инфекции во время родов встречается редко. Клиническая картина перинатальной инфекции развивается в течение 2 лет. Наличие генитальных бородавок у детей старше 18 мес, особенно старше 2 лет, указывает на возможность совершения сексуального насилия.
ВПЧ определяют как в повреждённых тканях, так и в неизменённом эпителии. В 80% случаев при неизменённой шейке матки выявляют ВПЧ 16-го типа. Среди молодых женщин (средний возраст 22,9 лет) ВПЧ выявляют у 33%. Наиболее часто вирус обнаруживают в цервикальном канале и вульве – 46%. В большинстве случаев причиной инфекции является ВПЧ 16-го и 18-го типов. Далеко не у всех женщин, инфицированных онкогенными типами ВПЧ, в том числе и 16-го, и 18-го, разовьётся клинически выраженное заболевание, переходящее в рак шейки матки (РШМ).
В результате проведённых эпидемиологических и молекулярно-биологических исследований установлено, что важнейшим фактором канцерогенеза шейки матки является инфицирование женщин ВПЧ. Различные типы ВПЧ были найдены в 99,7% биоптатов, взятых у больных РШМ по всему миру, как при плоскоэпителиальных карциномах, так и при аденокарциномах.
Инкубационный период при наружных бородавках — 2–3 мес, при раке и предраке — годы. ЭТИОЛОГИЯ
ВПЧ — мелкий вирус, содержащий двунитевую ДНК. В настоящее время известно более 120 типов ВПЧ. Более 30 типов могут инфицировать генитальный тракт. Все типы ВПЧ разделяют на две группы: высокого онкогенного риска, которые выявляют в злокачественных опухолях, и низкого онкогенного риска, выявляемые при доброкачественных поражениях шейки матки и кондиломах. К группе высокого онкогенного риска относят 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 73, 82 типы вируса, к группе низкого риска — 6, 11, 36, 42, 43, 44, 46, 47 и 50. В Европе ВПЧ 16-го типа наиболее распространённый, был выявлен более чем в половине случаев РШМ. Если добавить к этому четыре других типа ВПЧ (18, 31, 33 и 45), то они выявляются более чем в 85% всех случаев этого заболевания. Инфекция, вызванная ВПЧ низкого онкогенного риска, обычно протекает доброкачественно с быстрым, в течение 12–18 мес, выздоровлением.
ПАТОГЕНЕЗ Основная мишень для воздействия онкогенных типов ВПЧ — зона трансформации шейки матки, где и развиваются
диспластические и предраковые изменения. Возможна прогрессия от клеточных изменений, связанных с ВПЧ инфекцией, до развития РШМ. Весь процесс обычно занимает 10–40 лет, но в редких случаях может развиться за 1–2 года.
КЛИНИЧЕСКАЯ КАРТИНА Развитие на коже и/или слизистых оболочках аногенитальной области экзофитных разрастаний, похожих на цветную
капусту; ороговевающих, возвышающихся над уровнем кожи, которые служат причиной кровотечений, зуда, выделений. У женщин частая локализация — шейка матки. Нередко поражаются одновременно несколько участков (например, шейка матки, влагалище и вульва). Размеры и количество бородавок различные. Во время беременности клиническая картина может меняться. Наружные кондиломы редко малигнизируются. Только некоторые типы ВПЧ вызывают цервикальный и аноректальный рак, а также рак вульвы и полового члена. Часто инфекция течёт бессимптомно. Самое грозное осложнение — РШМ.
Осложнения гестации Носительство ВПЧ не оказывает влияния на течение и исход беременности. Описаны лишь единичные случаи
развития папилломатоза гортани у новорождённых, родившихся от матерей с обширными генитальными бородавками.
ДИАГНОСТИКА Диагностика направлена на выявление онкогенных типов ВПЧ: типирование вируса с определением конкретных
генотипов, длительности персистенции вируса в цервикальном канале шейки матки; вирусной нагрузки (количество вируса) и степени интеграции вируса в клетку хозяина. При наличии онкогенных типов ВПЧ обязательно проведение цитологического исследования, а при выявлении дисплазии цервикального эпителия шейки матки — биопсия с гистологическим исследованием.
АНАМНЕЗ Факторы риска:
·возраст старше 35 лет;
·патология шейки матки; ·;ИППП в анамнезе;
·проституция;
·раннее начало половой жизни;
·наличие большого числа половых партнёров;
·частая смена половых партнёров;
·иммунодефицитные состояния. ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Выявление при осмотре в зеркалах аногенитальных бородавок, эрозии шейки матки и других поражений цервикального канала.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ При бессимптомных формах в качестве материала для исследования на онкогенные типы ВПЧ используют соскоб
эпителия уретры и/или цервикального канала. Для выявления вируса применяют исключительно молекулярно-биологические методы диагностики (ПЦР, ПЦР в реальном времени, ПЦР с использованием гибридной ловушки) с типированием онкогенных и неонкогенных типов и определением вирусной нагрузки (количество ДНК
вируса). При обнаружении онкогенных типов ВПЧ обязательно проводят цитологическое исследование с установлением степени дисплазии эпителия цервикального канала. При высокой степени дисплазии проводят гистологическое исследование. Если имеются наружные генитальные бородавки, то типирование ВПЧ не проводят. Серологическое исследование не применяют.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ При локализации бородавок на шейке матки проводят кольпоскопию, а при локализации в области наружного
отверстия мочеиспускательного канала — уретроскопию. Для визуализации субклинических проявлений папилломавирусной инфекции на коже и слизистых оболочках используют метод выявления повреждений с помощью уксусной кислоты: 5% уксусную кислоту наносят на кожу гениталий или шейки матки, через 3–5 мин наблюдают повреждения в виде побелевших участков. Пациентам с клинически видимыми повреждениями данную методику не проводят.
СКРИНИНГ Все существующие руководства по профилактике РШМ содержат практические рекомендации, касающиеся
выделения целевых групп для скрининга, интервалов при проведении скрининга, а также стратегий в отношении специальных групп пациентов.
Существующие в России нормативные документы не дают однозначных ответов на вопросы, касающиеся времени начала скрининга РШМ и временного интервала между тестами.
Основываясь на опыте различных стран по организации скрининга РШМ, впервые в нашей стране предложены следующие рекомендации для проведения профилактических программ в России.
·Возраст начала скрининга — 25 лет.
·Возраст, при котором нецелесообразно продолжать скрининг, — 65 лет.
·Интервалы при проведении скрининга — каждые 3 года у женщин моложе 50 лет и каждые 5 лет у женщин в возрасте
50–65 лет.
·Специальные группы пациенток:
G женщины с заболеваниями матки;
G женщины с субтотальной гистерэктомией;
G женщины с гистерэктомией по поводу инвазивного цервикального рака.
Беременным женщинам, не принимавшим участие в скрининге, цитологическое исследование необходимо проводить при постановке на учёт по беременности, а далее, согласно рекомендациям, вне беременности. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ·;Контагиозный моллюск ·;Микропапилломатоз половых губ ·;Жемчужные папулы полового члена ·;Себорейный кератоз ·;Интрадермальный невус
· Сancer in situ
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При выявлении дисплазии эпителия цервикального канала II–III степени, cancer in situ, РШМ показана консультация онкогинеколога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА Папилломавирусная инфекция. ЛЕЧЕНИЕ
Методов терапии, эффективно гарантирующей полное излечение от папилломавирусной инфекции, нет. Собственный клеточный иммунитет может подавить активность ВПЧ на некоторое время, однако бородавки склонны к рецидивированию. Считается, что удаление генитальных бородавок уменьшает риск передачи вируса, а также снижает риск злокачественного перерождения, однако полностью не исключает их.
ЦЕЛИ ЛЕЧЕНИЯ Элиминация вируса происходит не всегда, поэтому лечение направлено на удаление аногенитальных бородавок,
терапию эрозии шейки матки, дисплазию эпителия цервикального канала. Все диагностические, профилактические и терапевтические мероприятия направлены на профилактику РШМ.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ При небольших наружных генитальных и перианальных бородавках, а также при интраэпителиальных поражениях
шейки матки легкой степени возможно использование метода криотерапии. При обширных генитальных бородавках, включая поражение влагалища, цервикального канала, шейки матки и наружного отверстия мочеиспускательного канала, используется лазеродеструкция, хирургический метод или электроэксцизия и пластика. Для этого требуется специальное оборудование и подготовленный специалист. Необходима местная анестезия или наркоз. Обычно достигается хороший результат, но в некоторых случаях могут оставаться рубцы.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ При наличии небольших наружных генитальных и перианальных бородавок медикаментозную терапию во время беременности не проводят.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Используется при наличии обширных генитальных бородавок или поражений шейки матки тяжёлой степени (cancer in situ или РШМ).
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ При необходимости хирургического вмешательства госпитализация обязательна.
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ Для профилактики папилломатоза гортани у новорождённого при наличии крупных или множественных кондилом в
области половых органов женщины рекомендуется операция КС. При наличии ВПЧ высокого онкогенного риска никаких специальных рекомендаций нет.
Первичная профилактика РШМ предполагает проведение мероприятий в отношении лиц, не имеющих признаков заболевания, с целью предотвращения его развития в дальнейшем. Классическим примером первичной профилактики любого заболевания является вакцинация, которую проводят вне беременности.
Вторичная профилактика РШМ предполагает раннее выявление и лечение лиц, имеющих признаки заболевания, с целью замедлить или остановить его прогрессирование.
Третичная профилактика представляет собой хирургическое удаление развившейся опухоли в сочетании с лучевой терапией или химиотерапией.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ Контроль излеченности осуществляется с помощью периодических (1 раз в 6–12 мес) осмотров пациенток,
цитологического исследования, определения онкогенных типов вируса и их генотипирования. Выявления контактов не требуется. Половых партнёров необходимо осмотреть и обследовать, при наличии проявлений папилломавирусной инфекции — лечить.
При выявлении аногенитальных бородавок производится регистрация по форме 089/у-кв. ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Возможна длительная персистенция вируса без развития РШМ, а также элиминация вируса без лечения. При длительной персистенции генотипа вируса с повышенной онкогенной активностью, интеграции его в геном клетки с развитием дисплазии шейки матки возможна малигнизация. В связи с половой передачей вируса должны быть обследованы половые партнёры. При выявлении в цервикальном канале ВПЧ высокого онкогенного риска необходимо 1 раз в год проводить кольпоцитологическое исследование, а при выявлении дисплазии шейки матки III степени или РШМ — наблюдение и лечение у онкогинеколога.
При выявлении ВПЧ типов высокого онкогенного риска у беременных беременность продолжается. При наличии дисплазии шейки матки проводится кольпоскопическое и колипоцитологическое исследование.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Башмакова М.А., Савичева А.М. Папилломавирусная инфекция. — Н.Новгород: Изд-во НГМА, 2002. — 20 с.
Соколовский Е.В., Савичева А.М., Домейка М. и др. Инфекции, передаваемые половым путем. Руководство для врачей. — М.: Медпресс-информ, 2006. — 256 с.
Приказ МЗ РФ №403 от 12.08.2003 «Об утверждении и введении в действие учётной формы №089/у-кв».
Кулаков В.И., Паавонен Й., Прилепская В.Н и др. Профилактика рака шейки матки. Руководство для врачей. — М., Медпресс-информ, 2007. — 56 с.
Шипицына Е.В., Бабкина К.А., Оржесковская Е.А. и др. Папилломавирусная инфекция: факторы риска цервикальной неопластической прогрессии // Журнал акушерства и женских болезней, том LIII. — вып. 3. — 2004. — С. 38–45 Шипицына Е.В., Оржесковская Е.А., Бабкина К.А. и др. Определение вирусной нагрузки и статуса ДНК вируса папилломы человека 16 типа методом ПЦР в реальном времени // Журнал акушерства и женских болезней, том LIII. — вып. 4.— 2004. — С. 26–32.
ACOG: ACOG Practice Bulletin: clinical management guidelines for obstetrician–gynecologists. — Number 45 — August 2003.
— Cervical cytology screening (replaces committee opinion 152, March 1995) // Obstet Gynecol. — 2003. – Vol. 102. — P. 417–427.
Canadian STD Guidelines. Canada. — 1998. — 239 р.
Dalstein V., Bory J., Graesslin O., Quereux C. et al. Human papillomavirus testing for primary cervical cancer screening. Monsonego J (ed): Emerging issues on HPV infections: from science to practice. — Basel, Karger. — 2006. — P. 103–119. European Cervical Cancer Screening network. European guidelines for quality assurance in cervical screening. 2nd draft of 15 Dec. — 2003.
European STD Guidelines. Ed.: K Radcliffe. International Journal of STD AIDS. — 2001. — 12. — Suppl 3. — 107 p. Guidelines for the Management of Sexually Transmitted Infections. — WHO. — 2001. — 79 p.
Monsonego J., Bosch F.X., Coursaget P. et al. Cervical Cancer Control Priorities and new directions Int. J. Cancer. —2004. — Vol. 108. – P. 329–333.
Monsonego J. EUROGIN 2006 expert consensus report Innovations in cervical cancer prevention: Science, practice and actions // Gynecol. Oncol. — 2006. — Aug 9. [Epub ahead of print]
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva: World Health Organization. – 2005. — 186 р.
48.12. БЕРЕМЕННОСТЬ И ГЕНИТАЛЬНАЯ ГЕРПЕСВИРУСНАЯ ИНФЕКЦИЯ
Генитальная герпесвирусная инфекция — воспалительное заболевание половых органов, вызванное ВПГ (Herpes simplex virus) 1-го и 2-го типов (ВПГ-1 и ВПГ-2), характеризующееся пожизненной персистенцией и периодическим размножением вируса в организме человека, что приводит к возникновению рецидива. Иногда герпетическая инфекция протекает бессимптомно.
СИНОНИМЫ Генитальный герпес; герпетическая инфекция. КОД ПО МКБ-10
А60. Аногенитальная герпесвирусная инфекция (Herpes simplex).
А60.0. Герпетические инфекции половых органов и мочеполовой системы. А60.1. Герпетические инфекции перианальных кожных покровов и прямой кишки. А60.9. Аногенитальная герпесвирусная инфекция неизвестной этиологии. ЭПИДЕМИОЛОГИЯ
Герпетическая инфекция — одна из самых распространённых вирусных инфекций, которые возникают у человека. Симптомы заболевания, вызванного ВПГ, очень разнообразны. К ним относят высыпания вокруг рта (простуда) и в области половых органов, поражения глаз (офтальмогерпес), головного мозга (герпетический энцефалит) или внутренних органов.
Исследования, проведённые в разных странах мира, показали, что распространённость АТ к ВПГ-1 у взрослых составляет от 40 до 95%.
При изучении заболеваемости ВПГ 2 типа (ВПГ-2) учёные сделали вывод: инфекцию, вызванную этим вирусом, диагностируют в детском возрасте чрезвычайно редко. Однако с возрастом (начиная с 15 лет) вероятность обнаружения ВПГ-2 значительно увеличивается, достигая максимума у 30–35-летних пациентов. Помимо возраста, существуют другие важные факторы, способствующие инфицированию. К ним относят: количество половых партнеров, другие инфекции, ИППП, половую принадлежность (женщины заболевают чаще мужчин), а также уровень социально-экономического статуса.
В случае определения АТ к ВПГ пациентов считают серопозитивными. По данным серологических исследований, проведённых в разных странах мира, распространённость ВПГ-2 у беременных составляет до 55%, а ВПГ-1 — 50– 70%. У 75% серопозитивных людей носительство бессимптомно.
Источник заражения — инфицированный человек, причём заражение возможно как при появлении выраженных клинических симптомов заболевания, так и в латентный период. Вирус можно выделить из различных биологических секретов: слюны, слёзной жидкости, содержимого везикул и т.д. Инфицирование ВПГ 1-го типа чаще происходит в течение первых трёх лет жизни ребёнка, ВПГ 2-го типа — после начала половой жизни. В отличие от вируса герпеса 1- го типа, который вызывает поражение аногенитальной области, вирус герпеса 2-го типа характеризуется появлением клинических признаков на любых участках кожи и слизистых. В 70% случаев неонатальный герпес развивается вследствие инфицирования ВПГ-2.
Заражение возможно как воздушно-капельным путём, так и при прямом и непрямом контактах: через прикосновение (в том числе при половом контакте), предметы быта, посуду, игрушки, медицинские инструменты. Инфицирование новорождённого происходит трансплацентарно (от матери к плоду) или при рождении. Необходимо знать ещё и о парентеральном способе распространения ВПГ: при трансплантации органов и тканей, а также при искусственном оплодотворении инфицированной донорской спермой.
Инкубационный период Продолжительность инкубационного периода обычно составляет 7 сут, хотя развитие заболевания возможно и
раньше (например, на первые сутки), но не позже 26-го дня. КЛАССИФИКАЦИЯ
Существуют первичная и вторичная (рецидивирующая) генитальная герпесвирусная инфекция. Кроме этого, выделяют обычное течение герпесвирусной инфекции (локализованные формы) и тяжёлое течение — на фоне иммунодефицита (распространённые и генерализованные формы).
ЭТИОЛОГИЯ
ВПГ типа 1 и 2 относятся к подсемейству a-герпес вирусов семейства Нerpesviridae. Ещё один представитель этого подсемейства, поражающий человека, — ВПГ типа 3 (Varicella-zoster). Объединение этих трёх типов вирусов обусловлено наличием у них одного важного свойства: способности вызывать, главным образом, латентные инфекции, не только в нервных клетках, но и в сенсорных ганглиях. Генетический материал всех членов семейства Нerpesviridae — двухнитевая ДНК — заключён в нуклеокапсид икосаэдральной (20-гранной) формы, который состоит из 162 капсомеров. Капсид окружает аморфный материал — тегумен и белковая оболочка, содержащая вирусные гликопротеиновые шипы. ВПГ-1 и ВПГ-2 имеют значительную степень сродства.
Важная особенность инфекций, вызванных ВПГ, — способность переходить в латентное состояние с последующей реактивацией. Полагают, что, однажды попав в организм человека, вирус персистирует в нём в течение всей жизни. Признак реактивации процесса — появление специфических пузырьковых высыпаний на коже и слизистых оболочках. ПАТОГЕНЕЗ При первичном попадании вирионов в организм человека происходит их адсорбция на эпителиоцитах и прикрепление
к клеточным рецепторам. Мембраны клетки и вирионов сливаются, а ДНК вируса проникает в ядро клетки-хозяина. После ряда преобразований в ядрах эпителиоцитов образуются незрелые капсиды, которые, транспортируясь в цитоплазму, приобретают оболочку и выходят из клетки. В зоне поражения, на коже или слизистой, происходит воспалительный процесс: хемотаксис клеточных элементов, выброс в ткани биологически активных веществ, реактивные изменения сосудов, деградация эпителиоцитов. В результате на инфицированной поверхности образуется ограниченный отёк, гиперемия и микровезикулы, — всё это сопровождается ощущением зуда и жжения. При первичном заражении вирус из входных ворот инфекции попадает в сенсорные, спинальные или церебральные ганглии (распространение идет по эндоневральным и периневральным путям, интрааксонально и по шванновским клеткам). Однако ВПГ имеет свойство проникать в кровь и персистировать в ней. Первичное инфицирование всегда сопровождается периодом вирусемии, в результате чего ВПГ проникает не только в сенсорные ганглии, но и в любые другие клетки организма. Вирус обладает тропностью к форменным элементам крови и иммуноцитам. Попадая в генетический аппарат клетки, ВПГ вызывает её деградацию и гибель, или значительное снижение функциональной активности и развитие вторичного иммунодефицита, что делает невозможным его полную элиминацию.
Пребывание ВПГ в организме человека приводит к развитию патологии клеточного и гуморального звеньев иммунитета. Нарушается антителозависимая цитотоксичность лейкоцитов периферической крови, изменяется функциональная активность естественных киллеров, Т-лимфоцитов и неспецифических факторов защиты, снижается интерфероногенная способность лейкоцитов.
Вследствие снижения иммунитета, развиваются вторичные рецидивы заболевания, так как вирус может распространяться из сенсорных ганглиев по периневральным пространствам и повторно инфицировать кожу или слизистые оболочки. Ослабление иммунного контроля исключает возможность полной элиминации вируса из организма.
Патогенез осложнений гестации
Инфицирование плода может произойти внутриутробно (in utero), интранатально (во время родоразрешения) и постнатально (в послеродовом периоде). Вероятность внутриутробного заражения составляет 5%, интранатального — 85%, постнатального — 10%.
Генитальная герпесвирусная инфекция, перенесённая женщиной при сроке беременности до 20 нед, может спровоцировать спонтанный аборт. Герпесвирусная инфекция, возникшая на более позднем сроке беременности, — частая причина ЗРП. Риск спонтанного аборта, связанный с первичной инфекцией, может быть оценен как 25%.
Передача вируса плоду во время родов зависит от наличия у матери характерных герпетических высыпаний в области половых органов, уровня специфических АТ, а также длительности безводного промежутка. Риск инфицирования ребёнка значительно повышается, если у матери заболевание возникло впервые.
Вероятность интранатального заражения плода составляет 33–50% при первичном эпизоде и 5% — при рецидиве генитального герпеса.
КЛИНИЧЕСКАЯ КАРТИНА Клиническая картина герпесвирусной инфекции складывается из симптомов общего воспаления и признаков,
характерных только для данного заболевания. Первичная инфекция
·;Симптомы общего воспаления: лихорадка, гриппоподобное состояние, менингеальные симптомы (редко). ·;Клинические признаки, характерные для герпетической инфекции — высыпания на коже и слизистых оболочках: эритемы, пузырьки, эрозивные и язвенные дефекты на половых органах, образованию которых предшествует зуд, жжение, боль.
·;Дизурия.
·;Увеличение регионарных лимфатических узлов: на ощупь они тестоватой консистенции, болезненны при пальпации. ·;Длительность заболевания не превышает в среднем 16 дней.
Рецидив заболевания Рецидивы протекают в более мягкой форме, без общих воспалительных симптомов, продолжительность их составляет примерно 7–9 дней.
Бессимптомное течение заболевания Процесс выделения вируса в окружающую среду, как правило, не сопровождается развитием симптомов заболевания.
При этом происходит распространение инфекции. Первичная инфекция во время беременности
В исключительных случаях (выраженная лейкопения и тромбоцитопения) генитальная герпесвирусная инфекция во время беременности протекает тяжелее, чем обычно.
Рецидивирующая инфекция при беременности Для рецидивирующей герпесвирусной инфекции при беременности характерны все обычные симптомы: общие
воспалительные явления, дизурия, высыпания на коже и слизистых и т.д. Однако некоторые женщины отмечают учащение рецидивов, а также интенсификацию всех обычных симптомов. До сих пор не ясно, обусловлено ли это беременностью, или персистенцией вируса в организме.
Неонатальный герпес Неонатальный герпес встречается нечасто, но представляет серьёзную опасность для жизни и здоровья ребёнка.
Особенности неонатального инфицирования: ·;антенатальное заражение — редкость;
·;инфицирование новорождённых вирусом герпеса происходит, как правило, при прохождении через родовые пути матери;
·риск развития заболевания повышается (до 50% и более) у новорождённых, матери которых столкнулись с первичной инфекцией, возникшей непосредственно перед родами; при этом характер течения герпесвирусной инфекции роли не играет;
·клиническая картина развивается или сразу после рождения ребёнка, или спустя 4–6 нед после рождения. Формы герпетической инфекции у новорождённых
·Генерализованная герпесвирусная инфекция: поражение кожи и слизистых оболочек (происходит не всегда), печени, ЦНС и других органов (инкубационный период — одна неделя).
·Изолированное поражение ЦНС без кожных или висцеральных симптомов (инкубационный период 2–4 нед). Энцефалит в сочетании с микроцефалией или гидроцефалией.
·; Поражения кожи, конъюнктивы и слизистой оболочки полости рта без вовлечения ЦНС или внутренних органов (инкубационный период — 1–3 нед). На коже любой части тела появляются пузырьки и/или эрозии. При вовлечении глаз в воспалительный процесс развивается: блефароконъюнктивит, хориоретинит, конъюнктивит, кератит, увеит. При наличии герпетической инфекции, затрагивающей только кожные покровы, новорождённым необходимо парентеральное введение ацикловира для профилактики неврологических осложнений.
· Постнатальное заражение ВПГ происходит при первичном контакте с серопозитивной матерью или иным лицом. Формы постнатальной инфекции новорождённых: локализованная, распространённая и энцефалит. Клинические проявления герпесвирусной инфекции возникают примерно у 1/3 инфицированных новорождённых.
Повреждения кожи, глаз и слизистых оболочек у новорождённых могут проявляться в любых сочетаниях. При ограниченных формах болезни осложнения герпесвирусной инфекции у новорождённых диагностируют редко. Однако возможны рецидивы, присоединение вторичной инфекции, частичная потеря зрения, слепота, неврологические нарушения в виде микроцефалии и спастической тетра-плегии. При распространённой форме герпеса в процесс могут вовлекаться любые внутренние органы.
Болезнь, как правило, начинается неожиданно, отсутствуют характерные симптомы, что осложняет постановку диагноза. У младенцев наблюдают раздражительность, потерю аппетита, заторможенность. Затем повышается температура тела, развиваются дыхательные нарушения. При осмотре отмечают желтушность кожных покровов и геморрагический диатез, при пальпации — гепатоспленомегалию. Типичные поражения кожи — нередко единственный симптом, помогающий определить наличие герпесвирусной инфекции. Однако у большинства младенцев симптомов повреждения кожи не бывает. При отсутствии лечения смерть наступает вследствие развития ДВС-синдрома или пневмонии и достигает 80%.
Осложнения гестации Осложнения беременности при генитальном герпесе: невынашивание (выкидыш), инфицирование плода и новорождённого.
ДИАГНОСТИКА
Диагностика герпесвирусной инфекции основана на обнаружении вируса, его Аг или ДНК, а также на определении специфических противогерпетических IgG, IgM и подсчёте индекса авидности IgG.
АНАМНЕЗ Информация о ранее перенесённой герпесвирусной инфекции и частоте рецидивов необходима для назначения
адекватного лечения, предупреждения развития осложнений при планировании беременности и для защиты уже родившегося ребёнка.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ Производят осмотр кожных покровов и слизистых оболочек, в том числе слизистой влагалища и цервикального
канала, с применением вагинального зеркала. Цель — выявление специфических пузырьковых высыпаний или эрозивно-язвенных поражений.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В качестве материала для исследований используют содержимое пузырьковых высыпаний и/или отделяемое с
эрозивно-язвенной поверхности слизистых оболочек и кожи, при бессимптомных формах — соскоб эпителия уретры и цервикального канала. Для серологических исследований берут кровь из вены.
Взятие материала необходимо осуществлять в период выделения вируса: при первичном инфицировании оно продолжается около 12 дней, при рецидивах — не более 5 дней.
Методы лабораторной диагностики
·ПИФ направлена на выявление Аг ВПГ, имеет ограниченное диагностическое значение из-за большого количества ложноположительных результатов.
·;Молекулярно-биологический метод: ПЦР. Определение ДНК вируса методом ПЦР в биологических жидкостях не всегда имеет клиническое значение. Только обнаружение вируса в АЖ свидетельствует об инфицировании плода.
·Выделение вируса в культуре клеток проводится в единичных лабораториях.
·;Серологическая диагностика: ИФА. При проведении серологической диагностики следует учитывать, что около 90% населения России серопозитивны, т.е. имеют специфические IgG. Для постановки диагноза требуется определить уровень специфических;IgM,;а также — сероконверсию;IgG;при исследовании сыворотки крови с интервалом в две нед. Четырёхкратное нарастание титров;АТ при одномоментном сравнении двух образцов сыворотки — доказательство возникновения острой инфекции или рецидива. При диагностике герпес-вирусной инфекции, особенно у беременных, определяют индекс авидности специфических IgG. Индекс авидности менее 30% свидетельствует об острой первичной инфекции, более 40% — о хронической инфекции. При индексе авидности, равном 30–40%, анализ повторяют через две нед. В настоящее время исключительно важно обнаружить типоспецифические АТ разных классов к ВПГ-1 и ВПГ-2 в сыворотке крови.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ Исследование проводят с использованием вагинального зеркала. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Инфекции, вызванные ВПГ-1 и ВПГ-2, необходимо дифференцировать от эрозивно-язвенных поражений кожи и слизистых оболочек, первичного сифилиса, дерматитов, дерматозов, а также от заболеваний, причиной которых становится вирус Varicella-zoster.
ПРИМЕР ФОРМУЛИРОВКИ КЛИНИЧЕСКОГО ДИАГНОЗА Генитальная герпесвирусная инфекция.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
В связи с тем, что, начиная с момента инфицирования и до конца жизни, ВПГ персистирует в организме человека, все терапевтические мероприятия сводятся к снижению выраженности клинических симптомов заболевания, их исчезновению и к уменьшению количества рецидивов. У беременных лечение должно быть направлено на предупреждение инфицирования плода и новорождённого.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ Терапия во время беременности
•При наличии клинических проявлений герпесвирусной инфекции лечение обязательно должно быть проведено по схемам, указанным ниже.
•Применение противовирусных препаратов при беременности возможно только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода. При необходимости приёма этих лекарственных средств, в период лактации производят прерывание грудного вскармливания.
•При диссеминированных и генерализованных формах герпетической инфекции (энцефалиты, гепатиты и пр.) у
беременных используют исключительно ацикловир.
· КС в качестве профилактики неонатального герпеса показано только при наличии герпетических высыпаний на половых органах или при первичном клиническом эпизоде инфекции у матери в течение последнего месяца беременности. В остальных случаях возможно родоразрешение через естественные родовые пути.
Схемы лечения первичной инфекции:
•ацикловир назначают внутрь по 200 мг 5 раз в сутки или по 400 мг 3 раза в сутки в течение 5–7 дней. Рецидивирующая инфекция При рецидивирующей инфекции (обострении):
•ацикловир назначают внутрь по 400 мг 3 раза в сутки в течение 5 дней.
Лечение новорождённых Для лечения новорождённых применяют ацикловир по 45–60 мг/кг внутривенно каждые 8 ч. Длительность терапии составляет 2–3 нед.
Схемы проведения длительной супрессивной терапии: ·;ацикловир назначают внутрь по 400;мг;2;раза в сутки (ежедневно).
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ Профилактика герпесвирусной инфекции направлена на предупреждение развития неонатального заражения.
Профилактика неонатального герпеса заключается в обнаружении и лечении первичного и рецидивирующего генитального герпеса у беременной (для снижения вероятности внутриутробной передачи инфекции плоду), предупреждении интранатального и постнатального инфицирования плода и новорождённого.
Операция КС — основная мера профилактики интранатального заражения плода при наличии генитальной герпесвирусной инфекции у матери.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ При развитии осложнений требуются консультации смежных специалистов: терапевта, офтальмолога, невропатолога, отоларинголога и др.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ Госпитализацию проводят при генерализации инфекции и возникновении осложнений. ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Исчезновение клинических симптомов заболевания — основной критерий качества терапии. Выявление контактов Выявление контактов не требуется.
Лечение полового партнера При обнаружении герпетической инфекции следует произвести осмотр и обследование полового партнёра, а при необходимости — его лечение.
Регистрация Направляется экстренное извещение в КВД по форме 089/у-кв.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ Выполнение операции КС рекомендуют при возникновении клинических симптомов герпетической инфекции половых
органов в период, начиная с 36 нед беременности, или во время родов, при наличии продромальных явлений к моменту родов, при желании инфицированной женщины.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
•Генитальный герпес — рецидивирующая и неизлечимая инфекция, а следовательно, пациенты и их сексуальные партнёры должны быть проинформированы об этом.
•Необходимо объяснить сущность заболевания пациентке, акцентируя внимание на возможности рецидивов болезни, частом бессимптомном течении и половом пути передачи (происходит даже при отсутствии каких-либо признаков болезни). В этом случае пациентке требуется ознакомление со способами предотвращения заражения.
•В период выраженных клинических симптомов от половой жизни лучше воздержаться.
•Использование презерватива обязательно во время сексуальных отношений с новым партнёром.
•Презервативы — недостаточно эффективный метод профилактики инфицирования ВПГ, так как пузырьковые высыпания или эрозивно-язвенные поверхности могут быть локализованы на коже или слизистой оболочке ротовой
полости, заражение возможно и при бессимптомном течении заболевания, а также высока вероятность передачи ВПГ оро-генитальным путём.
•Рекомендуя длительное использование презервативов моногамным парам, необходимо взвешивать все «за» и «против».
•Следует обсудить риск развития заболевания у новорождённого при наличии инфекции у беременной. Пациенткам, страдающим генитальным герпесом, советуют сообщить об этом при постановке на учет в женской консультации по поводу беременности: это обеспечит наблюдение за течением заболевания во время беременности.
•Пациентам с первичным эпизодом генитального герпеса необходимо назначать кратковременную антивирусную
терапию, направленную на быстрое исчезновение симптомов, и длительную супрессивную антивирусную терапию, которая позволит сократить количество рецидивов.
• Анализ половых контактов проводят в зависимости от клинических проявлений заболевания и предполагаемого срока заражения. Пациентка, страдающая генитальным герпесом, должна предупредить своего сексуального партнёра (партнёров) о риске инфицирования.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Айламазян Э.К., Потин В.В., Тарасова М.А. и др. Гинекология от пубертата до постменопаузы под ред. Э.К. Айламазяна. —М.:Медпресс-информ, 2006. — 491 с.
Соколовский Е.В., Савичева А.М., Домейка М. и др. Инфекции, передаваемые половым путем. Руководство для врачей. — М.: Медпресс-информ, 2006. — 256 с.
Приказ МЗ РФ №403 от 12 авг. 2003. «Об утверждении и введении в действие учётной формы №089/у-кв». Canadian STD Guidelines. — Canada, 1998. — 239 р.
Corey R., Flynn J. Maternal intrauterine herpes simplex virus infection leading to persistent fetal vasculature. — Arch. Ophtalmol., 2000. — Vol. 118. — Р. 837–840.
European STD Guidelines. Ed.: K Radcliffe. International Journal of STD AIDS, 2001. — Suppl. 3. — 107 p. Guidelines for the Management of Sexually Transmitted Infections. — WHO, 2001. — 79 p.
Guidelines for Treatment of Sexually Transmitted Diseases. — CDC, 2002.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections — a practical guide. — WBS: London, 1999. — 509 p.
Kimberlin D.W., Lin C.Y., Jacobs R.F. et al. Natural history of neonatal herpes simplex virus infections in the acyclovir era. — Pediatrics, 2001. — Vol. 108. — P. 230.
Kimberlin D.W., Rouse D.J. Genital herpes / N. Engl. J. — Med., 2004. — Vol. 350. — P. 1970.
Libman M.D., Dascal A., Kramer M.S., Mendelson I. Strategies for the prevention of neonatal infection with herpes simplex virus: a decision analysis / Rev. Infect. — Dis., 1991. — N13. — P. 1093–1104.
Monif G.R.G, Baker D.A. Infectious Diseases in Obstetrics and Gynecology / 5th Edition. — The Parthenon Publishing Group, London, 2004. — 23 p.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva: World Health Organization, 2005. — 186 р.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions. — STI, 1999. — Vol. 75. — Suppl.1. — 89 p.
48.13. БЕРЕМЕННОСТЬ И ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ Цитомегалия — инфекция, вызванная ЦМВ.
КОД ПО МКБ-10 В25. Цитомегаловирусная болезнь.
В25.0. Цитомегаловирусная пневмония. В25.1. Цитомегаловирусный гепатит. В25.2. Цитомегаловирусный панкреатит.
В25.8. Другие цитомегаловирусные болезни. В25.9. Неуточненная цитомегаловирусная болезнь.
О35.3. Поражение плода (предполагаемое) в результате вирусного заболевания матери, требующее предоставления медицинской помощи матери.
ЭПИДЕМИОЛОГИЯ ЦМВИ сейчас называют инфекцией современной цивилизации вследствие её чрезвычайной распространённости.
ЦМВИ диагностируют гораздо чаще большинства заболеваний, угрожающих жизни и здоровью беременных и детей в период их внутриутробного развития. Диагностику этой инфекции производят по наличию специфических АТ, вероятность обнаружения которых составляет 50–98% в зависимости от социально-экономического положения обследуемых групп пациентов. У доноров крови АТ к ЦМВ определяют в 90–95% случаев, у женщин репродуктивного возраста — в 70–90%.
Для вируса цитомегалии характерна пожизненная персистенция и реактивация при снижении иммунитета в инфицированном организме.
Врождённую цитомегалию регистрируют в 0,4–2,3%, причём у 5–10% инфицированных новорождённых симптомы заболевания можно визуализировать, а у остальных 90–95% — клинические признаки полностью отсутствуют. КЛАССИФИКАЦИЯ Выделяют следующие формы ЦМВИ: первичную, первично-хроническую, латентную (неактивную), персистирующую
реактивированную (реактивация латентной инфекции), суперинфекцию (заражение инфицированной пациентки другим штаммом вируса).
ЭТИОЛОГИЯ
Таксономически ЦМВ принадлежит к группе герпетических вирусов, в которую входят также ВПГ типа 1 и 2 (Herpes simplex virus), вирус Varicella-zoster, вирус Эпштейна–Барр и ещё недостаточно изученные вирусы герпеса 7 и 8 типов. Вирионы ЦМВ имеют икосаэдральную форму, состоят из молекулы двухцепочечной ДНК, поверхностного белка и липидного слоя, а их диаметр составляет 1800–2000 ангстрем. В инфицированных тканях вирус образует внутриядерные включения, при этом заражённые клетки и их ядра значительно увеличиваются в размерах. Кроме внутриядерных включений, придающих клеткам вид «совиного глаза», образуются ещё и цитоплазматические включения.
Результатом размножения и персистенции вируса может стать инфицирование любых тканей и внутренних органов. Однако манифестные формы ЦМВИ встречаются редко, в основном, у лиц с недостаточно развитым (например, у растущего плода) или сниженным иммунитетом. Вирус обнаруживают во всех биологических жидкостях: слюне, моче, сперме, ликворе, грудном молоке, крови, а также в слизи из прямой кишки и в выделениях из шейки матки, влагалища и уретры. ЦМВ обладает способностью реактивироваться, размножаться и выделяться с биологическими жидкостями довольно продолжительное время. У лиц, инфицированных вирусом цитомегалии, периодически или постоянно происходит экскреция вирионов с мочой, грудным молоком, цервикальным секретом, слезами и т.п. Выделение вируса при первичной инфекции может происходить в течение нескольких месяцев или даже лет. При реактивации латентной инфекции экскреция вируса происходит быстрее.
Пути передачи Инфицирование вирусом цитомегалии возможно воздушно-капельным путём, трансфузионно (при переливании
крови), через грудное молоко при кормлении, через шприцы при внутривенном введении наркотиков, через инфицированную сперму, при пересадке органов и тканей.
ПАТОГЕНЕЗ ЦМВ хорошо адаптирован к существованию в организме человека, поэтому появление выраженных симптомов —
большая редкость.
Убольшинства людей ЦМВИ протекает бессимптомно. Повышение температуры тела отмечают лишь в 10% случаев.
Улиц с иммунодефицитом возможна генерализация инфекции, приводящая к поражению лёгких, печени и других органов.
Персистенция вируса сопровождается выработкой специфических АТ: сначала появляются иммуноглобулины класса М, затем — G. IgG, в отличие от IgM, сохраняются в крови пожизненно.
Патогенез осложнений гестации По мере увеличения срока беременности у женщин увеличивается частота выделения вируса с мочой и слизью из
влагалища. Этот феномен наблюдают и при латентно протекающей цитомегалии. К концу беременности количество экскретируемых вирусных частиц достигает 20%.
Присутствие вируса в моче и цервикальной слизи не свидетельствует об инфицировании плода. Наличие в крови матери АТ к ЦМВ полностью не исключает возможность трансплацентарной передачи вируса плоду, но снижает вероятность его заражения или активность инфекции.
Значение предшествующей инфекции у матери В патогенезе врождённой цитомегалии большое значение имеет наличие в анамнезе у женщины ЦМВИ до настоящей
беременности. В этом случае в крови матери содержатся специфические АТ. Число серопозитивных лиц выше среди малообеспеченных слоёв населения (60–80%). У женщин с более высоким уровнем достатка частота выявления АТ к ЦМВ существенно ниже (15%), поэтому они, как правило, подвергаются первичному инфицированию во время беременности. Первичная материнская инфекция — основная причина рождения детей с ЦМВИ у 63% серонегативных женщин с высоким уровнем дохода. Среди социально менее обеспеченных женщин только у 25% пациенток первичная материнская инфекция приводит к внутриутробному инфицированию ребенка ЦМВ.
Женщины из малообеспеченных слоёв населения приобретают вирус цитомегалии в детстве, наиболее часто врождённая цитомегалия бывает у их первого ребёнка, особенно, если матери на тот момент было меньше 20 лет. Возможность вертикальной передачи вируса, в первую очередь, ассоциируется с первичной инфекцией у женщины во время беременности и возникает в 35–40% случаев. Вероятность инфицирования плода при наличии цитомегалии во время предшествующей беременности составляет всего 1–3%. В период вынашивания плода экскреция вируса с мочой и выделениями из полового тракта увеличивается до 7–10%. Количество выделяемого вируса зависит от возраста, но не коррелирует с частотой вертикального инфицирования плода. Однако если во время беременности фиксируют высокий уровень экскреции вирионов с мочой, вероятность рождения ребёнка с внутриутробной ЦМВИ заметно повышается. Материнская иммунная система не может полностью элиминировать вирус и предотвратить плацентарную инфекцию, но снижает заболеваемость и/или активность инфекции у новорождённого.
Врождённая цитомегаловирусная инфекция Частота врождённой цитомегалии среди живорождённых детей составляет 0,4–2,3%. У 5–10% этих детей инфекция
протекает бессимптомно. В отличие от краснухи, врождённая ЦМВИ развивается, несмотря на наличие специфических АТ. Врождённая цитомегалия из-за реактивации латентной формы встречается в высоко иммунной популяции, а также у иммунокомпрометированных лиц.
Первичную инфекцию диагностируют у 0,7–4% беременных, при этом в 35–40% случаев происходит внутриутробное заражение плода. Гестационный возраст значения не имеет и не влияет на вероятность трансплацентарного инфицирования. Аналогично материнской краснухе, в I триместре беременности возможны два варианта вовлечения плода в патологический процесс. В первом случае инфекция ограничивается плацентой, во втором — в процесс вовлечены не только плацента и плод, но и практически все его органы.
КЛИНИЧЕСКАЯ КАРТИНА Клинические признаки ЦМВИ, как правило, незначительны в связи с хорошей адаптацией вируса к условиям
внутренней среды организма. Врача должно насторожить появление у беременной симптомов, сходных с признаками инфекционного мононуклеоза. Симптомом заболевания служит периодическое и нерегулярное повышение температуры до фебрильных цифр в течение трёх и более недель. Пациенты жалуются на тошноту, сонливость. Изменяется картина белой крови: происходит увеличение абсолютного и относительного содержания моноцитов, а также атипичных лимфоцитов (12–55%). В отличие от инфекционного мононуклеоза, при ЦМВИ отсутствуют тонзиллит, фарингит, лимфаденопатия. Могут появляться биохимические признаки гепатита: повышение активности трансаминаз и ЩФ, но специфические тесты на Аг гепатита и на АТ к Toxoplasma gondii отрицательны. ОСЛОЖНЕНИЯ ГЕСТАЦИИ Заболеваемость новорождённых зависит от срока беременности, при котором произошло заражение плода ЦМВ. В
случае инфицирования плода в I триместре беременности высока вероятность развития у него патологических нарушений и/или начала преждевременных родов у матери, при этом ребёнок имеет низкую массу тела (для данного гестационного возраста). Характеристика внутриутробных поражений при ЦМВИ также зависит от времени трансмиссии вируса от матери плоду. Манифестные формы цитомегалии у новорождённых (возникают при трансплацентарной передаче первичной материнской инфекции) протекают тяжело и сопровождаются развитием серьёзных осложнений, приводящих в дальнейшем к инвалидизации и снижению качества жизни. Заражение плода вирусом при наличии у матери латентной персистирующей формы заболевания наблюдается при реактивации инфекции, вызывает бессимптомно протекающую врождённую патологию, для которой характерно развитие отдалённых последствий (например, прогрессирующего нарушения слуха).
Инфекция в I триместре беременности
Перенесённая на ранних сроках беременности ЦМВИ не обязательно ведёт к клинически выраженному заболеванию новорождённого. Наиболее часто инфицированные дети рождаются недоношенными, а если рождаются в срок, то имеют низкую массу тела. Симптомы цитомегалии похожи на признаки врождённого сифилиса или врождённого герпеса. Имеет место тенденция к микроцефалии. На рентгенограмме обычно визуализируют экстенсивную кальцификацию боковых желудочков головного мозга. У детей с микроцефалией нередко возникает хорио-ретинит. Экстрамедуллярное кроветворение — причина развития гепатомегалии, которая иногда сопровождается гепатитом. У инфицированных детей часто возникает генерализованное внутрисосудистое свертывание крови. На коже появляются петехии, обусловленные коагулопатией и тромбоцитопенией. У детей, даже с неярко выраженными симптомами врождённой цитомегалии, нередко развивается снижение умственного или физического развития (как отдалённые последствия). Если же при рождении отсутствуют симптомы заболевания, то вероятность серьёзных патологий составляет 10%.
Полагают, что врождённая ЦМВИ провоцирует самопроизвольные аборты. При исследовании плодов, изгнанных во время спонтанных абортов, находят и характерные внутриядерные включения, и выделяют вирус из поражённых тканей плода. Вирус цитомегалии обнаруживают в тканях изгнанных плодов в 0,5–10% случаев, хотя приведённые цифры не отражают истинной вероятности заражения эмбрионов и плодов, так как возможна контаминация плода вирусом из эндоцервикса.
Инфекция во II триместре беременности
Если заражение произошло во II триместре и привело к развитию выраженных симптомов заболевания и постнатальной инфекции, то клиническая картина ЦМВИ у новорождённого менее выражена. Микроцефалия возникает редко, причём субэпендимальные поражения головного мозга с образованием в нём дистрофических кальцификатов отсутствуют. Реже возникает и хориоретинит. У некоторых детей диагностируют врождённую гепатомегалию или спленомегалию, а также коагулопатию или желтуху. Однако у большинства новорождённых о перенесённой внутриутробной инфекции свидетельствует только наличие IgM к вирусу цитомегалии в сыворотке крови.
Инфекция в III триместре беременности
Инфекция в III триместре, по-видимому, редко приводит к ранним нарушениям соматического роста или к умственным нарушениям. Ребёнок выглядит нормальным по всем параметрам. В пуповинной крови обнаруживают IgM, но их концентрация обычно невысока.
Поздние нарушения развития
В ходе продолжительных наблюдений за детьми с врождённой цитомегалией (клинические симптомы отсутствовали), сопровождавшейся лишь повышением концентрации IgM в пуповинной крови, было выявлено небольшое снижение слуха (аудиометрический метод), прогрессирующее с течением времени. Серьёзные нарушения умственного развития и слуха у детей с врождённой ЦМВИ, приобретённой в III триместре беременности, диагностируют в 1 случае из 1000. Бессимптомно протекавшая цитомегалия вызывает у ребёнка снижение слуха, дискинезию, замедление умственного развития, которые проявляются в первые два года жизни.
Постнатальная диссеминация Срок беременности влияет на количество экскретируемых вирионов. К концу беременности процент женщин, у
которых происходит выделение вируса, достигает 7–20%. Родовые пути — основной источник заражения ребёнка, а грудное молоко — дополнительный. Инфицирование плода чаще всего регистрируют у юных матерей из неблагополучных семей. Инкубационный период цитомегалии, приобретённой в перинатальный период, составляет
8–12 нед.
ДИАГНОСТИКА Для выявления возбудителя и специфического иммунного ответа применяют лабораторные методы. Серологические
методы являются основными для диагностики цитомегалии у беременных или женщин, планирующих беременность. Они направлены на обнаружение АТ к ЦМВ в сыворотке крови. Определение ДНК вируса в крови и расчёт вирусной нагрузки (количества вируса) проводят, в основном, у пациентов с иммунодефицитами, в том числе после трансплантации органов (особенно костного мозга и почек).
АНАМНЕЗ
Информация о присутствии специфических IgG в сыворотке крови имеет большое значение при планировании беременности. Их наличие говорит об иммунитете. В ранние сроки беременности необходимо знать не только наличие IgG, но и индеск авидности IgG, для того, чтобы исключить первичную инфекцию.
Наибольшую опасность для беременной представляет именно первичное попадание ЦМВ в организм. После неблагоприятного исхода предыдущей беременности в связи с ЦМВИ в крови пациенток образуются и сохраняются специфические IgG, которые защищают плод от повторной инфекции.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ При появлении симптомов гриппоподобного заболевания необходимо: выполнить осмотр слизистых оболочек, термометрию, аускультацию.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ Методы, используемые для выявления вируса цитомегалии:
·культуральный — выделение вируса в культуре клеток из крови, слизи из полости рта, мочи и других образцов клинического материала и определение раннего Аг;
·иммунофлюоресцентный — выявление раннего вирусспецифического Аг в клетках плаценты, слизистой оболочки
ротовой полости, а также в клетках, заражённых биологическим материалом пациента. Используется редко из-за большого количества ложноположительных результатов;
·;серологический — определение;IgМ к вирусу цитомегалии или повышение титра;АТ класса G (достоверным признаком считают прирост АТ в 4 раза и более), определение индекса авидности IgG (индекс авидности менее 30% свидетельствует о первичной инфекции); ·;молекулярно-биологический, наиболее часто ПЦР — обнаружение вирусной ДНК в крови, моче и других биологических материалах.
ДИАГНОСТИКА МАТЕРИНСКОЙ ИНФЕКЦИИ Наиболее широко применяют серологические методы исследования. Для визуализации АТ используют различные
реакции. ИФА с определением классов иммуноглобулинов — «золотой стандарт». Наличие IgM — достоверный признак острой инфекции у матери. К сожалению, при попытке обнаружить специфические IgM к вирусу цитомегалии у беременных велика вероятность получения ложноположительных результатов. В таком случае полезно определить авидность IgG. Индекс авидности, превышающий 50%, характерен для АТ, образовавшихся, по-видимому, ещё в детстве. При этом ЦМВИ оценивают как латентную.
ДИАГНОСТИКА ВНУТРИУТРОБНОГО ИНФИЦИРОВАНИЯ
Доказательством возможного инфицирования плода может служить повышение уровня специфических IgМ к вирусу цитомегалии в пуповинной крови. Следует помнить о высокой вероятности получения ложноположительных результатов и о том, что специфические АТ (IgM) образуются к моменту рождения лишь у 50–60% детей, заражённых ЦМВИ внутриутробно. В настоящее время возможно проведение анализа ОВ, полученных при амниоцентезе, методом ПЦР. Это наиболее достоверный метод, подтверждающий наличие внутриутробной инфекции. Быстрое получение результата по сравнению с заражением культуры клеток — ещё одно преимущество данного исследования. КОНСУЛЬТИРОВАНИЕ ЖЕНЩИН ВО ВРЕМЯ БЕРЕМЕННОСТИ Осуществить пренатальное консультирование женщин с первичной ЦМВИ очень трудно. Отрицательные результаты
ПЦР и культурального исследования ОВ свидетельствуют о том, что на данный момент плод не инфицирован. Однако трансплацентарное заражение возможно при дальнейшем течении беременности. УЗИ — недостаточно чувствительный метод, так как не позволяет сразу распознать серьёзные нарушения: гидроцефалию, микроцефалию, множественные поражения плода.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ЦМВИ следует дифференцировать с ОРЗ, инфекционным мононуклеозом, пневмонией, гепатитами, токсоплазмозом и др.
ЛЕЧЕНИЕ В связи с персистенцией вируса цитомегалии в организме в течение всей жизни проведение терапевтических
мероприятий, направленных на элиминацию вируса, нецелесообразно. Для поддержания иммунной системы организма необходимо назначить иммуномодуляторы, интерфероны, иммуноглобулины; для деактивации вируса — противовирусные препараты, для борьбы с клиническими проявлениями проводят симптоматическую терапию. ЦЕЛИ ЛЕЧЕНИЯ Основные цели терапии:
•предупреждение внутриутробного инфицирования плода;
•профилактика цитомегалии у новорождённых. НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В качестве немедикаментозного лечения иногда используют плазмаферез и эндоваскулярное лазерное облучение крови.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ В настоящее время разработаны противовирусные препараты, активные в отношении вируса цитомегалии. Такие
препараты как ганцикловир и фоскарнет применяют при висцеральных поражениях и диссеминированной инфекции. Из-за высокой токсичности лекарственных средств их применение показано только для терапии детей с тяжёлыми висцеральными поражениями, однако результаты такого лечения не всегда однозначны. Препаратов, одинаково хорошо действующих на вирусы при бессимптомной цитомегалии у всех новорождённых и младенцев, не существует. Выпускаемый немецкой фирмой препарат цитотект, содержащий АТ к ЦМВ, фактически обладает лишь иммуномодулирующим действием без отчётливой противовирусной активности. Для запуска клеточного иммунитета используют также рекомбинантные и природные интерфероны, индукторы эндогенного интерферона и другие иммуномодуляторы.
ПРОФИЛАКТИКА И ПРОГНОЗ ВНУТРИУТРОБНЫХ ОСЛОЖНЕНИЙ Основные профилактические меры — ограничение слишком близкого контакта детей друг с другом в детских садах, в
школах. Для этого существуют правила личной гигиены: частое мытье рук и отсутствие прямого контакта с биологическими жидкостями. Разработана живая аттенуированная вакцина, применение которой, главным образом при пересадке почек, исследуют уже больше 20 лет. Результат использования вакцины — снижение заболеваемости цитомегалией.
Ухаживать за новорождённым с ЦМВИ, развившейся внутриутробно, должны только серопозитивные женщины, поскольку ребёнок может служить источником инфекции. В случае выделения ЦМВ с молоком грудное вскармливание необходимо продолжать, если мать серопозитивна, так как пассивно переданные, в том числе и с молоком, материнские АТ способствуют развитию бессимптомной формы заболевания у ребёнка.
Особое значение имеет выделение в группу высокого риска рождения детей с врожденной цитомегалией женщин, переносящих во время данной беременности первичную ЦМВИ. Обязательные критерии диагностики — иммунологические маркёры активности инфекционного процесса (серологическая диагностика с выявлением специфических АТ). Реже используют определение тем или иным методом (культуральным или молекулярно-биологическим) присутствия вируса в крови, половых органах, моче, поскольку оценка положительных результатов всегда предполагает дальнейшее использование иммунологических (серологических) маркёров. В первую очередь обследуют женщин с отягощенным акушерским анамнезом (невынашивание, спонтанный аборт, мёртворождение).
Прерывание беременности возможно только при комплексном учёте тяжести заболевания матери, поражения плода или плаценты (по данным УЗИ).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ Консультация соответствующих специалистов (иммунолог, вирусолог) необходима при генерализации инфекции. ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация необходима при генерализации инфекции у пациенток с иммуносупрессией, а также при развитии осложнений.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценить эффективность лечения очень трудно, так как IgG сохраняются в крови пожизненно. Определение динамики снижения вирусной нагрузки при молекулярно-биологическом исследовании крови целесообразно только у пациентов, перенёсших трансплантацию органов и/или тканей.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
· Проведение серологического исследования (на наличие специфических IgG) необходимо женщинам при планировании беременности.
·;Важно знать, что в крови большинства пациентов (примерно;96%);репродуктивного возраста присутствуют IgG к;ЦМВ.
·;Первичная ЦМВИ представляет наибольшую опасность во время беременности, поэтому при подозрении на неё требуется проводить серологическое исследование сыворотки крови (определение IgG, IgМ, определение индекса авидности IgG).
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Ткаченко С.Б., Савичева А.М., Шипицына Е.В., Шалепо К.В., Дробченко С.Н. Быстрые простые методы в диагностике
TORCH-комплекса. Практическое руководство для врачей. — М.: Астер-Х — 2006. — 104 с. Инфекции в акушерстве и гинекологии / Под ред. О.В. Макарова, В.А. Алешкина, Т.Н. Савченко. — М.: Медпресс-информ — 2007. — 464 с.
Antsaklis A., Daskalakis G. et al. Prenatal diagnosis of fetal primary CMV infection / Br. J. Obstet. Gynaecol. — 2000. — Vol.107. — Р. 84–88.
Bodeus M., Hubinont C., Bernard P. et al. Prenatal diagnosis of human cytomegalovirus by culture and polymerase chain reaction: 98 pregnancies leading to congenital infection / Prenatal Diagn. — 1999. — Vol.19. — Р. 314.
Kimberlin D.W., Lin C.Y., Sanchrz P.J. et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: A randomized, controlled trial // J. Pediatr. — 2003. — Vol. 143.
— Р. 16.
Lazzarotto T., Gabrielli L., Lanari M. et al. Congenital cytomegalovirus infection: recent advances in the diagnosis of maternal infection // Hum. Immunol. — 2004. – Vol. 65. — Р. 410.
Lazzarotto T., Spezzacetena P. et al. Anti CMV IgG avidity in identification of pregnant women at risk of transmitting congenital CMV infection // Clin. Diagn. Lab. Immunol. — 1999. — Vol. 6. — Р. 127–129.
Malinger G., Lev G., Zahalka N. et al. Fetal cytomegalovirus infection of the brain: the spectrum of sonographic findings // AJNR Am. J. Neuroradiol. — 2003. — Vol. 24. — Р. 28.
Nigro G., Anceschi M.M., Cosmi E.V. et al. Clinical manifestation and abnormal laboratory findings in pregnant women with primary cytomegalovirus infection // Br. J. Obstet. Gynaecol. — 2003. — Vol. 110. — Р. 572.
Nigro G., Mazzocco M. et al. Prenatal diagnosis of fetal CMV infection after primary or recurrent maternal infection // Obstet. Gynaecol. — 1999. — Vol. 94. — Р. 909–914.
Peckham C., Tooky P., Logan S. et al. Screening options for prevention of congenital cytomegalovirus infection // J. Med. Screen. — 2001. — Vol. 8. — Р. 119.
Plotkin S. Vaccination against CMV, the changing demon // Pediatr. Infect. Dis. J. — 1999. — Vol. 18. — Р. 313–326. Revello M.G., Gerna G. Diagnosis and management of human cytomegalovirus infection in the mother, fetus and newborn infant // Clin. Microbiol. Rev. — 2002. — Vol. 15. — Р. 680.
Revello M.G., Gerna G. Pathogenesis and prenatal diagnosis of human cytomegalovirus infection // J. Clin. Virol. — 2004. — Vol. 29. — Р. 71.
Yow M.D., Demmler G.J. Congenital cytomegalovirus disease — 20 years is long enough // N. Engl. J. Med. — 1992. — Vol. 326. — Р. 703.
48.14. БЕРЕМЕННОСТЬ И ИНФЕКЦИЯ, ВЫЗВАННАЯ ПАРВОВИРУСОМ В 19 СИНОНИМЫ Парвовирусная инфекция.
КОД ПО МКБ-10 В97.6 Парвовирусы как причина болезней, классифицированных в других рубриках. ЭПИДЕМИОЛОГИЯ
Парвовирусные инфекции у животных были давно изучены, установлена их повсеместная распространённость среди скота (диарея у телят), собак (энтерит у щенков), кошек (панлейкемия), свиней (внутриутробное поражение плодов). Парвовирусы животных привязаны к определённым хозяевам и вызывают заболевания лишь в пределах данного вида. Сравнительная вирусология подчёркивает наличие аналогии среди семейств вирусов у животных и у человека, в особенности сходный патогенез репродуктивных потерь (мёртворождения, мумификация эмбрионов, неонатальная смерть, бесплодие).
Парвовирусная инфекция человека, в частности матери и плода, стала известна сравнительно недавно — в 1975 г. Но уже в последующие годы появилось огромное число сообщений о негативном влиянии материнской инфекции на плод. Впервые информация об антенатальной гибели плода, обусловленной парвовирусной В 19 инфекцией, была опубликована в 1984 г. В настоящее время появились данные о том, что парвовирусная В 19 инфекция встречается примерно у 8% погибших плодов с неиммунным отёком и у 27% плодов без пороков развития. Данную инфекцию относят к наиболее часто выявляемой вирусной инфекции при задержке развития плода.
Истинный риск гибели плода при этом заболевании выше, поскольку случаи бессимптомной инфекции у беременных до сих пор не учитывают. При инфицировании женщины в первом триместре беременности заболеваемость плода выявляется в 10–12%. Снижение в последние годы показателя фетальных потерь связывают с применением антенатальных трансфузий эритроцитов донора при анемии плода, обусловленной данным заболеванием. Ряд авторов высказали точку зрения, что возможен благоприятный исход беременности при выявлении инфекции у матери.
Частота трансплацентарного переноса инфекции от матери к плоду составляет от 25 до 50%. Способ родоразрешения не влияет на данный показатель.
ЭТИОЛОГИЯ Возбудитель этой инфекции — парвовирус В 19, известный ранее как вирус, который вызывает неиммунную водянку плода (hydros fetuses).
Парвовирусы (от лат. parvus — маленький) относятся к числу самых мелких и простых вирусов, содержащих ДНК. Свойства вируса ещё изучают. Известно, что это автономный вирус, так как не требует присутствия вирусов-помощников для своей репликации. Вирус способен к интеграции в геном клетки-хозяина. После перенесённой инфекции остаётся пожизненный иммунитет.
Парвовирус человека получил свое название «парвовирус В 19» по лабораторному коду. Ложноположительная реакция на австралийский Аг была получена с сывороткой донора в ряду В под номером 19. Полоску агарозного геля с преципитатом исследовали в электронном микроскопе и обнаружили частицы вируса, сходные по строению с парвовирусами животных. До недавнего времени парвовирус В 19 считали единственным патогенным для человека вирусом. Сейчас к этому роду отнесён RA-вирус, ассоциированный с ревматоидным артритом.
ПАТОГЕНЕЗ Основные звенья патогенеза были изучены при апластическом кризе, осложняющем течение хронической
гемолитической анемии. Криз проявляется быстрым снижением Hb, ретикулоцитов в крови и эритробластов (предшественников эритроцитов) в костном мозге. Снижение или прекращение эритропоэза длится 5–7 дней. Иногда для его купирования необходима гемотрансфузия.
Рецептор для парвовируса — эритроцитарный Аг Р, который представлен не только в клетках эритроцитарного ряда, но также в клетках печени, почек, плаценты. Лица, не имеющие этого Аг, толерантны к парвовирусной В 19 инфекции. В патогенезе парвовирусной инфекции отчётливо проявляется двухфазность заболевания. Первая фаза отражает литическую инфекцию, при которой вирус активно поражает быстро растущие клетки – эритробласты и разрушает их. Проявления второй фазы зависят от взаимодействия с иммунной системой хозяина. В первой фазе симптомы неспецифичны: лихорадка, плохое самочувствие, снижение числа ретикулоцитов, Hb в периферической крови, лейкопения, тромбоцитопения. Во второй фазе наблюдают нарастание АТ к вирусу, образование комплексов «Аг-АТ», появление высыпаний на 14–16 день заболевания, артралгию.
Патогенез осложнений гестации С парвовирусной инфекцией связывают так называемую неиммунную водянку плода, которая служит причиной его
гибели или смерти в неонатальном периоде. Более внимательное изучение роли данного вируса в репродуктивных потерях выявило случаи поражения плода без признаков отёчности.
Вирус проявляет тропность к эритроцитарным предшественникам крови, вызывая задержку созревания нормобластов путём прямого цитопатического действия. Это приводит к умеренной или выраженной анемии, отсутствию
ретикулоцитов, снижению кислородной ёмкости крови, гипоксемии и СН. Гипоксемия, в свою очередь, обусловливает прямое повреждение капилляров, повышение их проницаемости, что усугубляет отёк и накопление жидкости в серозных полостях плода. В результате снижения коллоидно-осмотического давления и проникновения жидкости в экстраваскулярные отделы отмечают развитие гипоальбуминемии. Существуют данные о выявлении у плода нейтропении и тромбоцитопении. Парвовирусная инфекция В 19 может повреждать миокард плода за счёт непосредственного действия вируса и опосредованного влияния гипоксии, которая возникает на фоне анемии. При этом описывают набухание ядер миоцитов, субэндокардиальный фиброэластоз, наличие парвовируса в клетках миокарда, что приводит к застойным нарушениям сердечной деятельности, повышению гидростатического давления в капиллярах.
При наличии инфекции у матери могут быть обнаружены воспалительные изменения плацентарных сосудов в виде периваскулярной инфильтрации, набухания эндотелиальных клеток и фрагментации их ядер. Кроме того, могут быть выявлены скопления вирусов с эндогенными АТ — иммунные комплексы.
КЛИНИЧЕСКАЯ КАРТИНА В спектр поражений, вызванных парвовирусом В 19, входит как бессимптомная инфекция, так и заболевания разной
степени тяжести, вплоть до летального исхода у лиц с предрасполагающими факторами.
Одна из форм парвовирусной инфекции — пятая инфекционная эритема у детей (заболевание, сходное с краснухой). Болеют дети 5–14 лет. Заражение происходит воздушно-капельным путём. Характерный симптом — появление пятнистой, интенсивно окрашенной сыпи на щеках и туловище, интенсивно окрашенной; держится 1–2 дня. На руках и ногах сыпь имеет вид кружева или сети. Высыпание сопровождается лимфаденопатией и болями в суставах. Поражения суставов чаще наблюдаются у взрослых, артропатии сходны с рубеолярными, поражаются симметрично мелкие суставы кистей и стоп. Реакция на ревматоидный фактор при этом отрицательна. Причастность парвовируса В 19 к суставным поражениям подтверждается образованием АТ к этому вирусу (сероконверсия, нарастание титра реакции). Кроме того, вирус может распространяться при гемотрансфузии и введении пулированных коагуляционных факторов.
ОСЛОЖНЕНИЯ ГЕСТАЦИИ Наиболее частое проявление заболевания у плода — водянка. Она характеризуется генерализованным отёком кожи,
выпотом в перикардиальное и плевральное пространства, асцитом. Другим клиническим проявлением парвовирусной В 19 инфекции у плода считают анемию.
На любой стадии заболевания может произойти гибель плода. Интервал между инфицированием матери и смертью плода обычно составляет от 3 до 5 недель, однако может достигать и 11 нед. Известны случаи спонтанного разрешения отёчного синдрома у плода, вызванного парвовирусом В 19.
Самопроизвольное прерывание беременности, обусловленное парвовирусной В 19 инфекцией, в I триместре наблюдается редко. Наиболее высок риск гибели плода во II триместре беременности, поскольку именно в это время происходит интенсивное развитие эритроидного ростка крови. Однако фетальные потери наблюдают и в III триместре. Не существует прямых доказательств тератогенного влияния парвовируса В 19 на плод.
ДИАГНОСТИКА Заподозрить наличие парвовирусной В 19 инфекции у новорождённого (в том случае, когда он не установлен
антенатально), инфицированного в результате трансплацентарного переноса вируса, можно на основании одного из следующих признаков:
·неблагоприятный исход беременности;
·наличие специфических IgM в пуповинной крови после рождения или в крови новорождённого;
·стойкое содержание специфических IgG в сыворотке крови ребёнка старше одного года жизни. АНАМНЕЗ
Указание на неиммунный отёк плода при предыдущей беременности, симптомы заболевания у матери (лихорадка, анемия, боли в суставах) до беременности или на ранних её сроках. Наличие в анамнезе контакта с больными,
имеющими сыпь на коже и слизистых, а также с другими экзантемными заболеваниями, с детьми из детских учреждений с карантином по краснухе, кори.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ Осмотр кожных покровов и слизистых на предмет наличия сыпи. ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При беременности используют серологическую диагностику, основанную на определении специфических IgM, которые свидетельствуют о свежей инфекции, либо на определении нарастания специфических IgG. Необходимость применения серологических методов диагностики возникает при контакте беременной женщины с ребенком, клинические проявления болезни у которого дают основание думать о парвовирусной В 19 инфекции или о краснухе. Определение АТ к парвовирусу В 19 проводят методом ИФА. Следует отметить, что вируснейтрализующие IgM определяют при ИФА только через 2 мес после заражения.
Внедрение в практику молекулярного метода определения ДНК вирусов, такого, как ПЦР, стали успешно использовать при врождённой инфекции для исследования клинических материалов, например образцов костного мозга. Кроме того, возможно исследование в ПЦР образцов ОВ, отёчной жидкости из брюшной и плевральной полостей, которые получают при проведении пренатальной диагностики.
Постмортальная гипоплазия костного мозга с экстрамедуллярным эритропоэзом в печени и селезёнке, отёчная плацента с избытком эритробластов служат веским основанием для проведения ДНК–диагностики парвовирусной В 19 инфекции.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ Применяют ультразвуковую и пренатальную диагностику плода. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Любые заболевания, дающие сходную клиническую картину: заболевания суставов, заболевания с повышением температуры тела, появление кожной сыпи. Наиболее часто дифференциальную диагностику проводят с краснухой, корью, аллергическими заболеваниями, дерматозами, ревматоидным артритом, ОРЗ и др.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Возможна консультация инфекциониста, дерматолога, ревматолога, терапевта и др. в зависимости от превалирования той или иной симптоматики.
ЛЕЧЕНИЕ Медикаментозное лечение не разработано.
Тактика ведения беременных при подозрении или выявлении парвовирусной В 19 инфекции
·женщина, имеющая симптомы парвовирусной В 19 инфекции, должна быть направлена на лабораторное обследование с целью определения в сыворотке крови специфических IgG и IgM;
·если у беременной обнаружены IgG и отсутствуют IgM, то это свидетельствует о состоянии иммунитета; вероятность развития заболевания мала, вирус не оказывает неблагоприятного влияния на беременность;
·если оба иммуноглобулина (IgG и IgM) отсутствуют, при этом инкубационный период прошёл, то женщина не иммунизирована и инфекции нет;
·если у женщины была диагностирована инфекция (обнаружены IgM), то об этом должен быть информирован ее акушер или перинатолог. При этом беременная должна быть консультирована относительно возможного риска
инфицирования плода, развития водянки или его гибели. В течение ближайших 8–12 нед после начала заболевания следует выполнять неоднократные УЗИ, чтобы своевременно диагностировать водянку плода.
При обнаружении водянки у плода специалист-перинатолог должен решить вопрос о проведении диагностического кордоцентеза с последующей возможностью внутриутробной трансфузии эритроцитов и, при необходимости, тромбоцитов донора.
Профилактика и прогнозирование осложнений гестации Парвовирусная инфекция, возникшая при беременности, не является показанием для её прерывания. Рекомендуют
проводить мониторинг инфицированных женщин с частыми определениями у них уровня АФП в сыворотке крови, значение которого увеличивается при данном заболевании, УЗИ (каждые 1–2 недели) для своевременной диагностики отёка у плода и коррекции его с помощью внутриутробных переливаний крови.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ При обнаружении парвовирусной инфекции В 19 у беременной необходима её консультация у перинатолога.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Башмакова М.А., Савичева А.М. Парвовирусная инфекция В 19 при беременности. I Свойства вируса, клиническая картина заболевания, патогенез, диагностика / Пренатальная диагностика — 2005. — 4 т. — № 2. — C. 94–96. Павлова Н.Г., Константинова Н.Н. Парвовирусная инфекция В 19 при беременности. II Влияние парвовируса В19 на плаценту и риск для плода / Пренатальная диагностика. — 2005. — 4 т. — № 2. — C. 97–99.
Медицинская микробиология / Под общ. ред. В.И. Покровского, О.К. Поздеева — М.: Медицина, 1999. — С. 768–769. Anand A., Grug E.S., Brown T. et al. Human parvovirus infection in pregnancy and hydrops fetalis // N. Engl. J. Med. — 1987. —Vol. 316(4). — P. 183–186.
Anderson M.J., Hurwitz E.S. Human parvovirus B19 and pregnancy // Clin. Perinatol. — 1988. — Vol. 15. — P. 273–286. Brown K.E., Green S.W., Mayolo J.A. et al. Congenital anaemia after transplacental B19 parvovirus infection // Lancet. — 1994. — Vol. 343. — P. 895–896.
Brown K.E., Anand A., Ritchie L.D., Clewley J.P. Intrauterine infection with human parvovirus // Lancet. — 1986. — Vol. 1. P. 48.
Crane J. Society of Obstetricians and Gyneacologists of Canada. Parvovirus B19 infection in pregnancy // J. Obstet. Gyneacol. Can. — 2002. — Vol. 24. — № 9. — P. 727–743.
de Krijger R.R., van Elsacker-Neile A.M., Mulder-Stapel A. et al. Detection of parvovirus B19 infection in first and second trimester fetal loss // Pediatr. Pathol. Lab. Med. — 1998. — Vol. 18. — P. 23.
Enders M., Weidner A., Zoellner I. et al. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases // Obstet. Gynecol. Surv. — 2005. — Vol. 60. — № 2. — P. 83–84.
Isaacs D., Moxon E.R. Handbook of Neonatal Infections – a practical guide // WBS. — London, 1999. — P. 509.
Monif G.R.G, Baker D.A. Infectious Diseases in Obstetrics and Gynecology/ 5th Edition // The Parthenon Publishing Group, London, 2004. — P. 723
Naides S.J., Weiner C.P. Antenatal diagnosis and palliative treatment of non-immune hydrops fetalis secondary to parvovirus B19 infection // Prenat. Diagn. — 1989. — Vol. 89. — P. 105–114.
Peters M.T., Nicolaides K.H. Cordocentesis for the diagnosis and treatment of human fetal parvovirus infection // Obstet.Gynecol. — 1990. — Vol. 75. — № 3 (part2). — P. 501–514.
Tofvenstam T.N., Papadogiannakis N., Norbeck O. et al. Frequency of human parvovirus B19 infection in intrauterine fetal death // Lancet. — 2001. — Vol. 357. — P. 1494.
48.15. БЕРЕМЕННОСТЬ И ИНФЕКЦИЯ, ВЫЗВАННАЯ СТРЕПТОКОККОМ ГРУППЫ В СИНОНИМЫ Стрептококковая В инфекция.
КОД ПО МКБ-10 А40 Стрептококковая септицемия.
А40.1 Септицемия, вызванная СГВ.
В95.1 СГВ как возбудители болезней, классифицированных в других рубриках. ЭПИДЕМИОЛОГИЯ
Первое описание стрептококковой инфекции с ранним началом заболевания появилось в 1939 г. К этому времени уже была разработана классификация стрептококков по строению их полисахаридных Аг (Lancefield R., 1935), и
Streptococcus agalactiae был отнесён в группу В.
В 60-e годы прошлого столетия появились первые сообщения о том, что эти микроорганизмы могут вызывать тяжелейшие заболевания у новорождённых. Инфекция, обусловленная СГВ, у новорождённых протекает остро, иногда молниеносно, летальность достигает 60%. До 50% выживших детей страдают заболеваниями ЦНС. Заражение происходит в родах от матери, родовые пути которой колонизированы СГВ.
Для СГВ характерно бессимптомное пребывание на слизистых оболочках (колонизация). Предполагают, что у взрослых людей основной путь распространения СГВ — половой контакт, хотя это признают не все исследователи. В
связи с ростом распространённости ИППП и с широким использованием оральных контрацептивов, нарушающих естественный баланс половых гормонов и поддерживающих повышенную чувствительность влагалищного эпителия к адгезии СГВ, происходит значительное увеличение колонизации влагалища этими микроорганизмами.
Основным резервуаром стрептококковой инфекции у человека является ЖКТ, а у женщин ещё влагалище и уретра. В США процент колонизации СГВ влагалища и прямой кишки у женщин равен 20–40%, в Бразилии — 26%, в Индии — 6%, в Италии — 7%, в Австрии — 12%, в Израиле — 2–3%.
Максимальную обсеменённость влагалища СГВ у беременных наблюдают в сроке 35–37 нед. Факторами риска передачи микроорганизма плоду и ребёнку являются: присутствие СГВ в моче, роды до 37-й недели беременности, безводный промежуток более 18 ч, лихорадка у матери выше 38 °С. Поэтому CDC (Center for Diseases Control) рекомендует обследовать беременных для выявления колонизации СГВ в сроки 35–37 нед беременности, а также при наличии перечисленных выше факторов риска в любые другие сроки беременности.
Главным источником заражения новорождённого являются половые пути матери. При прохождении через родовые пути, а также при восходящем инфицировании ОВ СГВ обсеменяют кожные покровы плода. При аспирации ОВ микроорганизмы попадают в дыхательные пути, лёгкие. Отсутствие защитных механизмов против инфекции у плода может вызвать генерализованное заболевание и смерть новорождённого.
ЭТИОЛОГИЯ
Возбудителем инфекции, вызванной СГВ, является грамположительный диплококк Streptococcus agalactiae. Он является единственным видом в этой группе стрептококков и чаще образует цепочки, нежели остальные штаммы. Большинство штаммов этого вида являются b-гемолитическими. СГВ содержит два полисахаридных Аг: группоспецифичный С-Аг и типоспецифичный S-Аг, на базе последнего штаммы СГВ разделяются на типы 1a, 1b, 1с, 1a/c, 2, 3, 4, 5 и 6. Типоспецифические Аг содержатся в капсуле и являются важными факторами вирулентности. Серотип 1c содержит белковый Аг. Серотипы 3, 2 и 1c наиболее часто вызывают заболевание с ранним началом, в то же время серотип 3 доминирует и среди заболеваний с поздним началом.
ПАТОГЕНЕЗ СГВ — условно-патогенный микроорганизм. В настоящее время изучают возможность проявления патогенного
действия микроорганизма при определённых условиях. Доказано присутствие генов вирулентности у некоторых штаммов, чаще вызывающих развитие внутриутробной СГВ-инфекции.
Патогенез осложнений гестации Инфицирование плода происходит при прохождении его через родовые пути матери. СГВ могут проникать в полость
матки как при ПРПО, так и интраканаликулярно через интактные плодные оболочки и тем самым внутриутробно поражать плод. В таких случаях они могут быть причиной ранних и поздних выкидышей, преждевременных родов, мертворождений.
При поражении эндометрия нарушается процесс плацентации и развития последа, что способствует вторичной плацентарной недостаточности. СГВ могут поражать плаценту (плацентит) и плодные оболочки (хориоамнионит), что в свою очередь приводит к ЗРП, а также к преждевременному возбуждению родовой деятельности. Часто наблюдают несвоевременное отхождение ОВ, аномалии родовой деятельности (быстрые роды). В послеродовом периоде возможно развитие параметрита, вследствие распространения инфекции лимфогенным путём из послеродовой раны или инфицированной матки, а также при разрыве шейки матки и верхней трети влагалища.
В патогенезе развития СГВ-инфекции у плода и новорождённого имеет значение массивность колонизации Streptococcus agalactiae. При колонизации более чем пяти участков кожи и слизистых оболочек у новорождённого в первые дни жизни возможно развитие СГВ-сепсиса.
Причины, по которым в определённых случаях в организме новорождённых развивается специфический инфекционный процесс, до сих пор не известны. Возможно, возникновению заболевания способствуют микробные факторы, такие, как полисахаридная капсула СГВ. Доказана роль капсулы в обеспечении защиты микроба от фагоцитоза. Продемонстрирована также корреляция между принадлежностью СГВ к определённому серотипу по капсульному Аг (чаще всего III) и частотой возникновения инфекционных процессов у новорождённых. Однако наличие капсульного полисахарида определённого типа не может объяснить причин, по которым баланс взаимоотношений «паразит–хозяин» сдвигается в сторону тяжёлой патологии.
При изучении белковых факторов патогенности СГВ, таких, как b-, a-Аг и С5а пептидаза, установлено, что данные факторы при всей своей значимости в формировании вирулентного фенотипа микроба не являются определяющими. Они либо содержатся у всех представителей СГВ, либо с их наличием не коррелирует степень тяжести СГВ-патологии (как в случае c присутствием в геноме СГВ bС-белка). Однако исследованиями последних лет показано, что СГВ, имеющие гены потенциальных адгезинов (sspB1 и sspB2), способны активизировать своё патогенное действие и вызывать развитие внутриутробной инфекции.
КЛИНИЧЕСКАЯ КАРТИНА У взрослых СГВ наиболее часто вызывает воспалительные заболевания мочевыделительных органов, особенно при
аномалиях их развития и СД. В настоящее время СГВ рассматривается как один из основных возбудителей инфекции мочеполовой системы. Описаны также пневмония, эндокардит, остеомиелит у взрослых.
У беременной может возникнуть хориоамнионит, инфекция мочевыделительных органов, а после родов — эндометрит. Частота этих осложнений в США исчисляется для эндометрита 12 на 1000 родов, бактериурии — 8 на 1000 родов. Риск развития эндометрита и бактериемии выше при родоразрешении путём операции КС. Симптомы возникновения СГВ-инфекции неспецифичны: лихорадка, плохое самочувствие, озноб, боль внизу живота, болезненность матки при пальпации. При заражении плода возможно мертворождение. Симптомов, свидетельствующих о заболевании плода, немного, и они носят неспецифический характер (нарушение сердцебиения, метаболический ацидоз, низкий рН артериальной крови пуповины).
В неонатальный период может развиться одна из двух форм стрептококковой инфекции — сепсис с ранним началом заболевания в первые часы и сутки жизни ребёнка и вторая форма, для которой характерно позднее начало, наиболее часто после десятого дня жизни. Заболевание с поздним началом клинически наиболее часто протекает как менингит.
Неонатальное заболевание с ранним началом характеризуется возникновением признаков заболевания в течение первых 7 дней, при этом в 90% случаев признаки заболевания появляются в первые 24 часа жизни. Поражения органов дыхания выявляются у 54%, сепсис без определенного очага — у 27%, менингит —у 12%. ОСЛОЖНЕНИЯ ГЕСТАЦИИ Колонизация мочеполовых путей СГВ беременных существенным образом не влияет на течение беременности.
Исключение составляет бессимптомная бактериурия или пиелонефрит беременных, вызванные СГВ. У новорождённых возможно выявление внутриутробной инфекции, особенно при колонизации более чем 5 участков кожных покровов и слизистых.
ДИАГНОСТИКА Основана исключительно на результатах лабораторных исследований. АНАМНЕЗ
Важно наличие в анамнезе длительной колонизации мочеполовых путей СГВ, а также пиелонефрита или бактериурии. ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ Выявляют признаки воспалительных заболеваний мочеполовой системы.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ Для диагностики колонизации СГВ у женщин проводят посев материала, взятого из влагалища и из аноректальной
области, на жидкую или плотную питательную селективную среду.
Поскольку проникновение микроорганизма из нижних отделов пищеварительного тракта происходит периодически, взятие образцов для посева одновременно из аноректальной области и из влагалища обеспечивает рост СГВ на 5– 15% выше по сравнению с посевом образцов только из влагалища. Следует также заметить, что питательные селективные среды (например, с добавлением подавляющих рост сопутствующей микрофлоры антибиотиков) увеличивают выделение СГВ на 50%.
Для этиологической диагностики СГВ-инфекции у новорождённых используют стерильно взятую кровь, спинномозговую жидкость, мочу, эндобронхиальный аспират. Важно знать, что в большом проценте случаев СГВ у новорождённых выделяют из мочи. Необходимо помнить, что сепсис с ранним началом ассоциируется с относительно быстро нарастающей нейтропенией, определяемой при частом исследовании крови. Желательно проводить полный анализ крови, включая определение таких показателей, как С-реактивный белок, фибронектин, фракции комплемента
C3d.
СКРИНИНГ Поскольку колонизация мочеполовых путей беременных СГВ ассоциируется с высоким риском преждевременных
родов, преждевременного излития ОВ, колонизацией СГВ плода и риском развития системной инфекции у новорождённого, встаёт вопрос выбора теста для скрининга СГВ-инфекции у беременных.
Стратегия химиопрофилактики требует установления колонизации СГВ у женщин с использованием тестов, обладающих высокой чувствительностью и специфичностью выделения и идентификации культуры стрептококка. Недостатком является получение результата не ранее 18–24 ч, что не всегда удобно. Однако до настоящего времени посев и выделение культуры СГВ с последующим проведением видовой и типовой идентификации микроорганизма остаётся золотым стандартом диагностики стрептококковой колонизации и инфекции.
Скрининг-тесты основаны на определении Аг СГВ с помощью латекс-агглютинации, коагглютинации, а также ИФА. Латекс-агглютинация основана на сорбции на мелких стандартизованных по размеру частицах латекса АТ к Аг СГВ. Реакцию ставят на стекле путём смешивания капли исследуемого образца и капли тест-системы. Положительный результат учитывается по образованию хлопьев.
В реакции коагглютинации АТ сорбированы на поверхности клеток стафилококка, обладающего протеином А. АТ к СГВ присоединяются к протеину А за счёт Fс-фрагмента, а Fab-фрагмент свободен для соединения с Аг СГВ, если Аг содержится в исследуемом материале. Здесь необходимо отметить, что в реакции участвует полисахаридный Аг, поэтому из исследуемого материала его извлекают кислотной экстракцией с кипячением.
Более специфична и чувствительна ИФА для определения антигена СГВ, однако реактивы для неё не всегда доступны. Быстрые тесты — коагглютинация и латекс-агглютинация мало чувствительны при преждевременном излитии ОВ и преждевременных родах из-за разведения материала водами и кровью. Поэтому культуральный метод выявления СГВ остаётся самым надёжным.
Молекулярно-биологические методы диагностики (ПЦР) также используют для выявления СГВ. При этом появилась возможность в изучении генов вирулентности у СГВ. Стрептококки с наличием генов вирулентности могут вызвать наиболее тяжёлые поражения у новорождённых.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА Проводят с аналогичными воспалительными заболеваниями другой этиологии (вульвовагинит, пиелонефрит, бактериурия).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ При наличии пиелонефрита — консультация нефролога. Возможна консультация других специалистов при развитии осложнений инфекции.
ЛЕЧЕНИЕ Для профилактики инфицирования плода медикаментозное лечение проводят, начиная с 35-й недели беременности,
и в родах. При необходимости (наличие угрозы невынашивания беременности, развития пиелонефрита беременных или бактериурии) возможно назначение терапии на более ранних сроках беременности (после 12 нед).
ЦЕЛИ ЛЕЧЕНИЯ Лечение должно быть направлено на элиминацию СГВ, на сохранение беременности и предупреждение передачи инфекции плоду.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ Проводят согласно чувствительности СГВ к антибактериальным препаратам. Наиболее часто назначают ампициллин,
бензилпенициллин, в ряде случаев — макролиды. ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценку эффективности лечения проводят по отсутствию колонизации СГВ новорождённого.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ Самостоятельное заболевание госпитализации не требует. ПРОФИЛАКТИКА
Проводят антибиотикопрофилактику передачи СГВ новорождённым. Для этого беременным, колонизированным СГВ, в сроки 35–37 нед беременности назначают бензилпенициллин в дозе 5 млн ЕД внутривенно, затем 2,5 млн ЕД каждые 4 ч также внутривенно или ампициллин в дозе 2 г внутривенно, затем 1 г каждые 4 ч в течение 5 дней. При этом происходит временное подавление размножения СГВ, после отмены антибиотиков колонизация может восстанавливаться.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
·СГВ могут присутствовать во влагалище в составе нормального микробиоценоза.
·Передача плоду происходит лишь в 37% при колонизации СГВ половых путей матери.
·Лечение проводят, начиная с 35-37 недели беременности. При необходимости лечащий врач может назначить лечение в более ранние сроки, но не ранее чем в 12 нед.
·Новорождённые не всегда рождаются инфицированными.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Оганян К.А. и др. Колонизация мочевых путей беременных стрептококком группы В и перинатальные исходы. //
Журнал акушерства и женских болезней. — 2006. — Том LV. — вып. 1. — С. 26–31.
Оганян К.А. и др. Течение и исход беременности при колонизации урогенитального тракта женщин стрептококком группы В, содержащим гены sspB семейства // Журнал акушерства и женских болезней. — 2006. — Том LV. — вып. 2.
— С. 47–52.
А.Н. Суворов и др. Анализ клинических штаммов стрептококка группы В на наличие генов потенциальных адгезинов, локализованных на «островах патогенности» // Журнал акушерства и женских болезней. — 2005. — Том LIV. — вып. 2.
— С. 50–55.
Berner R. Infektionen durch Gruppe-B-Streptokokken In der Neonatalperiode // Monatsschr. Kinderheild. — 2003. — Vol. 151.
— S. 373–383.
Genome sequence of Streptococcus agalactiae, a pathogen causing invasive neonatal disease. C. Glaser et al. // Molecular Microbiology. — 2002. — Vol. 45. — P. 1499–1514.
Lukacs S.L., Schoendorf K.C., Schuchat A. Trends in sepsis-related neonatal mortality in the United States, 1985–1998 // Pediatr. Infect. Dis. J. — 2004. — Vol. 23. — P. 599–603.
Monif G.R.G., Baker D.A. Infectious Diseases in Obstetrics and Gynecology. — 5th edition. — London: The Parthenon Publishing Group, 2004. — 723 p.
Sexually transmitted and other reproductive tract infections / A guide to essential practice. — Geneva: World Health Organization, 2005. — 186 р.
