
- •Оглавление
- •СПИСОК СОКРАЩЕНИЙ
- •ПОДРОБНОЕ СОДЕРЖАНИЕ
- •ГЛАВА 02. ДЕМОГРАФИЧЕСКАЯ СИТУАЦИЯ В РОССИЙСКОЙ ФЕДЕРАЦИИ. ОБЩИЕ И ЧАСТНЫЕ АСПЕКТЫ
- •ГЛАВА 03.МАТЕРИНСКАЯ И ПЕРИНАТАЛЬНАЯ ЗАБОЛЕВАЕМОСТЬ И СМЕРТНОСТЬ. СТРАТЕГИЯ РИСКА В АКУШЕРСТВЕ И ПЕРИНАТОЛОГИИ
- •ГЛАВА 04.ПОСЛЕДИПЛОМНАЯ ПОДГОТОВКА ВРАЧЕЙ АКУШЕРОВГИНЕКОЛОГОВ В КОНТЕКСТЕ БОЛОНСКОЙ ДЕКЛАРАЦИИ
- •ГЛАВА 05.ДЕОНТОЛОГИЯ В АКУШЕРСТВЕ
- •ГЛАВА 07. ИЗМЕНЕНИЯ В ОРГАНИЗМЕ ЖЕНЩИНЫ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ГЛАВА 08. РАЦИОНАЛЬНОЕ ПОВЕДЕНИЕ ЗДОРОВОЙ ЖЕНЩИНЫ В ПЕРИОД БЕРЕМЕННОСТИ
- •ГЛАВА 09. КЛИНИЧЕСКИЕ МЕТОДЫ ОБСЛЕДОВАНИЯ БЕРЕМЕННЫХ
- •ГЛАВА 10. ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ.
- •ГЛАВА 11. ИНСТРУМЕНТАЛЬНЫЕ НЕИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ.
- •ГЛАВА 12.ИНСТРУМЕНТАЛЬНЫЕ ИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ
- •ГЛАВА 13. ПРИНЦИПЫ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ В АКУШЕРСТВЕ
- •ГЛАВА 14. ХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
- •ГЛАВА 15. ФАРМАКОТЕРАПИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
- •ГЛАВА 16.ВЕДЕНИЕ ФИЗИОЛОГИЧЕСКОЙ БЕРЕМЕННОСТИ
- •ГЛАВА 17. ФИЗИОЛОГИЧЕСКИЕ РОДЫ
- •ГЛАВА 18.ФИЗИОЛОГИЧЕСКОЕ ТЕЧЕНИЕ ПОСЛЕРОДОВОГО ПЕРИОДА И ПЕРИОДА НОВОРОЖДЁННОСТИ
- •ГЛАВА 19.БЕРЕМЕННОСТЬ У НЕСОВЕРШЕННОЛЕТНИХ
- •ГЛАВА 20.ТАКТИКА ВЕДЕНИЯ БЕРЕМЕННОСТИ ПОСЛЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ
- •ГЛАВА 21. МНОГОПЛОДНАЯ БЕРЕМЕННОСТЬ
- •ГЛАВА 22. САМОПРОИЗВОЛЬНЫЙ АБОРТ (ВЫКИДЫШ)
- •ГЛАВА 23. ПРИВЫЧНОЕ НЕВЫНАШИВАНИЕ БЕРЕМЕННОСТИ
- •ГЛАВА 24. НЕРАЗВИВАЮЩАЯСЯ БЕРЕМЕННОСТЬ
- •ГЛАВА 25. ПРЕЖДЕВРЕМЕННЫЕ РОДЫ
- •ГЛАВА 26. ПЕРЕНАШИВАНИЕ БЕРЕМЕННОСТИ
- •ГЛАВА 27. ПЛАЦЕНТАРНАЯ НЕДОСТАТОЧНОСТЬ
- •ГЛАВА 28. ЗАДЕРЖКА РОСТА ПЛОДА
- •ГЛАВА 29. ПАТОЛОГИЯ ОКОЛОПЛОДНЫХ ВОД
- •ГЛАВА 30. АНОМАЛИИ ПУПОВИНЫ, ОСЛОЖНЯЮЩИЕ ТЕЧЕНИЕ РОДОВ И УХУДШАЮЩИЕ ПЕРИНАТАЛЬНЫЙ ИСХОД
- •ГЛАВА 31. ТОКСИКОЗЫ БЕРЕМЕННЫХ И ГЕСТОЗ
- •ГЛАВА 32. НАСЛЕДСТВЕННЫЕ ДЕФЕКТЫ СИСТЕМЫ ГЕМОСТАЗА
- •ГЛАВА 33. АНТИФОСФОЛИПИДНЫЙ СИНДРОМ
- •ГЛАВА 34. HELLP-СИНДРОМ
- •ГЛАВА 35. СИНДРОМ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЁРТЫВАНИЯ КРОВИ
- •ГЛАВА 36. ЭМБОЛИЯ ОКОЛОПЛОДНЫМИ ВОДАМИ
- •ГЛАВА 37. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ВЕН
- •ГЛАВА 38. ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЁННОГО
- •ГЛАВА 40. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ КРОВИ
- •ГЛАВА 41. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ОРГАНОВ ДЫХАНИЯ
- •ГЛАВА 42. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ОРГАНОВ ПИЩЕВАРЕНИЯ
- •ГЛАВА 43. БЕРЕМЕННОСТЬ И ЗАБОЛЕВАНИЯ ПОЧЕК И МОЧЕВЫВОДЯЩИХ ПУТЕЙ
- •ГЛАВА 44. БЕРЕМЕННОСТЬ И ОФТАЛЬМОЛОГИЧЕСКИЕ ОСЛОЖНЕНИЯ
- •ГЛАВА 45. БЕРЕМЕННОСТЬ И ЭНДОКРИННАЯ ПАТОЛОГИЯ. БЕРЕМЕННОСТЬ И БОЛЕЗНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- •ГЛАВА 46. БЕРЕМЕННОСТЬ И ДЕПРЕССИВНЫЕ СОСТОЯНИЯ
- •ГЛАВА 47. БЕРЕМЕННОСТЬ И ПСИХОАКТИВНЫЕ ВЕЩЕСТВА
- •ГЛАВА 48. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ГЛАВА 49 БЕРЕМЕННОСТЬ И ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ МАЛОГО ТАЗА
- •ГЛАВА 50. БЕРЕМЕННОСТЬ И ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
- •ГЛАВА 51. БЕРЕМЕННОСТЬ И ХИРУРГИЧЕСКАЯ ПАТОЛОГИЯ
- •ГЛАВА 52. ПАТОЛОГИЧЕСКИЕ РОДЫ
- •ГЛАВА 53. КРОВОТЕЧЕНИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
- •ГЛАВА 54 .ПАТОЛОГИЯ ПОСЛЕРОДОВОГО ПЕРИОДА
- •ГЛАВА 55. РОДОВОЙ ТРАВМАТИЗМ
- •ГЛАВА 56. ВНУТРИУТРОБНАЯ ИНФЕКЦИЯ
- •ГЛАВА 57. ВРОЖДЁННЫЕ ПОРОКИ РАЗВИТИЯ
- •ГЛАВА 58 .АСФИКСИЯ НОВОРОЖДЁННОГО
- •ГЛАВА 59. РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ НОВОРОЖДЁННЫХ
- •ГЛАВА 60. ИНФЕКЦИИ НОВОРОЖДЁННЫХ
- •ГЛАВА 61. РОДОВЫЕ ТРАВМЫ ПЛОДА И НОВОРОЖДЁННОГО
- •ПРИЛОЖЕНИЕ. БЕЗОПАСНОСТЬ ИСПОЛЬЗОВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ВО ВРЕМЯ БЕРЕМЕННОСТИ
- •ПРАВА БЕРЕМЕННЫХ ЖЕНЩИН И КОРМЯЩИХ МАТЕРЕЙ
ГЛАВА 49 БЕРЕМЕННОСТЬ И ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ МАЛОГО ТАЗА
49.1. БЕРЕМЕННОСТЬ И ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ ШЕЙКИ МАТКИ
Согласно рекомендациям ВОЗ, используют два основные термина: дисплазия шейки матки и цервикальная интраэпителиальная неоплазия (ЦИН).
Дисплазия — нарушение роста и дифференцировки клеток многослойного плоского эпителия, нередко связанное с присутствием ВПЧ. Базальная мембрана при этом остаётся интактной. Степень тяжести дисплазии определяется количеством клеток с признаками атипии в эпителиальном пласте многослойного плоского эпителия. Это преобразование обычно начинается в базальных и парабазальных клетках. При лёгкой дисплазии вовлекается нижняя треть эпителиального пласта, при умеренной — от одной до двух третей, при тяжёлой — признаки атипии приобретает более двух третей клеток эпителиального пласта.
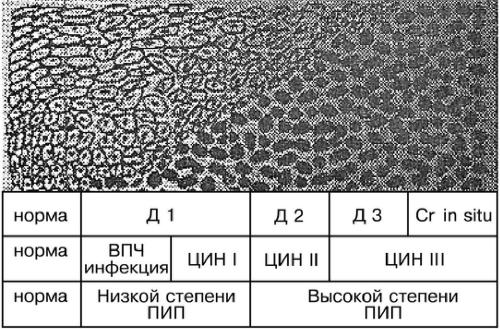
В 1975 г. был принят термин ЦИН. Выделяют 3 степени выраженности: I и II степени соответствуют лёгкой и умеренной дисплазии, III включает наличие одновременно тяжёлой дисплазии и карциномы in situ (рис. 49-1).
Рис. 49-1. Классификация ЦИН.
Плоскоклеточное интраэпителиальное поражение шейки матки (ПИП) — цитопатологический термин,
применяемый для описания дисплазии (терминология цервиковагинальных цитологических аномалий системы Бетесда). ПИП низкой степени соответствует лёгкой дисплазии или ЦИН I. Как правило, ПИП низкой степени — клиническое свидетельство инфицирования ВПЧ. ПИП высокой степени соответствует умеренной и тяжёлой дисплазии, (ЦИН II или ЦИН III) и карциноме in situ. ПИП высокой степени, как правило, сочетается с инфицированием штаммами ВПЧ высокого онкогенного риска.
СИНОНИМЫ
Предраковое состояние шейки матки.
КОД ПО МКБ-10
N87 Дисплазия шейки матки.
ЭПИДЕМИОЛОГИЯ
Инфицирование ВПЧ может произойти как до беременности, так и после её наступления. Распространённость инфицирования ВПЧ среди беременных варьирует, по разным данным, от 10 до 42%. Нет данных о том, что беременные более восприимчивы к инфицированию или активации ВПЧ. Беременность вызывает временное снижение клеточного иммунитета, уменьшение содержания CD4-лимфоцитов, что способствует клиническому проявлению вирусной инфекции. Как и в общей популяции, во время беременности субклиническую форму инфекции ВПЧ выявляют чаще, чем клинически выраженную в виде кондилом. Временная иммуносупрессия может вызывать быстрый рост кондилом.
Дисплазия шейки матки среди беременных женщин, встречается столь же часто, как и у небеременных того же возраста. Распространённость ЦИН у беременных варьирует среди различных социальных групп и составляет от 3,4 до 10%. У большинства беременных, имеющих дисплазию шейки матки, отмечают ЦИН I или другое свидетельство продуктивной инфекции ВПЧ. Тяжёлая дисплазия (ЦИН III) встречается намного реже. Её диагностируют у 0,1–1,8% беременных. ЦИН во время беременности чаще обнаруживают у молодых женщин. Средний возраст беременных с карциномой in situ — 29,9 лет со средним паритетом 4,0.
Осложнения при инфицировании ВПЧ и ЦИН во время беременности. Субклиническая форма инфекции ВПЧ, а
также небольшие кондиломы шейки матки, влагалища, вульвы и перианальной области не представляют серьёзной угрозы для беременности. Клинически выраженная инфекция ВПЧ может причинить вред в процессе родов или новорождённому. Может возникнуть ряд осложнений, если по ходу родового канала находятся большие кондиломы: их повреждение в ходе родов вызывает кровотечение. Кондиломы на промежности вызывают проблемы при
эпизиотомии или зашивании разрыва промежности. Большие кондиломы могут механически препятствовать родам, их целесообразно удалить заранее. Наличие кондилом, не препятствующих родам, — не показание к КС. При инфицировании ВПЧ новорождённого наиболее неблагоприятно развитие возвратного респираторного папилломатоза, вызывающего поражения гортани и голосовых связок. Однако заболеваемость этой инфекцией составляет менее 1 на 100 000 родов, поэтому КС как мера профилактики респираторного папилломатоза не показано.
В настоящее время развитие ЦИН во время беременности активно изучается. Исследования показали, что ЦИН не прогрессирует во время беременности. При II и III степени выраженности ЦИН, диагностируемой во время беременности, регрессия после родов происходит в 60 и 70% случаях соответственно. Данные другого исследования свидетельствуют о том, что во время беременности при ЦИН в 25% случаев происходит регрессия заболевания, в 47% случаев состояние сохраняется стабильным, и в 28% случаев заболевание прогрессирует. В случае прогрессирования заболевания возникновение микроинвазивного рака происходит реже, чем в 1% случаев. При обнаружении кондилом и ЦИН у беременной могут возникать и психологические проблемы, связанные с беспокойством за себя и состояние плода. Врач в беседе может подчеркнуть, что прогрессирование цервикальной интраэпителиальной неоплазии происходит достаточно редко.
ПАТОГЕНЕЗ
В настоящее время окончательно установлено, что этиология цервикальных эпителиальных поражений и цервикального рака неразрывно связана с определёнными типами инфекции ВПЧ. Выявлено более 100 типов ВПЧ, около 40 из них могут инфицировать половые пути. Приблизительно 15 типов часто обнаруживают при цервикальном раке (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 82), в связи с чем их называют типами высокого канцерогенного риска. К типам низкого канцерогенного риска относят следующие: 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81, 25, 53, 66 и СР 6108). Вирусы типов 6 и 11 в 90% случаев вызывают развитие экзофитных кондилом шейки матки, влагалища и вульвы. Смешанное инфицирование вирусами высокого и низкого канцерогенного риска отмечают у 2–25% женщин. При цервикальных поражениях II–III степени в 50% случаев обнаруживают 16-й тип ВПЧ, также обнаруживаемый приблизительно в трети случаев возникновения аденокарцином.
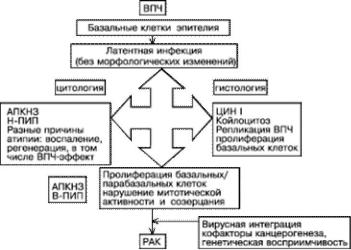
Участки незрелого метапластического эпителия в переходной зоне или зоне трансформации шейки матки наиболее подвержены инфицированию. Вирус способен проникать только в базальные клетки эпителия, легко доступные в зоне метаплазии или при микротравмах эпителия. Метаплазия может быть реакцией на хроническое раздражение во многих органах, но на шейке матки этот процесс всегда имеет место у сексуально активных женщин. Очень активно процесс метаплазии протекает во время беременности из-за выворота цилиндрического эпителия на влагалищную порцию шейки в результате сильного эстрогенного воздействия. Цервикальная неоплазия — сложное взаимодействие между ВПЧ и незрелым плоским эпителием. Однако в большинстве случаев инфекция протекает в латентной субклинической форме без морфологических изменений и элиминируется через 8–16 мес. При развитии морфологических изменений цитологический анализ указывает на проявления продуктивной инфекции ВПЧ (ПИП низкой степени, койлоцитоз) или на наличие атипических плоских клеток неопределённого значения. Гистологическое исследование позволяет обнаружить изменения, свойственные ЦИН I, или эффект ВПЧ. Большая часть этих изменений спонтанно регрессирует. Меньшая часть прогрессирует до поражений высокой степени (цервикальная интраэпителиальная неоплазия II–III степени). Исторически ЦИН рассматривали как прогрессирующий биологический континуум, приводящий к цервикальному раку. Была принята теория о том, что ЦИН I переходит в ЦИН II, а затем в ЦИН III. Полученные позднее данные показали, что одновременно могут присутствовать два различных по тяжести поражения с разным генезом и динамикой развития. Факторы, провоцирующие прогрессию ЦИН и инвазию до конца не изучены. К таким факторам относят: отдельные комбинации онкогенных штаммов ВПЧ, генетическую восприимчивость, пищевые факторы. Геномная нестабильность приводит к инактивации гена супрессора опухоли и интеграции генома ВПЧ в геном клетки хозяина. Риск прогрессии ЦИН напрямую зависит от типа вируса. Типы ВПЧ высокого канцерогенного риска чаще провоцируют прогрессию заболевания. Кроме того, существуют различные геномные варианты одного и того же типа вируса, например ВПЧ 16, также влияющие на вероятность прогресса или регресса заболевания (рис. 49-2).
Рис. 49-2. Развитие ВПЧ инфекции и цервикальной неоплазии. ДИАГНОСТИКА
При обследовании шейки матки следует помнить, что самые большие изменения происходят именно во время беременности. Данные изменения могут затруднять выполнение диагностических процедур и влиять на клиническую интерпретацию данных.
Физиологические изменения влагалища и шейки матки во время беременности. Степень изменений зависит от паритета. Во время беременности происходит увеличение маточного кровотока для того, чтобы поддержать рост плода. Маточный кровоток увеличивается, что приводит к полнокровию и появлению синеватого оттенка шейки матки. В течение беременности происходит прогрессивное размягчение шейки. Эндоцервикальный эпителий пролиферирует и продуцирует густую непрозрачную слизь, предотвращающую проникновение микрофлоры.
Цервикальный эпителий очень чувствителен к изменению уровня эстрогенов, высокий уровень которых увеличивает объём шейки матки за счёт гипертрофии мышечнофиброзной стромы. Вследствие увеличения диаметра шейки матки происходит выворачивание эндоцервикального эпителия наружу. Особенно выражено данное явление при первой беременности. Это состояние называют эктопия шейки матки (выворот), которую во время беременности считают вариантом нормы. Эктопия шейки матки облегчает проведение кольпоскопии из-за лучшей визуализации переходной зоны. В результате выворота и зияния наружного зева цилиндрический эпителий попадает в кислую среду влагалища и подвергается активной метаплазии в течение всей беременности. При обработке уксусной кислотой этот эпителий будет. Данный эпителий необходимо отличать от атипического эпителия. Физиологические изменения касаются не только шейки матки, но и влагалища. Влагалищный эпителий утолщается, приобретает синеватый оттенок. Увеличивается длина влагалища и влагалищные стенки несколько пролабируют, затрудняя в ряде случаев осмотр.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
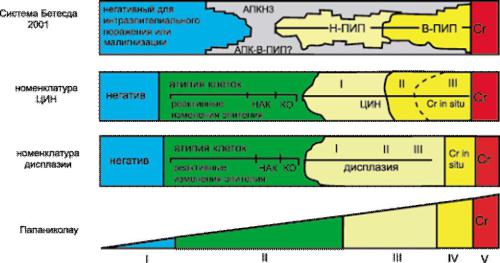
Цитологическое исследование. Физиологические изменения во время беременности практически не влияют на диагностическую точность цервикальной цитологии. Обязательный ПАП-мазок в I триместре беременности у многих женщин порой бывает первым и единственным за всю прожитую жизнь. Забор материала из цервикального канала следует проводить с использованием цервикальных щёточек с осторожностью. Используют традиционную (жидкостную) цитологию — клеточный материал помещают в ёмкость со специальным консервирующим раствором. Особенность цитологических мазков при беременности — частое наличие реактивных изменений в мазке. У незрелых метапластических клеток ядро обычно более крупное, чем у обычных метапластических клеток. В отличие от атипичных клеток незрелые метапластические клетки имеют чёткие ядерные границы и одинаковый размер ядер. У подобных клеток не происходит неправильных митозов. Иногда в мазке присутствуют децидуальные клетки. Цитологические аномалии плоских клеток, в зависимости от стандартов лаборатории, могут быть описаны по разным классификациям (рис. 49-3, см. цв. вклейку). Наиболее широко используют классификацию Бетесда.
Рис. 49-3. Сравнение цитологических классификаций плоскоклеточных аномалий шейки матки. АПКНЗ — атипичные плоские клетки неопределённого значения; АПК-В-ПИП — атипичные плоские клетки, подозрительные на атипию высокой степени; Н-ПИП — плоскоклеточное интраэпителиальное поражение низкой степени; В-ПИП — плоскоклеточное интраэпителиальное поражение высокой степени; Сr — карцинома; НАК — неклассифицируемые атипичные клетки; КО — койлоцитоз.
Гистологическое исследование. Биопсия выполняется при кольпоскопическом исследовании из наиболее выраженного участка атипии или любого подозрительного участка. Техника биопсии идентична у беременных и небеременных женщин. При беременности увеличивается риск кровотечения после биопсии.
Во время беременности могут происходить изменения плоского и цилиндрического эпителия. Возможна гиперплазия цилиндрического эпителия и базальных клеток. Отмечают незрелую метаплазию, отёк стромы, усиленную васкуляризацию. В биоптат часто попадают децидуальные клетки, в которых происходит цитоплазматическая вакуололизация и увеличение ядра, что может быть похоже на дис-плазию. Иногда децидуальная ткань напоминает полип (децидуальный полип), а он может быть похож на инвазивный рак. В связи с этим, достаточно взятия нормального цитологического мазка, чтобы не прибегать к излишней биопсии.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Кольпоскопическое исследование. Главная цель кольпоскопии у беременных — установить наличие, тяжесть и распространённость неоплазии. Эндоцервикальный кюретаж запрещён, так как эта процедура может повредить плодный пузырь. При необходимости биопсию выполняют из наиболее подозрительного участка с наименьшим числом образцов (только биопсийными щипцами, не ножом!). Конусовидную биопсию (конизация) выполняют только при подозрении на инвазивный рак.
Показания для кольпоскопии во время беременности:
·Аномальная цитология: ПИП высокой степени, ПИП низкой степени, атипичные железистые клетки, атипические плоские клетки неопределённого значения, аденокарцинома in situ, раковые клетки.
·Любое объёмное образование шейки матки, выявленное при осмотре в зеркалах или пальпации.
·Клинически очевидная инфекция ВПЧ половых путей или неоплазия.
·Необъяснимое кровотечение, в том числе посткоитальное, во время беременности (при отсутствии других осложнений беременности: предлежание плаценты, аборт, пузырный занос и др.).
Если в мазке обнаружены атипические плоские клетки неопределённого значения, кольпоскопию проводят только при выявлении с помощью теста ПЦР высококанцерогенных штаммов ВПЧ. При невозможности типирования ВПЧ следует повторить цитологическое исследование. При повторном обнаружении атипичных клеток выполняют кольпоскопию.
Женщинам с аномалиями в цитологическом мазке, обнаруженными до беременности, тоже проводят кольпоскопию. В I триместре беременности изменения незначительны и проведение кольпоскопии незатруднено. При осмотре и кольпоскопии можно обнаружить полип слизистой оболочки цервикального канала (железистый, железистофиброзный). Удаляют полип, как правило, после родов, если он не препятствует родоразрешению, а также при благоприятных результатах цитологического исследования.
В исследовании кольпоскопии подвергли более 1000 беременных. Точность оценки составила 99,5%, осложнения возникли в 0,6%, случаев, а конизация потребовалась 4% обследуемых. Ни один случай инвазивного рака не был пропущен.
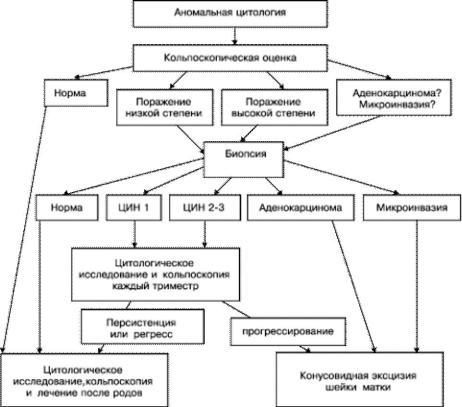
ЛЕЧЕНИЕ Тактика ведения беременных с аномальной цитологической картиной мазка (рис. 49-4). Беременных, с
обнаруженными атипическими плоскими клетками неопределённого значения, похожими на ПИП высокой степени, ПИП низкой степени (лёгкая дисплазия, ЦИН I, ЦИН II–III), необходимо направлять на кольпоскопию. Если результаты кольпоскопии подтвердят наличие атипических плоских клеток неопределённого значения, выполняют повторный цитологический мазок или тест на высококанцерогенные типы инфекции ВПЧ.
Рис. 49-4. Алгоритм ведения беременных с аномальной цитологической картиной содержимого цервикального канала.
Эпителиальные поражения низкой степени выраженности могут быть представлены экзофитными, микропапиллярными кондиломами, или участками нестойкого уксуснобелого эпителия с неправильными «географическими» очертаниями. Если результаты кольпоскопии удовлетворительны — переходная зона чётко визуализирована, кольпоскопическая оценка соответствует поражению низкой степени, проведение биопсии не требуется. Беременную необходимо подвергать цитологическому контролю каждый триместр. Если данные цитологического исследования отражают прогрессирование поражения (что случается редко), необходима повторная кольпоскопия. Если есть сомнения в результатах кольпоскопического исследования, то лучше выполнить биопсию. В случаях, когда кольпоскопия неудовлетворительна (переходная зона не визуализируется), исследование следует повторить после 20-й недели беременности, после того, как произойдёт физиологический выворот слизистой (эктопия) и можно будет увидеть переходную зону.
Высокоатипичный эпителий может захватывать несколько квадрантов шейки матки, края могут быть ровными или зазубренными. Могут быть внутренние границы между высокоатипичным эпителием, находящимся внутри зоны поражения низкой степени, что выражается в степени и продолжительности побеления после аппликации уксусной кислотой. Биопсию выполняют со всех подозрительных участков. При подтверждении высокой степени поражения данными гистологии наблюдение за беременными необходимо каждый триместр: выполняют цитологическое исследование мазка и кольпоскопию. Как правило, поражение не прогрессирует. Окончательное лечение поражения необходимо провести после родов.
Микроинвазивную карциному невозможно точно диагностировать цитологическим методом исследования. Определить инвазию можно только при гистологическом исследовании биоптата. Очаги микроинвазивного рака могут скрываться внутри больших очагов поражения. Обычной прицельной биопсии, как правило, недостаточно для уточнения микроинвазии. Только проведение расширенной биопсии в виде конусовидной эксцизии позволяет установить окончательный диагноз. Конизацию лучше выполнять во II триместре беременности. Если инвазия исключена, при конусовидной биопсии беременность можно пролонгировать. В случаях, когда диагноз микроинвазивного рака установлен до срока 23–24 нед беременности необходимо ведение пациентки вместе с онкологом.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Пациенткам, желающим сохранить репродуктивную функцию, выполняют конизацию шейки матки после родов. Если при исследовании образцаконуса поражение отсутствует в краях эксцизии, глубина инвазии меньше 3 мм и нет вовлечения лимфатических пространств, матку можно сохранить. Пациентка должна находиться на цитологическом, кольпоскопическом и, при необходимости, гистологическом контроле в течение по крайней мере 2 лет после лечения. Окончательное лечение проводят только после родоразрешения. Конизация во время беременности — диагностическая, а не лечебная процедура. Женщинам, не желающим больше рожать, может быть проведена гистерэктомия после КС.
СРОКИ И МЕТОДЫ РОДОРАЗРЕШЕНИЯ
Время и способ родоразрешения зависит от глубины инвазии и других особенностей рака, включая вовлечение в процесс лимфатических пространств, слияние очагов инвазии и площади поверхности опухоли. Нет убедительных данных о связи разрастания опухоли и способа родоразрешения. Обычно роды происходят в срок через естественные родовые пути.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Минкина Г.Н. и др. Предрак шейки матки / Минкина Г.Н., Манухин И.Б., Франк Г.А. — М.: Аэрограф-Медиа, 2001. — 112 с.
Bertini-Oliveira A.M, Keppler M.M., Luisi A. et al. Comparative evaluation of abnormal cytology, colposcopy and histopathology in preclinical cervical malignancy during pregnancy // Acta. Cytol. — 1982. — N 26. — P. 636–644.
Carter P.M., Coburn T.C., Luszczak M. Cost-effectiveness of cervical cytologic examination during pregnancy // J. Am. Bd. Fam. Pract. — 1993. — N 6. — P. 537–545.
Palle C., Bangsboll S., Andreasson B. Cervical intraepithelial neoplasia in pregnancy // Acta. Obstet. Gynecol. Scand. — 2000. — N 79. — P. 306–310.
Peng T.C., Searle C.P., Shah K.V. et al. Prevalence of human papillomavirus infection in term pregnancy // Am. J. Perinatol. — 1990. — N 7. — P. 189–192.
Siddiqui G., Kurzel R.B. et al. Cervical displasia in pregnancy: progression versus regression postpartum // Obstet. Gynecol. — 2001. — N 97. — P. 13.
Tenti P., Zappftore R., Migliora P. et al. Latent human papillomavirus infection in pregnant women at term: a case-control study // J. Inf. Dis. — 1997. — N 176. — P. 277–280.
49.2. БЕРЕМЕННОСТЬ И МИОМА МАТКИ
Миома матки — доброкачественная опухоль, характеризующаяся различными локализацией, размерами, клиническим проявлениям, патогенетическими особенностями развития. Как правило, миома матки множественная, растёт из незрелых миоцитов мышечной оболочки сосудов.
СИНОНИМЫ
Фибромиома, лейомиома.
КОД МКБ-10
D25.0 Подслизистая лейомиома.
D25.1 Интрамуральная лейомиома.
D25.2 Субсерозная лейомиома.
D25.9 Лейомиома неуточнённая (первичный гинекологический осмотр).
ЭПИДЕМИОЛОГИЯ
Среди всех гинекологических заболеваний миома матки встречается в 30–35% случаев, а во время беременности — в 0,5–6,0% наблюдений.
КЛАССИФИКАЦИЯ
Классификация предложена ВОЗ в 1994 г. ·Обычная лейомиома.
·Клеточная лейомиома.
·Эпителиоидная лейомиома (лейомиобластома).
·Внутрисосудистый лейомиоматоз или «метастазирующая» лейомиома. ·Растущая (пролиферирующая) лейомиома.
·Малигнизирующаяся миома.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Лейомиома матки — гормонозависимая опухоль. Образование и рост лейомиомы связаны со сложным взаимодействием стероидных гормонов и их рецепторов в миометрии и опухоли посредством комплекса факторов, влияющих на процессы пролиферации, апоптоза и ангиогенеза.
С началом беременности меняется содержание половых стероидных гормонов в локальном кровотоке матки. Увеличение объёма узлов в первые 8 нед беременности может быть связано с клеточной гиперплазией и гипертрофией. С 8-й недели беременности и до её окончания полностью блокируется клеточная гиперплазия в миоматозных узлах, ускоряется гибель миоцитов в центральной зоне узлов. Изменение объёма узлов миомы в эти сроки связано с отёком ткани, нарушениями гемо- и лимфодинамики, деструктивными изменениями и некрозом.
КЛИНИЧЕСКАЯ КАРТИНА
Проявления миомы матки во время беременности зависят от локализации, размеров миоматозных узлов, а также сопутствующей патологии матки (гиперпластические процессы эндометрия, аденомиоз, опухоли яичников). Основные клинические симптомы:
·патологические маточные кровотечения — менометроррагии, межменструальные кровянистые выделения; ·болевой синдром — боли внизу живота и пояснице, различающиеся по характеру и интенсивности; ·нарушение функций соседних органов — учащённое мочеиспускание, запоры;
·симптомы «острого живота» при нарушении кровообращения в миоматозном узле — признаки раздражения брюшины, повышение температуры тела, диспепсические нарушения.
Возможно бессимптомное течение миомы матки, при котором нарушения менструальной функции отсутствуют.
ОСЛОЖНЕНИЯ ГЕСТАЦИИ
Выделяют две группы риска развития осложнений во время беременности. ·В группу низкого риска входят женщины:
--до 35 лет; --без экстрагенитальной патологии;
--с подбрюшинной локализацией узлов; --с небольшими размерами внутримышечно расположенных узлов (до 5 см в диаметре);
--с длительностью заболевания не более 5 лет. ·К группе высокого риска относят женщин: --первородящих в возрасте 35 лет и старше;
--с интрамуральным расположением узлов больших размеров (исходная величина матки 10–13 нед беременности); --с центрипетальным ростом узлов, деформациями полости матки; --при подслизистом и шеечном расположении узлов; --в случае выраженных миоматозных изменений матки;
--при вторичных изменениях в узле, признаками нарушения кровообращения; --с расположенной в проекции миоматозного узла плацентой («плацента на узле»); --с наследственной миомой матки; --с длительностью заболевания более 5 лет;
--страдающих бесплодием — в случае индуцированной беременности; --с соматическими заболеваниями.
Наиболее частые осложнения во время беременности при наличии миомы матки: ·угроза прерывания в различные сроки гестации; ·ИЦН при шеечно-перешеечной локализации миоматозных узлов;
·ПН при расположении плаценты в проекции межмышечного миоматозного узла, при центрипетальном росте миомы или при наличии конгломерата миом; ·гестоз; ·ЗРП;
·быстрый рост опухоли; ·нарушение питания и некроз миоматозного узла;
·ПОНРП, особенно если она частично расположена в проекции миоматозного узла; ·плотное прикрепление плаценты; ·тромбоз вен таза из-за их сдавления миоматозными узлами больших размеров;
·неправильное положение и предлежание плода.
При любом сроке беременности у больных миомой матки высокий риск преждевременного прерывания, обусловленный ПН, нарушением питания миоматозного узла, периодическим повышением тонуса матки, в результате которого усиливается венозный отток крови и возникает ишемия миометрия.
Сохранять беременность рекомендуют только при низкой степени риска. При высокой степени риска вопрос о продлении беременности решают индивидуально, принимая во внимание следующие факторы:
·настойчивое желание женщины иметь ребёнка; ·позднее поступление под врачебное наблюдение — в сроки более 22–24 нед беременности (при жизнеспособном плоде); ·длительное бесплодие;
·невозможность прервать беременность через естественные родовые пути (шеечно-перешеечное расположение миоматозного узла, полное предлежание плаценты, центрипетальный рост низко расположенной миомы).
ДИАГНОСТИКА
Сроки обследования беременных с миомой матки: I триместр — 6–10-я неделя беременности;
II триместр — 14–16-я и 22–24-я недели беременности;
III триместр — 32–34-я и 38–39-я недели беременности.
АНАМНЕЗ
При расспросе необходимо обратить внимание на: ·наличие факторов риска; ·миому матки у матери и близких родственниц;
·длительность и особенности течения заболевания; ·детородную функцию;
·характерные жалобы (меноррагии и/или метроррагии, боли внизу живота и пояснице); ·анемию; ·нарушение функций соседних органов.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При бимануальном исследовании пальпируют плотную, бугристую, увеличенную в размерах (за счёт миоматозных узлов) матку.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
·Клинический анализ крови. ·Биохимический анализ крови.
·Общий анализ мочи. ·Гемостазиограмма.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
УЗИ помогает оценить количество, локализацию, структуру миоматозных узлов, отношение их к плаценте, наличие деформации полости матки, характер кровотока в миоматозном узле, а также позволяет провести фетометрию, оценить дыхательные движения и двигательную активность плода, зрелость плаценты.
Допплерографию проводят для оценки кровотока в сосудах миоматозных узлов, а также плодовоматочного кровотока в различные сроки беременности.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Миому матки следует дифференцировать с опухолями яичников, трофобластической болезнью.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Сопутствующая экстрагенитальная патология.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 16 нед. Миома матки с субсерозной локализацией узла.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
·Снижение тонуса матки. ·Продление беременности. ·Рождение здорового ребёнка.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
·Спазмолитики: дротаверин [по 40 мг (2 мл) 2–3 раза в сутки] внутримышечно с последующим переходом на приём внутрь (от 120 мг до 240 мг/сут).
·Антиагреганты: дипиридамол (по 75–150 мг/сут за час до еды), пентоксифиллин (по 10–20 мг/сут во время еды), малые дозы ацетилсалициловой кислоты (по 80–100 мг/сут) до 34-й недели.
·Токолитики: гексопреналин (5 мл в 400 мл 0,9% раствора натрия хлорида) вводят в/в со скоростью 8 капель в минуту, увеличивая дозу до снижения сократительной активности; средняя скорость введения — 15–20 капель в минуту, продолжительность введения 6–12 ч. За 15 мин до окончания в/в введения начинают прием препарата внутрь по 0,5 мг 4–6 раза в сутки.
·Антибиотики широкого спектра действия назначают при появлении признаков нарушения питания ткани узла.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Показания к миомэктомии во время беременности:
·угрожающий аборт и невозможность выскабливания стенок полости матки из-за шеечного или перешеечного расположения узлов; ·сдавление тазовых органов, болевой синдром;
·гигантские размеры опухоли, отсутствие перспективы для развития беременности; ·нарушение питания в узле (боли, повышение температуры тела, мягковатая консистенция опухоли, признаки деструкции и отёка узла при проведении УЗИ).
Оптимальные сроки для проведения консервативной миомэктомии — 16–19 нед беременности. После операции в течение 2–3 дней необходима инфузионная терапия, включающая кристаллоидные растворы и средства, улучшающие микроциркуляцию и регенерацию тканей. Для профилактики инфекционных осложнений назначают антибактериальные препараты. Применяют средства, направленные на продление беременности, — спазмолитики, токолитики, магния сульфат.
ПРОФИЛАКТИКА И ПРОГНОЗИРОВАНИЕ ОСЛОЖНЕНИЙ ГЕСТАЦИИ
·Проводят раннюю профилактику плацентарной недостаточности с 16–18 нед, назначая антиагреганты и антиоксиданты.
·На протяжении всей беременности контролируют состояние фетоплацентарной системы, рост плода и его соответствие сроку гестации.
·Наблюдают за состоянием, размерами, локализацией миоматозных узлов.
·Своевременно устраняют выявленные осложнений беременности, применяя, в том числе, спазмолитики и токолитики. В любом триместре беременности возможно развитие осложнений, для лечения которых назначают антиагреганты, спазмолитики, токолитики и антибактериальные препараты. При отсутствии эффекта от консервативного лечения показано оперативное вмешательство — консервативная миомэктомия, удаление матки.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
·Нарушение кровообращения в миоматозном узле. ·Осложнённое течение беременности:
--ПН; --гипоксия плода; --ЗРП и др.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Эффективность лечения оценивают по результатам общеклинического обследования, данных УЗИ и допплерографии.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
У беременных, отнесённых к группе низкого риска, возможно родоразрешение через естественные родовые пути.
В родах необходимо проводить адекватное обезболивание в сочетании с применением спазмолитиков для профилактики и лечения аномалий родовой деятельности, гипоксии плода и родового травматизма. Утеротонические средства могут быть опасными для матери и для плода из-за усугубления дегенеративных и некробиотических изменений в узлах, поэтому их можно применять только по строгим показаниям, одновременно со спазмолитиками или b-адреномиметиками.
Роды у беременных с миомой матки часто осложняются: ·несвоевременным излитием ОВ; ·аномалиями родовой деятельности;
·возникновением РДС плода; ·нарушениями из-за плотного прикрепления плаценты; ·ПОНРП; ·гипотоническим кровотечением;
·кровотечениями в последовом и раннем послеродовом периоде.
При осложнённом течении беременности родоразрешение, чаще всего, проводят путём КС с последующей миомэктомией (если это возможно) или с удалением матки без придатков.
Послеродовый период может осложниться субинволюцией матки. Показания к КС при миоме матки:
·расположение миоматозных узлов в полости малого таза (шеечные миомы); ·наличие больших, множественных внутримышечных миоматозных узлов;
·сочетание миомы матки с другими заболеваниями и осложнениями беременности, которые служат показаниями к этой операции; ·угрожаемые состояния плода;
·наличие рубца на матке после консервативной миомэктомии со вскрытием полости матки и осложнённым течением послеоперационного периода; ·миоматозные узлы, препятствующие нормальному вставлению и продвижению плода (центрипетальный рост, субмукозная локализация опухоли);
·нарушение питания и некроз миоматозного узла; ·подозрение на малигнизацию миоматозного узла. Показания к миомэктомии во время КС:
·субсерозные узлы на тонком основании в любой доступной локализации; ·субсерозные узлы на широком основании (исключая нижний сегмент); ·крупные (более 10 см) узлы количеством не более 5;
·расположенный интрамурально либо с центрипетальным ростом миоматозный узел размерами более 10 см (не более одного узла); ·хороший доступ к узлу различной локализации, исключая интрамуральные с размерами менее 5 см.
Показания к экстирпации матки:
·множественной миоме с низким расположением узлов (шеечные, перешеечные); ·малигнизации узла, подтверждённой гистологически во время операции;
·необходимости одновременного удаления придатков матки (опухоли яичников, тубоовариальные образования).
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
·Противопоказания к сохранению беременности при миоме матки: --подозрение на злокачественное перерождение опухоли; --быстрый рост миоматозных узлов; --шеечно-перешеечная локализация миоматозного узла;
--ущемление миоматозного узла, некроз, перекрут узла на ножке; --тромбофлебит вен таза;
--поздняя беременность (возраст более 40 лет), неудовлетворительное состояние здоровья.
Следует предупредить беременную о возможности самопроизвольного прерывания беременности, нарушения питания в узле, о необходимости при больших размерах миомы выполнения КС с последующим удалением узла или матки.
СПИСОК РАКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Адамян Л.В., Белоглазова С.В. Диагностическая и хирургическая гистероскопия в гинекологии/Методические рекомендации — М., 1997.
Адамян Л.В., Селиверстов А.А., Сухих Г.Т. Особенности состояния общего и локального иммунитета больных при миоме матки в молодом возрасте до и после оперативного лечения //Материалы международного конгресса «эндоскопия в диагностике и лечении патологии матки» — М., 1997. — С. 136–139.
Безнусенко Г.В. Гладкие миоциты миометрия в периоды его ускоренного роста в пренатальном онтогенезе, при беременности и миоме матки: Дис. … канд. мед. наук. — Иваново, 1997. — 175 с.
Бохман Я.В. Руководство по онкогинекологии. — Л.: Медицина, 1989. — 464 с.
Брехман Г.И. Синдром психоэмоционального напряжения и миома матки // Акушерство и гинекология — 1990. — № 2. — С. 13–17.
Вихляева Е.М. О стратегии и тактике ведения больных с миомой матки // Вестник Российской ассоциации акушеров– гинекологов. — 1997. — № 3. — С. 21–23.
Вихляева Е.М., Железнов Б.И., Запорожан В.Н. и др. Руководство по эндокринной гинекологии. — М.: Медицинское информационное агенство, 1997. — 768 с.
Вихляева Е.М., Василевская Л.Н. Миома матки. — Кишинёв, 1981.
Вихляева Е.М., Палладии Г.А. Патогенез, клиника и лечение миомы матки. — Кишинёв, 1982. — 300 с. Вихляева Е.М. Руководство по эндокринной гинекологии. — М., 1997. — С. 424–454.
Козаченко В.П., Ландеховский Ю.Д. Особенности содержания рецепторов эстрогенов и прогестерона в миоме матки и в миометрии//Акуш. и гинекология. — 1995. — № 6. — С. 34–36.
Кох Л.И. Функциональная хирургия матки при миоме матки: Дис. … дра мед. наук. — Томск, 1988. — 327 с.
Кудрина Е.А. Современные подходы к патогенезу, диагностике и лечению генитального эндометриоза: Дис. … дра мед. наук. — М., 1999.
Курашвили Ю.Б. Клинико-морфологический вариант «ложного» роста миомы матки у женщин репродуктивного возраста: Автореф. дис. … канд. мед. наук — М., 1997.
Пальцев А.А., Иванов А.А. Межклеточные взаимодействия. — М: Медицина, 1995. — 224 с.
ПетровМаслаков М.А., Калашникова Е.П. Морфологическая диагностика миомы матки при контактной микроскопии // Фибромиома матки. — Кишинёв: Штиница, 1976. — С. 41–44.
Савельева Г.М. и др. Плацентарная недостаточность. — М.: Медицина, 1991. — 272 с.
Савицкий Г.А., Савицкий А.Г. Миома матки. Проблемы патогенеза и патогенетической терапии. — СПб.: «Элби», 2000. — С. 221.
Савицкий Г.А., Герман М.С. Локальная гипергормонемия и некоторые гиперпластические процесы матки. — Кишинёв: Штиница, 1987. — 143 с.
Савицкий Г.А., Скопичев В.Г., Ракицкая В.В. «Денервация» узла опухоли, как один из элементов патогенеза миомы матки // Акушерство и гинекология. — 1986. — № 2. — С. 24–27.
Сапожников А.Г. Структура гемомикроциркуляторного русла при интрамуральных миомах матки//Вопросы онкологии. — 1987. — Т. XXXIII. — № 10. — С. 43–48.
Семенов Н.С. Возможности эхографии, ЦДК и допплерометрии в диагностике миомы матки и оценке восстановления репродуктивной системы при консервативной миомэктомии: Автореф. дис. … канд. мед. наук. — М., 2000. — 21 с.
Серов В.В., Журавлева Т.Б., Василевская Л.Н., Мельников Ю.Г. Морфогенез миом матки //Акушер. и гинек. — 1973. — № 1. — С. 3–8.
Серов В.П., Прилепская В.Н., Жаров Е.В. и др. Практическое руководство по гинекологической эндокринологии. — М.: РУСФАРМАМЕД, 1995. — 426 с.
Сидорова И.С. Миома матки и беременность. — М., 1985. — 197 с.
Сидорова И.С., Анзимиров В.Л., Гасанов Я.К. Миома матки. — М., 1979. — С. 18–21.
Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. Книга 2. — СПб.: СОТИС, 1995. — 224 с.
Стрижаков А.Н., Давыдов А.И. Эндометриоз. Клинические и тереотические аспекты. — М.: Медицина, 1996. — С. 69. Стрижаков А.Н. Актуальные проблемы генитального эндометриоза//Акуш. и гинек. — 1988. — № 8. — с. 3–5. Стрижаков А.Н., Давыдов А.И. Эндометриоз: клинические и теоретические аспекты. — М.: Медицина, 1996. — 330 с. Тихомиров А.Л. Патогенетическое обоснование ранней диагностики, лечения и профилактики миомы матки: Дис. … д- ра мед. наук. — М., 1998.
Уварова Е.М. Сочетанная доброкачественная патология эндо и миометрия у больных репродуктивного возраста (вопросы патогенеза, диагностики и лечения): Дисс. … дра мед. наук — М., 1993.
Хирш Х., Кезер О., Икле Ф. Оперативная гинекология: Атлас: Пер. с англ. — М.: ГЭОТАР-Медиа. — 1999. — 656 с. Хмельницкий О.К. Патоморфологическая диагностика гинекологических заболеваний. — СПб: СОТИС, 1994. — С. 479. Хэм А., Кормак Д. Гистология. М.: Мир, 1983. Том 2. — 254 с.
Черезов А.Е. Общая теория рака — тканевой подход. — М.: Издательство Московского университета, 1997. — 252 с. Эдвардс Р.Г., Биард Г., Фермейден Я.П. Аналоги ГнРГ в репродуктивной медицине. — Мед. Пресс, 1997. — С. 123– 128.
49.3. БЕРЕМЕННОСТЬ И ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЯИЧНИКОВ
КОД МКБ-10
M844–M849 Кистозные, муцинозные и серозные новообразования. M8440/0 Цистаденома БДУ.
M8441/0 Серозная цистаденома БДУ (D27).
M8442/3 Серозная цистаденома пограничной злокачественности (C56). M8450/0 Папиллярная цистаденома БДУ (D27).
M8451/3 Папиллярная цистаденома пограничной злокачественности (C56). M8452/1 Папиллярная кистозная опухоль (D37.7).
M8460/0 Папиллярная серозная цистаденома БДУ (D27). M8461/0 Серозная поверхностная папиллома (D27).
M8462/3 Папиллярная серозная цистаденома пограничной злокачественности (C56). M8470/0 Муцинозная цистаденома БДУ (D27).
M8471/0 Папиллярная муцинозная цистаденома БДУ (D27).
M8472/3 Муцинозная цистаденома пограничной злокачественности (C56).
M8473/3 Папиллярная муцинозная цистаденома пограничной злокачественности (C56). M8480/0 Муцинозная аденома.
M8480/3 Муцинозная аденокарцинома. M8480/6 Псевдомиксома брюшины (C78.6).
M859–M867 Специфические новообразования половых желёз. M8590/1 Опухоль стромы полового тяжа.
M8600/0 Текома БДУ (D27). M8601/0 Текома лютеиновая (D27).
M8602/0 Склерозирующая опухоль стромы (D27). M8610/0 Лютеома БДУ (D27).
M8620/1 Гранулёзоклеточная опухоль БДУ (D39.1). M8621/1 Гранулёзоклеточная опухоль (D39.1).
M8622/1 Ювенильная гранулёзоклеточная опухоль БДУ (D39.1). M8623/1 Опухоль полового тяжа с кольцевыми трубочками (D39.1). M8630/0 Андробластома доброкачественная.
M8630/1 Андробластома БДУ.
M8631/0 Опухоль из клеток Сертоли-Лейдига. M8632/1 Гинандробластома (D39.1). M8640/0 Опухоль из клеток Сертоли БДУ.
M8641/0 Опухоль из клеток Сертоли с накоплением липидов (D27). M8650/0 Доброкачественная опухоль из клеток Лейдига (D29.2). M8650/1 Опухоль из клеток Лейдига БДУ (D40.1).
M8650/3 Злокачественная опухоль из клеток Лейдига (C62.-). M8660/0 Хилусноклеточная опухоль (D27).
M8670/0 Липидно-клеточная опухоль яичника (D27). M8671/0 Опухоль адреналовых остатков [гнёзд]. M900–M903 Фиброэпителиальные новообразования. M9000/0 Опухоль Бреннера БДУ (D27).
M9000/1 Опухоль Бреннера пограничной злокачественности (D39.1). M9010/0 Фиброаденома БДУ (D24).
M9011/0 Интраканаликулярная фиброаденома (D24).
M9012/0 Периканаликулярная фиброаденома (D24). M9013/0 Аденофиброма БДУ (D27).
M9014/0 Серозная аденофиброма (D27). M9015/0 Муцинозная аденофиброма (D27). M9016/0 Гигантская фиброаденома (D24).
M9020/0 Филлоидная [листовидная] опухоль доброкачественная (D24). M9020/1 Филлоидная [листовидная] опухоль БДУ (D48.6).
M9030/0 Ювенильная фиброаденома (D24).
M906–M909 Герминогенные [зародышевоклеточные] новообразования. M9060/3 Дисгерминома.
M9061/3 Семинома БДУ (C62.-).
M9063/3 Сперматоцитарная семинома (C62.-). M9064/3 Герминома.
M9070/3 Эмбриональный рак БДУ. M9071/3 Опухоль эндодермального синуса. M9073/1 Гонадобластома.
M9080/0 Тератома доброкачественная. M9080/1 Тератома БДУ.
M9084/0 Дермоидная киста БДУ.
M9085/3 Смешанная герминогенная [зародышевоклеточная] опухоль. M9090/0 Струма яичника БДУ (D27).
ЭПИДЕМИОЛОГИЯ
Беременность при опухолях яичников диагностируют в 0,02–0,46% случаев, чаще всего в репродуктивном возрасте.
КЛАССИФИКАЦИЯ Гистологическая классификация опухолей яичников (ВОЗ, 1973) ·Эпителиальные опухоли:
--серозные опухоли; --муцинозные опухоли; --эндометриоидные опухоли;
--светлоклеточные (мезонефроидные) опухоли; --опухоли Бреннера; --смешанные эпителиальные опухоли;
--недифференцированная карцинома. ·Опухоли стромы полового тяжа: --гранулёзо-стромальноклеточные опухоли;
--андробластомы и опухоли из сустентоцитов и гландулоцитов; --гинандробластома; --неклассифицируемые опухоли стромы полового тяжа.
·Липидно-клеточные (липоидно-клеточные) опухоли. ·Герминогенные опухоли:
--дисгерминома; --опухоль эндодермального синуса;
--эмбриональная карцинома; --полиэмбриома; --хорионэпителиома; --тератомы;
--смешанные герминогенные опухоли. ·Гонадобластома:
--чистая (без примеси других форм); --смешанная с дисгерминомой и другими формами герминогенных опухолей.
·Опухоли мягких тканей (неспецифичные для яичников). ·Неклассифицированные опухоли.
·Вторичные (метастатические) опухоли. ·Опухолевидные процессы:
--лютеома беременности; --гиперплазия стромы яичники и гипертекоз; --массивный отёк яичника;
--единичная фолликулярная киста и киста жёлтого тела; --множественные фолликулярные кисты (поликистозные яичники);
--множественные лютеинизированные фолликулярные кисты и/или жёлтые тела; --эндометриоз; --поверхностные эпителиальные кисты включения (герминальные кисты включения); --простые кисты;
--воспалительные процессы; --параовариальные кисты.
Во время беременности наиболее часто встречаются лютеомы, дермоидные и муцинозные опухоли.
ЭТИОЛОГИЯ
Этиологические факторы опухолей яичников: ·отягощённая наследственность; ·гормональные нарушения; ·наличие ИППП; ·частые аборты;
·отсутствие беременности в течение длительного времени; ·раннее или позднее начало половой жизни.
Чётких данных о специфических факторах, провоцирующих развитие опухолей при беременности, нет. Большинство опухолей яичников не связано с беременностью. Часто патологические изменения в яичниках предшествуют наступлению беременности. Теоретически, иммунодепрессия во время беременности может способствовать возникновению и развитию опухолей яичников.
ПАТОГЕНЕЗ
·Одна из причин возникновения опухолей репродуктивной системы женщины — нарушение механизмов нейроэндокринной регуляции половых желёз:
--первичное ослабление функции яичников и снижение уровня овариальных эстрогенов; --компенсаторное повышение уровня гонадотропинов гипофиза, в первую очередь ФСГ.
При длительном повышении секреции ФСГ в яичниках возникают диффузная, а затем очаговая гиперплазия и пролиферация клеточных элементов. Данные процессы могут закончиться образованием опухоли. У больных с гормон--продуцирующими опухолями вследствие изменения секреции гонадотропинов часто встречаются нарушения менструального цикла или преждевременная менопауза. В результате возникают гормональноактивные гранулёзоклеточные и текаклеточные опухоли, андробластомы.
·По разнообразию возникающих в нём опухолей яичник занимает одно из первых мест среди других органов человека. Источники происхождения опухолей яичника:
--различные клеточные элементы (неэмбриональные), формирующие ткань яичников; --эмбриональные остатки; --постнатальные разрастания и гетеротопии.
·Источником появления кистом может быть яичниковый покровный эпителий, который погружается в корковый слой, образуя сосочковые и железистые структуры.
·Теория эмбриональных зачатков поясняет причины развития опухолей яичника из тканей, не свойственных для него. Согласно этой теории недифференцированные мезенхимальные элементы остаются в яичнике с раннего периода эмбриогенеза. В различные периоды жизни женщины под действием гормональных или иных факторов возникает дифференцировка мезенхимальных клеток с последующей их малигнизацией.
·Развитию опухолей яичников способствует процесс старения организма. У большинства больных раком яичников в менопаузе имеется повышенное выделение неклассических эстрогенов — фенолстероидов.
·Существует гипотеза о роли непрерывной овуляции в развитии рака яичника. Согласно ей при каждой овуляции поверхностный эпителий яичника подвергается травме и воздействию эстрогенсодержащей фолликулярной жидкости, что вызывает его активную пролиферацию и увеличивают риск развития рака яичников.
·Наследственные факторы.
КЛИНИЧЕСКАЯ КАРТИНА
Доброкачественные опухоли яичников различной гистологической структуры, исключая гормонпродуцирующие, имеют во многом сходную клиническую картину.
Ранние стадии заболевания, как правило, протекают бессимптомно. Даже при появлении первых признаков заболевания некоторых больных длительное время не оперируют. Это связано с тем, что женщина либо не обращается к врачу, либо врач, наблюдая за ней, не рекомендует оперативного лечения. При ретроспективном опросе может быть установлено, что те или иные симптомы заболевания присутствовали продолжительное время.
Доклиническая фаза может длиться десятки лет. В начале заболевание имеет медленное и доброкачественное течение, но со временем появляются признаки злокачественного роста. Большинство больных оперируют по поводу опухоли яичника в течение первого года после её обнаружения. Однако 33,3% больных наблюдают по поводу образования в придатках матки от 2 до 10 лет, им проводят (как правило, безрезультатно) курсы консервативной терапии в связи с предполагаемым воспалением придатков матки. Эти данные свидетельствуют об отсутствии онкологической настороженности у врачей.
Симптомы заболевания зависят от величины и расположения опухоли. В большинстве случаев больные предъявляют неспецифические жалобы. Наиболее частая из них — боли внизу живота, реже — в пояснице и в паховых областях. Чаще всего боль имеет тупой, ноющий характер. Острая боль бывает при перекруте ножки опухоли и при кровоизлияниях (в случае разрыва капсулы опухоли). Как правило, боль не связана с менструацией. Она возникает изза раздражения или воспаления серозных покровов и спазма гладкой мускулатуры полых органов, а также из-за натяжения капсулы опухоли и, вследствие этого, раздражения рецепторного аппарата и нарушения кровоснабжения стенки опухоли. Чаще всего именно болевой синдром заставляет женщину обратиться к врачу.
Почти 20% больных отмечают наличие запоров и расстройств мочеиспускания. При значительных размерах опухоли женщины жалуются на чувство тяжести в животе и увеличение его объёма. 14,7% больных беспокоят слабость и одышка. У 7,8% пациенток основная жалоба — бесплодие.
Необходимо помнить, что у значительного числа больных симптомы заболевания отсутствуют. У 25% женщин с муцинозными и почти у 20% с дермоидными и цилиоэпителиальными кистомами опухоль обнаруживают случайно.
Во время беременности матка увеличивается в объёме, что изменяет анатомотопографические отношения придатков. В связи с этим возрастает риск осложнений, связанных с наличием опухолевидного или опухолевого образования в яичниках.
К данным осложнениям относят:
·прерывание беременности на ранних сроках (в 18% случаев); ·перекрут ножки опухоли яичника при серозных опухолях и дермоидных кистах (в 12% случаев); ·сдавление опухоли маткой в сроке беременности 12–13 нед;
·косое или поперечное положение плода (при межсвязочном развитии опухоли яичника); ·озлокачествление доброкачественной опухоли яичника (в 25% случаев); ·разрыв капсулы опухоли в конце первого периода родов;
·нарушения продвижения головки плода по родовому каналу при больших малоподвижных опухолях яичника; ·перекрут ножки и некроз капсулы опухоли яичника с появлением клиники «острого живота» в третьем периоде родов и послеродовом периоде.
ДИАГНОСТИКА ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Латерально, над маткой или в дугласовом пространстве определяют подвижное образование, округлой или овальной формы, с тугоэластичной консистенцией, с гладкой, ровной поверхностью.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Клинический анализ крови. Изменения картины крови при доброкачественных опухолях яичников не специфичны. Однако в большинстве случаев имеется увеличение СОЭ до 25–30 мм/ч. Лейкоцитоз возникает, как правило, только при наличии осложнений. Лейкоцитарная формула не изменена.
Определённый уровень концентрации CA-125, CA-19-9, CA-72-4 в сыворотке крови позволяет судить о характере процесса в яичнике. Повышение уровня CA-125 обнаруживают у 78–100% больных раком яичников, особенно при серозных опухолях. Превышающий норму (35 мЕ/мл) уровень CA-125 отмечается только у 1% женщин без опухолевой патологии яичников и у 6% больных с доброкачественными опухолями. При раке яичников повышение концентрации CA-125 обнаруживают в 82% и при эпителиальных опухолях негинекологической локализации — в 23%. Чувствительность метода — 73% (при III–IV стадиях — 96%), специфичность — 94%.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Ультразвуковые признаки доброкачественных опухолей яичников: ·округлая или овальная форма; ·тонкие стенки;
·чёткие ровные внутренние и наружные контуры; ·однокамерное образование, или единичные камеры;
·однородное гипоэхогенное или анэхогенное внутреннее содержимое; ·гладкая внутренняя капсула.
При УЗИ органов брюшной полости патологических изменений не обнаруживают.
При ЦДК определяют кровоток в единичных высокорезистивных сосудах, расположенных в капсуле опухоли. При планировании беременности необходимо выполнение ЭГДС, ректороманоскопии (колоноскопии).
СКРИНИНГ
Трансвагинальное УЗИ органов малого таза в ранних сроках беременности — скрининговый метод обследования больных с доброкачественными опухолями яичников.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА Миома матки:
·гиперэхогенное изображение образования с эффектом дистального поглощения звука, наличие периферического уплотнения в виде капсулы; ·сниженный кровоток в миоматозном узле с единичными цветовыми сигналами по периферии;
·ИР: в миометрии — 0,63±0,05, в миоматозных узлах — 0,59±0,06; ·максимальная систолическая скорость — 18,7 см/с.
Злокачественные опухоли яичников: ·увеличение поражённого яичника в размерах; ·неправильная форма; ·нечёткие неровные (бугристые) наружные контуры;
·неоднородная солиднокистозная внутренняя структура; ·разрастание тканевого компонента по внутренней капсуле по типу «цветной капусты»;
·при ЦДК определяют большое количество сосудов как по периферии, так и в центральных структурах опухоли, на перегородках с низкой резистентностью кровотока (ИР <0,4).
Опухолевидные изменения яичников: ·однокамерное образование; ·анэхогенное внутреннее содержимое; ·гладкая внутренняя и наружная капсулы.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Решение о необходимости оперативного лечения совместно принимают акушер-гинеколог и онколог.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Беременность 12–13 нед. Лютеома беременности.
ЛЕЧЕНИЕ ЦЕЛИ ЛЕЧЕНИЯ
Удаление опухоли яичника, выявленной во время беременности.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В дооперационном и послеоперационном периодах необходимо проводить терапию, направленную на сохранение беременности (гестагены, спазмолитики, b-адреномиметики).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
При неосложнённом течении доброкачественной опухоли яичника и беременности оперативное лечение следует проводить после полноценного созревания плаценты, т.е. в сроки 14–16 нед беременности. Оперативное
вмешательство лучше осуществлять лапароскопическим доступом под эндотрахеальным наркозом. Решение вопроса об объёме операции принимают после срочного гистологического исследования. В более поздние сроки проведение лапароскопической операции может представлять сложности, поэтому используют лапаротомный доступ.
При подозрении на малигизацию опухоли яичника по данным клинического осмотра (плотная консистенция), УЗИ (солидная структура, эхопризнаки неоангио-генеза), повышении показателей онкомаркёров (CA-125, CA-19-9), промедление с операцией недопустимо.
Если в I триместре беременности находят подвижную кисту яичника размерами до 10 см в диаметре, то от операции можно воздержаться, так как чаще всего это киста жёлтого тела или лютеома беременности, которые регрессируют во II триместре.
Оперативное вмешательство при доброкачественных опухолях яичника направлено на сохранение органа. Однако даже при выполнении овариоэктомии опасность прерывания беременности невелика.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Готовясь к беременности, женщина должна обследоваться у гинеколога и пройти УЗИ органов малого таза. Желательно планировать беременность после исключения опухолей яичников. Часто беременность протекает при наличии кист яичников. В большинстве случаев при небольших размерах образований врачи придерживаются консервативной тактики. При возникновении опухоли яичника во время беременности регулярное наблюдение у врача позволит избежать осложнений.
ПРОГНОЗ
Прогноз при доброкачественной опухоли яичника или опухолевидном образовании благоприятный. Своевременное удаление доброкачественного объёмного образования позволяет пролонгировать беременность до доношенного срока, родить нормального ребёнка и сохранить здоровье женщине.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Бохман Я.В. Руководство по онкогинекологии. — Л.: Медицина, 1989. — С. 462 Нечаева И.Д. Опухоли яичников. — Л.: Медицина, 1987. — 215 с.
Селезнёва Н.Д. Доброкачественные опухоли яичников. — М., 1983.
Савельева Г.М., Бреусенко В.Г. Гинекология. — М.: ГЭОТАР-Медиа. — 2005. — С. 431.
