
terapy / федер рекомендации / федер рекомендации / федеральные рекомендации / гематология / 04 - Лимфопролиферативные заболевания
.pdf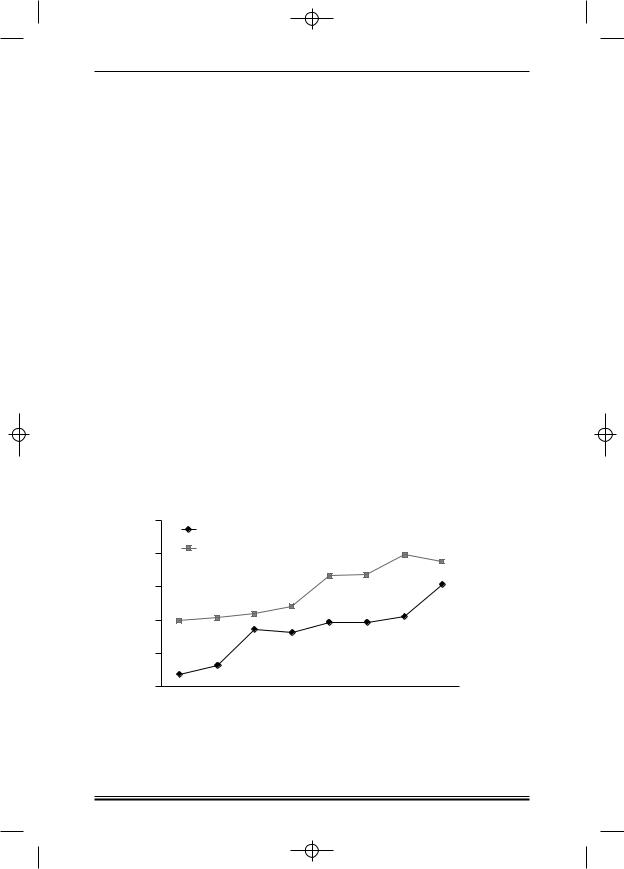
Протокол диагностики и лечения множественной миеломы
агноз был поставлен в 2001—2006 гг., достигала 44,8 мес, в то время как у пациентов, заболевших в предыдущие годы, составляла лишь 29,9 мес (Р < 001). Поскольку именно в этот период в схему терапии ММ начина ли включать талидомид, бортезомиб и леналидомид, авторы пришли к заключению, что повышение показателей выживаемости обусловлено в первую очередь новыми лекарственными препаратами.
Еще более яркие доказательства эффективности новых лекарствен ных средств были получены при оценке выживаемости больных, у кото рых рецидив развился после аутологичной трансплантации. Так, медиа на продолжительности общей выживаемости от момента диагностики посттрансплантационного рецидива составляла 23,9 мес, если рецидив выявлялся в период после 2000 г., и была вдвое короче, если рецидив вы являлся в предыдущие годы (11,8 мес; Р < 0,001). Назначение одного или нескольких лекарственных средств (бортезомиба, талидомида, ленали домида) обеспечивало достоверное увеличение выживаемости после ре цидива с 14,8 мес до 30,9 мес (Р < 0,001). При этом представленные пре имущества новых лекарственных препаратов не зависели от других про гностических признаков.
Несмотря на расширяющиеся возможности применения новых ле карственных препаратов в качестве первой и последующих линий тера пии ММ, трансплантационная активность при этом заболевании не только не снижается, но прослеживается ее явное увеличение. Так, по данным Европейского Регистра трансплантации костного мозга, коли чество ежегодно выполнявшихся при ММ трансплантаций аутологич ных гемопоэтических клеток за период с 2004 по 2009 г. в европейских странах возросло с 5315 до 6918 [36].
На рис. 1 представлены кривые вероятности достижения высокого противоопухолевого ответа после выполнения индукционной терапии и
100 |
До ауто ТСКК |
После ауто ТСКК |
80 |
60 |
40 |
20 |
0 |
Dex VAD Thal + TAD CTD |
VD |
PAD VTD |
Dex |
|
|
Рисунок 1. Вероятность достижения полной + очень хорошей частичной ре миссии после индукционной терапии и последующей высокодозной консо лидации [86—91]. ТСКК — трансплантация стволовых кроветворных кле ток; Dex — дексаметазон; Thal — талидомид.
543

Лимфопролиферативные заболевания
консолидирующей терапии высокими дозами мелфалана с последующей ауто ТСКК. Данный рисунок демонстрирует достижение полной + очень хорошей частичной ремиссии после индукционных схем, вклю чавших различные сочетания новых препаратов (талидомида, бортезо миба, леналидомида), в 38—60% случаев. Аутотрансплантация, выпол няемая после такой индукционной терапии, позволяет повысить проти воопухолевый эффект еще у 20—40% больных.
Итак, применение комплекса современных лечебных методик, вклю чающих ауто ТCКК, позволяет добиться полноценной ремиссии не ме нее чем у половины больных. Важность достижения полной ремиссии была доказана несколькими клиническими исследованиями, обнару жившими зависимость показателей общей выживаемости и выживаемо сти без признаков заболевания от полноты противоопухолевого ответа у больных, перенесших трансплантацию аутологичных стволовых крове творных клеток [37—39]. Авторами было показано, что в случае достиже ния полной ремиссии после ауто ТCКК общая и безрецидивная выжи ваемость пациентов была существенно выше, чем в случае достижения частичного ответа.
Новые лекарственные препараты
Препаратами так называемой прицельной, биологически обоснован ной терапии ММ являются ингибиторы протеосом (бортезомиб, кар филзомиб) и иммуномодулирующие препараты (талидомид, леналидо мид, помалидомид). В настоящее время Министерством здравоохране ния и социального развития РФ зарегистрированы для лечебного приме нения два новых лекарственных препарата — бортезомиб и леналидомид. Бортезомиб применяется и в качестве препарата 1 й линии терапии у первичных больных с ММ, и при рецидивах заболевания. Леналидомид используется и как препарат 2 й линии, если не удалось достичь значи мого стабильного ответа в результате как минимум одной линии тера пии, и при резистентном/рецидивирующем течении ММ.
Бортезомиб
Представляет собой дипептид борониковой кислоты и является мощ ным селективным обратимым ингибитором протеосомного комплекса. Бортезомиб избирательно подавляет активность химотрипсина как од ного из компонентов ферментативного комплекса протеосомы 26S, пре пятствует активизации нуклеолярного фактора (NF κB), что в свою оче редь тормозит каскад реакций, способствующих опухолевой пролифера ции.
Клиническое испытание препарата (II фаза) у пациентов с рефрак терным и рецидивирующим течением ММ проводилось в рамках двух открытых многоцентровых исследований — SUMMIT [40] и CREST [41]. Общая эффективность бортезомиба у больных с крайне неблагоприят ным прогнозом оказалась более 50% при назначении препарата в дозе 1,3 мг/м2 и более 30% при назначении препарата в дозе 1,0 мг/м2. Частота
544

Протокол диагностики и лечения множественной миеломы
полной ремиссии составила около 10%. Добавление дексаметазона при недостаточном ответе на терапию бортезомибом позволило увеличить общий ответ у больных обеих групп до 62% и 44% соответственно. Ме диана продолжительности достигнутого объективного ответа на лечение оказалась равной 12 мес, а общей выживаемости — 16 мес.
В следующем многоцентровом, уже рандомизированном, исследо вании APEX было проведено сравнение эффективности монотерапии бортезомибом (1,3 мг/м2) и монотерапии дексаметазоном в дозе 40 мг [42]. Результаты исследования свидетельствовали о значительном пре имуществе лечения бортезомибом. Общая эффективность терапии бор тезомибом (ПР + ЧР) составила 43%, а дексаметазоном — 18%, медиана выживаемости, свободной от прогрессирования, в сравниваемых груп пах была 6,2 и 3,5 мес, а общей выживаемости — 29,8 и 23,7 мес соответ ственно.
Дальнейшие испытания показали синергизм бортезомиба с различ ными цитостатическими препаратами: при сочетании с мелфаланом воз можно повышение общего ответа до 50%, с доксорубицином — до 73%, с талидомидом — до 70% [43—45].
Наиболее яркие результаты, достоверно подтвердившие высокую противоопухолевую эффективность бортезомиба, были получены в меж дународном многоцентровом рандомизированном исследовании VISTA (Velcade as Initial Standard Therapy in multiple myeloma: Assessment with melphalan and prednisone). San Miguel с соавт. сравнили результаты ин дукционной терапии по схемам мелфалан + преднизолон (МР) и борте зомиб + МР (VMP) у 682 первичных нелеченных больных с ММ пожило го возраста, которые не являлись кандидатами на трансплантацию ауто логичных стволовых кроветворных клеток. Главным оцениваемым кри терием противоопухолевого ответа было время до прогрессирования. Кроме того, оценивались такие показатели, как общая выживаемость и выживаемость без прогрессирования, частота полного и общего ответа, безопасность лечения и др. Оказалось, что результаты терапии по схеме VMP значительно превосходили результаты схемы МР по всем измеряе мым критериям. Частичный и полный ответы наблюдались у 71 и 30% больных, а длительность ответа составила 19,9 мес [46]. На основании представленных данных схема VMP была признана новым стандартом индукционной терапии пациентов с ММ, которым в дальнейшем не пла нировалась аутотрансплантация.
На 53 й ежегодной конференции Американского общества гематоло гов (ASH) в 2011 г. обсуждались пятилетние результаты исследования VISTA [47]. При медиане наблюдения за пациентами, равной 60,1 мес, все исследовавшиеся ранее показатели свидетельствовали о преимуще ствах схемы VMP по сравнению со схемой МР. Так, пятилетняя общая выживаемость составила 46% против 34,4% при медиане выживаемости 56,4 и 43,1 мес. При этом более высокие показатели общей выживаемо сти в группе, получавшей лечение по схеме VMP, наблюдались у пациен тов с прогностически неблагоприятным течением заболевания (возраст старше 75 лет, III стадия по ISS, клиренс креатинина менее 60 мл/мин).
545

Лимфопролиферативные заболевания
Поскольку высокодозная химиотерапия с последующей аутологич ной трансплантацией рассматривается как терапия 1 й линии у больных с ММ моложе 60—65 лет, весьма интересны исследования, посвященные включению бортезомиба в курсы индукционной терапии у нелеченных больных. Результаты этих исследований оказались обнадеживающими. Так, использование схемы бортезомиб + дексаметазон позволило до биться общего ответа у 75% больных, а схемы PAD (бортезомиб + доксо рубицин + дексаметазон) — у 95%, причем у трети из них была достигну та полная или хорошая частичная ремиссия. Последующий сбор аутоло гичных гемопоэтических клеток был эффективным, отрицательного влияния на приживление трансплантата не наблюдалось [48—50].
Большой интерес вызвало исследование, посвященное новому пути введения бортезомиба — п/к. В проспективном рандомизированном ме ждународном исследовании проводилось сравнение эффективности, безопасности, фармакокинетики и фармакодинамики бортезомиба при п/к и в/в введении у пациентов с рецидивирующей множественной мие ломой [51, 52]. Авторам удалось достоверно доказать одинаковую эффек тивность при в/в и п/к введении препарата: частота общего, полного и частичного ответов была равнозначной. Кроме того, как при в/в, так и при п/к введении фармакокинетические (системная экспозиция) и фар макодинамические (ингибирование протеосом) профили бортезомиба были сходными. Положительным моментом явилось значительное сни жение частоты периферической нейропатии всех степеней тяжести при п/к введении по сравнению с в/в. При этом уменьшение риска перифе рической нейропатии достигалось без уменьшения дозы препарата. По лученные результаты позволяют предполагать возможность применения препарата в домашних условиях и в сочетании с другими пероральными противоопухолевыми препаратами, избежав тем самым введения его в центральную вену.
Талидомид
Сведения об усилении ангиогенеза в костном мозге у больных с ММ позволили предположить возможность использования в терапии этого заболевания такого антиангиогенного препарата, как талидомид [53, 54]. Дальнейшие исследования показали, что действие талидомида не огра ничивается только антиангиогенным эффектом и что препарат способен также индуцировать апоптоз опухолевых клеток, ингибировать экспрес сию ИЛ 6, ФНОα и эндотелиального фактора роста сосудов, участвую щих в регуляции пролиферации миеломных клеток [55].
Положительные результаты исследований эффективности талидоми да у больных с резистентными формами ММ позволили применить его и у нелеченных больных [56]. Было показано, что на фоне терапии талидо мидом возможно достижение не только частичной, но, в редких случаях, и полной ремиссии, причем продолжительность полученного эффекта достаточно большая [57]. В течение последних нескольких лет исследо ватели пытаются увеличить эффективность терапии талидомидом, соче тая его с различными химиотерапевтическими препаратами. Сочетание
546

Протокол диагностики и лечения множественной миеломы
талидомида с дексаметазоном оказалось эффективным в 50% случаев ре зистентной миеломы. Весьма перспективной представляется схема ин дукционной терапии, включающая Велкейд, талидомид и дексаметазон (VTD). Сравнив эффективность этой схемы с эффективностью сочета ния талидомид + дексаметазон, авторы отметили бесспорное преимуще ство 3 препаратной схемы. Частота достижения полной + очень хоро шей частичной ремиссии равнялась 60% и 25% соответственно. Выпол ненная в последующем аутотрансплантация в режиме кондиционирова ния мелфаланом, 200 мг/м2, позволила повысить указанный результат в обеих группах больных до 77% и 54% соответственно. В связи с этим схе ма VTD рассматривается в качестве 1 й линии терапии для больных, ко торым по возрасту и соматическому статусу показано выполнение ауто логичной трансплантации [58].
Леналидомид
Леналидомид является структурным аналогом талидомида с идентич ной, но более выраженной биологической активностью, которая прояв ляется в виде мощного иммуномодулирующего и ингибирующего ангио генез воздействия.
Исследования in vitro показали, что леналидомид индуцирует проли ферацию Т лимфоцитов и повышает синтез ИЛ 2 и интерферона γ, а также повышает цитотоксическую активность собственных Т киллеров. Препарат ингибирует пролиферацию клеток различных линий гемопо этических опухолей, главным образом тех, которые имеют цитогенети ческие дефекты хромосомы 5, ингибирует ангиогенез, блокируя образо вание микрососудов и эндотелиальных каналов, а также миграцию эндо телиальных клеток на модели ангиогенеза in vitro. Кроме того, леналидо мид ингибирует синтез проангиогенного сосудистого эндотелиального фактора роста, а также секрецию провоспалительных цитокинов, включая ФНОα, ИЛ 1β, ИЛ 6 и ИЛ 12, липополисахарид стимулированными пе риферическими мононуклеарными клетками крови и повышает продук цию этими клетками противовоспалительного цитокина ИЛ 10 [59—61].
На рис. 2 представлена схема противоопухолевого эффекта леналидо мида, проявляющегося как в виде прямого воздействия на миеломные опухолевые клетки, так и в виде влияния на костномозговое микроокру жение.
Высокую эффективность леналидомида при лечении ММ убедитель но доказали два больших многоцентровых рандомизированных исследо вания, проводившиеся практически одновременно в США и Канаде (ММ 009), а также в Европе, Австралии и Израиле (ММ 010). В течение года (с 2003 го по 2004 й) в эти исследования было включено 704 паци ента с рецидивирующим или рефрактерным течением ММ. Целью дан ного клинического исследования являлось сравнение эффективности схемы леналидомид + дексаметазон и монотерапии дексаметазоном (плацебо + дексаметазон).
Результаты исследования подтвердили бесспорный успех нового пре парата. Так, в группе больных, получавших леналидомид, общий ответ
547

Лимфопролиферативные заболевания
Леналидомид
|
Мишень: опухолевые клетки |
|
|
Мишень: микроокружение |
||
Прямой апоптоз опухолевых клеток |
|
Блокирование адгезии эндоте |
||||
Опосредованное через NK клетки |
|
лиальных клеток |
||||
уничтожение опухолевых клеток |
|
Антиангиогенное действие |
||||
|
|
|
|
Ингибирование выработки |
||
|
|
|
|
провоспалительных цитокинов |
||
|
|
|
|
(ФНОα, ИЛ 6) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Снижает опухолевую массу |
|
|
|
Замедляет пролиферацию |
|
|
|
|
|
опухолевых клеток |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 2. Схема противоопухолевого эффекта леналидомида.
был отмечен у 60% пациентов, а полная ремиссия — у 14—16% больных, в то время как при монотерапии дексаметазоном частота общего ответа не превышала 24%, а полная ремиссия была достигнута лишь в 1—6% случа ев. Продолжительность периода до прогрессирования заболевания так же была выше после применения схемы леналидомид + дексаметазон: медиана — 11,3 мес против 4,7 мес. Более того, леналидомид оказался эффективным у пациентов, получавших ранее талидомид [62, 63].
Нейтропения и инфекции, а также тромбоцитопения и тромбоэмбо лические осложнения чаще наблюдались после применения леналидо мида. В связи с этим авторами были предложены конкретные профилак тические меры по предупреждению указанных осложнений (введение колониестимулирующего фактора, антикоагулянтов). Важным благо приятным фактором, сопровождавшим терапию леналидомидом, яви лась низкая частота полинейропатии, не превышавшая таковую у боль ных, получавших плацебо + дексаметазон.
По результатам клинических исследований ММ 009 и ММ 010, по казавшим достоверную противоопухолевую эффективность леналидо мида при удовлетворительной переносимости препарата, леналидо мид был разрешен для клинического применения в Северной Америке и Европе.
Двумя годами позже в публикациях, посвященных отдаленным ре зультатам исследований ММ 009 и ММ 010, были представлены еще бо лее четкие свидетельства высокой эффективности леналидомида у паци ентов с рецидивирующим и резистентным течением миеломы [64]. При медиане наблюдения за пациентами, равной 48 мес, медиана времени до прогрессирования составляла 13,4 против 4,6 мес (Р < 0,001), медиана длительности ответа на терапию — 15,8 против 7,0 мес (Р < 0,001), медиа на выживаемости без прогрессирования — 11,1 против 4,6 мес (Р < 0,001), медиана общей выживаемости — 38,0 против 31,6 мес (Р = 0,045). При этом было отмечено, что низкое содержание β2 микроглобулина в
548

Протокол диагностики и лечения множественной миеломы
сыворотке и плазматических клеток в костном мозге в момент назначе ния леналидомида ассоциируется с более продолжительной выживаемо стью пациентов.
Дальнейший анализ результатов исследований ММ 009 и ММ 010 позволил показать целесообразность более раннего назначения ленали домида при рецидиве ММ. Так, в работе Stadtmauer [65] сообщалось, что полный и очень хороший частичный ответ на лечение по схеме ленали домид + дексаметазон чаще удавалось достичь у пациентов, которым эти препараты назначали после одной линии предшествующей терапии, по сравнению с теми больными, которым ранее уже было проведено две или более линий терапии: 39,8% против 27,7% (Р = 0,028). При наблюдении в течение 15,5 мес за больными, у которых был достигнут ответ на тера пию, медиана продолжительности этого ответа не была достигнута в ко горте больных, ранее получивших одну линию терапии, в то время как в группе больных, ранее получавших две или более линий терапии, медиа на продолжительности ответа составила 13 мес. Время до прогрессирова ния (17,1 против 10,6 мес) и выживаемость без прогрессирования (14,1 против 9,5 мес) также подтверждали преимущества более раннего назна чения леналидомида.
Частота рецидивов ММ также отличалась в зависимости от того, на сколько рано была назначена схема леналидомид + дексаметазон. Так, рецидивы наблюдались реже у больных, получавших леналидомид сразу после 1 й линии терапии (38,2%), чем у больных, которым этот препарат назначали в качестве «терапии отчаяния» (45,6%).
Предыдущими клиническими исследованиями, сравнивавшими эф фективность талидомида и бортезомиба в сочетании с мелфаланом и преднизолоном (схема МРТ: мелфалан + преднизолон + талидомид и схема VMP) с золотым стандартом МР у первичных нелеченных больных ММ, были доказаны достоверные преимущества терапевтических схем, включавших новые препараты [46, 66]. Аналогичное исследование эф фективности и переносимости схемы леналидомид + мелфалан + пред низолон (MPR) было предпринято Palumbo с соавт. [67]: 44 пожилым первичным нелеченным больным с ММ назначали леналидомид, 10 мг с 1 го по 21 й день курса; мелфалан, 0,18 мг/кг, и преднизолон, 2 мг/кг, с 1 го по 4 й день. В результате лечения у 81% больных был достигнут час тичный ответ, у 47,6% больных — очень хороший частичный ответ и у 23,8% больных — полный иммунохимический ответ. В течение первого года наблюдения выживаемость без прогрессирования и общая выжи ваемость составили 92% и 100%. Связанных с лечением ранних леталь ных исходов не отмечалось. Авторы рассматривают схему MPR, вклю чающую таблетированные формы препаратов, как многообещающую для пожилых пациентов с ММ в качестве 1 й линии терапии.
Большой интерес вызвали результаты нового многоцентрового ран домизированного клинического исследования ММ 015 [68]. Это иссле дование посвящено изучению эффективности длительного применения леналидомида в качестве поддерживающего лечения после завершения индукционного этапа терапии (MPR R). В исследование было включено
549

Лимфопролиферативные заболевания
459 пациентов в возрасте от 65 до 75 лет, не рассматривавшихся в качест ве кандидатов на аутологичную трансплантацию. Авторы провели срав нение результатов трех схем лечения: МР, MPR и MPR R. При этом по сле индукции, включавшей фиксированное число курсов, равное 9, одна группа пациентов получала леналидомид по 10 мг/сут в виде 21 дневных курсов до прогрессирования заболевания. Оказалось, что поддерживаю щая терапия леналидомидом позволила снизить риск прогрессирования ММ на 68% и увеличить продолжительность выживаемости без прогрес сирования до 31 мес, в то время как в группах больных, получавших лече ние по схемам МР и MPR, медиана выживаемости без прогрессирования была вдвое короче — 12 и 15 мес.
Длительная поддерживающая терапия леналидомидом хорошо пере носилась пожилыми пациентами, не сопровождалась кумулятивной ток сичностью, и только 5% больных прервали лечение в связи с побочными эффектами препарата. Авторы предлагают рассматривать схему MPR R в качестве стандарта лечения пациентов, не являющихся кандидатами на аутотрансплантацию, поскольку ответ на лечение достигается уже после 2 курсов, а общая выживаемость в течение 3 лет составляет 73% против 65% у больных, получавших лечение по схеме МР.
Новое поколение ингибиторов протеосом и иммуномодуляторов
Противоопухолевая эффективность нового поколения ингибиторов протеосом и иммуномодуляторов (карфилзомиба и помалидомида) изу чается в международных клинических исследованиях II—III фазы. На 53 й ежегодной конференции Американского общества гематологов (ASH 2011) были представлены результаты применения этих препаратов как в 1 й линии терапии для нелеченных больных, так и при резистент ности опухоли. Обсуждались результаты терапии по таким схемам, как: карфилзомиб + леналидомид + дексаметазон или карфилзомиб + тали домид + дексаметазон, а также помалидомид + циклофосфамид + пред низолон или помалидомид + дексаметазон.
Настоящие и будущие клинические исследования позволят опреде лить роль и место этих препаратов в лечении ММ.
Трансплантация аллогенных стволовых кроветворных клеток
Несмотря на весьма обнадеживающие результаты аутологичных трансплантаций при ММ, их безопасность и возможность выполнения пациентам старшей возрастной группы (65 лет и более), основной про блемой этого метода лечения остается высокая частота рецидивов. Ука занные факты позволили клиническим исследователям перейти к сле дующему этапу интенсивной терапии ММ — трансплантации аллоген ных гемопоэтических клеток в надежде на повышение противоопухоле вого эффекта за счет реакции «трансплантат против опухоли». Первые публикации о применении аллогенной трансплантации у больных с ММ датируются серединой 1990 х гг. В большинстве исследований была по казана высокая эффективность данного метода для достижения полных
550

Протокол диагностики и лечения множественной миеломы
ремиссий (35—60%). Однако настораживающим моментом явилась вы сокая летальность, связанная с самой процедурой трансплантации (30— 50%), из за чего общая четырехлетняя выживаемость больных не превы шала 30% [69—71].
В настоящее время за счет более совершенной системы выхаживания больных в период тяжелых инфекционных и токсических осложнений, более эффективного контроля реакции «трансплантат против хозяина», тщательного отбора больных, а также использования новых режимов кондиционирования удалось снизить посттрансплантационную леталь ность. Так, применение предтрансплантационного кондиционирования пониженной интенсивности позволило уменьшить процент летальных исходов в первые 100 дней после аллогенной трансплантации до 5—10% за счет уменьшения частоты тяжелых инфекций, однако 20—25% боль ных все таки погибают в последующие сроки от хронической реакции «трансплантат против хозяина» [72, 73].
Таким образом, для больных с ММ аллогенная трансплантация явля ется эффективным, но небезопасным методом лечения. Если есть воз можность использовать данный вид терапии (при наличии совместимого донора), необходимо крайне тщательно отбирать больных с учетом воз раста (моложе 55 лет), удовлетворительного соматического статуса, а также факторов, ухудшающих прогноз при использовании других лечеб ных методик.
Алгоритм лечения ММ
I. Мероприятия, необходимые для установления диагноза ММ
1.Общий анализ крови с подсчетом лейкоцитарной формулы и числа тромбоцитов.
2.Биохимический анализ крови, включающий определение содержа ния (активности):
—общего белка;
—альбумина;
—креатинина;
—мочевой кислоты;
—общего билирубина;
—аминотрансфераз;
—калия;
—кальция;
—ЛДГ.
3.Иммунохимический анализ крови и мочи (качественное и количест венное определение парапротеина):
—электрофорез и иммунофиксация белков сыворотки и мочи;
—определение уровня поликлональных иммуноглобулинов;
—определение содержания β2 микроглобулина в сыворотке;
—определение содержания криоглобулинов и CРБ;
—определение свободных легких цепей при «неизмеряемом» забо левании.
551
Лимфопролиферативные заболевания
4.Пункция костного мозга (подсчет миелограммы).
5.Гистологическое (при необходимости — иммуногистохимическое) исследование трепанобиоптата и/или биоптата пораженного участка кости или мягкотканного образования.
6.Рентгенография скелета — черепа, костей таза, ребер, лопаток, всех отделов позвоночника, проксимальных отделов плечевых и бедрен ных костей (остальных костей — при наличии клинических показа ний).
7.МРТ при подозрении на поражение позвоночника и компрессию спинного мозга.
8.КТ или МРТ при костных и экстрамедуллярных плазмоцитомах.
9.Общий анализ мочи.
10.При наличии протеинурии — определение суточной потери белка с мочой.
11.Определение концентрационной способности почек по методу Зим ницкого.
12.Определение клиренса креатинина (проба Реберга).
13.Коагулограмма.
14.Маркеры вирусов гепатита В и С, вируса простого герпеса, цитомега ловируса, ВИЧ; реакция Вассермана.
15.ЭКГ.
16.УЗИ почек, печени, селезенки.
Дополнительные методы обследования
17.Цитогенетическое исследование костного мозга (стандартное, FISH).
18.Иммунофенотипическое исследование костного мозга (при несекре тирующей ММ обязательно).
19.Определение пролиферативного индекса плазматических клеток.
20.МРТ головного мозга.
21.ЭхоКГ.
22.Биопсия слизистой десны, желудочно кишечного тракта или аспира ция подкожного жира с последующей окраской конго красным на амилоидоз.
II. Схемы терапии, применяемые при лечении ММ
РAD
Бортезомиб |
1,3 мг/м2 в/в струйно в 1, 4, 8 и 11 й дни |
|
|
Доксорубицин |
9 мг/м2 в/в в виде постоянной инфузии или |
|
ежедневно болюсно в 1—4 й дни |
|
|
Дексаметазон |
40 мг в/в капельно или внутрь: |
|
в 1 м курсе — в 1—4 й и в 8—11 й дни |
|
в остальных курсах — только в 1—4 й дни |
|
|
Начало следующего курса на 22 й день от начала предыдущего
552
