
terapy / федер рекомендации / федер рекомендации / федеральные рекомендации / гематология / 04 - Лимфопролиферативные заболевания
.pdf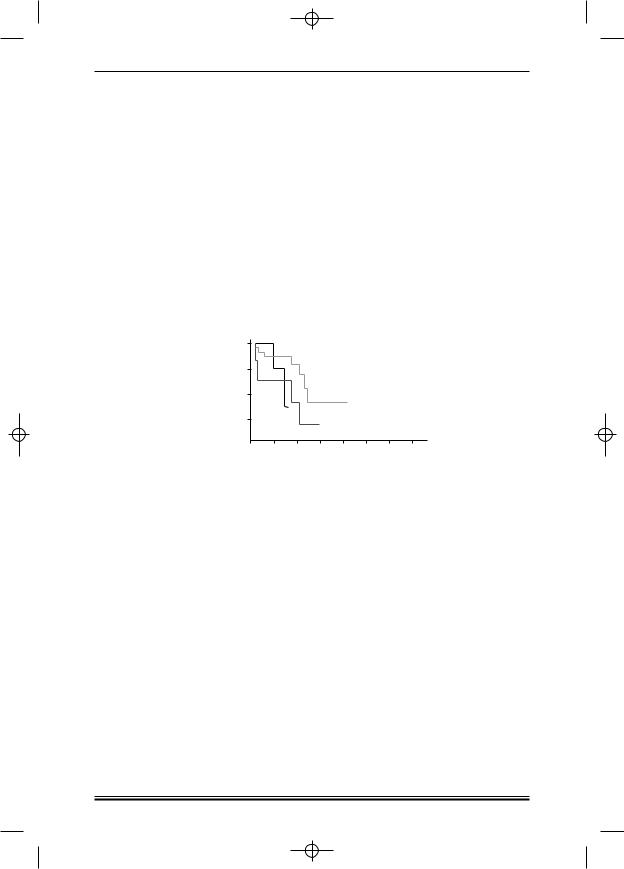
Протокол лечения фолликулярной лимфомы у больных из группы высокого риска
У пациентов, которым в качестве индукционной терапии было прове дено лечение по программе (R) F(M)C (13 больных), имело место преиму щественно генерализованное поражение, но отсутствовали опухолевые конгломераты размером более 7 см («bulky») — 10 пациентов (77%). Гене рализованное поражение и «bulky» были у 1 пациента (8%), генерализо ванное поражение и «bulky» в сочетании с одним или несколькими экстра нодальными очагами — у 2 больных (15%). По критериям FLIPI в группу низкого риска вошло 4 пациента (31%), среднего риска — 2 (16%), высоко го риска — 7 (53%). У большинства больных (10 пациентов, 77%) выявлена ФЛ II гистологической градации, у 2 (15%) — I, у 1 (8%) — III. Тип проли ферации опухоли был фолликулярным у 1 пациента (8%), нодулярным — у 4 (31%), нодулярно диффузным — у 5 (38%), диффузным — у 3 (23%). Пя тилетняя бессобытийная выживаемость при лечении курсами R CVP со ставила 42% (медиана 56 месяцев), R CHOP — 21% (медиана 39 месяцев). Трехлетняя бессобытийная выживаемость после терапии по программе R FMC составила 38% (медиана 32 месяца) (Р = 0,05) (рис. 2).
Бессобытийная |
выживаемость |
100%
75%
50%
31
25%
2
024 48 72 96 120 144 168 Месяцы после начала лечения
Рисунок 2. Бессобытийная выживаемость после курсов R CVP (1), R CHOP (2), R FMC (3).
Пациентам с ФЛ I и II гистологической градации в качестве индукци онной терапии назначали курсы R CHOP и R FMC в равном соотноше нии. Для пациентов с ФЛ III гистологической градации были выбраны преимущественно антрациклин содержащие курсы. Летальный исход был в 21 случае (26%) (медиана 24 месяца; 80% случаев в III—IV группах риска по критериям FLIPI). Десять больных (53% случаев с «bulky» в за брюшинном пространстве) умерли в результате прогрессии опухоли в за брюшинном пространстве в первые 4 года от установления диагноза (ме диана 47 месяцев). Летальность вследствие прогрессии опухоли не зави села от гистологической градации: II гистологическая градация была у 5 пациентов (50%), IIIА/В — у 5 пациентов (50%). Пятилетняя общая вы живаемость в группе с генерализованным поражением без «bulky» соста вила 98%, в группе с генерализованным поражением и «bulky» — 50% (медиана выживаемости 56 месяцев); различия в выживаемости между этими двумя группами статистически значимы (Р = 0,001) (рис. 3).
Вероятность летального исхода в первые 4 года от окончания лечения во второй группе оказалась в среднем в 10 раз выше, чем в первой (Р = 0,01).
603

Лимфопролиферативные заболевания
Общая выживаемость
100% 

80%
1
60%
40% |
2 |
Рисунок 3. Общая выживаемость в 20% Р = 0,001 группах с генерализованным пора  жением без «bulky» (1) и с генерали
жением без «bulky» (1) и с генерали
024 48 72 96 120 144 168 зованным поражением и «bulky» в
Месяцы после начала лечения |
забрюшинном пространстве (2). |
Все летальные исходы во второй группе произошли в течение первых 4 лет от окончания лечения (среднее время до летального исхода равно 42 меся цам). Пятилетняя бессобытийная выживаемость составила 58% (медиана 72 месяца) и 42% (медиана 48 месяцев) соответственно (Р = 0,05).
Полученные результаты позволяют предположить, что III FLIPI для ФЛ в сочетании с «bulky» в забрюшинном пространстве являются неза висимыми факторами неблагоприятного прогноза. Возможно, эта груп па больных нуждается в ранней интенсификации лечения. Пятилетняя общая выживаемость пациентов, получивших в качестве индукционных курсов R FMC, высока — 99%. Полученные результаты превышают дан ные зарубежных авторов [10]. Возможно, высокая общая выживаемость связана с тем, что у большинства больных (77%), несмотря на распро страненный процесс, не было «bulky». Генерализованное поражение и «bulky» отмечались в 8% случаев. В 15% случаев имело место генерализо ванное поражение и «bulky» в сочетании с экстранодальными очагами (легкие, поджелудочная железа). Возможно, экстранодальные опухоли прогностически благоприятны.
Протокол
Описание
Дизайн нашего протокола предполагает проведение индукционной терапии курсами R CHOP, а в случае их недостаточной эффективно сти — интенсификацию лечения курсами второй линии (DHAP), далее последовательную терапию высокими дозами циклофосфамида и этопо зида со сбором аутологичных стволовых клеток периферической крови, кондиционирование в режиме BEAM и ауто ТСКК.
В качестве факторов, определяющих показания к интенсификации химиотерапии, предлагается включить факторы неблагоприятного про гноза по критериям FLIPI (III группа риска), а также клинический фак тор — эффективность курсов R CHOP, оцениваемую по объему сокра щения опухоли.
Режим кондиционирования ВЕАМ выбран в связи с его высокой эф фективностью (двухлетняя общая выживаемость — 74%, безрецидивная выживаемость — 69%) [20].
604

Протокол лечения фолликулярной лимфомы у больных из группы высокого риска
Итак, предлагаемая в протоколе высокодозная терапия предполагает две фазы: I фаза — два курса R DHAP, включающие дексаметазон, 40 мг в 1—4 й дни курса, цитарабин, 2000 мг/м2 во 2 й день, и цисплатин, 100 мг/м2 в 1 й день, с применением филграстима. Режим R DHAP заим ствован из протокола последовательной высокодозной терапии и эффек тивен как при быстро, так и при медленно пролиферирующих опухолях.
Применение препаратов платины обеспечивает блокирование ряда механизмов лекарственной устойчивости, поэтому платиносодержащие курсы используются в качестве второй линии химиотерапии лимфом [21—22].
Два цикла индукционной терапии позволяют оценить химиочувстви тельность опухоли, которая является важным прогностическим факто ром [23].
Применение филграстима (препарата Г КСФ) обеспечивает сокра щение периодов цитопении, что позволяет увеличивать дозоинтенсив ность индукции [24].
Двойная индукция имеет преимущество перед первым сбором ство ловых клеток периферической крови — применяются основные цито статики, к которым не возникает перекрестная резистентность в корот кий промежуток времени [25].
Высокодозная терапия открывает возможности для интенсификации дозы с укорочением перерывов. На этом этапе в периферической крови определяются злокачественные, клоногенные клетки [26]. После введе ния высоких доз циклофосфамида возможен сбор CD34 позитивных клеток [27].
Циклофосфамид обладает высокой эффективностью в терапии реци дивных и рефрактерных лимфом [28], строгая циклоспецифическая ци тотоксичность отсутствует. In vitro препарату свойственна строгая дозо зависимость по отношению к лимфомным клеткам [29]. У пациентов с недостаточным количеством собранных после введения высоких доз циклофосфамида CD34 позитивных клеток проводятся цитаферезы по сле введения высоких доз этопозида.
На последнем этапе химиотерапии проводится миелоаблативная те рапия с кармустином, этопозидом, цитарабином и мелфаланом (BEAM). Курс BEAM показал хорошую эффективность при фолликулярной лим фоме [21, 23, 29].
После окончания лечения пациентам показана поддерживающая те рапия ритуксимабом. Минимальный срок поддерживающей терапии — 2 года от окончания химиотерапии.
Критерии включения в протокол
Возраст старше 18 лет. Верифицированный диагноз ФЛ. I—III градации (типы).
II—IV стадии ФЛ по Анн Арборской классификации (1971 г.). Информированное согласие больного.
605

Лимфопролиферативные заболевания
Критерии исключения из протокола
Застойная сердечная недостаточность, нестабильная стенокардия, тяжелые нарушения ритма и проводимости, инфаркт миокарда. Почечная недостаточность (уровень сывороточного креатинина бо лее 0,2 ммоль/л), кроме случаев специфического поражения почек. Печеночная недостаточность (кроме случаев специфического пора жения, обусловленного лейкемической инфильтрацией органа), ост рый гепатит или активная фаза хронического гепатита (сывороточ ный билирубин более 1,5 нормы, АЛТ и АСТ более 3 норм, протром биновый индекс менее 70%).
Тяжелая пневмония (дыхательная недостаточность — одышка более 30 дыхательных движений в минуту, артериальная гипоксемия — PaO2 менее 70 мм рт. ст.) при невозможности скомпенсировать ситуацию в течение 2—3 дней.
Сепсис (септикопиемические очаги, нестабильность гемодинамики); высокая лихорадка не должна служить поводом для задержки начала химиотерапии, так как может носить специфический характер.
Угрожающие жизни кровотечения (желудочно кишечные, кровоиз лияние в мозг), за исключением желудочно кишечных кровотечений на фоне специфического поражения органов при успешном консер вативном лечении.
Тяжелые психические нарушения (бред, тяжелый депрессивный син дром, другая продуктивная симптоматика).
Кахексия (уровень общего белка ниже 35 г/л), кроме случаев специ фического поражения печени.
Декомпенсированный сахарный диабет. Беременность.
Факторы неблагоприятного прогноза
В перечень включены следующие факторы неблагоприятного про гноза.
1.Быстрое (в течение 1—3 месяцев) увеличение объема опухоли.
2.В симптомы: лихорадка, потливость, не связанные с инфекцией.
3.Признаки трансформации в ДБККЛ, выражающиеся в преобладании крупных атипических клеток в отпечатках биоптата и биоптате опухо ли, нодулярно диффузном и диффузном характере пролиферации опухоли в биоптате.
4.Отсутствие ответа на индукционные курсы либо уменьшение разме ров опухоли менее чем на 50% (недостаточная эффективность первой линии терапии по программе R CHOP).
5.Быстрое увеличение размеров опухоли в межкурсовом перерыве, по
сле кратковременного эффекта, развившегося во время полихимио терапии.
Основной идеей предлагаемого в данном протоколе алгоритма тера пии является раннее применение высокодозной терапии с последующей
606
Протокол лечения фолликулярной лимфомы у больных из группы высокого риска
ауто ТСКК у больных из группы высокого риска. Выбор сроков начала высокодозной терапии определяется эффективностью курсов R CHOP.
В случае прогрессии опухоли после проведения 1—2 индукционных курсов R CHOP показана терапия по программе mNHL BFM 90, как при диффузной В крупноклеточной лимфоме.
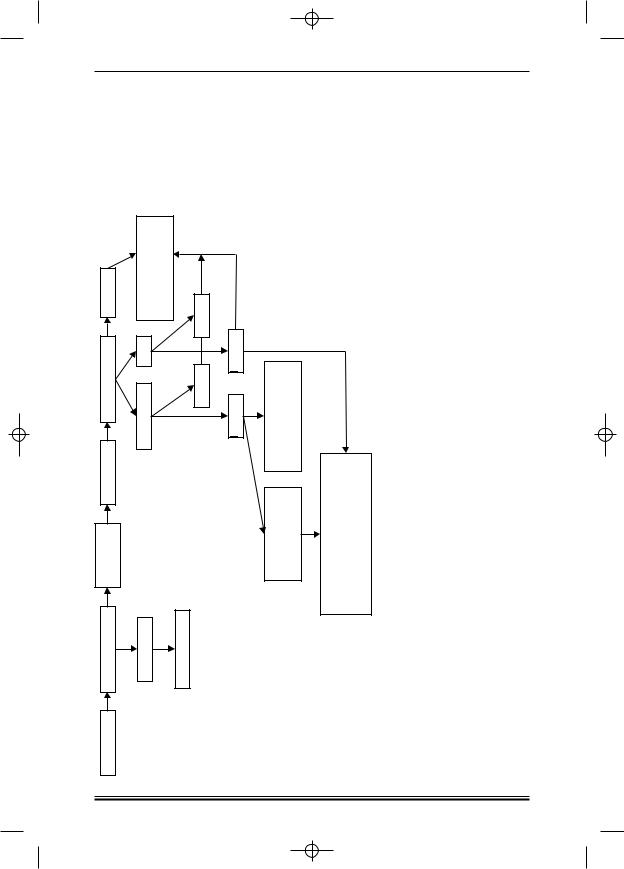
Схема протокола (рис. 4) |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Схема протокола. ПР — полная ремиссия; ПРн — недоказанная полная ремиссия; |
|
|
держивающаятера |
пияритуксимабом |
|
|
|
|
|
|
|
|
|
|
||
ПРиПРн |
CHOPR2+подx |
|
>60лет >60лет |
|
|
|
|
|
|
|
стволовые кроветворные клетки; ЦФ — циклофосфамид; ЧР — частичная ремиссия. |
|||
Рестадирование |
50—75%(ЧР) <50% |
|
60лет |
|
|
|
|
|
|
|||||
|
> |
Дополнительные Нетдополнительных |
|
|
|
|
|
|||||||
|
60лет |
неблагоприятные неблагоприятных |
факторы факторов |
|
|
|
||||||||
2x |
|
|
> |
|
|
BEAM,ТСКК,аутоподдержи вающаятерапияритуксимабом |
||||||||
CHOPR |
|
|
DHAP,Rвведениевысоких |
,курс |
||||||||||
|
|
+ |
||||||||||||
Отсутствие прогрессии |
|
|
дозЦФ,сборСКК34 |
|||||||||||
Рестадирование2x |
Прогрессия |
90BFMmNHL |
||||||||||||
CHOPR |
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок |
СКК — |
607

Лимфопролиферативные заболевания
Критерии эффективности терапии при фолликулярной лимфоме (International Working Group to Standardize Response Criteria in NHL, 1999) и определение понятий
Полная ремиссия (ПР, CR)
Отсутствие проявлений болезни (клинически и по данным обследо вания).
Отсутствие обусловленных болезнью В симптомов (снижение массы тела, повышенная потливость, выраженная общая слабость, повыше ние температуры тела без видимых очагов инфекции), нормализация уровня ЛДГ.
Сокращение размеров лимфоузлов и конгломератов лимфоузлов до «нормальных»: при исходных размерах > 1,5 см сокращение до 1,5 см, при исходных размерах > 1,1—1,5 см — сокращение до 1,0 см (или бо лее чем на 75% общей массы).
Уменьшение размеров всех ранее увеличенных органов.
Отсутствие специфического поражения костного мозга при повтор ном исследовании биоптата/аспирата (цитология, гистология, имму ногистохимия, отсутствие В клеточной клональности).
Недоказанная полная ремиссия (ПРн, CRu — unconfirmed)
Отсутствие признаков болезни, определяемых клинически и объек тивными методами обследования.
Остаточные лимфоузлы размером 1,5 см в максимальном диаметре должны быть результатом регрессии более чем на 75%.
Конгломераты лимфоузлов должны сократиться более чем на 75% (сокращение объема опухолевой массы).
Уменьшение размеров всех ранее увеличенных органов.
Данные исследования костного мозга интерпретируются как «неоп ределенные» («indeterminate»).
Частичная ремиссия (ЧР, PR)
Уменьшение объема опухоли одной из локализаций более чем на 50% и/или отсутствие костномозговой ремиссии по данным исследования трепанобиоптата.
Отсутствие увеличения размеров других лимфоузлов и ранее увели ченных органов.
Отсутствие новых признаков болезни.
Стабилизация (SD) Рецидив (RD) Прогрессирование (Пр, PD)
Минимальная остаточная болезнь (МОБ) при поражении костного мозга — постоянно определяемая остаточная популяция опухолевых клеток, вы явить которую можно лишь с помощью новых высокочувствительных мо
608

Протокол лечения фолликулярной лимфомы у больных из группы высокого риска
лекулярно генетических методов: определение В клеточной клонально сти методом ПЦР и определение t(14;18).
Остаточная опухоль — постоянно определяемое остаточное образова ние, не сокращающееся в размерах от курса к курсу, не накапливающее контрастное вещество при проведении КТ и аваскулярное по данным УЗИ.
Основной метод оценки полноты достижения ремиссии — КТ. В сложных случаях предполагается (не строго обязательно) проведение по зитронно эмиссионной томографии (ПЭТ).
Обследование перед началом терапии
В течение 14 дней
Вирусы гепатитов и их репликация, ВИЧ.
Иммунохимический анализ сыворотки и мочи.
Биопсия лимфоузла (и/или органа при экстранодальном пораже нии) с гистологическим, цитологическим, иммунофенотипическим (иммуногистохимическим), цитогенетическим, молекулярно био логическим исследованиями. При поступлении пациента после опе рации (биопсии) со стеклами и блоками диагноз устанавливается на основании гистологического и иммуногистохимического исследо ваний биопсийного материала, возможно проведение FISH на гис тологических срезах парафиновых блоков. В случае наличия асцита и/или плеврита при общем крайне тяжелом состоянии больного в отсутствие периферической лимфаденопатии возможна постановка диагноза на основании цитологического, иммунофенотипического, цитогенетического исследований асцитической (плевральной) жид кости.
ЭКГ.
Эхокардиография.
Рентгенография грудной клетки.
Консультация гинеколога. Криоконсервирование спермы.
В течение 7 дней
УЗИ брюшной полости, почек, малого таза.
КТ области шеи, грудной клетки, брюшной полости, полости таза.
Фиброэзофагогастродуоденоскопия (ФГДС), фиброколоноскопия (ФКС) при появлении клинической симптоматики или выявлении патологии при КТ брюшной полости; всем пациентам старше 50 лет. В случае невозможности проведения эндоскопических исследований
(тяжесть состояния пациента или другие причины) — связаться с иссле дователем.
В течение 3 дней
Общий анализ крови: лейкоцитарная формула, СОЭ, ретикулоциты, цитология.
609

Лимфопролиферативные заболевания
Биохимический анализ крови: общий белок и фракции, креатинин, мочевина, мочевая кислота, билирубин, аминотрансферазы, ЩФ, ЛДГ, обмен железа, обмен электролитов.
Коагулограмма: АЧТВ, протромбин, тромбиновое время, фибрино ген.
Трепанобиопсия с аспирацией костного мозга. Иммунофенотипи рование и кариотипирование клеток костного мозга при его пораже нии.
Общий анализ мочи. Проба Реберга.
Терапевтическая тактика в ходе терапии по программе R CHOP c последующей высокодозной полихимиотерапией
Курс R CHOP проводится в течение пяти дней.
В день 0 вводится ритуксимаб (Мабтера). Доза препарата для взрос лых больных составляет 375 мг/м2. Необходимое количество препарата набирают в асептических условиях и разводят до расчетной концентра ции (1—4 мг/мл) в инфузионном контейнере с 0,9% раствором натрия хлорида для инфузий или 5% раствором глюкозы (растворы должны быть стерильными и апирогенными). Перемешивают содержимое флакона, аккуратно переворачивая контейнер во избежание пенообразования. Так как Мабтера не содержит консервантов, приготовленный раствор необходимо использовать немедленно. Мабтеру вводят внутривенно, ка пельно, медленно, через отдельный катетер.
Нельзя вводить в/в болюсно или в виде в/в инъекций. Рекомендуемая начальная скорость первой инфузии — 50 мг/ч, в
дальнейшем ее можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч. Последующие инфузии можно начи нать со скорости 100 мг/ч и увеличивать ее на 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч.
Перед каждой инфузией Мабтеры необходимо проводить премедика цию (анальгетик/антипиретик, например кетопрофен; антигистамин ный препарат, например клемастин или дифенгидрамин). Если Мабтера не применяется в комбинации с химиотерапией, содержащей глюкокор тикоиды, то в состав премедикации также входят дексаметазон или пред низолон.
С 1 го по 5 й дни проводится курс CHOP:
Циклофосфамид, 750 мг/м2 в/в капельно, день 1.
Доксорубицин, 50 мг/м2 в/в капельно, день 1.
Винкристин, 2 мг в/в струйно, день 1.
Преднизолон, 100 мг в сутки внутрь, дни 1—5. При наличии гастрита, язв в ЖКТ или трудностей, сопряженных с необходимостью приема большого количества таблеток, преднизолон можно вводить внутри венно в той же дозе.
Начало очередного курса — на 21—22 й день от начала предыдущего. Последовательная высокодозная полихимиотерапия:
610

Протокол лечения фолликулярной лимфомы у больных из группы высокого риска
Дни l—4 |
Дексаметазон |
40 мг всего (дни 1—4) |
|
Цитарабин |
2000 мг/м2 (2 раза в сутки через 12 часов, день 2) |
|
Цисплатин |
100 мг/м2 (24 часовая инфузия, день 1) |
Дни 15—18 |
Дексаметазон |
40 мг всего (дни 1—4) |
|
Цитарабин |
2000 мг/м2 (2 раза в сутки через 12 часов, день 2) |
|
Цисплатин |
100 мг/м2 (24 часовая инфузия, день 1) |
Рестадирование (КТ, УЗИ, контрольная трепанобиопсия при первичном вовлечении костного мозга с определением В клеточной клональности методом ПЦР).
Без изменений или прогрессия: снятие с протокола
День 37 |
Циклофосфамид |
4000 мг/м2 (8 часовая инфузия) |
|
|
Сбор CD34+ Минимальное количество 2 × 106/кг |
||
|
|
|
|
|
|
300 мг/м2 |
|
|
|
|
|
Дни 58—63 |
Кармустин |
(день 58) |
|
|
Этопозид |
150 мг/м2 |
(каждые 12 часов, дни 59—62) |
|
Цитарабин |
200 мг/м2 |
(каждые 12 часов, дни 59—62) |
|
Мелфалан |
140 мг/м2 |
(день 63) |
День 64: ТКМ — CD34+, минимум 2 × 106/кг
В случае если после введения высоких доз циклофосфамида собрано недостаточное количество CD34 позитивных клеток периферической крови, то, в отсутствие цитопении в периферической крови и выражен ной гипоплазии костного мозга в трепанобиоптате, показана терапия большими дозами этопозида с повторной процедурой сбора аутологич ных СКК:
Дни 58—61 |
Этопозид |
500 |
мг/м2 (дни 58—61) |
|||
|
|
Сбор CD34+ Минимальное количество 2 × 106/кг |
||||
|
|
|
|
|
|
|
|
|
|
мг/м2 |
|
||
|
|
|
|
|
||
Дни 80—85 |
Кармустин |
300 |
(день 80) |
|||
|
Этопозид |
150 |
мг/м2 |
(каждые 12 часов, дни 81—84) |
||
|
Цитарабин |
200 |
мг/м2 |
(каждые 12 часов, дни 81—84) |
||
|
Мелфалан |
140 |
мг/м2 |
(день 85) |
||
День 86: ТКМ — CD34+, минимум 2 × 106/кг
611

Лимфопролиферативные заболевания
Сопроводительная терапия
Под термином «сопроводительная терапия» подразумевается ком плекс терапевтических мероприятий, позволяющий предотвратить или уменьшить осложнения, вызываемые цитостатической терапией.
Профилактика синдрома распада опухоли
Синдром распада опухоли — сложный патогенетический комплекс, включающий электролитные, метаболические нарушения, мочекислую канальцевую нефропатию. При массивном распаде опухолевых клеток происходит высвобождение калия, фосфора, продуктов распада пуринов (ксантина, гипоксантина и мочевой кислоты), что приводит к развитию гиперкалиемии, гиперфосфатемии, гиперурикемии и гипокальциемии, а также возникновению и прогрессированию метаболического ацидоза. При проведении курса R CHOP данные осложнения встречаются редко, однако нужно соблюдать ряд правил.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты, ингибируя ксантиноксидазу и снижая образование уратов в сы воротке. Аллопуринол назначается внутрь в дозе 300 мг в сутки в течение 5 дней химиотерапии на каждом курсе.
Контроль электролитов (особенно калия и кальция), креатинина, мо чевины, мочевой кислоты, общего белка, альбуминов, фосфатов, pH мо чи — до полихимиотерапии и на второй день после нее.
Контроль диуреза, баланса жидкости. При недостаточном мочевыде лении — стимуляция фуросемидом в дозе 1—10 мг/кг, при гипоальбуми немии — нормализация уровня альбумина.
Взвешивание пациента до начала терапии и перед началом каждого курса.
Прием преднизолона
С целью профилактики ульцерогенного действия глюкокортикоидов на весь период терапии глюкокортикоидами назначают перорально Н2 блокаторы (ранитидин, 150 мг 2 раза в день, или фамотидин, 20 мг 2 раза в день или 40 мг 1 раз в день) либо ингибиторы протонного насоса (омепразол, 20 мг 2 раза в день, или эзомепразол, 40 мг 1 раз в день, или рабепразол, 20 мг 1 раз в день), а также антациды (Маалокс, по 1 пакетику 3 раза в день, или Алмагель, по 1 столовой ложке 3 раза в день, или Фос фалюгель, по 1 пакетику 3 раза в день).
При доказанном специфическом поражении желудка, а также при на личии в анамнезе осложненной язвенной болезни желудка или двена дцатиперстной кишки (кровотечение, перфорация, пенетрация) показа но внутривенное введение преднизолона. В этом случае назначаются вместе и Н2 блокаторы (фамотидин, 20 мг в/в капельно в 250 мл физио логического раствора за 30 мин), и ингибиторы протонного насоса (омепразол, 20 мг в/в капельно в 250 мл физиологического раствора за 30 мин или в/в струйно), желательно их внутривенное введение.
Обязателен контроль уровня глюкозы крови до начала приема глюко кортикоидов. Если отмечено повышение показателей — ежедневный
612
