
- •В. С. Корзанов, н. П. Шульгина химия редких, рассеянных и редкоземельных элементов
- •Корзанов в.С. , Шульгина н. П.
- •1. Введение
- •2. Химия скандия
- •2. 1. Минералы, руды, месторождения скандия
- •2. 2. Физические и химические свойства
- •2. 3. Кислородсодержащие соединения
- •2. 4. Соли кислородсодержащих кислот
- •2. 5. Соли органических кислот
- •2. 6. Соединения с галогенами
- •2. 7. Другие бескислородные соединения
- •2. 8. Методы отделения скандия от примесей
- •2. 8. 1. Методы осаждения
- •2. 8. 2. Конденсация и сублимация
- •2. 8. 3. Ионный обмен
- •2. 8. 4. Экстракция
- •2. 9. Получение металлического скандия
- •2. 10. Области применения скандия
- •3. Химия редкоземельных элементов
- •3. 1. История открытия лантанидов
- •3. 2. Распространенность в природе и изотопный состав
- •3. 3. Электронная структура атомов и ионов лантанидов
- •3. 4. Физические и химические свойства y и рзэ
- •3. 5. Соединения с кислородом
- •3. 6. Соли кислородсодержащих кислот
- •3. 7. Соли органических кислот
- •3. 8. Соединения с галогенами
- •3. 9. Другие бескислородные соединения рзэ
- •3. 10. Комплексные соединения
- •3. 11. Области применения рзэ
- •3. 12. Минералы и руды рзэ
- •4. Химия ванадия
- •4. 1. История открытия
- •4. 2. Минералы, руды и месторождения
- •4. 3. Физические и химические свойства
- •4. 4. Кислородсодержащие соединения
- •4. 5. Соединения с галогенами
- •4. 6. Соединения с другими неметаллами
- •4. 7. Органические комплексные соединения
- •4. 8. Получение металлического ванадия
- •4. 9. Области применения
- •Рекомендуемый библиографический список
- •Учебное издание
3. 10. Комплексные соединения
РЗЭ способны к образованию комплексных соединений. В качестве лигандов в комплексах могут выступать как неорганические, так и органические соединения. Способность к образованию комплексов и их устойчивость возрастает с увеличением атомного номера элемента или с уменьшением ионного радиуса (от LaкLu). Современные методы выделения и разделенияSc,Yи РЗЭ широко используют различие в устойчивости и растворимости их комплексных соединений с органическими веществами.
Особенности строения ионов РЗЭ, связанные с их значительными размерами, замкнутой наружной электронной оболочкой (5s25p6), трудной доступностью 4f-орбиталей, приводят к тому, что химическая связь в комплексных соединениях РЗЭ близка к ионному типу. По своим свойствам комплексы РЗЭ напоминают комплексные соединения иттрия, лантана и скандия, а в ряде случаев – щелочноземельных элементов. Вместе с тем наличие у РЗЭ 4f-электронов придает им ряд особенностей, в частности – наличие частично ковалентной связи, образующейся за счет взаимодействия орбиталей лигандов как с 4f-, так и с 6s-орбиталями.
Для комплексов РЗЭ наиболее характерно координационное число (КЧ) 6, однако существуют соединения с КЧ 8 и 9. В кристаллических соединениях РЗЭ часто проявляют КЧ = 9, но встречаются и 7, 8, 10, 12. На ряду с Ln3+комплексные соединения образуют иCe4+,Eu2+,Sm2+.
В виде сольватов с 3–4 молекулами тетрагидрофурана были получены боранаты (тетрагидридобораты)Ln(ВН4)3РЗЭ отSmдоLu. При 100°С в вакууме они теряют половину сольватных молекул, а около 200°С разлагаются. Для церия известен желтыйтетрагидридоалюминатСе[АlН4]3, медленно разлагающийся при обычных температурах и самовоспламеняющийся на воздухе.
Интересны получаемые взаимодействием NаС5Н5сLnСl3в тетрагидрофуранециклопентадиенильные производныеLn(С5Н5)3, некоторые характеристики которых в зависимости от природы атомаLnприведены в табл. 3. 13.
Обращает на себя внимание последовательное снижение температур плавления по мере уменьшения радиуса Ln3+. В вакууме приведенные соединения возгоняются около 200°С. Вместе с тем аналогичное по составу золотисто-коричневое производное европия неустойчиво в вакууме уже выше 100°С.
Взаимодействием циклопентадиена с раствором европия в жидком аммиаке был получен его желтый дициклопентадиенил – Еu(C5H5)2. Он около 430°С возгоняется в высоком вакууме, но очень чувствителен к воздуху и влаге. Был получен иYb(С5Н5)2.
Таблица 3. 13. Цвет и значения температуры плавления циклопентадиенильных некоторых лантанидов
|
Соединение |
Цвет |
tпл., ºС |
|
Ce(C5H5)3 Pr(C5H5)3 Nd(C5H5)3 Sm(C5H5)3 Gd(C5H5)3 Dy(C5H5)3 Er(C5H5)3 Yb(C5H5)3 |
желтый бледно-зеленый бледно-синий оранжевый бесцветный желтый розовый темно-синий |
435 415 380 365 350 302 285 273 |
Производные со степенью окисления ноль известны для Се, ЕuиYbв виде комплексов сдипиридиломсоставаLn(Diру)4. Интересно, что по координационному числу центрального атома они отличаются от аналогичных производных скандия и иттрия.
Соединения с комплексонами. Комплексонами называют группу α-аминополикарбоновых кислот, у которых два или три атома водорода при атомах азота замещены алкилкарбоксильными группами. Комплексоны образуют с катионами РЗЭ и других металлов комплексные соединения, называемые «хелатами» - клешневидными. Хелаты являются комплексами анионного типа, в которых связь осуществляется через атомы азота и атомы кислорода карбоксильных группировок. Устойчивость хелатов увеличивается отLaкLu.
Промышленное применение комплексоны нашли при разделении РЗЭ методом ионного обмена. В качестве элюантов (образующих комплекс агентов) применяют этилендиаминтетрауксусную, нитрилтриуксусную, этилентриаминпентауксусную кислоты. В аналитической химии наиболее удобным для определения РЗЭ считается комплексонометрическое титрование трилоном Б (динатриевая соль этилендиаминтерауксусной кислоты).
Этилендиаминтетраацетаты. Этилендиаминтетрауксусная кислотаC10H16O8N2
![]()
Встречаются следующие обозначения этой кислоты: H4ЭДТА, ЭДТА, ЭДТУК, ЭДТК, в уравнениях – Н4А, Н4V. В растворе РЗЭ с ЭДТА образуют комплексы состава [LnЭДТА]ˉ, протонированные комплексы [HLnЭДТА]º, гидроксокомплексы [LnЭДТА(OH)]2ˉ. Состав комплексов зависит от рН среды и изменяется с его повышением:
[HLnЭДТА]º![]() [LnЭДТА]ˉ
[LnЭДТА]ˉ![]() [LnЭДТА(OH)]2ˉ.
[LnЭДТА(OH)]2ˉ.
[HLnЭДТА]º – комплексная кислота, которая легко диссоциирует на Н+и [LnЭДТА]ˉ.
Показатели констант диссоциации pKакислотHLnV:La3+- 2,0,Nd3+- 2,5; 2,0; 3,7,Sm3+- 2,6; 2,2,Eu3+- 2,6,Gd3+-2,7; 2,0,Tb3+- 2,6,Dy3+- 2,0,Ho3+- 2,7,Er3+- 2,8,Tm3+- 2,6,Yb3+- 2,7,Lu3+- 2,5,Y3+- 1,7.
Состав образующихся комплексов зависит не только от рН раствора, но и концентрации реагентов. При избытке иона РЗЭ образуются комплексы Ln2V2+, при увеличении концентрации ЭДТА – [LnV2]5ˉ. В щелочной среде образуются малорастворимые комплексыLn2V(OH)2, которые растворяются в растворе щелочи в присутствии ионов [LnV]ˉ.
В твердом состоянии могут быть получены соединения состава HLnV·nH2Oпри взаимодействии ЭДТА с оксидом или солью РЗЭ, взятых в эквимолярных количествах. Эти соединения представляют собой мелкокристаллические осадки, содержащие различное число молекул воды и относительно мало растворимые в воде. Соединения РЗЭ цериевой подгруппы выделяются в виде гексагидратов ниже 50ºС. Обезвоживаются гексагидраты при 100-110ºС. Высушенные при 110ºС хелаты РЗЭ цериевой подгруппы отLnдоSmвключительно содержат одну молекулу воды. При удалении ее вещество становится рентгеноаморфным. Безводные соединения выделяются из кипящих растворов. Растворимости гидратированных и дегидратированных комплексов значительно различаются: обезвоженные при 100ºС комплексы РЗЭ с ЭДТА растворяются лучше, чем гексагидраты; последние растворяются лучше, чем безводные соединения, полученные из кипящих растворов. Комплексы аналогичного состава РЗЭ иттриевой подгруппы выделяются всегда в виде гидратов переменного состава. После высушивания при 110ºС они полностью обезвоживаются, но структура их при этом сохраняется.
У комплексов [LnV]ˉ цериевой подгруппы во внутреннюю сферу входят два атома азота и три карбоксильные группы; у элементов иттриевой подгруппы – все четыре карбоксильные группы.
При растворении оксидов или карбонатов РЗЭ в щелочном растворе ЭДТА или при растворении комплексной кислоты HLnVв растворе аммиака или щелочи образуются соединенияMeLnV·nH2O(где Ме –K+,Na+,Li+,NH4+). Все гидратированные соли, кроме солей аммония, легко теряют воду. Безводные соединения устойчивы до 350ºС.
Из табл. 3. 14 видно, что растворимость главным образом повышается при увеличении радиуса катиона, находящегося во внешней сфере комплекса. В ряду от LaкSmрастворимость уменьшается, а отGdкErувеличивается.
Таблица 3. 14. Растворимость комплексных солей РЗЭ с ЭДТА состава MeLnV·5H2Oв воде, г/л
|
t,ºC |
Me |
La |
Ce |
Pr |
Nd |
Sm |
Gd |
Dy |
Er |
Yb |
Y |
|
20
|
Na+ K+ NH4+ |
120 58 --- |
28 --- --- |
18 20 --- |
12 18 --- |
11 18 --- |
12 26 86 |
46 86 --- |
196 207 --- |
--- 167 --- |
97 220 --- |
|
25
|
Na+ K+ NH4+ |
139 182 --- |
70 --- --- |
42 66 --- |
31 53 --- |
29 54 --- |
36 81 240 |
133 273 --- |
450 435 --- |
--- --- --- |
260 443 --- |
|
35
|
Na+ K+ NH4+ |
--- 292
|
--- ---
|
--- ---
|
49 90 |
43 96 |
56 126 |
199 403 |
589 550 |
--- --- |
342 523 |
Получены комплексные соли Me(II)[YЭДТА]·10H2O. Выделены соединенияLn[LnЭДТА]3·nH2O. Эти комплексы легко образуются при взаимодействии стехиометрических отношений оксидов РЗЭ с ЭДТА. Выделить их можно после упаривания или добавления ацетона.
Другим примером комплексона является гидроксоэтилендиаминтриуксусная кислота (НЭДТА или H3R):
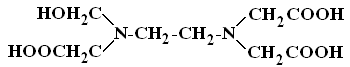
Она образует с РЗЭ соединения эквимолярного состава:
Ln3++H3R↔LnR+ 3H+.
В щелочной среде происходит гидролиз с образованием комплекса [LnR(OH)]ˉ. СоединенияLnR∙nH2Oвыделены при взаимодействии карбонатов РЗЭ с НЭДТА. Они хорошо растворяются в воде.
Нитрилтриацетаты.С нитрилтриуксусной кислотой (условное обозначениеNТА, Н3Х,H3V) РЗЭ при низких рН образуют комплексыLnX
Ln3++HX2ˉ ↔LnX+H+.
При рН < 4 возможно частичное образование комплексных ионов [LnH(X)]+, [LnH2X]2+, [LnH2X2]ˉ.
При рН > 4 образуются комплексы [LnX2]3ˉ
LnX+HX2ˉ ↔ [LnX2]3ˉ +H+.
В щелочной среде образуются гидроксокомплексы
LnX+OHˉ ↔ [LnX(OH)]ˉ.
В твердом состоянии выделены LnX∙nH2O(гдеn= 3 и 5 дляLa,Nd,Pr,Smиn= 4 дляSm,Gd,Y,Er,Yb). Растворимость некоторых кристаллогидратов в воде при 25ºС (г/л в расчете наLn2O3):LaNTA·5H2O– 0,2,LaNTA∙3H2O– 0,1,PrNTA∙5H2O– 0,3-0,4,NdNTA∙5H2O– 0,3-0,4,YNTA∙4H2O– 0,15-0,25. Тетрагидраты обезвоживаются при нагревании до 200ºС, тригидраты – до 225-300ºС. После обезвоживания вещества рентгеноаморфны.
Предполагается, что во внутреннюю сферу комплекса вместе с ионом РЗЭ входят атом азота и атомы кислорода двух карбоксильных групп; третья карбоксильная группа находится во внешней сфере. Связь РЗЭ с карбоксильной группой в большинстве случаев ионная, связь Ln-Nносит донорно-акцепторный характер.
Диэтилентриаминпентаацетаты. Диэтилентриаминпентауксусная кислота (ДТРА)
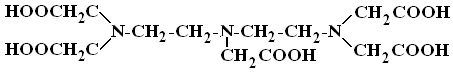
образует с РЗЭ комплексы эквимолярного состава [LnДТРА]2ˉ и комплексы, в которых на два иона РЗЭ приходится один кислотный остаток ДТРА (дляNd). ДляSmобнаружено три комплекса – [Sm2ДТРА]+, [HSmДТРА]ˉ, [SmДТРА]2ˉ, дляEu- [Eu2ДТРА]+, [EuДТРА]2ˉ. Предполагают, что во внутреннюю сферу комплексов входят три атома азота и три атома кислорода карбоксильных групп. Очевидно, две карбоксильные группы остаются во внешней сфере.
Соединения с фосфорорганическими кислотами. ДиалкилфосфатыРЗЭ – твердые вещества составаLnA3, где Аˉ – анион диалкилфосфорной кислоты (RO)2POOH.
Три низших диалкилфосфата (метил-, этил-, пропил-) РЗЭ получают, растворяя карбонаты лантанидов в водном растворе соответствующей кислоты.
Дибутил- и диамилфосфаты получают, смешивая водные растворы солей РЗЭ с водными растворами диалкилфосфатов натрия.
Диалкилфосфаты разлагаются щелочами до гидроксидов РЗЭ и диалкилфосфатов щелочных элементов. Формула диалкилфосфата – ((RO)2POO)3Ln.
Растворимость этих соединений в воде убывает с возрастанием атомного номера элемента и увеличением длины алкильного радикала в кислоте. Устойчивость возрастает от LaкLuи с увеличением длины алкильного радикала.
Растворимость дибутилфосфатов РЗЭ в органических растворителях меньше, чем в воде. С введением в органический растворитель дибутилфосфорной кислоты растворимость значительно повышается, что связано с образованием соединений Ln(HA2)3. Диалкилфосфорные кислоты используются как экстрагенты РЗЭ.
Соединения с нейтральными фосфорорганическими реагентами. Для экстракции РЗЭ применяются нейтральные эфиры фосфорсодержащих кислот. Широко применяющийся экстрагент – трибутилфосфат (ТБФ) (C4H9O)3PO, образующий с РЗЭ сольватыLn(NO3)3∙3ТБФ при экстракции изHNO3(< 7М). Указанные соединения хорошо растворяются во многих неводных растворителях.
При экстракции РЗЭ из сильнокислых сред (> 7 М HNO3) образуется комплексHn[Ln(NO3)3+n]x∙ТБФ.
С другими нейтральными фосфорорганическими соединениями - дибутилбутилфосфонатом (ДББФ), триоктилфосфиноксидом (ТОФО) в азотнокислой среде предположительно образуются комплексы Ln(NO3)3∙3S(S– молекула нейтрального фосфорорганического соединения). Во всех указанных соединениях связь осуществляется через фосфорильную группу Р=О.
Соединения с кетонами. Монокетоны образуют с солями РЗЭ сольваты. Попытки выделить комплексы с монокетонами были неудачными. β-Дикетоны с соединениями РЗЭ взаимодействуют по схеме:
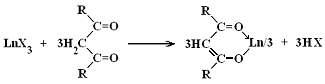
Для экстракционного разделения РЗЭ могут использоваться комплексы с теноилтрифторацетоном (ТТА). РЗЭ экстрагируются НТТА в неводную фазу в виде сольватированных комплексов Ln(ТТА)3Sx(гдеS– молекула нейтрального фосфорорганического соединения). Добавление фосфорорганических соединений значительно повышает экстракционную способность за счет образования устойчивых смешанных комплексов.
