
- •В. С. Корзанов, н. П. Шульгина химия редких, рассеянных и редкоземельных элементов
- •Корзанов в.С. , Шульгина н. П.
- •1. Введение
- •2. Химия скандия
- •2. 1. Минералы, руды, месторождения скандия
- •2. 2. Физические и химические свойства
- •2. 3. Кислородсодержащие соединения
- •2. 4. Соли кислородсодержащих кислот
- •2. 5. Соли органических кислот
- •2. 6. Соединения с галогенами
- •2. 7. Другие бескислородные соединения
- •2. 8. Методы отделения скандия от примесей
- •2. 8. 1. Методы осаждения
- •2. 8. 2. Конденсация и сублимация
- •2. 8. 3. Ионный обмен
- •2. 8. 4. Экстракция
- •2. 9. Получение металлического скандия
- •2. 10. Области применения скандия
- •3. Химия редкоземельных элементов
- •3. 1. История открытия лантанидов
- •3. 2. Распространенность в природе и изотопный состав
- •3. 3. Электронная структура атомов и ионов лантанидов
- •3. 4. Физические и химические свойства y и рзэ
- •3. 5. Соединения с кислородом
- •3. 6. Соли кислородсодержащих кислот
- •3. 7. Соли органических кислот
- •3. 8. Соединения с галогенами
- •3. 9. Другие бескислородные соединения рзэ
- •3. 10. Комплексные соединения
- •3. 11. Области применения рзэ
- •3. 12. Минералы и руды рзэ
- •4. Химия ванадия
- •4. 1. История открытия
- •4. 2. Минералы, руды и месторождения
- •4. 3. Физические и химические свойства
- •4. 4. Кислородсодержащие соединения
- •4. 5. Соединения с галогенами
- •4. 6. Соединения с другими неметаллами
- •4. 7. Органические комплексные соединения
- •4. 8. Получение металлического ванадия
- •4. 9. Области применения
- •Рекомендуемый библиографический список
- •Учебное издание
3. 8. Соединения с галогенами
Таблица. 3.9. Значения теплот образования галогенидов Laи лантанидов
|
Элемент |
Энергия образования, кДж/моль | ||
|
Cl |
Br |
I | |
|
La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu |
1072 1059 1055 1030 1022 1000 1005 992 988 976 959 959 963 955 |
925 913 900 888 867 858 850 837 825 --- 800 795 812 --- |
657 653 641 628 624 637 620 616 603 595 586 577 544 557 |
Из галогенидов лантанидов (LnГ3) фториды малорастворимы в воде. Теплоты образования СеF3и РrF3равны соответственно 1716,6 и 1683,1 кДж/моль. Практическое значение имеет главным образом СеF3, применяемый в производстве углей для дуговых ламп (его добавка резко повышает яркость свечения). При сильном нагревании на воздухе фторидыLnF3переходят сперва в оксофторидыLnОF, а затем в соответствующие оксиды. В расплавах они образуют с фторидами щелочных металлов комплексы М3[LnF6], устойчивость которых возрастает по мере уменьшения радиусаLn3+и увеличения радиуса М+. Были получены также комплексные фториды составаNаLnF4. Для константы диссоциации ионаGdF2+дается значение 1∙10-4.
Как видно из приведенных данных (табл. 3.9), теплоты образования, в основном, довольно последовательно снижаются по мере уменьшения радиусов ионов. Строение молекул LnГ3(в парах) установлено на примере неодима: они представляют собой плоские треугольники с атомомNdв центре и ядерными расстояниямиNd—Г, равными 0,222 (F), 0,258 (Сl), 0,272 (Вr) и 0,294 нм (I).
Интересен своеобразный ход изменения температур плавления галогенидов LnГ3. Как видно из рис. 3. 7, при переходе по рядуI– Вr– Сlминимум температуры плавления смещается от РrкSmи затем к Тb, а у фторидов (температуры плавления которых довольно последовательно снижаются от 1365 у СеF3до 1320 уLuF3) этот минимум приходится на лютеций, т. е. смещается еще далее. Причины этого не ясны.
Хлориды, бромиды и иодиды рассматриваемых элементов хорошо растворимы не только в воде, но и в низших спиртах. Интересно при этом, что растворимость СеСl3иNdСl3в нормальном пропиловом спирте оказалась гораздо большей, чем в изопропиловом. Из водных растворов выделяются кристаллогидратыLnГ3∙nН2О (где чаще всегоn= 6). Нагреванием таких кристаллогидратов были получены оксохлоридыLnОСl.
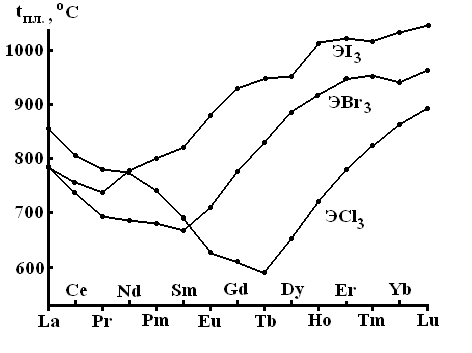
Рис. 3. 7. Температуры плавления LnГ3
В расплавах или неводных средах могут образовываться некоторые комплексные производные галогенидов LnГ3. Например, в расплавах установлено образование К3GdCl6(т. пл. 825) и К3DуСl6(tпл.= 790°С), а нерастворимый в эфире СеВr3дает сLiВrрастворимый комплексLi3СеВr6. Константы диссоциации ионовLnСl2+имеют порядок единицы и от Се кLuнесколько возрастают. Интересно, что с изменением природыLn3+растворимостьLnСl3в воде меняется мало, тогда как в концентрированной соляной кислоте она по направлению от Се кLuрезко уменьшается.
Фториды LnF3·0,5H2Oвыпадают в виде белых аморфных желатинообразных осадков при действии избытка фтороводородной кислоты и ее растворимых солей на водные растворы солей РЗЭ. При нагревании в вакууме до 250ºС теряют кристаллизационную воду и переходят в безводные соли. Безводные фториды получают действиемHFилиF2на оксиды или карбиды РЗЭ:
Ln2O3 + 6HF = 2LnF3 + 3H2O,
Ln4C3 + 12F2 = 4LnF3 + 3CF4.
Кроме того, фториды получают обработкой хлоридов РЗЭ кремнийфтористоводородной кислотой H2SiF6. Оксиды можно перевести во фториды, пропуская над нимиClF3. Оксиды элементов отLaдоSmфторируются полностью, остальные – в разной степени, которая понижается с увеличением порядкового номера лантанида.
Одним из способов получения фторидов является сплавление оксидов с NH4HF2при 200ºС:
Ln2O3 + 6NH4HF2 = 2LnF3 + 3H2O + 6NH4F.
Избыток NH4FиNH4HF2отгоняют при 450ºС.
Фториды обладают различными кристаллическими решетками: РЗЭ цериевой подгруппы – гексагональной, иттриевой – орторомбической или гексагональной. Фториды РЗЭ – главный исходный продукт для получения металлов и их сплавов электролизом, металлотермическим восстановлением магнием, кальцием и другими металлами. Фториды элементов от LaдоPrпрактически не реагируют с углеродом, аSmF3восстанавливается углеродом доSmF2. У фторидов РЗЭ высокие температуры плавления и кипения (табл. 3. 10).
Термическое разложение гидратированных фторидов происходит в диапазоне температур 315 – 405ºС; при нагревании до 800ºС во влажном воздухе или азоте LnF3гидролизуются с образованием оксофторидов
LnF3+H2O=LnOF+ 2HF.
При более высокой температуре оксофториды переходят в оксиды. LnOFполучаются при взаимодействии оксидов и фторидов при высокой температуре
LnF3+Ln2O3= 3LnOF.
Таблица 3. 10. Температуры плавления и кипения галогенидов РЗЭ
|
Элемент |
Фториды |
Хлориды |
Бромиды |
Йодиды | ||||
|
tпл.,ºС |
tкип.,ºС |
tпл.,ºС |
tкип.,ºС |
tпл.,ºС |
tкип.,ºС |
tпл.,ºС |
tкип.,ºС | |
|
Y La Ce (III) Ce (IV) Pr Nd Pm Sm (II) Sm (III) Eu (II) Eu (III) Gd Tb Dy Ho Er Tm Yb (II) Yb (III) Lu |
1390 1430 1465 977 1373 1413 1410 --- 1400 1377 1390 1380 1370 1360 1360 1350 1340 --- 1330 1320 |
2230 2330 2330 Разл. 2330 2330 2330 2727 2330 --- 2280 2280 2280 2230 2230 2230 2230 --- 2230 2230 |
703 855 805 --- 779 773 740 790 681 723 626 612 591 657 721 777 824 723 857 895 |
1510 1750 1730 --- 1710 1690 1670 2000 Разл. 2000 Разл. 1580 1550 1530 1510 1500 1490 1930 Разл. 1480 |
907 786 735 --- 693 687 680 700 667 677 705 778 830 884 917 953 955 677 943 960 |
1470 1580 1560 --- 1550 1540 1530 1880 Разл. 1880 Разл. 1490 1490 1480 1470 1460 1400 1820 Разл. 1410 |
1003 784 755 --- 736 778 800 527 823 527 880 929 955 958 1013 1023 1018 527 1030 1048 |
1310 1405 1400 --- 1380 1370 1370 1580 Разл. 1580 Разл. 1340 1330 1320 1300 1280 1260 1330 Разл. 1210 |
Фториды и оксофториды нерастворимы в разбавленных минеральных кислотах даже при кипячении, но реагируют с концентрированной серной кислотой и расплавленным гидросульфатом калия. Растворимы в растворах фторидов щелочных элементов и аммония, образуют с ними комплексные фториды Me3[LnF6], гдеMe–Na,K,NH4. Устойчивость комплексов возрастает отLnкSmиY. В системеLnF3-HF-H2OобразуетсяLnF3·3H2Oв интервале концентрацийHFот 0 до 52%; с 55%HFобразуется безводныйLnF3. Гексафторсурьмянистая кислотаH3SbF6образует с фторидами гексафторантимониты
LnF3+H3SbF6=LnSbF6+ 3HF.
При реакции с фторидом бора BF3образуются фторбораты
LnF3+BF3=Ln[BF6].
Радиус иона Се4+равен 0,102 нм. Из его галогенидов известен только бесцветный фторид – СеF4. Он может быть получен нагреванием СеF3до 400°С в токе фтора и представляет собой почти нерастворимое в воде кристаллическое вещество. Давление диссоциации по схеме 2СеF4↔ 2СеF3+F2составляет при 500°С менее 0,5 мм рт. ст. Водородом этот фторид восстанавливается до СеF3уже при 300°С (т. е. гораздо легче, чем СеО2).
Бесцветный ТbF4был получен действием фтора на ТbF3около 400°С. Теплота его образования из элементов равна 1992,6 кДж/моль. Он почти нерастворим в воде и лишь медленно реагирует с разбавленными кислотами. Так как РrF3с фтором не взаимодействует, РrF4был получен косвенным путем – экстракцией натрия изNа2РrF6посредством жидкого фтористого водорода (растворялсяNаНF2) в атмосфере фтора. Подобно ТbF4, он бесцветен.
При фторировании РrF3в присутствии фторидов щелочных металлов образуются комплексные фториды четырехвалентного празеодима, из которых были описаныNаРrF5, М2РrF6и М3РrF7(где М – отNа до Сs). Для четырехвалентного церия известны бесцветные комплексы со щелочными фторидами (Na– Сs) двух последних типов – устойчивые во влажном воздухе М2СеF6и медленно расплывающиеся М3СеF7. Интересно, что калийное производное последнего типа оказалось гораздо менее устойчивым, чем остальные. Для тербия был получен бесцветный и устойчивый на воздухе комплекс Сs3TbF7(а получить Сs2ТbF6не удалось). При фторировании смесейNdF3илиDуF3с избытком СsFтакже происходит, по-видимому, частичное образование комплексных фторидовNd+4иDу+4, но выделить их не удается.
Из фторидов LnF2известны светло-желтый ЕuF2и красно-коричневыйSmF2. Оба они малорастворимы в воде. Для иттербия был получен лишь продукт приблизительного составаYb4F9.
Хлориды LnCl3·nH2Oобразуются при растворении металлов, гидроксидов, карбонатов в хлороводородной кислоте. При упаривании растворов выделяются твердые кристаллические хлориды с различным числом молекул кристаллизационной воды (обычно 6 или 7 молекул). Получение безводных хлоридов из кристаллогидратов осложнено тем, что простое высушивание при повышенной температуре приводит к образованию оксохлоридов
LnCl3·nH2O![]() LnOCl+ 2HCl+ (n−1)H2O.
LnOCl+ 2HCl+ (n−1)H2O.
Безводные хлориды получают следующими способами
а) нагреванием кристаллогидратов в токе HClпри 400ºС и 60 мм. рт. ст. Образующийся при разложении кристаллогидрата оксохлорид в атмосфере хлороводорода переходит в хлорид
LnOCl+ 2HCl→LnCl3+H2O;
б) нагревание кристаллогидратов или оксидов с хлоридом аммония и отгонка избытка NH4Clпри 300 – 320ºС
LnOCl + 2NH4Cl → LnCl3 + 2NH3 + H2O,
Ln2O3 + 6NH4Cl → 2LnCl3 + 6NH3 + 3H2O;
в) хлорирование оксида тетрахлоридом углерода при 400-600ºС
2Ln2O3+ 3CCl 4→ 4LnCl3+ 3CO 2
(получаемый этим способом хлорид может содержать примесь углерода, наличие которой объясняется частично протекающей диссоциацией CCl4при высокой температуре: 2CCl4=Cl2+C2Cl6,C2Cl6= 3Cl2+ 2C);
г) хлорирование оксида хлордисульфаном
2Ln2O3 + 6S2Cl2 → 4LnCl3 + 3SO2 + 9S;
д) хлорирование оксида в присутствии углерода
Ln2O3+ 3С + 3Cl 2→ 2LnCl3+ 3СO.
Хлориды элементов от LaдоEu, включаяGd, имеют гексагональную решетку, а отDyдоLu, а такжеYCl3– моноклинную. Температура плавленияLnCl3постепенно снижается отLaдоDy, а затем снова возрастает доLu. Летучесть хлоридов увеличивается с возрастанием порядкового номера (с уменьшением ионного радиуса). Безводные хлориды гигроскопичны и расплываются на воздухе. Хорошо растворимы в воде и спирте. Поглощают аммиак, выделяя тепло и образуя аммиакатыLnCl3·nNH3. Устойчивость аммиакатов зависит от температуры, которая увеличивается с возрастанием порядкового номера.
Дихлориды SmCl2,EuCl2,YbCl2получают в две стадии: сначала проводят дегидратацию влажныхSmCl3,EuCl3,YbCl3, а затем их восстанавливают водородом до хлоридов элементов (II).
Бесцветный ЕuСl2(tпл.= 738,tкип.= 2190°С) начинает образовываться уже с 270°С, красно-коричневыйSmСl2(tпл.= 859,tкип.= 1950°С) – с 400°С, желто-зеленыйYbСl2(tпл.= 723,tкип.= 2105°С) – с 560°С. Так как по ряду галоидов Сl–Вr–I устойчивость двухвалентных производных несколько повышается, бромиды и иодидыLnГ3восстанавливаются легче хлоридов.
Образующийся SmCl2имеет примесь невосстановленногоSmCl3, плавится при 740ºС, переходя в буро-черную жидкость. При охлаждении затвердевает в виде тонких, длинных, красно-бурых иголочек. Хорошо растворим в воде. Растворы окрашены в красно-бурый цвет, очень неустойчивы.
EuCl2– белый аморфный порошок. Растворяется в холодной воде, при кипячении разлагается
3EuCl2
+ 3H2O
![]() EuCl3
+ Eu2O3
+ 6HCl.
EuCl3
+ Eu2O3
+ 6HCl.
Растворы EuCl2окрашены в желто-зеленый цвет.
YbCl2– желто-зеленое вещество, растворимое в воде. По устойчивости занимает промежуточное положение междуEuCl2иSmCl2. При подкислении водного раствораYbCl2образуется водород и сольYb(III).
SmCl2,EuCl2,YbCl2были получены восстановлениемSmCl3,EuCl3,YbCl3цинком.SmCl2иYbCl2незначительно гидролизуются, реагируют с жидким аммиаком, образуя аммиакатыLnCl2·8NH3, близкие по устойчивости к аммиакатам щелочноземельных элементов. Попытки получить дихлориды других РЗЭ восстановлением трихлоридов не имели успеха, т. к. они обладают высокими температурами восстановления (LaCl3- 880ºC,NdCl3- 840ºC,GdCl3- 820ºC,LuCl3- 750ºC, тогда какEuCl3- 270ºC,SmCl3- 400ºC,YbCl3- 560ºC). Выше 1000ºС все дихлориды диспропорционируют
3LnCl2![]() 2LnCl3+Ln.
2LnCl3+Ln.
В воде рассматриваемые галогениды легкорастворимы. Хлорид европия (теплота образования из простых веществ 808,05 кДж/моль) может быть выделен из раствора и в виде кристаллогидрата ЕuСl2∙2Н2O.
Для остальных лантанидов дигалогениды мало характерны. Лучше других охарактеризованы темно-зеленый NdСl2(tпл. = 841) и темно-пурпурныйNdI2(tпл. = 562°С). Были также описаны черный СеСl2и некоторые иодидыLnI2. Из нихNdI2и ТmI2 (подобноSmI2, ЕuI2иYbI2) являются нормальными галогенидами двухвалентных металлов, тогда как СеI2и РrI2(подобноLaI2) хорошо проводят электрический ток и, по-видимому, отвечают структуреLn3++ 2Iˉ + ē.
Оксохлориды LnOClполучают при гидролитическом разложении хлоридов и окислении хлоридов кислородом
LnCl3(тв.) + 1/2O2↔LnOCl(тв.) +Cl2(газ).
Оксохлориды РЗЭ имеют тетрагональную структуру.
Двойные хлоридыобразуются при совместной кристаллизации хлоридов РЗЭ с другими хлоридами. Так, хлоридыLa,Nd,Pr,Smс хлоридом цезия образуют двойной хлоридCs2LnCl5·5H2O. ХлоридыY,La,Ce,ErсHgCl2образуют соединения типаErCl3·5HgCl2·nH2O,CeCl3·4HgCl2·10H2Oи др., а также двойные хлориды подобного состава с хлоридамиPt,Auи т. д. В тройных водных системах хлоридов РЗЭ, щелочных (Na,K) и щелочноземельных металлов (Ca,Mg) двойные соли не обнаружены. Однако они могут быть получены взаимодействием безводных хлоридов РЗЭ с хлоридами щелочных и щелочноземельных металлов в расплаве (Me3LnCl6,Me2LnCl5(Me–Na,K,Rb,Cs),MeLnCl5(Me–Mg,Ca)). В тройных системахLnCl3-MeCl-MeCl,LnCl3-MeCl-MeCl2и т. д. образуются соединения на основе трех компонентов.
Простые хлориды четырехвалентных лантанидов не получены. Однако в виде оранжевых кристаллов был выделен сольват Н2СеСl6с 4 молекулами диоксана. Известны также соли этой кислоты с пиридином и тетраметиламмонием. Изучение последней из них показало, чтоd(Се-С1) = 0,255 нм. Получить натриевую соль не удалось.
Для празеодима были получены желтые соли типа М2РrСl6(где М –Nа – Сs, а такжеNН4+). Из них устойчивы на воздухе только производные СsиRb.
Бромиды и йодидыполучают аналогично хлоридам. Мало изучены. По внешнему виду напоминают хлориды. Растворимы в воде.
Для Sm,Eu,YbизвестныLnBr2иLnI2, получаемые восстановлением сухих тригалогенидов в токе сухого водорода. Восстановление трибромидов протекает легче, чем трихлоридов, а трийодидов – соответственно легче, чем трибромидов. Образуют двойные соли.
