
- •В. С. Корзанов, н. П. Шульгина химия редких, рассеянных и редкоземельных элементов
- •Корзанов в.С. , Шульгина н. П.
- •1. Введение
- •2. Химия скандия
- •2. 1. Минералы, руды, месторождения скандия
- •2. 2. Физические и химические свойства
- •2. 3. Кислородсодержащие соединения
- •2. 4. Соли кислородсодержащих кислот
- •2. 5. Соли органических кислот
- •2. 6. Соединения с галогенами
- •2. 7. Другие бескислородные соединения
- •2. 8. Методы отделения скандия от примесей
- •2. 8. 1. Методы осаждения
- •2. 8. 2. Конденсация и сублимация
- •2. 8. 3. Ионный обмен
- •2. 8. 4. Экстракция
- •2. 9. Получение металлического скандия
- •2. 10. Области применения скандия
- •3. Химия редкоземельных элементов
- •3. 1. История открытия лантанидов
- •3. 2. Распространенность в природе и изотопный состав
- •3. 3. Электронная структура атомов и ионов лантанидов
- •3. 4. Физические и химические свойства y и рзэ
- •3. 5. Соединения с кислородом
- •3. 6. Соли кислородсодержащих кислот
- •3. 7. Соли органических кислот
- •3. 8. Соединения с галогенами
- •3. 9. Другие бескислородные соединения рзэ
- •3. 10. Комплексные соединения
- •3. 11. Области применения рзэ
- •3. 12. Минералы и руды рзэ
- •4. Химия ванадия
- •4. 1. История открытия
- •4. 2. Минералы, руды и месторождения
- •4. 3. Физические и химические свойства
- •4. 4. Кислородсодержащие соединения
- •4. 5. Соединения с галогенами
- •4. 6. Соединения с другими неметаллами
- •4. 7. Органические комплексные соединения
- •4. 8. Получение металлического ванадия
- •4. 9. Области применения
- •Рекомендуемый библиографический список
- •Учебное издание
3. 4. Физические и химические свойства y и рзэ
В свободном состояний РЗЭ представляют собой типичные металлы, по большинству свойств сходные с лантаном (Се – Еu) или иттрием (Gd–Lu). Являются серебристо-белыми металлами (неодим и празеодим с желтоватым оттенком), на воздухе приобретают серый или слабо-желтый оттенок, в порошкообразном состоянии обладают цветом от серого до черного. Большая часть РЗЭ кристаллизуется в плотной гексагональной (ГП) решетке (за исключением церия, иттербия, самария и европия). Их важнейшие физические характеристики приведены ниже (табл. 3. 3).
Таблица 3. 3. Физические свойства Sc,Yи РЗЭ
|
Элемент |
tпл.,ºС |
tкип.,ºС |
Крист. структура |
а |
с |
Плотность, г/см3 |
|
La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Sc Y |
920 804 935 1024 1072 826 1312 1368 1380 1500 1525 1600 824 1675 1539 1525 |
3470 3700 3017 3210 1670 1430 2840 2480 2330 2380 2390 1720 1320 2680 2700 3025 |
ГП ГЦК* ГП ГП Ромбоэдр.** ОЦК*** ГП ГП ГП ГП ГП ГП ГЦК ГП ГП ГП |
3,77 5,16 3,67 3,66 8,97 4,58 3,64 3,60 3,59 3,58 3,56 3,54 3,49 3,50 3,31 3,65 |
12,20 - 11,84 11,79 - - 5,78 5,69 5,65 5,62 5,59 5,55 - 5,55 5,27 5,73 |
6,18 6,77 6,77 7,01 7,52 5,24 7,87 8,23 8,55 8,79 9,07 9,32 6,97 9,84 2,90 4,50 |
*ГЦК – гранецентрированная кубическая;
**Ромбоэдр. – ромбоэдрическая;
***ОЦК – объемноцентрированная кубическая.
Гексагональная плотная упаковка при достаточно высокой температуре переходит в кубическую; всем им присущ полиморфизм; в чистом виде имеют высокую электрическую проводимость, близкую к электрической проводимости ртути. Интересным исключением является Yb, проводимость которого примерно в 3 раза выше, чем у других лантанидов. Пластичны. Твердость зависит от чистоты, термической обработки и обычно возрастает с увеличением атомного номера. ЧистыеLaиCeкуются, прессуются, прокатываются в листы. Се вытягивается в проволоку. Механические свойства РЗЭ изучены недостаточно (прочность на растяжение, сжатие и др.).
РЗЭ заметно различаются давлением пара при температуре плавления. По уменьшению летучести металлы располагаются в ряд
Yb>Eu>Sm>Tm>Dy>Ho>Er>Lu>Gd.
Sm,Eu,Ybимеют низкие температуры кипения и потому – высокое давление пара.
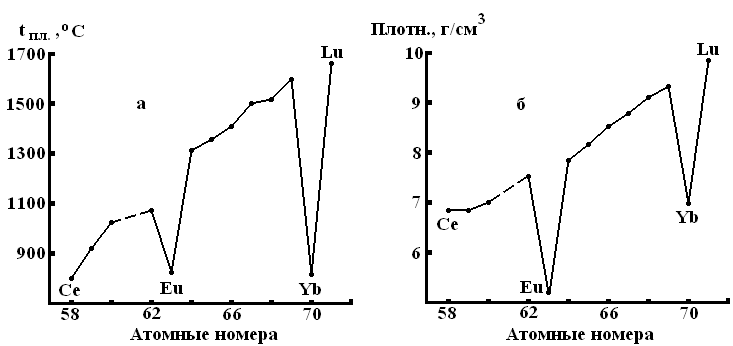
Рис. 3. 3. Температуры плавления (а) и плотности (б) РЗЭ
Как видно из рис. 3. 3, плотности и температуры плавления ЕuиYbрезко отклоняются от общего хода этих констант по семейству лантаноидов. Причины такого отклонения полностью не выяснены, но могут быть связаны с электронным строением атомов. Оба элемента характеризуются заполнением всех 7 орбиталей 4f-подуровня единичными электронами (Еu) или их парами (Yb). Заполненный таким образом 4f-подуровень обладает повышенной устойчивостью, поэтому использование третьего валентного электрона у ЕuиYbпо сравнению с другими лантаноидами затруднено. Если металлическое состояние большинства лантанидов можно схематически представить себе слагающимся изLn3++ 3ē, то для ЕuиYbоно соответственно выразилось бы какLn2++ 2ē. Отсюда и меньшие плотности (так как по объемуLn2+>Ln3+) и более низкие температуры плавления (так как связиLn3++ 3ē прочнее связейLn2++ 2ē). Действительно, по рассматриваемым свойствам ЕuиYbприближаются к своему двухвалентному соседу – барию (плотность 3,5 г/см3, температура плавления 710°С). Подобно барию, они способны растворяться в жидком аммиаке (с образованием голубых растворов), тогда как другие лантаниды в нем не растворяются. Из растворов могут быть выделены напоминающие по внешнему виду бронзу аммиакатыLn(NH3)6.
РЗЭ различаются по коррозионной устойчивости. Соответствующие переходу Ln3++ 3ē =Ln(в кислой среде) стандартные электродные потенциалы лантанидов изменяются от –2,52 до –2,25 В (табл. 3. 2). Следовательно, по активности они близки к магнию (Е° = –2,37 В).
Наибольшей устойчивостью обладают средние лантаниды. Крайние металлы ряда, напротив, проявляют повышенную склонность к коррозии. РЗЭ и Yхимически активны: во влажном воздухе тускнеют, покрываясь оксидной пленкой. Элементы иттриевой подгруппы устойчивее на воздухе, чем элементы цериевой подгруппы.
При нагревании в атмосфере кислорода лантаниды сгорают, переходя при этом в оксиды. Сродство к кислороду понижается с возрастанием атомного номера. Взаимодействуют с горячей и холодной водой, вытесняя водород. Реагируют с серной, соляной и концентрированной азотной кислотами. Щелочи на РЗЭ не действуют даже при нагревании.
С галогенами РЗЭ взаимодействуют при невысоких температурах. Интенсивность реакции уменьшается от F2кI2. При сплавлении сS,Se,Teобразуют соответствующие халькогениды.
С углеродом и углеродсодержащими газами дают карбиды LnC2; с фосфором – фосфиды.
С водородом при нагревании довольно быстро образуют гидриды. Yс водородом в интервале температур 315-540ºС дает устойчивые металлические гидриды различного состава.
При нагревании до температуры красного каления в атмосфере азота лантаноиды образуют нитриды LnN.
РЗЭ – хорошие восстановители. Они легко восстанавливают многие элементы из оксидов. Например, Ceпри температуре красного каления восстанавливаетCOиCO2до углерода.
Sc,Y,Laи лантаниды со многими металлами и неметаллами образуют сплавы и интерметаллиды. В литературе приводятся диаграммы состояния систем:Fe-Sc,Fe-Nd,Fe-Gd,Hf-Sc(Ce,Er),V-Sc,Ca-Eu,Tb-Re,La-Gaи др. СSeиTeРЗЭ дают устойчивые соединения, например,PrSe,PrTe,Pr3Se4,Pr2Se3,Pr2Te3. В системахLn-Gaобразуется ряд галлидов.
В соединениях они, как правило, трехвалентны. Церий, кроме того, дает ряд соединений, в которых он четырехвалентен. Меньшее значение имеют производные четырехвалентных Рr, Тb, а также двухвалентных лантанидов, наиболее характерные дляEu.
В щелочной среде производные трехвалентного церия являются восстановителями и, например, из соединений Нgи Аgвыделяют свободные металлы. Напротив, перевод Се+3в Се+4в кислой среде возможен только при действии таких сильных окислителей, как, например, РbО2. Так как перевод этот связан с изменением окраски раствора (от бесцветной к оранжевой), им пользуются в аналитической химии для открытия церия. Ион Се4+имеет оранжевую окраску. Соли четырехвалентного церия в растворе сильно гидролизованы. Если в щелочной среде трехвалентный церий легко окисляется до четырехвалентного (уже кислородом воздуха), то в кислой производные четырехвалентного церия малоустойчивы и являются сильными окислителями.
Потенциал перехода Се+4+ ē = Се+3сильно зависит от природы кислоты: при ее нормальной концентрации он равен +1,70 (в НСlO4), +1,60 (в НNО3) и +1,44 В (в Н2SO4). Различие обусловлено влиянием комплексообразования Се4+с соответствующими анионами. Так как тенденция к вхождению во внутреннюю сферу комплексных соединений у СlO4ˉ наименьшая, окислительную активность иона Се4+, как такового, наиболее правильно передает потенциал в перхлоратной среде. Хотя четырехвалентность церия в некоторых его соединениях и создает этому элементу несколько особое положение среди других лантанидов, однако в целом последние проявляют исключительно близкое сходство с элементами подгруппы скандия, закономерно укладываясь по большинству свойств между лантаном и скандием.
Для перехода Рr+4+ ē = Рr+3окислительный потенциал оценивается в +2,9 В, а для Тb+4+ ē = Тb+3должен быть таким же или еще выше. Ионы Рr4+и Тb4+энергично окисляют воду по схеме: 4Ln4++ 2Н2О = 4Ln3++ 4Н++ О2.
Производные двухвалентных Sm, ЕuиYbявляются сильными восстановителями, причем двухвалентное состояние наиболее характерно для Еu, наименее – дляSm. Так, в водном растворе восстановление водорода по схеме 2Ln+2+ 2Н+= 2Ln+3+ Н2идет сSm+2довольно быстро, сYb+2– медленнее, а с Еu+2– еще более медленно. Для соответствующих переходуLn+3+ ē =Ln+2нормальных потенциалов (в кислой среде) даются следующие значения: –0,43 (Еu), –1,15 (Yb) и –1,55B(Sm). Ион Еu2+бесцветен, тогда какSm2+имеет красную, аYb2+– зеленую окраску.
Для некоторых лантанидов известны аллотропные модификации, имеющие различные кристаллические структуры. В частности, это относится к церию, у которого таких модификаций четыре. Особый интерес представляет регистрируемый по скачку объема и относительного электрического сопротивления (рис. 3. 4, а и б) аллотропный переход церия под давлением в 7 тыс. атм., идущий без изменения типа кристаллической решетки. Он обусловлен, по-видимому, переходом 4f-электрона на 5d-подуровень, т. е. изменением электронного строения атома церия и его валентного состояния в металле (от Се3+к Се4+). Подобным же образом наложение избыточного давления на европий (до 35 тыс. атм.) сначала повышает его температуру плавления (до 995 °С), а затем вновь ее снижает, хотя кристаллическая структура металла при этом не изменяется. Энергия диссоциации молекулы Се2в парах – 276 кДж/моль – даже больше, чем у лантана (243 кДж/моль).
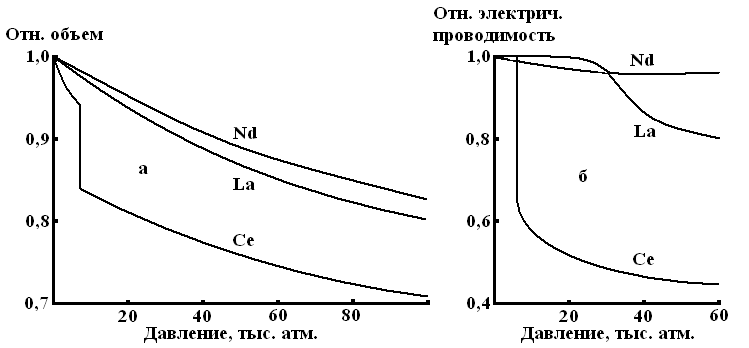
Рис. 3. 4. Влияние давления на относительный объем (а) и относительную электрическую проводимость (б)
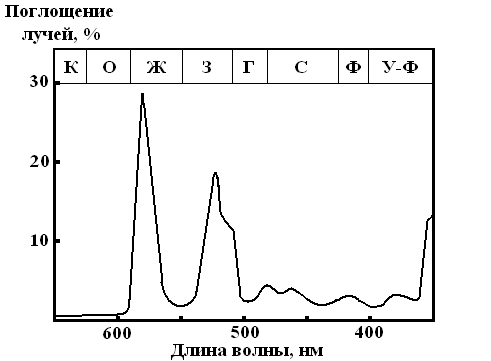
Рис. 3. 5. Светопоглощение раствора Nd(ClO4)3
По мере роста атомного номера подвижность гидратированных катионов Ln3+уменьшается. КатионыLn3+у Се,Gd, Тb,YbиLuбесцветны, остальные же имеют характерные цвета или оттенки: Рm, Еuи Еr– розовый,Sm,Dyи Но – желтый, Рrи Тm– зеленый,Nd– красно-фиолетовый. Такой же окраской в большинстве случаев обладают и гидратированные ионыLn3+. Исключением является розовыйNd3+, характер светопоглощения которого в разбавленном (1 г/л) раствореNd(ClO4)3виден на рис. 3. 5.
Безводные катионы Ln3+многих лантанидов могут быть, подобноCr3+в рубине, использованы для возбуждения лазерного излучения. Характерные длины генерируемых ими волн сопоставлены ниже (нм):
Pr3+ Nd3+ Eu3+ Gd3+ Dy3+ Ho3+ Er3+ Tm3+ Yb3+
1050 1060 610 310 2350 2050 1610 1910 1020
Как видно из приведенных данных, в видимой области спектра работает только Eu3+(оранжевые лучи), тогда какGd3+дает ультрафиолетовое излучение, а остальные перечисленные лантаниды – инфракрасное.
