
- •В. С. Корзанов, н. П. Шульгина химия редких, рассеянных и редкоземельных элементов
- •Корзанов в.С. , Шульгина н. П.
- •1. Введение
- •2. Химия скандия
- •2. 1. Минералы, руды, месторождения скандия
- •2. 2. Физические и химические свойства
- •2. 3. Кислородсодержащие соединения
- •2. 4. Соли кислородсодержащих кислот
- •2. 5. Соли органических кислот
- •2. 6. Соединения с галогенами
- •2. 7. Другие бескислородные соединения
- •2. 8. Методы отделения скандия от примесей
- •2. 8. 1. Методы осаждения
- •2. 8. 2. Конденсация и сублимация
- •2. 8. 3. Ионный обмен
- •2. 8. 4. Экстракция
- •2. 9. Получение металлического скандия
- •2. 10. Области применения скандия
- •3. Химия редкоземельных элементов
- •3. 1. История открытия лантанидов
- •3. 2. Распространенность в природе и изотопный состав
- •3. 3. Электронная структура атомов и ионов лантанидов
- •3. 4. Физические и химические свойства y и рзэ
- •3. 5. Соединения с кислородом
- •3. 6. Соли кислородсодержащих кислот
- •3. 7. Соли органических кислот
- •3. 8. Соединения с галогенами
- •3. 9. Другие бескислородные соединения рзэ
- •3. 10. Комплексные соединения
- •3. 11. Области применения рзэ
- •3. 12. Минералы и руды рзэ
- •4. Химия ванадия
- •4. 1. История открытия
- •4. 2. Минералы, руды и месторождения
- •4. 3. Физические и химические свойства
- •4. 4. Кислородсодержащие соединения
- •4. 5. Соединения с галогенами
- •4. 6. Соединения с другими неметаллами
- •4. 7. Органические комплексные соединения
- •4. 8. Получение металлического ванадия
- •4. 9. Области применения
- •Рекомендуемый библиографический список
- •Учебное издание
3. 2. Распространенность в природе и изотопный состав
Известно, что распространенность элементов четных номеров больше, чем нечетных (геохимическое правило Гаркинса). Для лантанидов эта закономерность в основном подтверждается, и лишь к концу ряда наблюдается отклонение от нее. Более распространены элементы, атомы которых содержат 50 (Y), 82 (Ce) и 84 (Nd) нейтрона.
Кларк Y,Laи лантанидов оценивается следующими значениями (в % масс.):
|
39Y– 2,8∙10-3, 57La– 1,8∙10-3, 58Ce– 4,5∙10-3, 59Pr– 7,0∙10-4, 60Nd– 3,7∙10-3,
|
62Sm– 7,0∙10-4, 63Eu– 1,2·10-4, 64Gd– 8,0∙10-4, 65Tb– 4,3∙10-4, 66Dy– 4,5∙10-4,
|
67Ho– 1,7∙10-4, 68Er– 3,3∙10-4, 69Tm– 2,7∙10-5, 70Yb– 3,3∙10-5, 71Lu– 8,0∙10-5.
|
Среди лантанидов наиболее распространенными являются церий и неодим. Церия в земной коре больше, чем олова; иттрия больше, чем свинца; менее распространены празеодим, самарий, гадолиний, тербий, диспрозий и эрбий. Самые редкие – европий, гольмий, тулий, иттербий и лютеций. Лантаниды в значительных количествах содержатся в рудах, содержащих торий, титан, ниобий и другие элементы.
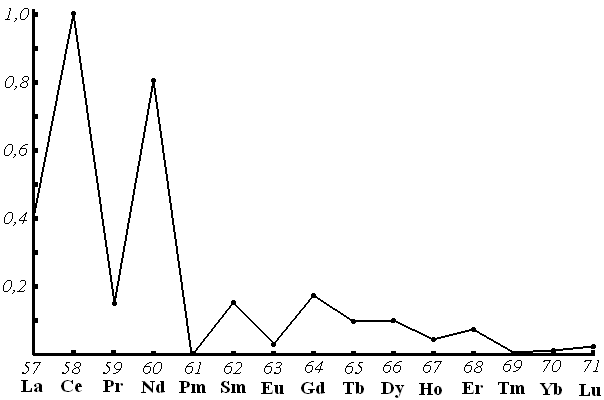
Рис. 3. 1. Относительное содержание РЗЭ в земной коре
В природе РЗЭ очень рассеяны и встречаются всегда смешанными друг с другом, лантаном и иттрием. Их относительное содержание в земной коре показано на рис. 3. 1 (за единицу принято содержание церия – 0,0045 %). Как видно, лантаниды с нечетными положительными зарядами ядер менее распространены в природе, чем их ближайшие соседи с четными. Несмотря на то, что содержание почти всех лантанидов в земной коре больше, чем таких «обычных» элементов, как, например, IиHg(~ 8,0∙10-5масс.%), их практическое использование еще сравнительно мало. Одной из причин этого является трудность отделения рассматриваемых элементов друг от друга.
Важнейшим для технологии лантанидов минералом является монацитовый песок, представляющий собой смесь фосфатов лантаноидов (в основном Се), лантана и иттрия, но содержащий также более или менее значительные примеси ТhО2,ZrО2,SiО2и т. д. Его промышленная переработка довольно сложна. Однако получение соединений индивидуальных лантанидов уже технологически освоено.
В элементарном состоянии РЗЭ могут быть получены восстановлением их оксидов, фторидов или хлоридов более активными металлами (Са и др.) или электролизом расплавленных хлоридов. Частично восстановление хлоридов LnСl3до металлов происходит также под длительным действием водорода при 800°С, причем наблюдается определенная закономерность – легкость восстановления возрастает по всему ряду лантанидов от лантана к лютецию (равно как и по рядуLа–Y–Sс). Исключениями являютсяSm, ЕuиYb, дающие дихлориды.
Вследствие трудностей разделения лантанидов из монацитового песка долго вырабатывалась лишь их смесь друг с другом, лантаном и иттрием – т. н. мишметалл, находивший ограниченные применения в металлургии, при изготовлении «кремней» для зажигалок и т. д.
Лантаниды подразделяются на две подгруппы:
цериевую – лантан, церий, празеодим, неодим, прометий, самарий, европий (иногда Euвключается в подгруппуY);
иттриевую – гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций.
В литературе лантаниды иногда делят на «легкие» (от LaдоGd) и «тяжелые» (отTbдоLu) элементы.
La и лантаниды (общее обозначение –Ln) (элементы с № 58-71) обладают групповым названием«редкоземельные элементы»(РЗЭ). К этой группе иногда относятScиY, хотя они имеют другое электронное строение.
По изотопному составу рассматриваемые элементы различны. Самый распространенный лантанид – церий – слагается из четырех изотопов с массовыми числами 136 (0,2), 138 (0,3), 140 (88,4) и 142 (11,1%). Празеодим, тербий, гольмий и тулий являются «изотопно чистыми» элементами (141Pr,159Тb,165Но,169Тm), европий и лютеций имеют по два изотопа, эрбий – 6, а неодим, самарий, гадолиний, диспрозий и иттербий – по 7 изотопов.
Прометий стабильных изотопов не имеет, и земная кора содержит лишь ничтожные следы его радиоактивных изотопов. Установлено существование одиннадцати изотопов – от 141Pmдо151Pm. Наиболее долгоживущий изотоп145Рm(период полураспада атомовТ1/2 ≈ 18 лет), а наиболее обычен получаемый в качестве побочного продукта при работе ядерных реакторов147Рm (Т1/2 ≈ 1,8 года).147Pmбыл выделен и из урановой руды (содержавшей в килограмме лишь 4∙10-15 г147Рm). Получено несколько миллиграммов розовой соли иона147Pm3+.
