
Материал презентаций по физике / Лекции для заочников / Физика для гуманитариев_1 / Вотинов_Перминов_Физика
.pdf
Таким образом, приходим к уравнению неразрывности струи: при стационарном течении несжимаемой жидкости величина Sv в любом се- чении одинакова:
Sv = const, |
(1.165) |
т. е. скорость жидкости возрастает в сужающихся и падает в расширяющихся участках струи.
Выделим в стационарно текущей идеальной жидкости трубку тока и рассмотрим произвольные сечения S1 è S2 (см. рис. 1.35). Пусть в месте сечения S1 скорость течения равна v1, давление ð1 и высота, на которой это сечение расположено, h1. Аналогично, в месте сечения S2 скорость те- чения v2, давление ð2 и высота h2. Из закона сохранения энергии можно показать, что для этих сечений выполняется равенство
v12 |
gh1 |
p1 |
|
v22 |
gh2 p2 , |
2 |
|
||||
|
|
2 |
|
||
где — плотность жидкости. Но так как сечения выбирались произвольно, то можем записать, что
v |
2 |
gh p const |
(1.166) |
|
|
||
2 |
|
||
|
|
|
для произвольного сечения.
Соотношение (1.166) называется уравнением Бернулли, и оно является выражением закона сохранения энергии применительно к установившемуся течению идеальной несжимаемой жидкости.
Величина ð в формуле (1.166) называется статическим давлением
(давление жидкости на поверхности обтекаемого ею тела), v 2 — äèíà- 2
мическим давлением, gh — гидростатическим давлением.
1.6.Вопросы для самоконтроля
1.Кинематика материальной точки. Системы отсчета. Траектория, перемещение, путь, скорость, ускорение. Равномерное и равнопеременное прямолинейные движения.
2.Криволинейное движение. Нормальное и тангенциальное ускорения.
61
3.Движение точки по окружности. Угловые перемещение, скорость, ускорение. Связь между линейными и угловыми характеристиками.
4.Динамика материальной точки. Инерциальные системы отсчета
èпервый закон Ньютона.
5.Фундаментальные взаимодействия. Силы различной природы (упругие, гравитационные, реакции), второй закон Ньютона. Масса. Третий закон Ньютона.
6.Импульс системы материальных точек, уравнение движения центра масс. Закон сохранения импульса.
7.Момент импульса и момент силы. Уравнение моментов. Закон сохранения момента импульса.
8.Вращение твердого тела относительно неподвижной оси. Основной закон динамики вращательного движения абсолютно твердого тела. Момент инерции.
9.Расчет момента инерции тел простой формы. Теорема Штейнера.
10.Кинетическая энергия материальной точки и абсолютно твердого тела.
11.Работа переменной силы, мощность. Потенциальные и непотенциальные поля. Консервативные и диссипативные силы. Потенциальная энергия.
12.Закон всемирного тяготения. Поле тяготения, его напряженность
èпотенциальная энергия гравитационного взаимодействия.
13.Работа по перемещению тела в поле тяготения.
14.Соударение тел. Упругое и неупругое взаимодействия.
15.Колебательное движение и его характеристики: смещение, амплитуда, фаза, циклическая частота, период, скорость, ускорение.
16.Векторные диаграммы для представления гармонических колебаний. Дифференциальное уравнение гармонических колебаний. Энергия колебательного движения.
17.Пружинный и физический маятники.
18.Сложение параллельных колебаний одинаковой и разной частоты. Биения.
19.Сложение взаимно перпендикулярных колебаний. Фигуры Лиссажу.
62
20.Свободные затухающие колебания. Характеристики затухания: коэффициент затухания, время релаксации, декремент затухания, добротность колебательной системы.
21.Вынужденные колебания. Резонанс.
22.Волновое движение. Уравнение плоской незатухающей бегущей волны. Энергия упругой волны. Вектор плотности потока энергии.
23.Сложение (интерференция) волн. Стоячие волны.
24.Закон Паскаля. Гидростатическое давление. Сила Архимеда. Уравнение Бернулли.
2.МОЛЕКУЛЯРНАЯ ФИЗИКА
ÈТЕРМОДИНАМИКА
2.1.Молекулярно-кинетическая теория
Основные положения молекулярно-кинетической теории
Молекулярно-кинетическая теория (МКТ) — учение, которое объясняет строение и свойства вещества движением и взаимодействием частиц, из которых оно состоит.
МКТ основана на следующих положениях:
1)все вещества состоят из частиц (атомов и молекул);
2)эти частицы находятся в непрерывном хаотическом движении (такое движение молекул называют также тепловым движением, поскольку скорости движения частиц зависят от степени нагретости тел);
3)между частицами существуют силы притяжения и отталкивания.
Эти положения подтверждаются явлениями диффузии, броуновского движения, особенностями строения и свойствами жидкостей и твердых тел.
Àòîì — наименьшая частица химического элемента.
Молекула — наименьшая устойчивая частица данного вещества, обладающая его основными химическими свойствами. Молекула состоит из атомов.
Отдельные атомы и молекулы визуально невозможно наблюдать даже в самый мощный оптический микроскоп ввиду их малости. Линейные
размеры атомов составляют порядка одного ангстрема: 1A& 10 10 ì.
Наблюдение атомов и молекул стало возможным с изобретением электронного микроскопа.
Диффузия — процесс выравнивания плотностей (или концентраций) контактирующих или самопроизвольно смешивающихся веществ.
64

Броуновское движение — непрерывное беспорядочное движение малых, взвешенных в жидкости или газе макроскопических твердых частиц. Это движение не зависит от внешних причин и обусловлено молекулярным движением в веществе.
Макроскопическое тело — тело, состоящее из очень большого числа частиц — атомов и молекул.
Измерять массы атомов и молекул удобнее в атомных единицах массы. Атомная единица массы mu численно равна 1/12 массы атома углерода (точнее его изотопа 126 C):
mu |
1 |
m |
12 |
|
1,66 10 27 |
êã 1 à. å. ì. |
(2.1) |
|
C |
||||||
|
12 |
атома |
6 |
|
|
|
|
|
|
|
|
|
|
|
Относительная атомная масса Ar химического элемента — отношение массы атома этого элемента к атомной единице массы:
Ar |
mатома |
. |
(2.2) |
|
|||
|
mu |
|
|
Относительная молекулярная масса Mr вещества — отношение массы молекулы этого вещества к атомной единице массы:
M r |
mìîë |
. |
(2.3) |
|
|||
|
mu |
|
|
Из определений относительных атомной и молекулярной масс следует, что они безразмерные.
Количество вещества — физическая величина, определяемая числом структурных элементов (атомов или молекул), из которых состоит вещество.
Единицей количества вещества является ìîëü: [ ] = ìîëü.
1 моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода (изотопа 126 C). Число частиц
в одном моле называется постоянной Авогадро: NA = 6,022 · 1023 ìîëü–1. Молярная масса — масса одного моля. [ ] = кг/моль. Количество вещества можно определить через массу m вещества
или через число молекул N (или атомов):
|
m |
|
N |
. |
(2.4) |
|
|
||||
|
N A |
|
|||
65

Массу молекулы можно определить через относительную молекулярную или молярную массы:
mìîë mu M r |
|
, |
(2.5) |
|
|||
|
N A |
|
|
откуда можно установить связь молярной и относительной молекулярной массы (кг/моль):
mu N A M r 10 3 M r . |
(2.6) |
От интенсивности теплового движения молекул и интенсивности их взаимодействия зависит агрегатное состояние вещества (твердое, жидкое, газообразное, плазменное). По мере увеличения интенсивности теплового движения среднее расстояние между молекулами возрастает, а силы взаимодействия уменьшаются, и тело переходит из твердого состояния в жидкое, из жидкого в газообразное…
Любая реальная макроскопическая система — очень сложный объект, так как состоит из большого числа взаимодействующих частиц. Нач- нем рассмотрение закономерностей макросистем с самой простой — идеального газа.
Идеальный газ — это модель газа, молекулы которого не взаимодействуют между собой на расстоянии, и их размерами можно пренебречь. Реальные газы по свойствам близки к идеальному при обычных условиях.
Основное уравнение МКТ (уравнение Клаузиуса)
При своем движении молекулы газа ударяются о стенку сосуда, в котором заключен газ, создавая тем самым давление на стенку. Это давление можно найти, исходя из молекулярно-кинетических представлений, предполагая, что:
а) давление газа не зависит от формы сосуда;
б) столкновение молекул идеального газа со стенками сосуда подчи- няется законам абсолютно упругого столкновения;
в) если газ находится в равновесии, то все направления движения молекул равновероятны.
Применив законы механики, с учетом этих предположений можно рассчитать давление газа на стенку сосуда:
p |
1 |
nmìîë v 2 |
|
1 |
nmìîë vñð.êâ2 , |
(2.7) |
|
|
|||||
3 |
3 |
|
||||
66

ãäå n — концентрация (число молекул в единице объема), n N  V ,
V ,
[n] = ì–3; |
v 2 |
— среднее |
значение квадрата скорости, |
v 2 v12 |
v22 |
v 2N N ; vñð.êâ |
— средняя квадратичная ско- |
рость, vñð.êâ 

 v 2
v 2  .
.
Выражение (2.7) называется основным уравнением молекулярно-ки- нетической теории идеальных газов или уравнением Клаузиуса.
Внеся массу молекулы в уравнении (2.7) под знак осреднения, можно прийти к соотношению
p |
2 |
n |
mìîë v 2 |
|
2 |
n ê ïîñò ìîë , |
(2.8) |
|
|
|
|||||
3 |
2 |
3 |
|
|
|||
ãäå  ê ïîñò ìîë
ê ïîñò ìîë  — средняя кинетическая энергия поступательного движения молекулы.
— средняя кинетическая энергия поступательного движения молекулы.
Умножив уравнение (2.8) на объем V сосуда, в котором находится газ, получим
pV |
2 |
N ê ïîñò ìîë |
|
2 |
Wê ïîñò , |
|
|
||||
3 |
|
3 |
|
||
(2.9)
ãäå Wê ïîñò — суммарная кинетическая энергия поступательного движения всех молекул в объеме V.
Уравнение состояния идеального газа
Физические величины, характеризующие то или иное состояние вещества, называются параметрами состояния.
Уравнение состояния — уравнение, связывающее параметры состояния.
Основными параметрами газообразного состояния являются объем V, давление ð, плотность , концентрация n и температура.
Температура — это скалярная физическая величина, характеризующая интенсивность хаотического движения частиц системы. Температура измеряется в градусах соответствующей шкалы (Цельсия t, °C; Кельвина T, К) и характеризует степень нагретости тела.
Температура по шкале Кельвина Ò называется абсолютной èëè термодинамической.
67

За начало отсчета абсолютной температуры — абсолютный нуль — принята такая температура, при которой прекращается хаотическое поступательное движение частиц системы.
Абсолютная температура связана с температурой по шкале Цельсия соотношением: Ò, Ê = t, °C + 273,16, деления же шкал одинаковы: 1 К = 1 °C.
Опытным путем установлено, что при обычных условиях параметры состояния таких газов, как кислород и азот, при неизменной массе газа хорошо подчиняются уравнению
pV |
const, |
(2.10) |
|
||
T |
|
|
причем чем разреженней газ, тем точнее выполняется соотношение. Следовательно, соотношение (2.10) является уравнением состояния идеального газа.
Закон Авогадро: при одинаковых давлениях и температуре в равных объемах различных газов содержится одинаковое число молекул. В частности, при нормальных условиях (t0 = 0 °C, p0 = 1 атм) объем моля Vì идеального газа равен 22,4 л: Vì = 22,4 · 10–3 ì3/ìîëü.
Отсюда следует, что в случае, когда количество газа равно одному молю, константа в (2.10) будет одинаковой для всех газов. Ее обозначают
буквой R и называют универсальной газовой постоянной: |
|
|
||||||
R |
p0Vì |
|
1,013 105 22,4 10 3 |
8,31 |
Äæ |
. |
||
T0 |
273,15 |
ìîëü |
Ê |
|||||
|
|
|
|
|||||
Тогда уравнение (2.10) для одного моля запишется в виде |
||||||||
|
|
|
pVì RT . |
|
|
|
(2.11) |
|
Учитывая, что молей газа будет занимать пропорционально больший объем V = Vì, можно прийти к уравнению состояния для произвольной массы или количества вещества газа, умножив (2.11) на количе-
ство молей m:
pV |
m |
RT , |
(2.12) |
|
ãäå m — масса газа; — молярная масса газа.
68

Уравнение (2.12) называется уравнением Менделеева — Клапейрона
для произвольной массы газа.
Учитывая, что плотность газа m, уравнению состояния можно
V
придать вид |
|
||||||||||
|
|
|
|
|
|
p |
|
RT . |
(2.13) |
||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||
Поделим уравнение (2.12) на объем и заменим количество вещества |
|||||||||||
через |
число молекул (2.4): p |
NR |
T . Отношение |
констант |
|||||||
|
|||||||||||
|
|
|
|
|
|
|
|
|
N AV |
|
|
k |
R |
1,38 10 23 |
Äæ |
называют коэффициентом Больцмана. Ñ ó÷å- |
|||||||
|
|
||||||||||
|
N A |
Ê |
|
|
|
|
|
|
|||
òîì òîãî, ÷òî |
N |
n — концентрация, можно записать: |
|
||||||||
|
|
||||||||||
|
|
|
V |
|
|||||||
|
|
|
|
|
|
p = nkT. |
(2.14) |
||||
Уравнение (2.14) показывает, что давление идеального газа при данной температуре определяется только числом молекул в единице объема и не зависит от рода молекул.
Из формулы (2.14) вытекает еще один справедливый для идеального газа закон — закон Дальтона для смеси газов.
Пусть имеется смесь нескольких, не взаимодействующих друг с другом идеальных газов. Допустим, что в единичном объеме смеси содержится n1 молекул первого газа, n2 молекул второго газа и т. д. Тогда общее число молекул в единичном объеме n = n1 + n2 + …. Согласно (2.14) давление газа определяется так:
p = nkT = (n1 + n2 + …) kT = n1kT + n2kT + … = p1 + p2 + …,
ãäå ð1, ð2, … — давления, которые оказывали бы газы этой смеси, если бы они заполняли объем по отдельности. Эти давления называются
парциальными. В итоге закон Дальтона гласит: давление смеси идеальных газов равно сумме парциальных давлений газов, входящих в смесь, ò. å.
ð = ð1 + ð2 + …. |
(2.15) |
69
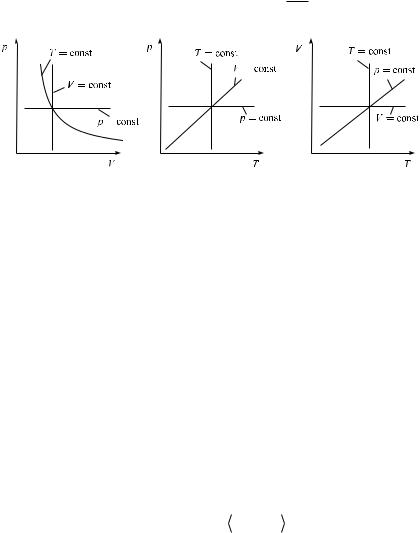
Изопроцессы
Изопроцессами называются процессы, при которых один из параметров состояния не изменяется. Различают изотермический (Ò = const), изобарный (p = const), изохорный (V = const) и другие процессы.
Сформулируем законы для изопроцессов в идеальном газе, предпо-
лагая, что количество вещества неизменно, т. е. pV const.
T
Ðèñ. 2.1
Изотермический процесс. Ïðè T = const получаем закон Бойля — Мариотта:
pV = const. |
(2.16) |
Изобарный процесс. Ïðè p = const получаем закон Гей-Люссака:
|
V |
const. |
(2.17) |
|
|||
|
T |
|
|
Изохорный процесс. Ïðè V = const получаем закон Шарля: |
|
||
|
p |
const. |
(2.18) |
|
|
||
|
T |
|
|
Графическое изображение изопроцессов в координатах (p, V), (p, T) è (V, T) представлено на рис. 2.1.
Средняя энергия молекул
Из соотношений (2.7), (2.8) и (2.14) следует:
p |
1 |
nmìîë vñð2 |
.êâ |
2n |
ê ïîñò ìîë nkT , |
|
|
||||
3 |
3 |
|
|||
70
