
Материал презентаций по физике / Лекции для заочников / Физика для гуманитариев_1 / Вотинов_Перминов_Физика
.pdf8.Дифракция Френеля на простейших преградах (диафрагма, диск). Зонные пластинки.
9.Дифракция Фраунгофера на щели и на дифракционной решетке.
10.Дисперсия и разрешающая способность дифракционной решетки.
11.Поляризация света. Виды поляризованного света. Поляризаторы. Закон Малюса.
12.Поляризация света при отражении и преломлении. Закон Брюстера.
13.Тепловое излучение, его характеристики. Абсолютно черное тело.
14.Распределение энергии в спектре излучения абсолютно черного тела. Законы Кирхгофа, Стефана — Больцмана, Вина.
15.Гипотеза и формула Планка.
16.Фотоэффект. Законы фотоэффекта. Уравнение Эйнштейна.
17.Энергия и импульс фотона. Световое давление.
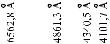
5. ОСНОВЫ АТОМНОЙ И ЯДЕРНОЙ ФИЗИКИ
5.1. Строение атома
Еще в античные времена возникло представление об атомах как неделимых мельчайших частицах вещества («атомос» — неразложимый). К началу XVIII в. существование атомов было доказано, но атомы по-прежнему считались неделимыми. В 1869 г. Д. И. Менделеев разработал Периодическую систему элементов, отражающую единую природу атомов. Напрашивался вывод о том, что атом имеет сложное строение. Когда было доказано, что электрон является составной частью любого атома, встал вопрос о строении атома. Результаты исследований свойств электрона и радиоактивности позволили строить конкретные модели атома.
Закономерности в атомных спектрах
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания
атомов называется линейчатым. На рис. 5.1 представлена часть спектра |
|||||||||
|
|
|
|
|
|
|
|
атомарного водорода в области видимого света |
|
|
|
|
|
|
|
|
|
с указанием соответствующих длин волн в Àíã- |
|
|
|
|
|
|
|
|
|
& |
–10 |
|
|
|
|
|
|
|
|
стремах (1A = 10 м). Спектры других эле- |
|
|
|
|
|
|
|
|
|
ментов оказываются более сложными. |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
В отличие от линейчатых спектров атомов |
|
|
|
|
|
|
|
|
|
молекулярные спектры представляются со- |
|
|
|
|
|
|
|
|
|
||
Ðèñ. 5.1 |
|
|
|
|
|
стоящими из сплошных полос. Тем не менее |
|||
|
|
|
|
|
|
|
|
при значительном увеличении обнаруживает- |
|
ся, что полосы состоят из большого числа тесно расположенных линий, поэтому спектры молекул носят название полосатых спектров.
Изучение атомных спектров послужило ключом к познанию строения атомов. Прежде всего было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы или, как их на-
222

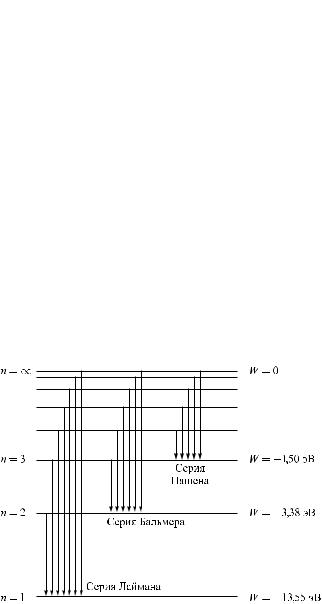
зывают, серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома — водорода. В рамках каждой серии линий расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким (см. рис. 5.1).
Швейцарский ученый И. Бальмер (1885) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
1 |
|
1 |
|
1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
(n = 3, 4, 5, …), |
|||
|
R |
2 |
n |
|
||||
|
|
|
|
|
|
|||
ãäå R = 1,10 · 107 ì–1 — постоянная Ридберга. Так как частота = c/ , то эта формула может быть представлена и для частот. В дальнейшем были обнаружены серии линий в ультрафиолетовой и инфракрасной областях спектра. Все серии линий в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
|
1 |
|
1 |
|
|
|
|
|
|
|
(5.1) |
|
|
||||
R |
|
, |
|||
m2 |
|
n2 |
|
||
ãäå R Rc = 3,293 · 1015 ñ–1 также называют постоянной Ридберга. Целое число m определяет номер серии. При ò = 1 получается серия линий, расположенная в ультрафиолетовой части спектра — серия Лаймана; ïðè ò = 2 наблюдается серия Бальмера, расположенная в видимой части спектра; при ò = 3 — серия Пашена è ò. ä.; ï принимает целочисленные значе- ния начиная с (ò + 1) и определяет отдельные линии в каждой серии.
Модели атома
Первая модель атома принадлежит Дж. Томсону (1903). Согласно этой модели атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны; отрицательный суммарный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что атом устроен иначе. Это открытие принадлежит английскому физику Резерфорду. Он исследовал прохождение -частиц в веществе через золотую фольгу толщиной примерно 1 мкм (-частицы — положительно заряженные частицы с зарядом +2å и массой, примерно в 7300 раз большей
223
массы электрона). Проходя через фольгу, основная часть этих частиц незначительно отклонилась (согласно предложенной Томсоном модели атома). Но совершенно неожиданно оказалось, что примерно 1 частица из 20 000 возвращается назад в сторону источника. Легкие электроны не могут существенно изменить движение тяжелых и быстрых частиц. Значительное отклонение -частиц обусловлено тем, что они наталкиваются на тяжелую частицу с положительным зарядом. Объем этой тяжелой частицы очень мал по сравнению с объемом атома, так как сильно отклоняются лишь немногие -частицы. Чтобы объяснить результаты опытов, Резерфорд в 1911 г. предложил принципиально новую модель атома, напоминающую по строению Солнечную систему — планетарную (ядерную) модель атома. Согласно этой модели положительно заряженная часть атома не распределена по всему его объему, а сосредоточе- на в чрезвычайно малом объеме — ÿäðå атома (размер — 10 15–10 14 м). Вокруг положительного ядра, имеющего заряд Ze (Z — порядковый номер элемента в системе Менделеева, å — элементарный заряд), по замкнутым орбитам движутся электроны, подобно планетам вокруг Солнца, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов. В атоме действуют электрические (кулоновские) силы.
Электрон движется вокруг ядра по круговой орбите радиусом r (с центростремительным ускорением). Согласно классической электродинамике ускоренно движущийся электрон должен непрерывно излу- чать электромагнитные волны, терять энергию на излучение и упасть на ядро. Однако этого не происходит. Другая трудность состоит в следующем: если принять, что частота излучаемого электроном света равна частоте колебаний электрона в атоме (или числу оборотов в одну секунду), то излучаемый свет по мере приближения электрона к ядру должен непрерывно изменять свою частоту. Соответственно, спектр излучаемого света должен быть сплошным (в нем должны присутствовать все частоты). Но это противоречит опыту. Атом излучает волны вполне определенных частот, типичных для данного химического элемента, и характеризуется спектром, состоящим из отдельных спектральных линий — линейчатым спектром (см. рис. 5.1).
Таким образом, в рамках модели атома Резерфорда не могли быть объяснены устойчивость атома и линейчатые спектры его излучения.
224
Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики.
Постулаты Бора
Датский физик Нильс Бор в 1913 г. предпринял смелую попытку объяснить результаты анализа спектра атома водорода. Это была первая попытка построить качественно новую (квантовую) теорию атома.
Предположение Бора заключалось в том, что классическая электромагнитная теория просто неприменима к электрону, движущемуся вокруг ядра. Если умножить обе части формулы (5.1) на постоянную Планка h и ввести обозначениеWn hR 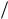 n2 , имеющее размерность энергии, то можно написать
n2 , имеющее размерность энергии, то можно написать
h Wn – Wm.
Бор предположил, что энергия электрона не теряется на излучение, когда он движется по любой из разрешенных орбит. Электрон излучает энергию только тогда, когда он совершает переход между двумя разрешенными орбитами. Энергия испущенного фотона в точности равна разности энергий электрона на этих орбитах.
Чтобы доказать правильность этих предположений, Бор попытался вычислить энергии этих состояний. Оказалось, что можно получить ряд дискретных разрешенных значений энергии «на орбитах» только при том предположении, что момент импульса квантуется, т. е. может принимать ряд дискретных значений. В итоге в основу своей теории Бор положил два постулата.
Первый постулат (постулат стационарных состояний): существуют стационарные состояния атома, находясь в которых, он не излучает энергию.
Этим стационарным состояниям соответствуют вполне определенные (стационарные) орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны, несмотря на наличие у них ускорения, не излучают электромагнитных волн. В этом утверждении заключается отказ от следствия из электродинамики, что ускоренно движущийся электрический заряд всегда излучает электромагнитные волны.
225

Правило квантования круговых орбит утверждает, что в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные (квантованные) значения момента импульса:
Ln mevn rn n |
|
, |
(5.2) |
h |
ãäå me — масса электрона; vn — скорость электрона на n-й орбите; rn — радиус n-й орбиты электрона; n = 1, 2, 3, …; h h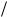 2 , h — постоянные Планка.
2 , h — постоянные Планка.
Второй постулат (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон. Энергия фотона равна разности энергий атома в двух его стационарных состояниях:
hnm Wn Wm , |
(5.3) |
ãäå nm — частота излучения, Wn è Wm — энергии атома в рассматриваемых состояниях.
Существование дискретных энергетических уровней атома подтверждается опытами, осуществленными в 1914 г. Франком и Герцем.
Боровская теория водородного атома
В атоме водорода на электрон, движущийся со скоростью vn ïî êðó-
говой орбите радиусом rn (рис. 5.2), со стороны ядра (протона) действует |
|||||||||||||
|
|
|
|
|
|
сила Кулона (3.3), которая создает центростре- |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мительное (нормальное) ускорение an . Â ñîîò- |
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
ветствии со вторым законом Ньютона (1.43) |
|||||||
|
|
|
|
|
|
можем записать: |
|
|
|
|
|
|
|
|
|
|
|
|
|
me |
vn2 |
|
1 |
|
e2 |
. |
(5.4) |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
4 0 |
|
|||||
|
|
|
|
|
|
|
rn |
|
|
rn2 |
|
||
|
|
|
|
|
|
Решая совместно уравнения (5.2) и (5.4), |
|||||||
Ðèñ. 5.2 |
получим выражение для радиуса n-й стацио- |
||||||||||||
нарной орбиты: |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rn r1 n2 , |
ãäå n = 1, 2, 3, …, |
(5.5) |
|||||
а радиус первой разрешенной орбиты электрона, называемый первым боровским радиусом,
|
0 h2 |
& |
|
r1 |
|
0,528 A. |
|
mee3 |
|||
|
|
226

Полная энергия электрона в атоме водорода складывается из его кинетической энергии (mev2/2) и потенциальной энергии в электростатиче- ском поле ядра (–e2/40r). Из (5.4) следует, что mev 2 e2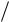 4 0 r , ïî-
4 0 r , ïî-
этому можем записать: |
|
|
|
|
|
|
|
W |
mev 2 |
|
e2 |
|
e2 |
. |
(5.6) |
|
|
|
|||||
2 |
|
4 0 r |
|
8 0 r |
|
||
Подставляя квантованные для радиуса n-й стационарной орбиты значения (5.5) в (5.6), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
Wn W1 |
1 |
(n = 1, 2, 3, …). |
(5.7) |
|
|||
|
n2 |
|
|
Целое число n в выражении (5.7), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием:
W1 me2e42 13,55 ýÂ. 8h 0
Состояния с n 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. Отрицательность значений энергии электрона в атоме свидетельствует о том, что он находится в связанном состоянии, т. е. принадлежит данному атому. Энергия атома водорода с увеличением n возрастает, а энергетические уровни сближаются. В пределе при n энергия атома стремится к нулю:
lim W 0.
n
Нулевая энергия атома соответствует его ионизации (отрыву от него электрона). Таким образом, энергия ионизации атома водорода (энергия, которую необходимо сообщить атому для высвобождения электрона)
Wi = –W1 = 13,55 ýÂ.
Согласно второму постулату Бора (5.3) при переходе атома водорода из стационарного состояния n в стационарное состояние ò (с меньшей энергией) испускается квант энергии:
227
|
|
|
|
|
mee4 |
|
1 |
|
1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h Wn Wm |
|
2 |
2 |
|
|
2 |
|
2 |
||||||||
|
|
|
|
m |
, |
|||||||||||
|
|
|
|
8h |
0 |
n |
|
|
|
|
||||||
откуда частота излучения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mee4 |
1 |
|
|
|
1 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
3 |
2 |
|
2 |
|
|
|
2 |
|
|
(5.8) |
|||||
|
|
|
n |
. |
|
|
||||||||||
8h |
0 |
m |
|
|
|
|
|
|
|
|
|
|||||
Сопоставив данное соотношение с формулой Бальмера (5.1), можно получить выражение для постоянной Ридберга R :
R |
mee4 |
|
Wi |
. |
(5.9) |
8h3 02 |
|
||||
|
|
h |
|
||
Подставляя в формулу (5.8) m = 1 è n = 2, 3, 4, …, получим группу линий, образующих серию Лаймана и соответствующих переходам электронов с возбужденных уровней (n = 2, 3, 4, …) на основной (рис. 5.3). Аналогично получаются серии Бальмера, Пашена и др.
Теория Бора была первым шагом в создании квантовой механики. Дальнейшее развитие атомной физики показало справедливость постулатов Бора не только для атомов, но и для других микроскопических систем — для молекул и атомных ядер. Эта часть теории Бора сохранилась при дальнейшем развитии квантовой теории. Иначе обстоит дело с моделью атома Бора, основанной на рассмотрении движения электрона в атоме
Ðèñ. 5.3
228

по законам классической механики при наложении дополнительных условий квантования. Вскоре выяснилось, что электронам присущи свойства, не согласующиеся с представлением об их планетарном движении.
5.2. Волновые свойства вещества
Изучение строения атома привело к выводу, что поведение электронов в атоме противоречит законам классической физики, т. е. законам, установленным в опытах с телами макроскопических размеров. В частности, существование дискретных энергетических уровней электронной оболочки атома, закономерности перехода между уровнями и заполнения этих энергетических состояний невозможно было объяснить, пользуясь классическими представлениями механики и законами электромагнетизма.
Корпускулярно-волновой дуализм свойств вещества
С классических позиций оказалось невозможным объяснить дифракцию электронов. Дело в том, что электроны, как и электромагнитные волны, способны обнаруживать дифракцию — явление, свойственное только волнам. Дифракционной решеткой для электронов служит кристалл. Пу- чок электронов, отраженный от кристалла или пропущенный через него, попадая на фотопленку, обнаруживает типичную картину дифракционных максимумов. Разберем это явление на двух опытах с дифракцией электронов на одной и на двух щелях.
Âпервом опыте поток электронов, предварительно разогнанный
âэлектрическом поле до определенной скорости, проходит через щель (рис. 5.4). За экраном помещается фотопленка,
позволяющая судить о распределении электро- |
|
нов в пространстве после прохождения ими |
|
щели (по степени затемнения). |
|
В этом опыте следовало бы полагать, что |
|
число отклоненных от первоначального на- |
|
правления электронов, во-первых, было бы не- |
|
велико, а во-вторых, монотонно убывало бы |
|
с увеличением угла отклонения. Однако на- |
|
блюдается типичная дифракционная картина с |
|
широким центральным максимумом. |
Ðèñ. 5.4 |
229
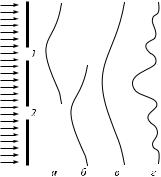
Во втором опыте поток моноэнергетических электронов направили на две щели, проделанные в непрозрачном экране (рис. 5.5). Эти щели снабжены затворами.
Если оставить открытой только пер-
вую щель, то распределение электронов
(отдельный электрон на фотопленке созда-
ет маленькое пятно) в различных точках эк-
рана имеет вид, указанный на рис. 5.5, à
(здесь не указаны менее важные дополни-
тельные максимумы). Если бы была откры-
та только вторая щель, распределение элек-
тронов осталось бы таким же, но только со-
ответствующая кривая сместилась бы вниз
на расстояние, равное расстоянию между щелями (см. рис. 5.5, á). Если сложить эти распределения, то получается кривая, изображенная на рис. 5.5, â. Эксперименталь-
ное же распределение электронов при двух открытых щелях, изображенное на рис. 5.5, ã, имеет совершенно иной вид.
Если исходить из того, что электрон — частица, то надо допустить, что каждый электрон проходит только через одну щель. Для него несущественно — открыта или закрыта другая щель. Если так, то когда открыты обе щели, распределение пятен на пленке должно соответствовать рис. 5.5, â. Ведь электрон «не чувствует», открыта или закрыта другая щель, через которую он не проходит. Его поведение за экраном в том и другом случае не должно зависеть от соседней щели. Опыт же показывает совершенно иное. Картина опыта с двумя открытыми щелями вовсе не совпадает с картиной наложения двух первоначальных пленок. Здесь наблюдается типичная картина интерференции от двух щелей с центральным максимумом (см. рис. 5.5, ã). Электроны ведут себя, как волны, причем так, как если бы каждый электрон (а не пучок!) представлял собой волну и интерферировал сам с собой.
При таком допущении это означало бы, что при двух открытых щелях каждый электрон проходит через обе щели сразу! Такое допущение переворачивает все наши установившиеся представления об электронах. Конечно, можно предположить, что мы до сих пор ошибались, рассматривая электроны как частицы, и теперь необходимо исправить ошибку: смотреть на них как на волны, которые способны проходить широкие по-
230
