
Материал презентаций по физике / Лекции для заочников / Физика для гуманитариев_1 / Вотинов_Перминов_Физика
.pdf
б) изобарный
V2 |
|
|
|
|
|
|
p const A12 p |
dV p(V2 V1 ) R(T2 T1 ); |
(2.62) |
||||
V1 |
|
|
|
|
|
|
в) изотермический |
|
|
|
|
|
|
T const A12 V2 |
pdV RT V2 |
dV |
RT ln |
V2 |
; |
(2.63) |
|
|
|||||
V1 |
V1 |
V |
V1 |
|
|
|
г) адиабатический
Q 0 A12 U U1 U2.
Используя соотношение (2.51) для внутренней энергии, получаем
|
p V |
|
p V |
|
p V |
|
V |
|
1 ( |
|
||
|
1 1 |
|
2 2 |
|
1 1 |
|
|
|
2 |
* |
|
|
A12 |
|
|
|
|
|
|
|
1 |
|
|
. |
(2.64) |
|
|
|
|
|
||||||||
|
1 1 1 |
|
V1 |
|
* |
|
||||||
|
|
|
|
* |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
) |
|
Для политропического процесса получается такое же выражение, если вместо подставить n.
Энтропия
Казалось бы, в изолированной термодинамической системе возможны любые процессы, в ходе которых сохраняется внутренняя энергия. Однако это не так. Дело в том, что различные состояния, отвечающие одной и той же энергии, обладают разной вероятностью. Естественно, что изолированная система будет самопроизвольно переходить из менее вероятных в более вероятные состояния либо пребывать преимущественно в состоянии, вероятность которого максимальна.
Например, в одной из половин изолированного, разделенного перегородкой сосуда имеется газ, а в другой его половине — вакуум. Если убрать перегородку, газ распространится на весь сосуд. Теплота к сосуду не подводилась, газ, расширяясь в вакуум, работы не совершал. Следовательно, не изменилась и внутренняя энергия, т. е. T = const. Обратный процесс, в результате которого газ самопроизвольно собрался бы в одной из половин сосуда, невозможен. Это обусловлено тем, что вероятность состояния, при котором молекулы газа распределены примерно поровну между обеими половинами сосуда, очень велика, а вероятность второго состояния практически равна нулю.
91
В литре воздуха при нормальных условиях содержится примерно 3 · 1022 молекул. Вероятность того, что они распределены поровну между половинами сосуда в 101022 раз больше вероятности того, что все они окажутся с одной стороны.
Заметим, что процесс распространения газа на весь объем — необратимый. Следовательно, необратимым является процесс, обратный которому маловероятен.
Чтобы определить, какие процессы могут протекать в изолированной системе, нужно знать вероятности различных состояний этой системы. Величина, которая служит для характеристики вероятности состояний, получила название энтропии. Она является функцией состояния системы.
В идеале самым детальным описанием состояния системы было бы задание координат и импульсов (или скоростей) всех частиц, из которых образована система. Столь детально охарактеризованное состояние системы называется микросостоянием.
Состояние системы может быть также задано с помощью макроскопических параметров (параметров состояния), характеризующих систему в целом. Охарактеризованное таким способом состояние системы называется макросостоянием.
Если система находится в равновесии, то параметры состояния не изменяются, т. е. не изменяется ее макросостояние. Вместе с тем частицы движутся и изменяют свой импульс в результате соударений, следовательно, микросостояние все время изменяется.
Число различных микросостояний, посредством которых осуществляется данное макросостояние, называется статистическим весом макросостояния .
Например, статистический вес моля кислорода при атмосферном давлении и комнатной температуре 106,5 1024 .
В основе статистической физики лежит гипотеза, согласно которой
все микросостояния равновесной термодинамической системы равновероятны, следовательно, вероятность макросостояния пропорциональна статистическому весу. Тогда в качестве энтропии как величины, характеризующей вероятность состояния, можно было бы взять сам статистический вес. Но это неудобно не только по причине огромных чисел, но и ввиду его неаддитивности (вероятности перемножаются):
1 2 . Но логарифм статистического веса — величина аддитивная:
92

ln ln 1 ln 2 .
Поэтому в качестве энтропии можно принять величину , равную натуральному логарифму статистического веса:
ln .
Поскольку энтропия является функцией состояния системы, то она может быть представлена в виде функции параметров состояния.
В статистической физике доказывается, что при обратимом процессе величина dQ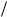 kT является полным дифференциалом энтропии :
kT является полным дифференциалом энтропии :
dQ |
|
||
|
|
|
, |
|
|||
d |
|
|
|
kT |
|
||
îáð
ãäå dQ — количество теплоты, полученное системой в ходе обратимого процесса; k — коэффициент Больцмана; T — температура системы (и нагревателя, так как единственный обратимый процесс, при котором может передаваться теплота — изотермический).
Огромные численные значения величины делают ее малопригодной для практических расчетов. По этой причине энтропией (Дж/К) называют величину S = k :
S k ln . |
(2.65) |
В примере со статистическим весом моля кислорода при атмосфер- |
|
ном давлении и комнатной температуре 106,5 1024 |
. Ïðè ýòîì, äëÿ ñðàâ- |
нения: 1,5 1025 ; S = 200 Äæ/Ê. |
|
Определение энтропии (2.65) лежит в основе ее статистического применения.
Для приращения энтропии при обратимом процессе
dQ |
|
|
||
|
|
|
, |
(2.66) |
|
||||
dS |
|
|||
T |
|
|
|
|
îáð
при этом для обратимого процесса справедливо тождество
dQ 0.
îáð T
93

Соотношение (2.66) лежит в основе термодинамического применения энтропии.
Свойства энтропии:
1. Переход системы из менее вероятного состояния в более вероятное сопровождается увеличением статистического веса , а следовательно, и энтропии S, поэтому можно утверждать, что в ходе необратимого процесса энтропия изолированной системы возрастает: dS 0.
2.Энтропия изолированной системы, находящейся в равновесном состоянии, максимальна:
= const dS = 0 S = const.
3.Энтропия неизолированной системы может как возрастать, так и убывать; состояние, осуществляемое многими способами, называется беспорядочным или случайным, поэтому энтропия — мера беспорядка в системе.
4.При стремлении абсолютной температуры к нулю энтропия любого тела также стремится к нулю:
lim S 0. |
(2.67) |
T 0 |
|
Свойства 1 и 2 составляют второе начало термодинамики. Свойство 4 называется теоремой Нернста (называемой иногда
третьим началом термодинамики).
Выражение (2.66) определяет не саму энтропию, а разность ее значе- ний в двух состояниях. Нернст доказал теорему (2.67), которая дает возможность определить само значение энтропии в любом состоянии. Согласно теореме Нернста энтропия любого тела при абсолютном нуле равна нулю. На этом основании энтропия в состоянии с температурой T может быть представлена следующим образом:
T
S
0
dQ. (2.68)
T
Если известна, например, теплоемкость тела при данных условиях как функция температуры, то энтропия может быть вычислена по формуле
T
S
0
|
C(T )dT |
. |
(2.69) |
|
|||
|
T |
|
|
94

КПД тепловой машины. Цикл Карно
Создание и развитие термодинамики было вызвано прежде всего необходимостью описания работы и расчета тепловых машин. Тепловая машина (èëè тепловой двигатель) — это периодически действующий механизм, совершающий работу за счет полу-  чаемого извне количества теплоты. Круговой
чаемого извне количества теплоты. Круговой  процесс (öèêë) такого двигателя схематично
процесс (öèêë) такого двигателя схематично  показан на рис. 2.9.
показан на рис. 2.9. 
Принцип действия тепловых машин заключается в следующем. Термостат (термодинамическая система, которая может обмениваться теплотой с телами без изменения температуры) с более высокой температурой Ò1 (называемый нагревателем) передает за цикл
рабочему телу теплоту Q1, вызывая повышение его температуры. Рабо- чее тело совершает за цикл работу A над каким-либо механическим устройством, например, приводит во вращение турбину, и далее отдает холодильнику (термостату с более низкой температурой Ò2) теплоту Q2 , возвращаясь в исходное состояние. Работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой в координатах (p, V). Величина Q2 Q2 представляет собой количество теплоты, передаваемое холодильником рабочему телу, и имеет отрицательное значение. Т. е. для того, чтобы машина работала повторными циклами, часть полученной от нагревателя теплоты нужно отдать холодильнику.
В соответствии с первым началом термодинамики (2.42) при осуществлении кругового процесса из-за возвращения рабочего тела в исходное состояние его внутренняя энергия за цикл не изменяется. Поэтому совершенная рабочим телом механическая работа равна разности подве-
денной и отведенной теплоты: |
|
A Q1 Q2 . |
(2.70) |
Эффективность тепловой машины принято характеризовать коэффициентом полезного действия , который определяется как отношение совершенной за цикл работы A к получаемой от нагревателя за цикл теплоте Q1:
|
A |
|
Q1 |
Q2 |
1. |
(2.71) |
|
|
|
Q1 Q1
95

Если цикл направить в другую сторону, то получится холодильная машина. Такая машина отбирает за цикл от холодного тела количество тепла Q2 и отдает горячему телу количество тепла Q1 . Над машиной за цикл должна быть совершена работа A . Ее эффективность характеризуется холодильным коэффициентом
õîë |
Q2 |
|
Q2 |
. |
(2.72) |
A |
|
||||
|
|
Q1 Q2 |
|
||
Французский инженер Сади Карно вывел теорему, которая называется его именем: из всех периодически действующих тепловых машин,  имеющих одинаковые температуры нагревателей (Ò1) и холодильников (Ò2), íàè-
имеющих одинаковые температуры нагревателей (Ò1) и холодильников (Ò2), íàè-  большим КПД обладают обратимые ма-
большим КПД обладают обратимые ма-
øèíû:
|
|
|
необр обр . |
(2.73) |
|
|
Единственным обратимым процессом, |
||||
|
при котором может подводиться теплота, |
||||
|
является изотермический, поэтому обрати- |
||||
|
мый цикл, совершаемый в тепловой маши- |
||||
|
не рабочим телом, может состоять из изо- |
||||
Ðèñ. 2.10 |
терм и адиабат. |
|
|||
Цикл, состоящий из двух изотерм и |
|||||
|
|||||
|
двух адиабат, называется циклом Карно |
||||
(рис. 2.10) — это цикл идеальной тепловой машины. |
|
||||
КПД цикла Карно определяется только температурами нагревателя |
|||||
и холодильника: |
|
|
|
|
|
|
Карно |
T1 T2 |
. |
(2.74) |
|
|
|
||||
|
|
T1 |
|
||
В качестве примера приведена зависимость КПД идеальной тепловой машины от температуры нагревателя, температура холодильника 20 °С (комнатная температура):
T1, °Ñ |
100 |
400 |
800 |
1200 |
2500 |
, % |
21 |
56 |
73 |
80 |
89 |
96
Второе начало термодинамики
Первое начало термодинамики не дает никаких указаний относительно направления, в котором могут протекать процессы в природе. Оно не запрещает, например, самопроизвольный переход тепла от холодного тела к горячему, хотя в природе такие процессы не наблюдаются. Обобщение огромного экспериментального материала привело к необходимости расширения термодинамики: было сформулировано второе начало. Второе начало позволяет судить о направлении процессов, которые могут происходить в действительности.
Наиболее очевидная формулировка принадлежит Рудольфу Клаузиусу (1850): невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему.
Формулировка Вильяма Томсона (лорда Кельвина) (1851): невозможен процесс, единственным результатом которого является превращение теплоты в эквивалентную ей работу.
Иными словами: невозможен вечный двигатель второго рода — периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты.
Используя понятие энтропии, второе начало термодинамики можно сформулировать как закон неубывания энтропии замкнутой системы: энтропия изолированной системы не может убывать при любых происходящих в ней процессах:
dS + 0, |
(2.75) |
причем знак равенства относится к обратимым процессам, а неравенства — к необратимым.
Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя произвольным образом.
Статистическое определение энтропии (2.65) позволяет объяснить постулируемое вторым началом термодинамики возрастание энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Таким образом, второе начало, являясь статистическим законом, описывает закономерности хаотического движения большого числа частиц, составляющих замкнутую систему.
В середине ХIХ века возникла проблема так называемой тепловой смерти Вселенной. Рассматривая Вселенную как замкнутую систему и применяя к ней второе начало термодинамики, Клаузиус свел его
97
содержание к утверждению, что энтропия Вселенной должна достигнуть своего максимума. Это означает, что со временем все формы движения должны перейти в тепловую. Переход же теплоты от горячих тел к холодным приведет к тому, что температура всех тел во Вселенной сравняется, т. е. наступит полное тепловое равновесие, и все процессы во Вселенной прекратятся — наступит тепловая смерть Вселенной.
Попытка избежать указанного противоречия гипотезы тепловой смерти Вселенной была предпринята Больцманом, который показал, что и в состоянии термодинамического равновесия наблюдаются флуктуации термодинамических параметров. Если считать, что наблюдаемая Вселенная является следствием такой флуктуации, то противоречия парадокса тепловой смерти Вселенной снимаются.
Ошибочность вывода о тепловой смерти заключается в том, что бессмысленно применять второе начало термодинамики к незамкнутым системам, например к такой безграничной и бесконечно развивающейся системе, как Вселенная.
Подобно тому, как в основе механики лежат законы Ньютона и все задачи могут быть решены с их помощью, так в основе термодинамики лежат два закона — два начала термодинамики.
Первое начало термодинамики утверждает тот факт, что в любых процессах должен соблюдаться закон сохранения и превращения энергии, т. е. первое начало представляет собой формулировку закона сохранения и превращения энергии применительно к тепловым процессам. Второе начало уточняет первое и показывает направление протекания всех процессов — стремление любой системы перейти из менее вероятных в более вероятные состояния.
2.3.Вопросы для самоконтроля
1.Основные положения молекулярно-кинетической теории газов.
2.Основное уравнение молекулярно-кинетической теории газов.
3.Термодинамическая система. Параметры состояния термодинамической системы.
4.Уравнение состояния идеального газа.
5.Закон равнораспределения энергии по степеням свободы молекул.
98
6.Закон Максвелла распределения молекул по скоростям теплового движения. Барометрическая формула. Распределение Больцмана.
7.Явления переноса. Диффузия, вязкость, теплопроводность.
8.Первый закон термодинамики. Работа, теплота, теплоемкость, ее виды.
9.Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный.
10.Второй закон термодинамики. Энтропия. Тепловые двигатели и холодильные машины. Цикл Карно.
11.Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реальных газов. Фазовые превращения.
3. ЭЛЕКТРОДИНАМИКА
Электродинамика — раздел физики, в котором изучаются электромагнитные взаимодействия.
Электромагнитное взаимодействие — одно из четырех выделяемых в настоящее время фундаментальных взаимодействий, это взаимодействие между электрически заряженными частицами или макроскопи- ческими заряженными телами.
Электрический заряд q — физическая величина, характеризующая свойство тел или частиц вступать в электромагнитные взаимодействия. Единица заряда — кулон: q Êë.
3.1. Электростатика
Электростатика — раздел электродинамики, в котором рассматриваются свойства и взаимодействия неподвижных в инерциальной системе отсчета электрически заряженных тел или частиц, обладающих электрическим зарядом.
Электрический заряд и его свойства
Электрические заряды бывают двух видов. Их условно назвали положительными è отрицательными; заряды взаимодействуют между собой: одноименные — отталкиваются, разноименные — притягиваются.
Носителями зарядов являются элементарные частицы (мельчайшие частицы материи).
Наименьший встречающийся в природе электрический заряд называется элементарным зарядом e:
e = 1,6021892 · 10–19 Êë.
Элементарные частицы: электрон, протон è нейтрон — несут заряды –e, +e, 0 соответственно.
Из этих частиц построены атомы любого вещества, поэтому электрические заряды входят в состав всех тел.
100
