
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
NaF |
MgF2 |
AlF3 |
SiF4 |
PF5 |
SF6 |
|
основные |
Амфотерный |
|
кислотные |
|
ионный тип связи |
Ионно- |
ковалентный тип связи |
|||
|
|
ковалентный |
|
|
|
|
|
тип связи |
|
|
|
Различной природы галогениды могут реагировать между собой: 2KF + SiF4 → K2[SiF6]
3NaF + AlF3 → Na3[AlF6]
2KF + BeF2→ K2[BeF4]
2AlF3 + 3SiF4 → Al2[SiF6]3
Основные фториды гидролизуются, если они растворимы в воде:
2NaF + H2O → NaHF2 + NaOH
Кислотные фториды гидролизуются с образованием 2-х кислот:
 SiF4 + 3H2O → H2SiO3 + 4HF 2SiF4 + 4HF → 2H2[SiF6]
SiF4 + 3H2O → H2SiO3 + 4HF 2SiF4 + 4HF → 2H2[SiF6]
3SiF4 + 3H2O→ H2SiO3 + 2H2[SiF6]
Аналогичная классификация на основные, амфотерные и кислотные существует у хлоридов, бромидов, иодидов:
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
PCl3 |
SCl2 |
tпл. оС |
801 |
708 |
190 |
58 |
–112 |
–78 |
|
|
основные |
Амфотерный |
|
кислотные |
|
|
ионный тип связи |
Ионно- |
ковалентный тип связи |
|||
|
|
|
ковалентный |
|
|
|
|
|
|
тип связи |
|
|
|
2KI + HgI 2→ K2[HgI4]
KBr + AlBr3 → K[AlBr4]
С увеличением степени ионности повышается термическая устойчивость галогенидов. Гидролиз галогенидов протекает по различным схемам. Подвергающиеся гидролизу основные хлориды, бромиды, иодиды гидролизуют по катиону:
MgCl2 + HOH MgOHCl + HCl
Кислотные галогениды гидролизуют с образованием 2-х кислот:
21

PCl5 + 4H2O → H3PO4 + 5HCl
PI3 + 3H2O → H3PO3 + 3HI
BCl3 + 3H2O → H3BO3 + 3HCl
SF6, СCl4, CF4 не подвергаются гидролизу. Относительная устойчивость SF6 по сравнению с SF4, обусловлена кинетическими факторами. Шесть атомов фтора стерически экранируют атом серы и мешают приближению возможных атакующих групп. Термодинамиче-
ски же гидролиз SF6: SF6(газ) + 3H2O(газ) → SO3(газ) + 6HF(газ) возможен, поскольку стандартное изменение энергии Гиббса этого процесса со-
ставляет  Gо = –301,2 кДж. В связи с инертностью и исключительными диэлектрическими свойствами SF6 широко используется в качестве газообразного изолятора в высоковольтных аппаратах.
Gо = –301,2 кДж. В связи с инертностью и исключительными диэлектрическими свойствами SF6 широко используется в качестве газообразного изолятора в высоковольтных аппаратах.
Галогениды практически всех металлов хорошо растворимы в воде. Исключение - соли серебра и свинца. Качественная реакция на галогенид-ионы - выпадение осадка белого цвета AgCl в реакциях нитрата серебра с соляной кислотой и хлоридами:
KCl + AgNO3 ® AgCl↓ + KNO3.
С бромоводородной кислотой и ее солями образуется светло-желтый осадок AgBr, с иодоводородной кислотой и ее солями - образуется желтый осадок AgI. Осадки не растворимы в воде и азотной кислоте. AgF – растворимая соль.
Кислородсодержащие соединения галогенов
Галогены непосредственно с кислородом не взаимодействуют. Это обусловлено небольшой энергией связи Г– О и невозможностью использовать высокие температуры для осуществления реакций окисления, т.к. для них ∆Но > 0, ∆S о < 0:
|
|
Cl2 + 2O2 = 2ClO2 |
||
DH оf , 298 , кДж/моль |
0 |
0 |
104,6 |
|
S о298 , Дж/(моль × К) |
223 |
205,04 |
251,3 |
|
DНо298 |
= 209,2 кДж, DS о298 = –130,48 |
Дж/К. |
||
DG о298 |
= DНо298 – ТDS= 226220 Дж |
|
||
Из соединений кислорода с фтором наиболее устойчив фторид кислорода OF2.
22
Больше всего устойчивых соединений образует хлор. Хлор образует четыре оксида в степенях окисления +1, +4, +6, +7. Оксиды брома
менее устойчивы, существуют лишь при температурах ниже 0°C. Иод имеет относительно устойчивый оксид в степени окисления йода +5:
Соеди |
Агрегатное |
|
|
|
|
|
||
еди- |
tпл,° С |
tкип,° С |
Получение |
|
||||
состояние |
|
|||||||
нение |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
OF2 |
Бесцветный |
-224 |
-145 |
2F2 + 2NaOHразб. = OF2 + 2NaF + |
||||
|
газ |
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
||
Cl2O |
Желто- |
|
-116 |
2 |
2HgO + 2Cl2 = HgO·HgCl2 + Cl2O |
|
||
|
коричне- |
|
|
|
2HClO + P2O5 = Cl2O + 2HPO3 |
|
||
|
вый |
газ |
с |
|
|
|
||
|
|
|
|
|
|
|||
|
резким |
за- |
|
|
|
|
|
|
|
пахом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ClO2 |
Желтый газ |
-60 |
10 |
2NaClO3 + SO2 |
+ H2SO4 |
= |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
= 2NaHSO4 + 2ClO2 |
|
|
|
|
|
|
|
|
2KClO3 + H2C2O4 |
+ 2H2SO4 |
= |
|
|
|
|
|
|
= 2KНSO4 + 2ClO2 + 2H2O + 2СО2 |
||
|
|
|
|
|
|
|
||
Cl2O6 |
Красная |
|
3,5 |
203 |
ClO2 + O3 = Cl2O6+O2 |
|
||
|
жидкость |
|
|
|
|
|
||
|
|
|
|
|
|
|||
Cl2O7 |
Масляни- |
-90 |
82 |
2HClO4 + P2O5 = Cl2O7 + 2HPO3 |
|
|||
|
стая |
бес- |
|
|
|
|
|
|
|
цветная |
|
|
|
|
|
|
|
|
жидкость |
|
|
|
|
|
||
|
|
|
|
|
|
|||
I2O5 |
Бесцветные |
Разлагается при |
2HIO3 ¾® I2O5 + H2O |
|
||||
|
|
|
|
|
|
t |
|
|
|
кристаллы |
нагревании |
|
|
|
|||
|
|
|
|
|
|
|
|
|
Все оксиды хлора – кислотные оксиды. Оксидам хлора соответствуют кислоты:
Сl2О |
СlО2 |
Сl2О6 |
Сl2О7 |
HClO |
HClO2 |
HClO3 |
HClO4 |
Хлорноватистая |
Хлористая |
Хлорноватая |
Хлорная |
(гипохлориты) |
(хлориты) |
(хлораты) |
(перхлораты) |
23
Как кислотные оксиды хлора реагируют с водой (образуются слоты); основными оксидами, основаниями. Оксидам Cl2O, Cl2O7 ответсвуют кислоты HClO, HClO4:
H2O + Cl2O = 2HClO
кисо-
Cl2O7 + H2O = 2HClO4
В темноте СlО2 может сохраняться без изменений в течение длительного срока. При действии света на ClO2 в присутствии воды происходит реакция диспропорционирования:
2ClO2 + H2O = HCl + HClO3
При действии на ClO2 ультрафиолета или озона происходит образование другого взрывоопасного оксида хлора Cl2O6. Молекула ClO3 парамагнитна, поэтому в жидком состоянии димеризована полностью. В парах существуют малостабильные молекулы ClO3. Этот оксид неустойчив и разлагается на простые вещества уже при температуре плавления (tпл = 3,5° С). В чистом состоянии оксид устойчив, но взрывается при соприкосновении с органическими соединениями, бурно реагирует с водой с образованием двух кислот:
Cl2O6 + H2O = HClO3 + HClO4
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O
2ClO3 + 2NaOH = NaClO3 + NaClO4 + H2O
I2O5 – это единственный термодинамически устойчивый оксид среди оксидов галогенов ( НOf , 298 = –184,5 кДж/моль). Его получают
при нагревании иодноватой кислоты:
2НIO3 = I2O5 + Н2О
Разложение кислоты осуществляется при температуре 240° С. Выше 300° С оксид разлагается на простые вещества:
2I2O5 = 2I2 + 5О2
I2O5 быстро растворяется в воде с образованием кислоты. Одно из применений I2O5 – для определения содержания СО. Анализ основан на реакции:
5СО + I2O5 = I2 + 5СО2
в которой I2O5 проявляет окислительные свойства.
24
Кислородсодержащие кислоты галогенов:
С.о. |
Cl |
Br |
I |
+1 |
HClO |
HBrO |
HIO |
+3 |
HClO2 |
|
|
+5 |
HClO3 |
HBrO3 |
HIO3 |
+7 |
HClO4 |
HBrO4 |
H5IO6 |
|
Сравнение свойств кислот хлора: |
|
|
HClO |
HClO2 |
HClO3 |
HClO4 |
ослабление связи O - H увеличение кратности связи Cl - O
увеличение силы и устойчивости кислот ослабление окислительных свойств
Кислородсодержащие кислоты, за исключением HClO4, в свободном виде не выделены, существуют только в растворе. Кислоты неустойчивы, проявляют окислительные свойства. Самым сильным окислителем является HClO, самой устойчивой кислотой является HClO4.
Возрастание силы кислот связано с увеличением количества атомов кислорода, которые оттягивают на себя электронную плотность и прочность связи Н – О ослабевает.
При переходе от С1О– к С1О4– устойчивость анионов возрастает, так как увеличивается число электронов, принимающих участие в образовании связей С1– О (σ- и π-связей). Порядок связи хлор – кислород возрастает. Возрастает и энергия связи хлор – кислород.
Пространственная конфигурация соответствующих кислот различна, хотя во всех этих соединениях атомные орбитали хлора находятся в состоянии sp3-гибридизации. Структура ионов меняется от линейной, уголковой до пирамидальной и тетраэдрической:
C ростом степени окисления хлора уменьшается число несвязывающих электронных пар и происходит постепенное достраивание кислородного окружения хлора до тетраэдрического.
25
НГО проявляют сильные окислительные свойства, характеризующиеся большими положительными значениями стандартных окислительно-восстановительных потенциалов:
НСlО + Н+ + 2е– = Сl– |
+ Н2О |
Е° = 1,482 В |
НBrО + Н+ + 2е– = Br– |
+ Н2О |
Е° = 1,331 В |
НIО + Н+ + 2е– = I– + Н2О |
Е° = 0,987 В |
|
Самая высокая окислительная способность у хлорноватистой кислоты, за счет атомарного кислорода, который достаточно быстро выделяется в результате разложения хлорноватистой кислоты:
HСlO = HCl + O
Еще более сильные окислительные свойства хлорноватистая кислота проявляет, восстанавливаясь до хлора:
НСlО + Н+ + е– = 0,5Сl2 + Н2О; Е° = 1,63 В
Схемы разложения HСlO зависят от условий протекания процесса. На свету:
2HClO ¾свет¾¾® 2HCl + O2
В присутствии водоотнимающих средств (P2O5, H2SO4 конц.):
|
|
2HClO → Cl2O + H2O |
|
|
||
При нагревании: |
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
3HClO ¾® 2HCl + HClO3 |
|
|
|||
Все кислоты НГО – |
слабые кислоты, в ряду НС1О – НBrО – НIО |
|||||
их сила уменьшается: |
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
НС1О |
|
|
НBrО |
НIО |
|
Кдис. |
3,98 · 10– 8 |
|
2,82 · 10– 9 |
3,16 · 10– 11 |
|
|
Кислота НIО диссоциирует как по типу кислоты: НIО Н+ + IО–
так и по типу основания:
НIО ОН– + I+
Основные свойства у НIО выражены сильнее, чем кислотные. Константа диссоциации соединения по кислотному типу меньше и составляет всего лишь 3,16 · 10–11 , а по основному – 3 · 10–10 .
Окислительные свойства гипогалогенитов в щелочной среде выражены в значительно меньшей степени. Значения Е° для процессов
26
ГО– + Н2О + 2е– = Г– + 2ОН– ,
где Г – Сl, Br и I, равны соответственно 0,81; 0,761 и 0,485 В.
Соли кислот НГО более устойчивы, чем сами кислоты, хотя в растворе при комнатной температуре они медленно диспропорционируют:
3КС1О = КС1О3 + 2КС1
Гипохлорит калия термически разлагается также с выделением кислорода:
2KClO → 2KCl + O2
Гипогалогениты в растворах гидролизуются:
КС1О + Н2О НС1О + КОН (рН > 7)
Раствор хлорноватистой кислоты получают, удаляя НС1 из равновесной смеси НС1О и НС1, образующейся при взаимодействии хлора с водой, с помощью СаСО3 или НgО (в избытке) и последующей отгонкой раствора НС1О при пониженном давлении:
СаСО3 + 2НС1 + (НС1О) = СаС12 + СО2 + Н2О + (НС1О) 2НgО + 2НС1 + (НС1О) = С1– Нg– О– Нg– С1 + Н2О + (НС1О)
НС1О – очень слабая кислота и не реагирует с СаСО3 и НgО. Кислота формы НГО2 известна только для хлора. HClO2 – хло-
ристая кислота – слабая, разлагается в водных растворах, обладает слабым отбеливающим свойством:
4НС1О2 = НС1 + НС1О3 + 2С1О2 + H2O
Получают НС1О2 из ее солей хлоритов, образующихся в результате взаимодействия С1О2 со щелочью:
Ва(С1О2)2 + H2SO4 = ВаSO4↓ + 2НС1О2
Соли хлористой кислоты более устойчивы, чем сама кислота. Но при нагревании они разлагаются:
NaС1О2 = О2 + NaС1,
или диспропорционируют:
3NaС1О2 = 2NaС1О3 + NaС1
HClO3 – хлорноватая кислота – более устойчива, по силе напоминает HNO3. Получают рекцией диспропорционирования ClO2 в воде:
2С1О2 + Н2О = НС1О3 + НС1
27
НС1О3 существует только в растворах, ее содержание в водном растворе не может превышать 40 %. Хлорноватая кислота НС1О3 и особенно бромноватая кислота НВrО3 в свободном виде неустойчивы:
3НС1О3 = НС1О4 + 2С1О2 + H2O 4НВrО3 = 2Вr2 + 5О2 + 2H2O
Хлорноватую и бромноватую кислоты можно получить по обменной реакции:
6Ва(ОН)2 + 6С12 ¾t ® 5ВаС12 + Ва(С1О3)2 + 6H2O Ва(С1О3)2 + H2SO4 = ВаSO4↓ + 2НС1О3
Кислоту НВrО3 можно получить также пропуская хлор через бромную воду:
Вr2 + 5Сl2 + 6Н2О = 2НВrО3 + 10НСl
В ряду НС1О3 – НВrО3 – НIО3 сила кислот и окислительная способность уменьшается, а устойчивость кислот и солей увеличивается.
НIО3 – иодноватая кислота – устойчивое кристаллическое соединение, разлагается при нагревании с образованием оксида иода(V) и воды:
2НIО3 ¾t ® I2О5 + H2О
НIО3 можно выделить из ее солей действием серной кислоты при нагревании:
Ва(IО3)2 + H2SO4 = ВаSO4↓ + 2НIО3
Иодноватую кислоту получают также окислением иода азотной кислотой:
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O
Соли кислот НГО3 получают при пропускании хлора (брома, йода) в горячий раствор щелочи:
3Cl2 + 6KOH ¾t ® KClO3 + 5KC1 + 3H2O
Хлорат калия (бертолетова соль) KClO3 плохо растворим в холодной воде в отличие от хлорида калия КС1. При охлаждении раствора хлорат калия выпадает в осадок в виде бесцветных кристаллов. Хлораты ядовиты.
При нагревании в сухом виде хлорат калия отщепляет кислород и окисляет многие вещества:
2КС1О3 ¾t ® 2KCl + 3O2 (в присутствии катализатора MnO2)
28
При осторожном нагревании преимущественно протекает диспропорционирование:
4КС1О3 ¾t ® 3КС1О4 + КС1
КС1О3 взрывоопасен. Окислительные свойства хлората калия и его способность разлагаться при нагревании используются, например, при применении спичек:
5KСlО3 + 6P = 5KСl + 3P2О5 2KСlО3 + 3S= 2KСl + 3SО2
В ряду НС1О3 – НВrО3 – НIО3 сила кислот и окислительная способность уменьшаются, а устойчивость кислот и солей увеличивается.
Соединения НГО4 известны для всех галогенов за исключением фтора, но наиболее устойчивыми и употребимыми являются хлорная и иодная кислоты.
HClO4 – хлорная кислота – самая сильная кислота в ряду кислородсодержащих кислот хлора, является самой сильной кислотой из всех известных кислот. Хлорная кислота представляет собой дымящую на воздухе жидкость. Безводная хлорная кислота и ее сухие соли – сильные окислители. НС1О4 разлагается с взрывом (иногда даже при стоянии в темноте):
4НС1О4 = 4С1О2↑ + 3О2↑ + 2Н2O
В водных растворах НС1О4 вполне устойчива. В разбавленных растворах НС1О4 и ее соли перхлораты не проявляют окислительных свойств. При обезвоживании хлорной кислоты получают оксид хло-
ра(VII):
2НС1О4 + Р2О5 = С12О7 + 2НРО3
Кислоту можно получить реакцией обменного взаимодействия с концентрированной серной кислотой:
KClO4 + H2SO4 (конц) → HClO4 + KHSO4
Большинство перхлоратов хорошо растворяются в воде. Их получают действием НС1О4 на основания или карбонаты металлов. КС1О4 получают нагреванием хлората калия без катализатора.
При нагревании перхлораты могут разлагаться по типу реакции внутримолекулярного окисления-восстановления:
2KClO4 → 2KCl + 4O2
29
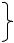
НВrО4 – бромная кислота – неустойчивая, существует только в водных растворах.
НIО4 – иодная кислота – бесцветное кристаллическое вещество, выделяется обычно в виде кристаллогидрата НIО4·2Н2О. H5IO6 – ортоиодная кислота – ведет себя как пятиосновная слабая кислота, при ее нейтрализации могут быть получены различные кислые соли.
H5IO6 можно получить из солей:
Ва5(IО6)2 + 5H2SO4 = 2Н5IО6 + 5ВаSO4↓
или гидролизом:
IF7 + 4H2O → 7HF + H5IO6
В ряду НС1О4 – НВrО4 – НIО4 (Н5IО6) кислотные свойства ослабевают, а окислительные свойства усиливаются.
Межгалогенные соединения
Галогены могут взаимодействовать между собой, образуя полярные ковалентные молекулы, состоящие из атомов двух разных галогенов. Межгалогенные соединения делят на фториды (ClF, ClF3, ClF5, BrF BrF5, IF, IF3, IF7), хлориды (BrCl, ICl, ICl3) и бромиды (IBr).
Получают их прямым синтезом:
Br2 + С12 = 2BrС1
Br2 + 5F2 = 2BrF5
Межгалогенные соединения подвергаются гидролизу:
ClF + H2O → HClO + HF
BrС1 + Н2О → НС1 + НBrО
BrF5 + 3Н2О → 5НF + НBrО3
5ICl3+ 9Н2О → 15НС1 + 3НIО3+ I2 |
(с диспропорционированием) |
|
3ICl3+ 6Н2О → 9НС1 + 2НIО3+ HI
Межгалогенные соединения являются сильными окислителями по отношению к разнообразным неорганическим и органическим веществам. Они относятся к высокотоксичным веществам.
Бигенная роль р-элементов VII А группы.
Фтор в организме человека содержится главным образом в костях и эмали зубов, он присутствует также в легких, тканях печени, сердца
30
