
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
 - N
- N
1100 H
+
N  N
N
Орбитали боковых атомов азота находятся в sp2-гибридном состоянии, атом водорода присоединяется под углом 110о. Центральный атом азота четырехвалентен, что возможно при переносе одного электрона с 2s-орбитали на р-орбиталь концевого атома азота, вследствие чего центральный атом приобретает заряд +1, а концевой - -1.
Кислота HN3 является окислителем. Ярко выраженные окислительные свойства азидоводородной кислоты можно объяснить, приняв во внимание, что она содержит азот в степени окисления +5 и -3:
−3 +5 −3
H¾N=N=N
Как и азотная кислота, HN3 растворяет металлы, стоящие в ряду напряжений после водорода. При взаимодействии с металлами образует соль металла, азот и аммиак, образующий соль с избытком HN3:
4HN3 + Cu = Cu(N3)2 + N2 + (NH4)N3
Смесь азидоводородной кислоты с концентрированной соляной кислотой при нагревании растворяет золото и платину, т.е. ведет себя аналогично «царской водке»:
Pt + 2HN3 + 8HCl = H2[PtCl6] + 2N2 + 2NH4Cl
Окислительные свойства обусловлены образованием атомарного хлора при взаимодействии HN3 и HCl:
HN3 + 2HCl = Cl2 + N2 + NH3
Соли азидоводородной кислоты называются азидами. Азиды щелочных металлов устойчивы и по свойствам напоминают галогениды. Азиды тяжёлых металлов неустойчивы, при нагревании или ударе взрываются. На этом основано применение, например, азида свинца Pb(N3)2 в качестве детонатора:
Pb(N3)2 = Pb + 3N2
Азиды щелочных металлов термодинамически неустойчивы, однако кинетически инертны. Их используют в подушках безопасности. Сильными окислителями HN3 окисляется, как и все соединения азота с отрицательной степенью окисления, до свободного азота:
10HN3 + 2KMnO4 + 3H2SO4 = 15N2 + 2MnSO4 + K2SO4 + 8H2O
81

Оксиды азота
В отличие от других элементов азот образует большое число ок-
сидов: N2O, NO, N2O3, NO2, N2O4, N2O5.
Стандартная энергия Гиббса образования G оf , 298 всех оксидов
больше нуля. Поэтому при обычных условиях непосредственным взаимодействием азота с кислородом (N2 + O2) оксиды получить нельзя. Однако анализ термодинамических характеристик реакции образования NO:
N2 + O2 ¾t ® 2NO
( H о298 = 180,6 кДж, S о298 = 24 Дж/К) свидетельствует о том, что реакция протекает с возрастанием энтропии и возможна при высокой
температуре, так как с увеличением температуры G о298 может стать меньше нуля (t > 7000° С). Взаимодействие азота с кислородом с образованием NO реально можно проводить при 3000оС:
Классификация оксидов азота:
N2O |
NO |
N2O3 |
NO2, N2O4 |
N2O5 |
несолеобразующие |
|
кислотные |
|
|
|
|
HNO2 |
|
HNO3 |
|
|
Азотистая |
|
Азотная |
|
|
кислота |
|
кислота |
N2O оксид азота (I). Строение молекулы. Молекула N2O линейная, орбитали центрального атома азота находятся в состоянии sp- гибридизации, строение молекулы описывается при помощи двух резонансных структур:
N– =N+=O или N≡N+→O−
Формально атомы азота в N2O имеют разные степени окисления и валентности, для N– =N+=O:
2p
2s
N + 
N O
82
Связь между атомами азота (0,113 нм) сравнима с длиной тройной связи.
Физические свойства N2O. Бесцветный газ, без запаха, сладковатый на вкус, сравнительно малорастворим в воде, при 0° С 1 объем газа растворяется в 1 объеме воды. При вдыхании вызывает судорожный смех, поэтому имеет название «веселящий газ».
Химические свойства. Несолеобразующий оксид. Инертное соединение, при обычной температуре не реагирует с галогенами, с водой, щелочами. При нагревании N2O выше 500° С разлагается с выделением кислорода:
2N2O ¾t ® 2N2 + O2
Поэтому N2O при повышенной температуре проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и горит сера, фосфор:
P4 + 10N2O → P4O10 + N2
Взаимодействует с водородом:
N2O + H2 = N2 + H2O
При поджигании смеси оксида азота(I) и аммиака происходит взрыв:
3N2O + 2NH3 = 4N2 + 3H2O
При взаимодействии с сильными окислителями N2O проявляет
восстановительные свойства:
5N2O + 2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O.
Получают оксид азота(I) нагреванием (250оC) предварительно очищенного от примесей нитрата аммония:
NH4NO3 ¾¾®to N2O + 2H2O.
или взаимодействием сульфаминовой кислоты с концентрированной
HNO3:
(H2N)HSO3 + HNO3 → N2O + H2SO4 + H2O
Оксид азота(I) применяется в медицине в качестве анестезирующего средства.
NO оксид азота (II). В соответствии с методом валентных связей между атомами азота и кислорода образуются две связи по обменному механизму:
83
2p
2s
O
N
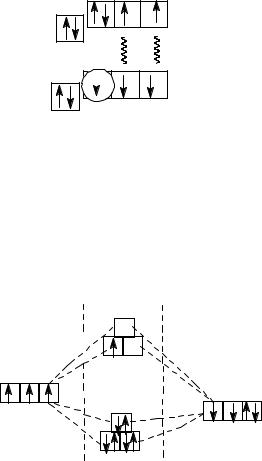
Молекула NO парамагнитна. Благодаря наличию неспаренного электрона и неподеленной электронной пары молекула NO очень реакционноспособна. Удаление электрона приводит к образованию более устойчивого диамагнитного катиона нитрозила NO+. Образование NO+ в соответствии с методом молекулярных орбиталей сопровождается упрочнением и укорочением связи, так как при образовании катиона NO+ удаляется электрон с разрыхляющей орбитали (рис. 3.3):
АО( N ) |
МО ( N O) |
АО( O ) |
|
σразр. |
|||
|
|
||
|
2p |
|
|
|
π разр. |
|
|
|
2p |
|
|
2p |
св. |
|
|
|
σ 2p |
|
π св. |
2p |
Рис. 3.3. Энергетическая диаграмма молекулы NO
Физические свойства NО. Бесцветный газ без запаха, малорастворим в воде, очень токсичный.
Химические свойства NО. Несолеобразующий оксид, не реагирует с водой, щелочами. Очень легко окисляется на воздухе, приобретая коричневую окраску из-за образования NО2:
2NО + О2 = 2NО2
Проявляет окислительные свойства:
2NО + 2H2 = N2 + 2H2O.
Окисляется галогенами:
NO + С12 = 2NO+С1– (хлорид нитрозила, галогенангидрид азотистой кислоты)
84
NOCl − оранжево-жёлтый газ (tпл = −60оС, tкип = −5,4оС), обладает сильными окислительными и хлорирующими свойствами за счёт дис-
социации на NO и Cl∙. В воде вещество разлагается:
NOС1 + H2O = НNO2 + НС1
За счет свободной пары электронов NO образует комплексные соединения:
[Fe(H2O)6]SO4 + NO [Fe(H2O)5NO]SO4 + Н2О.
В данной реакции образуется бурый комплекс. Реакция является качественной на NO и катион Fe2+.
Получение в промышленности. NO получают каталитическим окислением аммиака:
4NH3 + 5O2 ¾кат¾¾.,t o ® 4NO + 6H2O (катализатор Pt или Cr2O3, Fe2O3).
Получение в лаборатории. Действие разбавленной азотной кислоты на металлы:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
NO – образуется из элементов при электрических разрядах:
N2 + О2 2NO; ∆Η˚ = 180,6 кДж
В природе NO образуется в атмосфере при грозовых разрядах, а также при сгорании топлива в бензиновых двигателях. Реакция протекает с затратой энергии.
N2О3 оксид азота (III). Физические свойства N2O3. Неустойчивая тёмно-синяя жидкость не имеющая постоянной температуры кипения
(tкрист.= –100 оС). В твёрдом состоянии – это ионное соединение [NO]+[NO2]– (нитрит нитрозила). Оксид существует без разложения
только в твёрдом состоянии. При стандартных условиях полученная плавлением N2О3 жидкость содержит равновесную смесь NO, NО2, N2O4, N2О3, выше 40оС полностью разлагается с образованием NO и NO2:
N O NO + NO ; |
Н |
о |
= –41,2 кДж |
||
2 |
3 |
2 |
|
298 |
|
При понижении температуры протекает обратный процесс. Химические свойства. Оксид азота(III) – типичный кислотный
оксид, хорошо растворим в воде. При взаимодействии с водой и растворами оснований дает азотистую кислоту и нитриты:
N2О3 + Н2О = 2НNО2,
N2О3 + 2NaOH = 2NaNО2 + H2O.
85
Получение. N2O3 можно получить конденсацией при низких температурах стехиометрической смеси NO и NO2:
NO + NO2 |
охлаждение |
N2O3. |
|
NО2 оксид азота(IV). Физические свойства. Ядовитый газ бурого
цвета с резким запахом, tпл. = -11,2° С, tкип. = 21° С, даже в парах содержит примесь димера N2O4. Жидкий и твердый N2O4 бесцветен.
Химические свойства. При охлаждении димеризуется:
охлаждение
2NO2(г)  N2O4(ж)
N2O4(ж)
нагревание
Склонность к димеризации обусловлена наличием неспаренного электрона в молекуле NO2 (рис.3.4):
2p
2s
O
N |
|
|
|
|
N |
O |
O |
O |
Рис. 3.4. Механизм образования связей и строение молекулы NO2
В воде на холоде NО2 обратимо диспропорционирует:
2NО2 + Н2О НNО2 + HNO3
При растворении в теплой воде:
2NО2 + Н2О ¾¾®to НNО3 + NO
Со щелочами:
2NО2 + 2КОН = КNО3 + КNО2 + Н2О В воде и в щелочи в присутствии кислорода:
4NО2 + 2Н2О + О2 = 4НNО3 4NО2 + 4NaOH + О2 = 4NaNО3+ 2Н2О
Диоксид азота является довольно сильным окислителем. В атмосфере NO2 горят сера, фосфор, углерод:
86
2NO2 + 2S = N2 + 2SО2
NO2 + SО2 = NО + SО3
Получение в промышленности:
2NО + О2 = 2NО2.
В лаборатории получают взаимодействием концентрированной азотной кислоты с тяжелыми металлами, разложением нитратов:
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
N2О5 оксид азота(V). Физические свойства. Бесцветные кристаллы, tпл = +30,33° С, выше 30,33° С разлагается:
2N2О5 = 4NО2 + О2
Химические свойства. Кислотный оксид:
N2О5+ Н2О = 2НNО3
Оксид азота(V) – сильный окислитель, металлы превращает в оксиды, органические вещества воспламеняются. Сильные восстановители восстанавливают N2О5 до азота:
N2О5 + SО2 = N2 + SО3 + 2О2
2N2О5+ C = CO2 + 4NО2
Получение. N2О5 получают из азотной кислоты обезвоживанием ее фосфорным ангидридом или окислением оксида азота(IV) озоном:
|
|
|
2HNO3 + P2O5 = N2О5+2HPO3; |
|
|
|
N2О4 + О3 = N2О5 + О2. |
|
O-0,5 |
Азотистая кислота НNО2. Строение молекулы. |
|
|
Нитрит-ион NO 2− имеет угловое строение, атом азота |
||
|
|
|
|
|
|
|
|
|
|
|
находится в состоянии sp2-гибридизации с валентным |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
углом ONO, равным 109°. У атома азота имеется непо- |
|
-0,5O |
деленная пара электронов. Орбиталь с неподелённой |
||
электронной парой доступно расположена в пространстве. Это определяет высокую донорную способность NO −2 -иона и активное его уча-
стие в окислительно-восстановительных реакциях.
Физические свойства. HNO2 в чистом виде не выделена, азотистая кислота существует только в разбавленных водных растворах.
87
Химические свойства. В водных растворах HNO2 проявляет свойства слабой кислоты:
HNO2 Н+ + NO −2 (Кдис. = 4 10-4).
Взаимодействие с основаниями:
HNO2 + NaOH = NaNO2 + H2O.
Разложение при нагревании:
3HNO2 ¾t ® HNO3 + 2NO + H2O
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью. В соответствии со значением E˚ HNO2 – достаточно сильный окислитель, обычно восстанавливается до NO:
HNO2+ Н+ + ē = NO + H2O; E˚= 0,983 В
2НNO2 + 2KI + H2SO4 = K2SO4 + I2 + 2NO + 2H2O
С сильными окислителями может проявлять восстановительные свойства, окисляясь до NO 3− :
NO 3− + 3Н+ + 2ē = HNO2+ H2O; E˚= 0,934 В:
HNO2 + Cl2 + H2O = HNO3 + 2HCl;
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O.
Получение. На холоде из растворов солей:
AgNO2 + HCl = AgCl + HNO2
Действие серной разбавленной кислоты на нитриты:
NaNO2 + H2SO4 = Na2SO4 + HNO2
Растворение в воде смеси оксидов NO2 и NO:
NO2 + NO + H2O = 2HNO2
Соли азотистой кислоты – нитриты – более устойчивы, чем кислота. Нитриты щелочных, щелочноземельных металлов и аммония – бесцветные или желтоватые кристаллические вещества, хорошо растворимые в воде и плавящиеся без разложения (исключение – нитрит аммония). Получают нитриты при пропускании через щелочь смеси оксидов азота(II) и (IV), при разложении нитратов:
NO2 + NO + 2NаОН = 2NаNO2 + H2O
88

2KNO3 = 2KNO2 + O2
Нитриты переходных металлов в воде малорастворимы, их можно получить реакцией обмена:
NaNO2 + AgNO3= 2AgNO2↓ + NaNO3
Растворимые нитриты подвергаются гидролизу:
NaNO2 + H2O NaОН + HNO2;
NO −2 + H2O ОН– + HNO2.
Соли азотистой кислоты, также как и кислота, обладают окисли- тельно-восстановительной двойственностью. Восстановительные свойства:
5KNO2 + 2KMnO4 + 3H2SO4 (разб.) = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
Окислительные свойства:
2КNO2 + 2KI + 2H2SO4 = I2 + 2NO + 2К2SO4 + 2H2O
NaNO2 + 3Zn + 5NaOH + 5H2O = NH3 + 3Na2[Zn(OH)4]
Нитриты обладают токсичностью. Под воздействием нитритов гемоглобин теряет способность связывать и переносить кислород, таким образом, нитриты вызывают кислородную недостаточность, они служат причиной образования в продуктах питания нитрозааминов R2N–NO – канцерогенных веществ. В то же время в очень небольших количествах некоторые неорганические нитриты (NаNO2) и органические нитраты (нитроглицерин) улучшают коронарное кровообращение и применяются для профилактики при ишемической болезни сердца и снятия приступов стенокардии.
Азотная кислота HNO3. Строение молекулы. Атом азота в моле-
куле азотной кислоты находится в состоянии sp2-гибридизации(рис. 3.5):
2p |
2s |
2p |
|
O |
|||
2s |
|
||
O |
|
1s |
|
|
|
H |
|
N |
|
O |
|
|
|
||
|
H |
O N |
|
O |
|
O |
Рис. 3.5. Механизм образования связей и строение HNO3
89

Азот образует 4 связи. Так как атом азота не имеет d-орбиталей, он не способен образовывать больше четырёх ковалентных связей. В HNO3 валентность азота равна 4, степень окисления +5, оба негидроксидных атома кислорода связаны с атомом азота равноценно и имеют порядок связи, равный 1,5. π-связь является делокализованной трехцентровой.
Нитрат-ион − NО3− − имеет строение равностороннего треугольника:
-2/3 |
Геометрическая форма иона NО3− обусловлена sp2- |
|||||
O |
гибридизацией атомных орбиталей азота. В рас- |
|||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
+ |
сматриваемом ионе три σ-связи и одна делокализо- |
|||
N |
||||||
-2/3 |
|
|
O-2/3 ванная π-связь. Кратность связи N–O равна 1 |
1 |
|
|
O |
, а её |
|||||
|
||||||
|
|
|
3 |
|
||
длина составляет 0,122 нм. Положительный заряд атома азота вызывает смещение электронной плотности от атомов кислорода, что сильно понижает их донорные свойства. Поэтому нитрат-ион не образует прочной связи с ионом водорода (азотная кислота – сильный электролит).
Физические свойства. Летучая бесцветная жидкость, неограниченно растворимая в воде, имеет резкий запах, tпл = –41°C; tкип = 82,6° С, ρ = 1,52 г/см3. Часто бывает окрашена в желтый цвет изза наличия NO2.
Химические свойства. Реакции, характерные для кислот:
2HNO3 + CuO = Cu(NO3)2 + H2O
2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O
HNO3 + NH3 = NH4NO3
Специфические свойства. При взаимодействии с металлами и неметаллами HNO3 проявляет свойства кислот-окислителей, при ее восстановлении с увеличением активности восстановителя образуется преимущественно продукт восстановления с более низкой степенью окисления азота в соответствии со схемой:
90
