
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
Окислительные свойства. Углем при высоких температурах восстанавливается до угарного газа:
С + СО2 ¾¾®t o . 2СО
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C
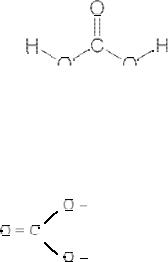
CO2 + 2NH3 = CO(NH2)2 + H2O (карбамид, мочевина) :
N H 2
O  С
С
N H 2
Мочевина разлагается водой:
CO(NH2)2 + 2H2O → (NH4)2CO3 → 2NH3 + СО2
Фотосинтез глюкозы на свету при участии хлорофилла:
6CO2 + 6H2O → C6H12O6 + 6O2−
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Сначала образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Диоксид углерода относится к «парниковым газам». Увеличение количества СО2 в атмосфере может привести к повышению температуры атмосферы. Коротковолновое излучение Солнца нагревает Землю, а тепловое излучение Земли, более длинноволновое, способно поглощаться молекулами СО2. В результате наблюдается повышение температуры атмосферы, а явление в целом называется «парниковым эффектом».
Диокси<д триуглеро<даC3O2 – бесцветный ядовитый газ с резким, удушливым запахом. с образованием продукта,. Молекула имеет линейное строение O=C=C=C=O, неполярна, атомы углерода в ней находятся в состоянии sp-гибридизации. Помимо σsp-sp-связей возникают πp-p-связи, плоскости симметрии p-облаков которых расположены взаимно перпендикулярно. При хранении диоксид триуглерода полиме-
131
ризуется с образованием нерастворимого в воде полимера (C3O2)n жёлтого, красного или фиолетового цвета.
При повышении температуры диоксид триуглерода разлагается:
C3O2 = CO2 + 2C
При растворении углекислого газа в воде образуется слабая угольная кислота Н2СО3. Углекислый газ в воде находится преимущественно в виде гидратированных молекул СО2 и лишь в незначительной степени в форме угольной кислоты. При этом в растворе устанавливается равновесие:
СО2 (г) + Н2О СО2 · Н2О Н2СО3
Угольная кислота – слабая неустойчивая
кислота, которую в свободном состоянии из





 водных растворов выделить нельзя, проявляет свойства слабых кислот, диссоциирует ступенчато и обратимо:
водных растворов выделить нельзя, проявляет свойства слабых кислот, диссоциирует ступенчато и обратимо:
I ступень Н2СО3 Н+ + HCO 3− ; К1 = 4×10-7
II ступень HCO 3− H+ + CO 32− ; К2 = 4,8×10-11
Как двухосновная кислота, образует два типа со-
лей: карбонаты и гидрокарбонаты. Карбонат-ион имеет форму правильного плоского треугольника. Три sp2-гибридные орбитали атома углерода участвуют в образовании трех σ- связей с атомами кислорода, ос-
тавшаяся р-орбиталь углерода перекрывается с р-орбиталью кислорода c образованием π-связи.
Карбонаты двухвалентных металлов плохо растворимы в воде, но их растворимость повышается в присутствии углекислого газа за счет образования гидрокарбонатов:
СаСО3 + СО2 + Н2О = Са(НСО3)2
Карбонаты металлов при нагревании разлагаются с образованием оксидов:
MgCO3 = MgO + CO2
Температура разложения карбонатов повышается по мере усиления металлических свойств катиона и ионного характера связи, карбонаты щелочных металлов плавятся без разложения. Так температуры разложения растут в ряду
MgCO3 (230oC) < MnCO3 < FeCO3 < CaCO3 < SrCO3 < BaCO3 (1300oC).
132
Гидрокарбонаты разлагаются до карбонатов:
2NaHCO3 = Na2CO3 + H2O + CO2
Растворимые карбонаты подвергаются гидролизу по аниону:
CO 32 − + H2O HCO 3− + ОН– (І ступень)
в молекулярной форме:
Na2CO3 + H2O NaНCO3 + NaОН
в растворе соли избыток ионов ОН– , среда щелочная, рН > 7.
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Сr3+, Al3+, Fe3+, Ti4+, Zr4+ и др.
Качественной реакцией на карбонат- и гидрокарбонат-ионы является их взаимодействие с сильной кислотой, наблюдается образование углекислого газа с характерным вскипанием:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = CO2↑ + H2O
Практическое значение имеют соли - Na2CO3 (сода), CaCO3 (мел, мрамор, известняк), K2CO3 (поташ), NaHCO3 (питьевая сода), Са(НСО3)2 и Mg(HCO3)2 обусловливают карбонатную жесткость воды.
Соединения углерода с отрицательной степенью окисления -
карбиды. Карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам:
1) Ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет В4С– черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифоваль-
133
ных материалов и в качестве полупроводника. Карбид бора, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах.
2) Ионноковалентные (солеобразные) карбиды с преимуществен-
но ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Ионный характер связи приводит к высокой температуре плавления. Карбид кальция СаС2, например, плавится при 2300° С, карбид тория ThC2 – при 2655° С.
Ионноковалентные карбиды разлагаются водой с образованием гидроксидов металлов и выделением газа. В зависимости от того, какой выделяется газ, ионноковалентные карбиды делят на метаниды
(Al4C3, Ве2С), ацетилениды (СаС2), смешанные карбиды.
Взаимодействие карбидов щелочных металлов с водой протекает бурно. Так, если карбид калия просто облить водой, произойдет реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию
К2С2 + 2Н2О = 2КОН + С2Н2
надо медленно пропускать над карбидом водяной пар. Самый известный пример гидролиза – получение ацетилена из карбида кальция (процесс проводят при сварочных работах):
СаС2 + 2Н2О = Ca(OH)2 + С2Н2
Ацетилен выделяется также при гидролизе Na2C2, К2С2, MgC2 и др. Поэтому такие карбиды (ацетилениды) можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла.
При гидролизе метанидов выделяется СН4: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Be2C+ 4H2O → 2Be(OH)2 + CH4
Иногда при гидролизе ионноковалентных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. Карбид магния состава Mg2C3 дает при гидролизе метилацетилен:
Mg2C3 + 4H2O = 2Mg(OH)2+ НС=С– СН3
134
Получение ионноковалентных карбидов. Многие карбиды можно получить непосредственно из элементов:
Са + 2С = СаС2 восстановлением оксидов углеродом:
СаО + 3С = СаС2 + СО Ацетилениды можно получить действием ацетилена на активные
металлы:
Zn + С2Н2 = ZnC2 + Н2
При взаимодействии ацетилена с солями:
С2Н2+ 2AgNO3 = Ag2C2 + 2HNO3
3) Металлоподобные карбиды (карбиды внедрения), которые об-
разуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения, в которых атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды часто отличаются большой твердостью и очень высокими температурами плавления. Карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид марганца разлагается водой с выделением почти равных количеств водорода и метана:
Mn3C + 6H2O = 3Mn(OH)2 + CH4 + H2
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических
135
алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1. Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
Карбонилы. Атом металла в карбониле находится в нулевой степени окисления, при этом d-элементы с чётным числом валентных электронов образуют одноядерные, а с нечётным – двухъядерные карбонилы со связью металл-металл. Химическая связь между атомом металла и молекулами СО образуется по донорно-акцепторному механизму, имеет место π-перекрывание по дативному механихму за счет электронных пар атома металла и вакантных орбиталей молекул СО (метод МО).
Карбонилы никеля Ni(CO)4, железа Fe(CO)5, осмия Os(CO)5, рутения Ru(CO)5 – жидкости; хрома Cr(CO)6, кобальта Со2(СО)8, марганца Mn2(CO)10 и др. – кристаллические вещества. Карбонилы диамагнитны, летучи, чрезвычайно токсичны, хорошо растворимы в органических растворителях, но, как правило, плохо растворимы в воде.
Общий способ получения карбонилов металлов заключается во взаимодействии оксида углерода CO с металлами или их солями при повышенных температурах и давлении. В частности, для получения Fe(CO)5 необходимы температура порядка 180–220°C и давление
1·107–2·10 7 Па; для Co2(CO)8 – 150–200°C и 2,5·107 Па; сравнительно легко можно получить тетракарбонил никеля Ni(CO)4, образующийся уже при 60-80°C.
5CO + Fe ¾¾®t o . [Fe(CO)5] (пентакарбонил железа) Наибольшее техническое значение имеют карбонилы никеля
Ni(CO)4, кобальта Со2(СО)8 и железа Fe(CO)5. Карбонилы применяют для получения чистых металлов, образующихся при их термическом разложении:
[Ni(CO)4] ¾t ® 4CO + Ni
Соединения углерода с галогенами. Углерод непосредственно реагирует только с фтором:
С + 2F2 = CF4
136

Тетрафторид углерода CF4 – очень инертный газ (tкип = −128оС). Он не реагирует ни с кислотами, ни со щелочами. Поэтому его, как и другие фторсодержащие соединения, в частности, CF2Cl2 (tпл =
= −155оС, tкип = −30оС) используют в качестве фреонов – рабочих веществ в холодильных машинах. Большое практическое применение
находят фторопласты, в частности тефлон используют для изготовления химически инертной посуды и аппаратуры. Тефлон получают по-
лимеризацией тетрафторэтилена CF2 CF2. На тефлон не действует кипящая HNO3 и расплавленная NaOH, он устойчив до 320оС.
Тетрахлорид углерода CCl4 – негорючая жидкость (tкип = 76оС), получают хлорированием метана на свету:
CH4 + 2Cl2 ¾¾®hν CCl4 + 4HCl
Молекулы тетрагалогенидов углерода образуются с участием sp3- гибридных орбиталей атомов углерода и имеют форму тетраэдра. Координационная насыщенность атомов углерода определяет кинетическую инертность и низкую реакционную способностью тетрагалогенидов. CCl4 менее устойчив, чем CF4.. Однако тетрахлорид углерода также не разлагается щелочами и кислотами. CCl4 широко используют в качестве неполярного растворителя.
Тетрабромид углерода CBr4 получают аналогично CCl4:
СH4 + 4Br2 ¾¾®hν CBr4+ 4HBr
CBr4 при комнатной температуре представляет собой бледножелтое твердое вещество (tпл = 93оС). Оно не растворяется в воде и полярных растворителях. При нагревании до 200оС разлагается.
Тетраиодид углерода CI4 можно получить по реакции: CCl4 + 4C2H5I = CI4 + 4C2H5Cl (катализатор AlCl3)
CI4 – светло-красное кристаллическое вещество с запахом иода. При нагревании и на свету CI4 разрушается:
2CI4 = 2I2 + C2I4
Уменьшение термической устойчивости и повышение реакционной способности тетрагалогенидов в ряду CF4 > CCl4 > CBr4 > CI4 коррелирует с изменением энтальпии связи С– Г (кДж/моль):
C – F (–487), C – Cl (–340), C – Br (–285), |
C – I (–214). |
Практическое значение имеют продукты неполного галогенирования метана – хлороформ CHCl3 (растворитель и средство для анестезии) и иодоформ CHI3 (антисептик).
137
Фосген СОCl2 – хлорангидрид угольной кислоты. Это бесцветный газ (tкип = 8,2оС) с запахом прелого сена, плохо растворим в воде и медленно реагирует с ней с образованием двух кислот:
COCl2 + H2O = 2HCl + H2CO3
В водных растворах щелочей фосген моментально гидролизуется:
COCl2 + 4KOH = K2CO3 + 2KCl + 2H2O
Фосген – важный промежуточный продукт в промышленной химии, применяется как сырьё в производстве красителей, мочевины, изоционатов, безводных хлоридов металлов, пестицидов, лекарств и растворителей. Фосген является отравляющим веществом удушающего действия.
Циановодород (HCN). Циановодород (водный раствор – синильная кислота) - излюбленное вещество всех отравителей. Сама кислота или ее соли, так называемые цианиды - сильные и очень быстрые яды, они замедляют ферментные процессы в клетках, связывают гемоглобин в циангемоглобин, парализуют дыхательный центр и вызывают удушье. Жидкий циановодород является неэлектролитом, так как вследствие наличия водородных связей его собственная ионизация ничтожно мала. В жидком состоянии HCN представляет смесь двух изомерных форм – нормальной и изоформы. В нормальной форме атом водорода связан с четырехвалентным углеродом ( H − C ≡ N ), а в изоформе водород соединен с азотом (H-N≡C), а углерод имеет ковалентность, равную трем. Обе формы находятся в динамическом равновесии и легко переходят друг в друга. Высокую токсичность циановодорода связывают именно с изоформой.
Физические свойства циановодорода. Циановодород – бесцвет-
ная легкокипящая жидкость с запахом горького миндаля. Смешивается с водой во всех отношениях.
Химические свойства циановодорода. Синильная кислота явля-
ется слабой кислотой (Кдис = 5,04 10-10).
HCN подвергается гидролизу. При гидролизе разрываются связи между углеродом и азотом, водород присоединяется к азоту, а оксо- и гидроксогруппы к углероду:
HCN + 2H2O = HCOOH + NH3
В зависимости от условий взаимодействия с воздухом образует углекислый газ, азот и воду или дициан и воду:
4HCN + 5O2 = 4CO2 + 2N2 + 2H2O
138
4HCN + O2 (150°C, Ag) = 2C 2N2 + 2H2O
Со щелочами образует соли цианиды:
HCN + NaOH = NaCN + H2O
При пропускании через раствор концентрированной серной кислоты образует оксид углерода(II) и гидросульфат аммония:
HCN + H2O + H2SO4 = CO + NH4HSO4
Получение циановодорода. Прямой синтез из аммиака и метана в присутствии воздуха и платинового катализатора при высокой температуре:
2CH4 + 2NH3 + 3O2 ¾t¾®,Pt 2HCN + 6H2O
Синтез из аммиака и метана в присутствии платинового катализатора при высокой температуре:
CH4 + NH3 ¾t¾®,Pt HCN + 3H2
Взаимодействие оксида углерода(II) с аммиаком:
CO + NH3 ¾t¾,ThO¾2 ® HCN + H2O
Взаимодействие водорода с дицианом:
H2+ (CN)2 = 2HCN
Синильная кислота выделяется в результате гидролиза или вытеснения цианидов из их солей:
KCN + H2O HCN + КOH
CN– + H2O HCN + OH–
KCN + H2O + CO2 = KHCO3 + HCN
Получение цианидов:
Na2CO3 + C + NH3 ¾t ® NaCN + H2O
NaNH2 + C ¾t ® NaCN + H2
Ион CN− (изоэлектронный молекуле СО) входит как лиганд в большое число комплексных соединений d-элементов. Комплексные цианиды в растворах стабильны, например K3[Fe(CN)6] (красная кровяная соль), K4[Fe(CN)6] (желтая кровяная соль). Цианид-ион является лигандом сильного поля. Ион CN− является не только σ-донором, но и π-акцептором электронных пар катионов-комплексообразователей.
139
Многие металлы при действии избытка цианида калия или цианида натрия образуют комплексные соединения, что используется, например, для извлечения золота и серебра из руд при промышленном получении золота. Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
4Au + 8KCN + 2H2O + O2 → 4K[Au(CN)2] + 4KOH
Цианоаураты легко восстанавливаются до чистого золота:
2K[Au(CN)2] + Zn = K2[Zn(CN)4] + 2Au
Дициан. Соединение углерода с азотом (СN)2 или С2N2 – дициан, (циан) - легко воспламеняющийся бесцветный газ с запахом миндаля; tпл = −27,8°C; tкип = −21,15°C; ограниченно растворим в воде, лучше – в спирте, эфире, уксусной кислоте. Строение молекулы:
N≡C-C≡N
Дициан по свойствам похож на галогены в молекулярной форме Г2. Так, в щелочной среде он, подобно галогенам, диспропорционирует с образованием цианида и цианата:
(CN)2 + 2KOH = KCN + KCNO + H2O
Чистый сухой дициан получают путем нагревания сулемы HgCl2 с цианидом ртути (II):
HgCl2 + Hg(CN)2 → Hg2Cl2 + (СN)2
Другие способы получения:
4HCNг + О2 ¾¾Ag¾, t ® 2(CN)2 +2H2O
2HCNг + Сl2 ¾активирова¾¾¾нный¾¾уголь¾® (CN)2 + 2HCl
Hg(CN)2 ¾t ® Hg + (СN)2
При окислении цианиды образуют соли – цианаты. Цианаты – производные циановой кислоты HCNO, существующей в виде 2х изомерных модификаций: циановой (HO–CN) и изоциановой (HN=C=O) кислот. Соли цианаты, а также сама циановая кислота в жидком состоянии содержат таутомерную смесь обоих изомеров, в твёрдом состоянии преобладает изомер НN=C=O. В разбавленных водных растворах циановая кислота легко гидролизуется (особенно быстро в присутствии минеральных кислот):
140
