
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
Тема 4. р - ЭЛЕМЕНТЫ IV А ГРУППЫ
Общая характеристика элементов
Сокращенная электронная конфигурация … ns2np2. На внешнем электронном уровне атомов 4 электрона. В невозбужденном состоянии атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные р-орбитали, то при переходе в возбужденное состояние электроны s-подуровней распари-
ваются: |
s |
|
p |
|
|
s |
|
p |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные характеристики атомов элементов IVА группы представлены в таблице 4.1.
Таблица 4.1
Основные характеристики атомов
Характеристика |
|
C |
|
|
Si |
Ge |
Sn |
Pb |
|
|
|
|
|
|
|
|
|
||
Валентные электроны |
|
2s22р2 |
|
3s23p2 |
4s24p2 |
5s25p2 |
6s26p2 |
||
Ковалентный радиус, нм |
|
0,077 |
|
0,111 |
0,122 |
0,141 |
0,147 |
||
|
|
увеличение |
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
Металлический радиус, нм |
|
- |
|
|
0,134 |
0,139 |
0,158 |
0,175 |
|
|
|
|
|
|
|
|
|
||
|
|
увеличение |
|
|
|
|
|||
|
|
|
|
|
|
||||
Энергия ионизации I1, кДж/моль |
1086,45 |
|
786,52 |
762,18 |
708,58 |
715,6 |
|||
Сродство к электрону Ее_, |
121,77 |
|
134,07 |
118,94 |
107,30 |
35,12 |
|||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
уменьшение |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Электроотрицательность |
χ |
|
|
|
|
|
|
1,8 |
|
(по шкале Полинга)χ |
|
2,55 |
|
1,90 |
2,01 |
1,96 |
|
||
Температура плавления, оС |
|
4489* |
|
1414 |
938,25 |
231,93 |
327,46 |
||
Агрегатные состояния |
|
|
|
|
Твердые вещества |
|
|
||
Ео, В (Э2+ + 2е– = Э) |
|
– |
|
|
– |
0,24 |
–0,138 |
–0,126 |
|
Содержание в литосфере, W,% |
2·10 |
-2 |
|
28,2 |
1,5·10-4 |
2,3·10-4 |
1,4·10 |
-3 |
|
|
|
|
|
|
|||||
Характерные степени окисле- |
–4 , +2, |
|
–4, +2, |
+2, +4 |
+2, +4 |
+2, +4 |
|||
ния в соединениях |
|
+4 |
|
|
+4 |
||||
|
|
|
|
|
|
|
|
|
|
*графит, под давлением 10,3 ГПа.
Вподгруппе с ростом порядкового номера проявляется тенденция
куменьшению энергии ионизации, электроотрицательности атомов, увеличению ковалентного и металлического радиусов. Неметаллические свойства элементов ослабевают, а металлические усиливаются.
121
Углерод и кремний относят к неметаллам, германий, олово и свинец – к металлам.
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и –4, а также +2. Для свинца +2 - наиболее характерная степень окисления. Для углерода, кремния и германия наиболее типична степень окисления +4. Степень окисления –4 в последовательности C – Pb становится все менее характерной.
Углерод. Аллотропия.
Углерод встречается в свободном состоянии – в форме графита и алмаза, входит в состав атмосферы в виде углекислого газа, содержится в природных карбонатах, каменном и буром угле, нефти и природном газе. Он является составной частью всех органических соединений, входит в состав всех живых организмов на Земле, это элемент жизни.
Углерод имеет следующие основные аллотропные модификации:
алмаз, графит, карбин, графен, фуллерены.
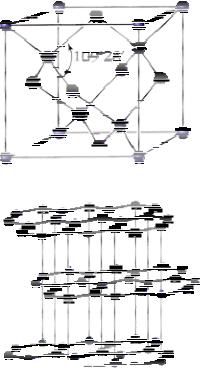
Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, самое твёрдое из природных веществ, не проводит 

 электрический ток, плохо проводит тепло, ρ
электрический ток, плохо проводит тепло, ρ
= 3,5 г/см3; tпл. = 3730°C; tкип = 4830°C. Физи-
ческие свойства алмаза обусловлены его
строением. В структуре алмаза каждый атом
углерода находится в состоянии sp3-
гибридизации и окружен четырьмя такими же атомами углерода, которые расположены





 в вершинах правильного тетраэдра (атомная кристаллическая решетка).
в вершинах правильного тетраэдра (атомная кристаллическая решетка).
Графит – мягкое вещество серого цве-
та со слабым металлическим блеском, жир-
ное на ощупь, проводит электрический ток;
ρ = 2,5 г/см3. Атомы углерода находятся в
состоянии sp2-гибридизации и связаны в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие пчелиных сот. Каждый атом в слое образует




 три ковалентные связи с соседними атомами углерода. Для образования трех ковалентных связей атом углерода предоставляет три электрона. Четвертая негибридная р-орбиталь атома углерода, располагающаяся перпендикулярно плоскости перекры-
три ковалентные связи с соседними атомами углерода. Для образования трех ковалентных связей атом углерода предоставляет три электрона. Четвертая негибридная р-орбиталь атома углерода, располагающаяся перпендикулярно плоскости перекры-
122
вания sp2-гибридных орбиталей, перекрывается своими боковыми областями с тремя подобными орбиталями трех соседних атомов. Таким образом, выше и ниже плоскости находятся единые для всех атомов углерода зоны π-перекрывания. В этом общем электронном облаке электроны уже не относятся к какому-либо определенному атому углерода, а принадлежат всем атомам, находящимся на плоскости. Графит проводит электрический ток по слою атомов, но не между слоями. В графите слои атомов легко скользят относительно друг друга. Когда пишут графитовым карандашом по бумаге, на ней остаются сместившиеся и прилипшие к бумаге слои атомов. В то же время графит не рассыпается на слои атомов, это свидетельствует о том, что слои взаимодействуют между собой. Связи между плоскостями (слоями) достаточно слабые, их длина почти в 2,5 раза больше, чем межъядерное расстояние С– С в плоскости.
Графит – наиболее устойчивая при комнатной температуре аллотропная модификация углерода. К разновидностям графита относят также сажу и древесный уголь. Как показывает рентгеноструктурное исследование, эти вещества состоят из мельчайших беспорядочно расположенных частиц графита. Высокодисперсный углерод обладает значительной адсорбционной способностью.
Одним из широко используемых адсорбентов является активированный уголь. Его получают обработкой древесного угля перегретым водяным паром, который удаляет смолистые вещества, заполняющие поры угля. Суммарная поверхность всех пор в 1 г активированного угля может доходить до 1000 м2. Адсорбционная способность активированного угля выше для газов, которые легко сжижаются (SО2, NН3, С12), по сравнению с трудно сжижающимися газами (Н2, О2, СН4).
На практике активированный уголь используют в противогазах (поглощает многие отравляющие вещества: хлор, фосген, иприт и др.). В нефтяной промышленности активированным углем улавливают пары бензина из природных нефтяных газов. В пищевой промышленности на сахарных заводах окрашенные сиропы обесцвечивают, обрабатывая их активированным углем (уголь поглощает красящие пигменты); винный спирт, фильтруя через активированный уголь, очищают от ядовитых примесей (сивушных масел).
Высокой адсорбционной способностью обладают угли, получаемые при обугливании животных остатков. Костяной уголь содержит от 7 до 11 % углерода и около 80 % фосфата кальция. Костяной уголь используют в медицине для поглощения некоторых ядовитых веществ, попавших в организм человека.
123

Карбин – цепочечный полимер, имеющий две формы:
…- С ≡ С – С ≡ С -… и …= С = С = С = С =…
Полиин (α-карбин) Поликумулен (β-карбин)
Структуру карбина образуют атомы углерода, собранные в цепочки чередующимися одинарными и тройными связями (α-карбин) или двойными связями (β-карбин). Полимерные цепочки имеют химически активные концы (т. е. несут локализованный отрицательный заряд) и изгибы в местах соединения цепочек между собой за счет перекрывания р-орбиталей атомов углерода.
Карбин получают каталитическим окислением ацетилена. Карбин обладает полупроводниковыми свойствами, под воздействием света его проводимость сильно увеличивается. На этом свойстве основано его практическое применение в фотоэлементах.
Графе<н– двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, находящихся в sp²-гибридизации и соединённых посредством σ- и π-связей в гексагональную двумерную кристаллическую решётку. Графен впервые был получен в 2004 году. Его можно представить как одну плоскость графита, отделённую
от объёмного кристалла. Графен обладает большой механической жёсткостью и хорошей теплопроводностью. Высокая подвижность носителей заряда (максимальная подвижность электронов среди всех известных материалов) делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.
Способ получения графена основан на механическом отщеплении или отшелушивании слоёв графита от высокоориентированного пиролитического графита. Сначала плоские куски графита помещают между липкими лентами (скотч) и расщепляют раз за разом, создавая достаточно тонкие слои (среди многих плёнок могут попадаться однослойные и двуслойные, которые и представляют интерес). Этот метод не предполагает использования масштабного производства, поскольку это ручная процедура. Он позволяет получать наиболее качественные образцы с высокой подвижностью носителей. Другой известный способ – метод термического разложения подложки карбида кремния – гораздо ближе к промышленному производству.
124

Графен ещё недостаточно изучен. Полагают, что в скором времени появится новый класс графеновой наноэлектроники с базовой толщиной транзисторов до 10 нм. Ещё одна перспективная область применения графена – его использование для изготовления электродов для использования их в качестве перезаряжаемых источников тока с удельной энергоёмкостью, сравнимую с таковой для свинцовокислотных аккумуляторов.
За «передовые опыты с двумерным материалом – графеном» А. К. Гейму и К. С. Новосёлову была присуждена Нобелевская премия по физике за 2010 год.
Идеальный графен состоит исключительно из шестиугольных ячеек. Присутствие пяти- и семиугольных ячеек будет приводить к различного рода дефектам.
Наличие пятиугольных ячеек приводит к сворачиванию атомной плоскости в конус. Структура с 12 такими дефектами одновременно известна под названием фуллерен. Фуллерены С60, С70 и др. – шарообразные полые молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединенных между собой. Названы по имени американского архитектора Бакминстера Фуллера, применявшего для постройки куполов своих зданий пяти- и шестиугольники. Фуллерены представляют собой
кристаллические вещества черного цвета с металлическим блеском, обладают магнитными и сверхпроводящими свойствами, при высоком давлении С60 становится твердым, как алмаз.
При сворачивании графена в цилиндр получается одностенная нанотрубка. В зависимости от конкретной схемы сворачивания графитовой плоскости, нанотрубки могут обладать или металлическими, или полупроводниковыми свойствами. Открыта сверхпроводимость углеродных нанотрубок.
Возможные применения нанотрубок.
Механические применения: сверхпрочные нити, композитные материалы, нановесы.
Применения в микроэлектронике: транзисторы, нанопровода, прозрачные проводящие поверхности, топливные элементы.
125
Для создания соединений между биологическими нейронами и электронными устройствами в новейших нейрокомпьютерных разработках.
Капиллярные применения: капсулы для активных молекул, хранение металлов и газов, нанопипетки и др.
Результаты экспериментов, проведённых в последние годы, показали, что длинные многостенные углеродные нанотрубки могут вызвать отклик, аналогичный асбестовым волокнам. У людей, занятых на добыче и переработке асбеста, вероятность возникновения опухолей и рака лёгких в несколько раз больше, чем у основного населения.
К аморфным модификациям углерода относится ещё одна форма углерода − стеклоуглерод, которую получили искусственным путём. Он состоит из связанных между собой фрагментов алмаза, графита и карбина. Стеклоуглерод – очень лёгкий, механически прочный, твердый, электропроводящий, коррозионно-устойчивый (устойчив к действию царской водки) и термостойкий материал. Он выдерживает нагревание до 3700оС.
Графит и стеклоуглерод широко используются в качестве материала для электродов в процессах электролиза. Из стеклоуглерода изготавливают химическую посуду – тигли, стаканы, трубки и пр., а также рыболовные удочки, рамы спортивных велосипедов, корпуса лодок, летательных аппаратов, самолётов и ракет.
Химические свойства углерода
Углерод в соединениях, как правило, четырехвалентен. В возбужденном состоянии в атоме углерода во внешнем слое отсутствуют как электронные пары, так и свободные орбитали. Поэтому донорноакцепторное взаимодействие для углерода в возбужденном состоянии невозможно. Углерод занимает промежуточное положение на шкале электроотрицательностей, благодаря чему образует связи с элементами, стоящими в периодичекой системе слева (металлы, водород), справа (кислород, азот галогены) и снизу (кремний, германий). Для углерода очень характерно образование цепей, это обусловлено тем, что прочность связей между атомами углерода сравнима с прочностью связей, образуемых углеродом с атомами других элементов.
Восстановительные свойства для углерода более характерны, проявляются при заимодействии с кислородом:
C + O2 = CO2; 2C + O2(недост.) = 2CO
126

с серой, азотом, галогенами:
C + S ¾t ® CS2 (сероуглерод)
C + N2 ¾электричес¾¾¾¾¾тво¾¾® C2N2 (дициан N≡ С– С ≡ N)
C + F2 ¾t ® CF4
Восстановление металлов из оксидов:
4C + Fe3O4 ¾t ® 3Fe + 4CO
Восстановление кремния из оксида:
2C + SiO2 ¾t ® Si + 2CO
Получение водяного газа:
C + H2O ¾t ® CO + H2
Реакции с кислотами-окислителями:
C + 4HNO3 = CO2 + 4NO2+ 2H2O
C + 2H2SO4 = CO2 + 2SO2+ 2H2O
Углерод взаимодействует с раствором дихромата калия в концентрированной серной кислоте:
3C + 8H2SO4 + 2K2Cr2O7 = 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 8H2O
Окислительные свойства углерод проявляет, при взаимодействии с водородом в присутствии никелевого катализатора, с металлами, образуя карбиды:
C + 2H2 ¾t¾, кат¾.® CH4 Ca + 2C ¾t ® CaC2
Кислородсодержащие соединения углерода
Оксид углерода (II) - угарный газ. Молекула оксида углеро-
да (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь: С О
О
2s 2p
С
O

2s 2p
127
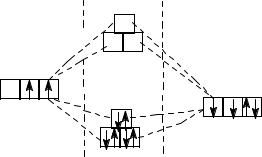
Две связи получены путем перекрывания неспаренных 2р-электронов углерода и кислорода, а третья – по донорно-акцепторному механизму за счет 2р свободной атомной орбитали углерода и электронной пары кислорода.
Тройная связь в молекуле является причиной низкой химической активности СО. В химическом отношении СО – инертное вещество. Наличие неподеленных электронных пар у атомов углерода и кислорода обусловливает возможность образования связей по донорноакцепторному механизму. Молекула СО является донором электронной пары. В соответствии с методом МО у молекулы СО существуют вакантные разрыхляющие орбитали:
АО( С ) |
МО ( С O) |
АО( O ) |
|
σразр. |
|||
|
|
||
|
2p |
|
|
|
π разр. |
|
|
|
2p |
|
|
2p |
св. |
|
|
|
σ 2p |
|
πсв. 2p
Сих участием также возможно образование связей по донорноакцепторному механизму, молекулы СО в этом случае являются акцепторами электронных пар. Например, в карбонилах образуются дативные связи, молекулы СО одновременно выступают в роли и донора, и акцептора электронов.
Физические свойства СО. Газ без цвета и запаха, легче воздуха,
очень мало растворим в воде, растворим в спирте и бензоле. = -205°C. Ядовит. Необратимо взаимодействует с ге-
моглобином крови.
Химические свойства СО. Несолеобразующий оксид, незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот, но при нагревании с расплавленными щелочами образует соли муравьиной кислоты:
CO + NaOH ¾® HCOONa (формиат натрия) |
|||||
|
|
t |
|
|
|
При нагревании на воздухе горит синим пламенем (температура |
|||||
начала реакции 700°C): |
|
|
|
|
|
2СО + О = 2СО ; |
G о |
= −257 кДж, |
S о |
= −86 Дж/K |
|
2 |
2 |
298 |
|
298 |
|
128
Реагирует с водородом. Ниже 830°C более сильным восстановителем является CO, выше – водород. Поэтому равновесие реакции до 830°C смещено вправо, выше 830°C – влево:
СО + Н2 С + Н2О
Под действием катализатора, соединяясь с водородом, оксид углерода (II) образует метанол:
CO + 2H2 ¾t ® CH3OH (t = 300°C, P = 50МПа, катализатор Cr2O3)
Энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
|
|
|
t |
|
Сu + CO2 |
|
|
|
|
CO + CuO ¾® |
|
||||
|
|
CO + Fe3O4 |
|
t |
|
|
|
|
|
¾® Fe + CO2 |
|
||||
C |
+2 |
O + Н2O ¾® Н2 + C |
+4 |
O2; |
о |
кДж |
|
|
|
H 298 = –41,17 |
|||||
|
|
t |
|
|
|
|
|
С галогенами. Наибольшее практическое применение получила реакция с хлором в присутствии катализатора (активированный уголь), экзотермическая реакция протекает уже при комнатной температуре:
СO + Cl2 = COCl2 (фосген); H о298 = –109,8 кДж
С металлами образует карбонилы:
5CO + Fe ¾t ® [Fe(CO)5] (пентакарбонил железа)
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение – циановодород HCN. Реакция идёт в присутствии катализатора(оксид тория ThO2) по уравнению:
CO + NH3 ¾t ® HCN + H2O (H – C ≡ N)
С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
|
о |
= −229 |
кДж, |
о |
= −134 |
Дж/K |
CO + S ¾® COS; G 298 |
S 298 |
|||||
t |
|
|
|
|
|
|
Получение CO в промышленности. Пропускание воздуха через раскаленный уголь:
C + O2 = CO2 CO2 + C ¾t ® 2CO
Пропускание водяного пара над раскаленным углем:
129

C + H2O ¾t ® CO + H2
В лаборатории. При термическом разложении муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5:
H2C2O4 = CO + CO2 + H2O
HCOOH = H2O + CO
Выделяющийся совместно с CO оксид углерода (IV) можно удалить, пропустив смесь через насыщенный водный раствор гидроксида бария.
Нагревание карбоната кальция с цинком:
CaCO3 + Zn ¾t ® CaO + ZnO + CO
Взаимодействие углекислого газа с цинком:
CO2 + Zn ¾t ® CO + ZnO
Применение оксида углерода (II). Главным образом угарный газ применяют, как горючий газ в смеси с азотом (так называемый генераторный или воздушный газ), или же в смеси с водородом (водяной газ). В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
Оксид углерода (IV) - углекислый газ. Молекула СО2 линейная,
две σ-связи образованы sp-гибридными орбиталями атома углерода и 2р-орбиталями атома кислорода. Не участвующие в гибридизации р- орбитали углерода образуют с р-орбиталями кислорода π-связи. Молекула неполярная:
O С O
Физические свойства CO2. Газ без цвета и запаха, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – « сухого льда». При атмосферном давлении он не плавится, а возгоняется, температура возгонки –78° С. Углекислый газ образуется при гниении и горении органических веществ. Содержится
ввоздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа
водном объеме воды при 15° С).
Химические свойства CO2. Кислотный оксид:
СaO + CO2 = СaCO3
2NaOH + CO2 = Na2CO3 + H2O
NaOH(недост.) + CO2 = NaHCO3
130
