
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
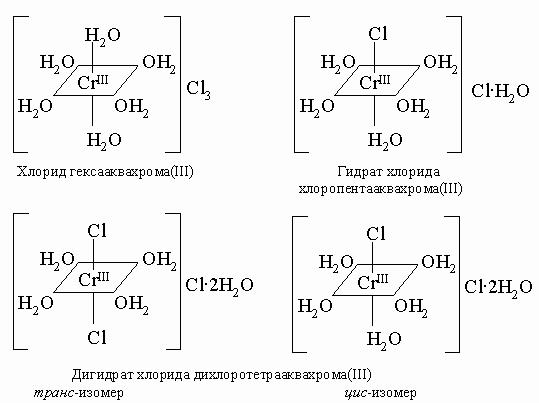
Для молибдена и вольфрама характерны комплексы с фтором и кислородом:
2KF + WF6 → K2[WF8].
Cr, Mo, W образуют гексакарбонилы Ме(СО)6, бесцветные твердые вещества. Их получают восстановительным карбонилированием галогенидов металлов:
CrCl3 + Al+6CO → Cr(CO)6 + AlCl3
Разложением карбонилов при нагревании получают тонкие порошки чистых металлов:
Cr(CO)6 → Cr + 6CO
Применение хрома, молибдена, вольфрама
Хром широко используется для получения лигированных сталей, в частности нержавеющей.
Соединения хрома окрашены и служат пигментами красок и лаков: Cr2O3 – хромовая зеленая, PbCrO4 – хромовая желтая, (PbOH)2CrO4 – хромовая красная, ZnCrO4 – цинковая желтая. Хромовые краски отличаются красотой и устойчивостью к свету.
Чистый молибден используют в электротехнике для изготовления нитей, трубок, электрообмотки печей и электроконтактов. Много вы-
246




 О
О
 О
О